2. 内蒙古医科大学基础医学院, 呼和浩特 010110
2. Basic Medical College, Inner Mongolia Medical University, Hohhot 010110, China
附睾是精子成熟的重要生殖器官[1-2],其上皮细胞分泌的多种细胞因子对精子运动能力和受精能力的获得起重要作用[3-6]。原代培养细胞具有直接来源于机体组织, 生物性状尚未发生变化的优势, 可以作为在一定周期内研究附睾上皮生理、病理机制的试验平台,也使精子成熟影响因素的研究得以开展。酶消化法在小鼠[7-8]和大鼠[9-11]附睾上皮细胞培养中获得了较好的培养效果;组织块培养法在野猪[12]、公牛[13]和人[14]附睾上皮细胞培养中也获得了相应的细胞系。迄今为止,国内外尚无山羊附睾上皮细胞相关培养体系的报道。酶消化法可能会破坏上皮细胞结构,或者在生长过程中因缺乏基底膜和一些微量元素而迅速去分化,组织块培养则可以使细胞在模拟体内条件的情况下保持其形态特征[12]。笔者把两种方法都用于绒山羊附睾上皮细胞的培养,并进行了对比,在此基础上对附睾上皮细胞的培养方法进行改良。旨在获得纯度高、生长特性好、效率高的附睾上皮细胞的体外培养方法。
1 材料和方法 1.1 试验材料10~12月龄被覆完整白膜的绒山羊睾丸冷藏保存,1~2 h内带回实验室。
1.2 主要试剂青霉素和链霉素(Gibco);0.25%胰酶(含EDTA)(Gibco);胶原酶Ⅶ (Sigma);胶原酶Ⅳ(Sigma);RPMI 1640(Gibco);胎牛血清(BI);胰岛素(Sigma);睾酮(Sigma);氢化可的松(Sigma);转铁蛋白(Sigma);角蛋白18抗体(Abcam);Gpx5抗体(Santa);Triton X-100(Sigma);DAPI (Sigma),CCK-8(TransGen Biotech)。
1.3 组织分离睾丸组织在生理盐水中清洗后,移入超净台,划破白膜,取附睾头组织于60皿,用含100 U·mL-1青霉素和100 μg·mL-1链霉素的DPBS清洗3次,剔除附睾头周围结缔组织。
1.4 细胞原代培养及传代 1.4.1 酶消化法细胞悬液培养[15-16]附睾头组织剪成5 mm3块,DPBS清洗2次,后剪碎(1~3 mm3)呈糊状混合物,移入0.25%的胰酶中,37 ℃水浴震荡消化50 min,血清终止消化后DPBS洗2次,再于37 ℃水浴中0.1%胶原酶Ⅳ(含0.36 mmol·L-1 CaCl2)震荡消化60 min。依次用100目和200目不锈钢滤网过滤,滤过液加入等体积RPMI 1640完全培养基(100 mL·L-1胎牛血清、100 nmol·L-1胰岛素、100 nmol·L-1睾酮、200 nmol·L-1氢化可的松、5 μg·mL-1转铁蛋白、50 U·mL-1青霉素和50 μg·mL-1链霉素),1 000 r·min-1离心5 min,弃上清,调整细胞浓度为2×105个·mL-1,25 mL培养瓶中加入3 mL细胞悬液。8 h后吸出未贴壁的细胞及培养基转移至另一培养瓶中培养, 1.5 d后更换培养基,随后每3 d换液1次,待细胞长满瓶底后,进行传代培养。
1.4.2 改良组织块消化法[12, 14]附睾头组织剪成2~3 mm小块,DPBS洗涤2次,移入300 U·mL-1胶原酶Ⅶ中,37 ℃水浴震荡消化120 min,完全培养基洗涤后,150 U·mL-1胶原酶Ⅶ继续消化50 min,完全培养基清洗3次(1 000 r·min-1离心5 min,弃上清),每个60皿中放置约60个块,37 ℃、5% CO2培养箱内贴壁,4 h后缓慢加入1640完全培养基3 mL,每2 d换液1次,待细胞30%~40%时,去掉组织块,加入新鲜培养液继续培养, 长满瓶底后,进行传代培养。
1.4.3 细胞传代待细胞融合接近80%~90%时传代,加入0.25%胰酶消化3~4 min, 光镜下观察到细胞收缩变圆或少数脱落浮起时, 振动瓶底使细胞大部分脱落,加入完全培养基终止消化,轻轻吹打, 使细胞基本成单个悬浮后,收集离心,重悬后接种到新的培养瓶。
1.5 绒山羊附睾上皮细胞鉴定及纯度分析 1.5.1 免疫细胞化学染色法角蛋白18是上皮细胞的特异性标记物之一[17-18],采用免疫细胞化学法鉴定附睾上皮细胞。预冷甲醇溶液固定爬片细胞,0.2% Triton X-100通透,3%过氧化氢去除内源性过氧化物酶,5%血清封闭,滴加鼠源角蛋白18(1:100) 抗体孵育,4 ℃过夜,再滴加HRP标记的抗小鼠二抗(1:300),37 ℃孵育1 h,DAB(迈新)显色,苏木素(迈新)复染后显微镜观察。
1.5.2 免疫荧光化学法GPx5是附睾特异性胞浆蛋白[19-20],采用免疫荧光化学法对其进行了定位检测。4%多聚甲醛固定细胞,经过3%过氧化氢和5%血清处理后,滴加兔源GPx5(1:100) 抗体孵育,4 ℃过夜,再滴加FITC标记的驴抗兔二抗(1:200),37 ℃孵育1 h,DAPI染细胞核后荧光显微镜观察。
1.5.3 透射电镜观察常规消化收集细胞, 2.5%戊二醛磷酸盐缓冲液固定细胞团块, 1%锇酸溶液中固定1~2 h, 乙醇、丙酮梯度脱水, 包埋、超薄切片机切片,透射电镜观察并拍照。
1.5.4 流式细胞仪检测细胞纯度0.25%胰酶消化收集细胞;DPBS清洗后,分装入Eppendorf管, 4%多聚甲醛固定10 min,5% BSA封闭,加入角蛋白18抗体(1:50), 混匀后, 4 ℃过夜,再加入FITC标记抗小鼠荧光二抗(1:100),37 ℃孵育1 h,DPBS洗3遍后,流式细胞仪(ACEA NovoCyteTM)检测。
1.6 附睾上皮细胞生长曲线采用CCK-8法检测细胞活性,建立绒山羊原代附睾上皮细胞生长曲线。取生长状态良好的第2代附睾上皮细胞, 以每孔2 500个细胞接种于96孔板中, 每孔100 μL培养基, 3个平行复孔,同时设不含细胞的空白对照孔, 在37 ℃、5% CO2培养箱中分别培养1、2、3、4、5和6 d后, 每孔加入10 μL CCK-8溶液, 37 ℃、5% CO2培养箱中继续孵育3 h后, 酶标仪检测450 nm波长处吸光度(A)值。所有培养基每24 h更换1次。
2 结果 2.1 绒山羊附睾上皮细胞形态及生长情况观察酶消化法原代培养的附睾上皮细胞,光镜下可见透亮的单个细胞及细胞团, 24 h内贴壁生长;36 h后呈岛屿状克隆生长,细胞界限清晰, 折光性好,胞核较大,当汇集到70%时, 呈鹅卵石状。以(1~2)×104 个·cm-2密度铺板时,约3~4 d即可贴壁长满培养瓶80%~90%,以1:2比例传代,可传5代。从第6代起细胞扩增速度明显放缓,细胞体积扩大,形状不规则,折光性降低(图 1)。
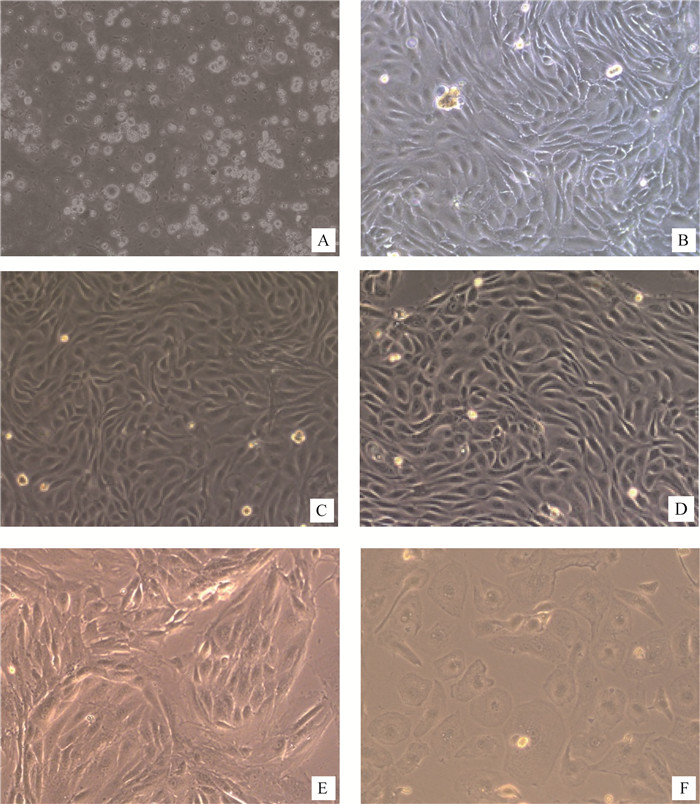
|
A.分离的细胞及细胞团;B.原代细胞生长近融合状态;C.第1代细胞生长近融合状态;D.第2代细胞生长近融合状态;E.第4代上皮细胞;F.第6代衰老的上皮细胞 A.Separation of cells and cell cluster; B.Close to the confluent state of primary cells; C.Close to the confluent state of the 1st passage cells; D.The 2nd passage cells; E. The 4th passage cells; F. Senescent cells of the 6th passage 图 1 绒山羊酶消化法培养的原代及传代附睾上皮细胞(100 ×) Figure 1 Primary culture and subculture of cashmere goats epididymal epithelial cells by enzymatic dispersion method(100×) |
改良组织块消化法原代培养的上皮细胞,培养4~5 d后, 见少量鹅卵石状细胞从组织块周边爬出;之后的3~4 d生长较快,迅速汇合成片。10 d内爬出细胞的组织块约为75%;光镜下细胞轮廓清晰,折光性强,胞核大,呈鹅卵石状。偶见部分组织块周边爬出其它形态的细胞,但未形成扩增趋势。待细胞融合约30%~40%时,去掉组织块,加入培养基继续培养。10 d左右,进行第1次传代,传代后生长速度较快,呈岛屿状克隆生长,以(1~2)×104 个·cm-2密度铺板时,约4 d传代1次,可传4代,第5代细胞即表现为细胞体积扩大,扩增速度明显减缓(图 2)。
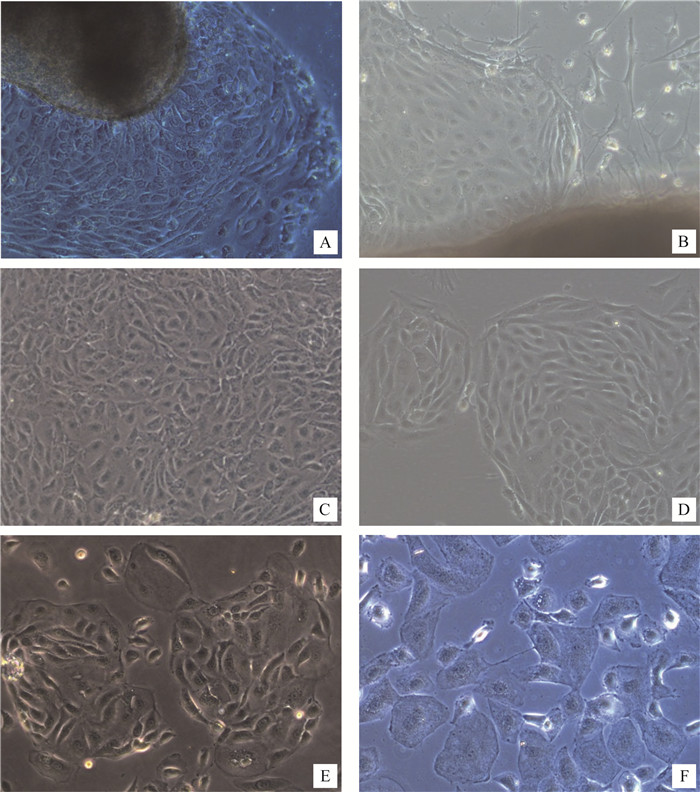
|
A.4~5 d鹅卵石状细胞从组织块周边爬出;B.部分组织块周边爬出其他形态的细胞,但未形成扩增趋势;C.原代细胞生长近融合;D.第1代上皮细胞;E.第2代上皮细胞;F.第5代衰老细胞 A.Cobblestone appearance cells crawled out from the edge of tissue blocks after 4-5 days of culture; B.Other types of cells crawled out from few tissue blocks, but no expansion trend; C.Close to the confluent state of primary cells; D.The 1st passage cells; E.The 2nd passage cells; F.Senescent cells of the 5th passage 图 2 绒山羊改良组织块消化法培养的原代及传代附睾上皮细胞(100×) Figure 2 Primary culture and subculture of cashmere goats epididymal epithelial cells by improved tissue-piece digestion method(100×) |
两种原代培养方法所获的细胞光镜下均呈鹅卵石状,胞核较大,呈岛屿状克隆生长,具有良好的分化能力。改良组织块消化法从接种到可以第1次传代大约需要10 d,获得原代细胞需要的周期长,传代数少;酶消化法获得原代细胞周期短,原代接种后, 约3~4 d即可传代培养,相同的培养时间内酶消化法获得的细胞数更多。
2.2 绒山羊附睾上皮细胞鉴定及纯度分析 2.2.1 免疫化学鉴定角蛋白18与GPx5均为胞浆蛋白,角蛋白18是上皮细胞的特异性标志物,GPx5则是附睾特异性蛋白,由附睾上皮细胞表达。分别选取两种方法所获得的第3代绒山羊附睾上皮细胞进行角蛋白18的免疫细胞化学染色和GPx5的免疫荧光染色,结果显示:绝大多数细胞胞浆内均有角蛋白18的棕色阳性颗粒信号,细胞轮廓清晰,呈多边形,大小均一;且绝大多数细胞胞浆内均有GPx5的绿色荧光信号(图 3),说明两种方法所获细胞均为纯度较高的附睾上皮细胞。
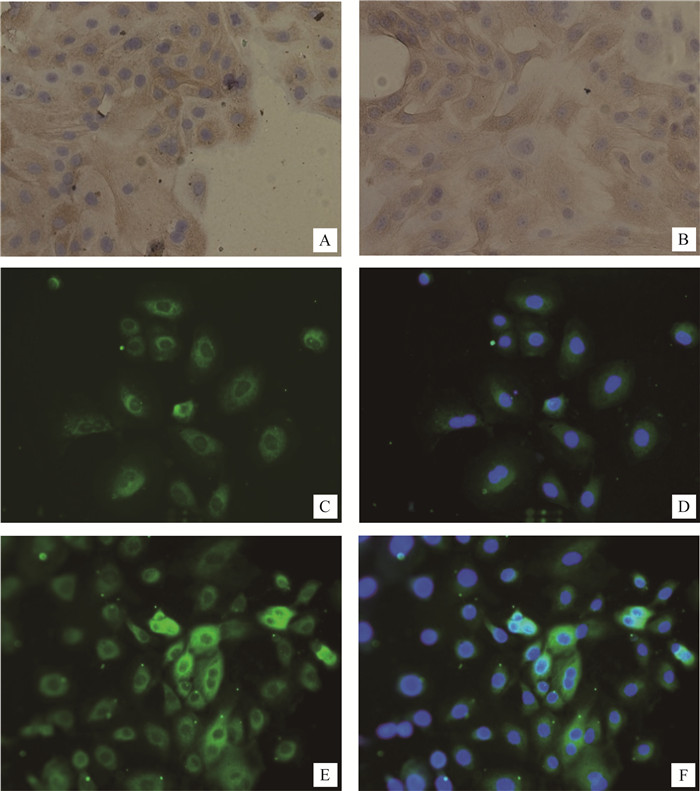
|
A.酶消化法细胞角蛋白18阳性染色;B.改良组织块消化法细胞角蛋白18阳性染色;C.酶消化法细胞浆GPx5染色;D、F.细胞核染色;E.改良组织块消化法细胞浆GPx5染色 A.Immunocytochemistry positive staining of cytokeratin 18 by enzymatic dispersion method; B. Immunocytochemistry positive staining of cytokeratin 18 by improved tissue-piece digestion method; C. Immunofluorescence positive staining of GPx5 in cytoplasm by enzymatic dispersion method; D, F.Nuclear staining; E.Immunofluorescence positive staining of GPx5 in cytoplasm by improved tissue-piece digestion method 图 3 绒山羊附睾上皮细胞生物学特性鉴定(第3代细胞) (200×) Figure 3 Indentification for biological characteristics of epididymal epithelial cells of cashmere goats(the 3rd passage cells)(200×) |
细胞悬液培养的第3代细胞(体外生长18 d)及改良组织块消化法第3代细胞(体外生长25 d)电镜分析结果显示:在体外培养的这段时间内,细胞没有退行性或去分化表现。附睾头上皮细胞富含纤毛,可见圆形或椭圆形的细胞核及明显的核仁,胞浆中有丰富的线粒体、内质网、囊泡和脂滴,还分布一些大小不等的致密颗粒,可能为分泌颗粒和溶酶体(图 4),提示细胞具有较活跃的分泌及代谢功能。
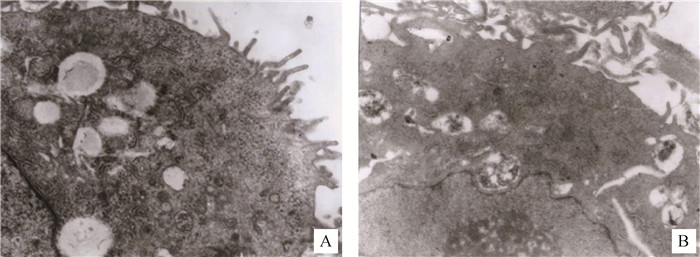
|
A.酶消化法第3代细胞(体外培养18 d);B.改良组织块消化法第3代细胞(体外培养25 d) A.The 3rd passage cells cultured in vitro for 18 days by enzymatic dispersion method; B.The 3rd passage cells cultured in vitro for 25 days by improved tissue-piece digestion method 图 4 绒山羊附睾上皮细胞电镜结构图(10 000×) Figure 4 Electron micrographs of epididymal epithelial cells of cashmere goats(10 000×) |
流式细胞仪检测显示,酶消化法和改良组织块消化法所获得的第3代细胞角蛋白18的阳性表达率分别为98.23%和96.16%,表明两种方法所获得上皮细胞纯度均较高(图 5)。
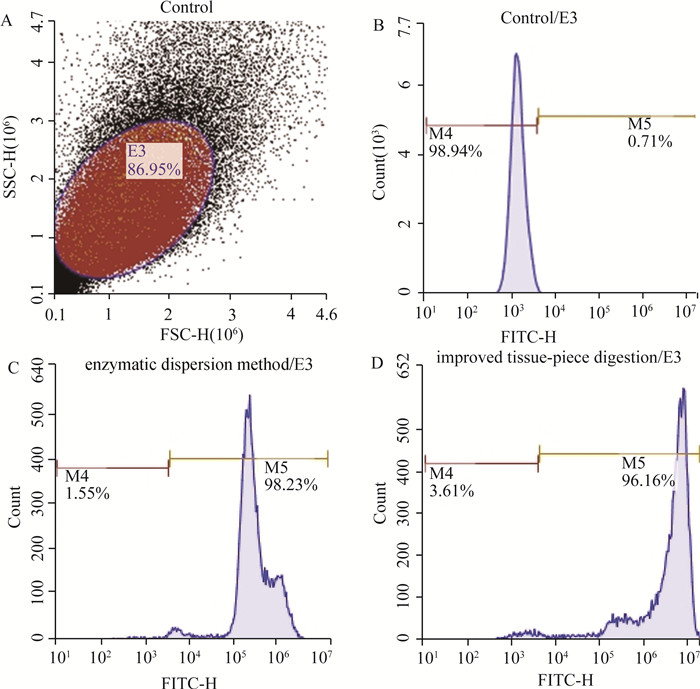
|
A、B.对照组附睾上皮细胞;C、D.角蛋白18阳性细胞。E3.附睾上皮细胞;M4.不表达角蛋白18的细胞;M5.角蛋白18的阳性细胞 A, B.Epididymal epithelial cells of the control; C, D.Cytokeratin 18 positive cells. E3.Epididymal epithelial cells; M4.Cells without cytokeratin 18; M5.Cytokeratin 18 positive cells 图 5 流式细胞仪检测角蛋白18的阳性细胞(第3代) Figure 5 Cytokeratin 18 expressing cells detected by flow cytometry (The 3rd passage) |
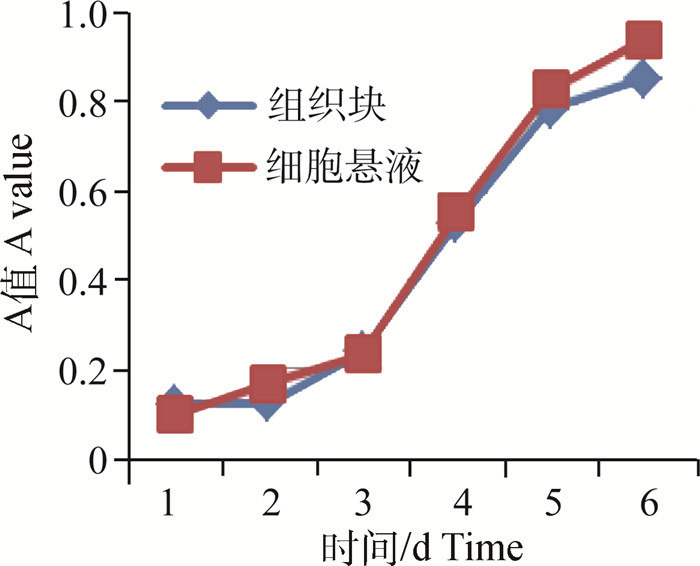
两种培养方法所获得的第2代上皮细胞增殖曲线均呈“S”形,且两种培养方法所获相同代数的细胞增殖曲线相似;3~5 d为其指数增长期(图 6),接种后3~5 d为细胞活性最佳阶段,可作为各种试验选择的最佳时间。
|
图 6 第2代绒山羊附睾上皮细胞生长曲线 Figure 6 Growth curve of the 2nd passage cells of epididymal epithelial cells of cashmere goats |
为建立较为稳定的、效率更高的绒山羊上皮细胞原代培养体系,采用胰蛋白酶+胶原酶Ⅳ消化法和胶原酶Ⅶ消化组织块后与贴壁法同时进行原代培养,通过两种方法的对比而建立高效稳定的绒山羊附睾上皮培养体系。结果发现,两种方法得到的细胞形态无差别,细胞界限清晰, 胞核较大,均呈鹅卵石样克隆生长,具有良好的分化能力。笔者对上皮细胞的标志性胞浆蛋白角蛋白18进行了上皮细胞的免疫细胞化学检测,以便对细胞轮廓形状和细胞核的结构观察更为清晰, 同时也对附睾特异性胞浆蛋白GPx5进行了免疫荧光化学检测,结果显示,绝大多数细胞均有角蛋白18及GPx5的阳性信号表达,这与细胞角蛋白18流式分析显示的细胞纯度分别在98%和96%以上的结果相符合,说明两种培养方法所得细胞纯度均极佳。此外,传代细胞贴壁、增殖均较快,细胞增殖曲线呈“S”形,最初两天增殖缓慢,3~5 d进入指数增长期,该阶段可作为各种试验选择的最佳时间。电镜下两种培养方法得到的细胞均观察到丰富的线粒体、发达的内质网、明显的致密颗粒和囊泡,显示细胞在体外培养过程中保持旺盛的合成和分泌功能,为绒山羊附睾上皮功能研究提供良好的试验基础。
改良组织块消化法获得原代细胞周期较长,相同的时间内获得的细胞数少于酶消化法;由于细胞内某些蛋白表达所受调控的复杂性,使得一些蛋白合成量可能会随着培养时间的延长受影响,如原代培养的大鼠附睾上皮细胞中Binlb的表达即呈时间依赖性减少[21],HLA-G在胸腺上皮细胞和羊膜上皮细胞的表达量同样随着细胞在体外培养时间延长逐渐降低[22],因此使用离体时间较短的细胞进行试验对保证试验的稳定性是必要的,故酶消化法原代培养绒山羊附睾上皮细胞更适用。
绒山羊附睾上皮细胞酶消化法细胞悬液培养时注意的问题:(1) 酶消化时间长对成功获得大量绒山羊附睾上皮细胞很关键。对于12月龄的绒山羊,用0.25%的胰酶消化50 min,接着0.1%胶原酶Ⅳ消化60 min,才获得大量上皮细胞,这个消化时间明显较结肠等上皮细胞培养消化时间长[23],这可能是因为附睾管壁上被覆有大量纤维结缔组织[12]。在预试验中,也把同样的消化时间用于36月龄的绒山羊,但获得的细胞量却很少(资料未显示),这可能也说明了月龄的选择和酶消化时间的掌控对附睾上皮细胞培养很重要。(2) 消化得到的原代细胞悬液中混杂有一些非上皮细胞,以成纤维细胞为主,因此纯化是另一个重要环节。(3) 差速贴壁法是根据不同细胞具有的不同贴壁能力而进行细胞分离纯化的方法。对获得的原代细胞悬液进行8 h差速贴壁尽可能去除贴壁较快的成纤维细胞, 大大提高了附睾上皮细胞的纯度。培养温度是另一个附睾上皮细胞培养需要考虑的因素。大多数哺乳动物附睾的温度低于基础体温3~4 ℃,因此有些研究者认为附睾上皮细胞体外培养温度应设置在33~35 ℃[14, 24]。而野猪附睾上皮细胞在37和33 ℃培养时保持有相同的形态特征,且37 ℃时细胞生长速度更快[25],而且在附睾上皮细胞与精子共孵育试验时,适合精子生存和成熟的温度是37 ℃[26-29],因此,绒山羊附睾上皮细胞的培养温度选定为37 ℃。应用本研究所建立的培养体系可以在体外保持近1个月(图 1E)而不失其原形态特征,表明, 此培养基体系适合绒山羊附睾上皮细胞的生长。
4 结论本研究成功建立了绒山羊附睾上皮细胞系,对绒山羊附睾头部上皮细胞培养体系及其生长特性进行报道,为绒山羊附睾上皮细胞分泌功能的研究提供了较好的平台,也为后续开展绒山羊附睾上皮细胞与精子共孵育研究提供了良好的基础。
| [1] | SULLIVAN R, MIEUSSET R. The human epididymis:its function in sperm maturation[J]. Hum Reprod Update, 2016, 22(5): 574–587. DOI: 10.1093/humupd/dmw015 |
| [2] | GERVASI M G, VISCONTI P E. Molecular changes and signaling events occurring in spermatozoa during epididymal maturation[J]. Andrology, 2017, 5(2): 204–218. DOI: 10.1111/andr.2017.5.issue-2 |
| [3] | SŁOWIŃSKA M, BUKOWSKA J, HEJMEJ A, et al. Hepatocyte growth factor activator is a potential target proteinase for Kazal-type inhibitor in turkey (Meleagris gallopavo) seminal plasma[J]. Theriogenology, 2015, 84(3): 425–436.e3. DOI: 10.1016/j.theriogenology.2015.03.026 |
| [4] | DUAN Y G, ZHANG Q L, LIU Y C, et al. Dendritic cells in semen of infertile men:association with sperm quality and inflammatory status of the epididymis[J]. Fertil Steril, 2014, 101(1): 70–77.e3. DOI: 10.1016/j.fertnstert.2013.09.006 |
| [5] | GAGNON A, SULLIVAN R, SIRARD M A. Epididymal epithelial cells cultured in vitro prolong the motility of bovine sperm[J]. J Androl, 2000, 21(6): 842–847. |
| [6] | WYSOCKI P, STRŻEEK J. Preliminary studies on phosphoproteins of boar spermatozoa[J]. Theriogenology, 2005, 63(2): 365–366. |
| [7] | SMALLEY M J. Isolation, culture and analysis of mouse mammary epithelial cells[M]//WARD A, TOSH D. Mouse cell culture:methods in molecular biology. Clifton, New Jersey:Humana Press, 2010, 633:139-170. |
| [8] | CARBALLADA R, SALING P M. Regulation of mouse epididymal epithelium in vitro by androgens, temperature and fibroblasts[J]. J Reprod Fertil, 1997, 110(1): 171–181. DOI: 10.1530/jrf.0.1100171 |
| [9] | ZAYA R, HENNICK C, PEARL C A. In vitro expression of androgen and estrogen receptors in prepubertal and adult rat epididymis[J]. Gen Comp Endocrinol, 2012, 178(3): 573–586. DOI: 10.1016/j.ygcen.2012.07.004 |
| [10] | KIERSZENBAUM A L, LEA O, PETRUSZ P, et al. Isolation, culture, and immunocytochemical characterization of epididymal epithelial cells from pubertal and adult rats[J]. Proc Natl Acad Sci U S A, 1981, 78(3): 1675–1679. DOI: 10.1073/pnas.78.3.1675 |
| [11] |
胡向农, 张忠林, 杨建军. 大鼠附睾上皮细胞的体外培养与研究[J]. 南京铁道医学院学报, 1999, 18(1): 1–3.
HU X N, ZHANG Z L, YANG J J. In vitro culture and study of rat epididymal epithelial cells[J]. Journal of Nanjing Railway Medical College, 1999, 18(1): 1–3. (in Chinese) |
| [12] | BASSOLS J, KÁDÁR E, BRIZ M D, et al. In vitro culture of epithelial cells from the caput, corpus, and cauda epididymis of Sus domesticus[J]. Theriogenology, 2004, 62(5): 929–942. DOI: 10.1016/j.theriogenology.2003.12.015 |
| [13] | JOSHI M S. Isolation and cell culture of the epithelial cells of cauda epididymidis of the bull[J]. Biol Reprod, 1985, 33(1): 187–200. DOI: 10.1095/biolreprod33.1.187 |
| [14] | LEIR S H, BROWNE J A, EGGENER S E, et al. Characterization of primary cultures of adult human epididymis epithelial cells[J]. Fertil Steril, 2015, 103(3): 647–654. DOI: 10.1016/j.fertnstert.2014.11.022 |
| [15] |
谢淑武. 度他雄胺对大鼠附睾精子成熟和生育影响的实验研究和机制探讨[D]. 上海: 复旦大学, 2007.
XIE S W. Empirical study and mechanism exploration of dutasteride treatment on rat epididymal sperm maturation and fertility[D]. Shanghai:Fudan University, 2007. (in Chinese) http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGYS200711002307.htm |
| [16] | QU B, GU Y H, SHEN J, et al. Trehalose maintains vitality of mouse epididymal epithelial cells and mediates gene transfer[J]. PLoS One, 2014, 9(3): e92483. DOI: 10.1371/journal.pone.0092483 |
| [17] | HU H, ZHENG N, GAO H N, et al. Immortalized bovine mammary epithelial cells express stem cell markers and differentiate in vitro[J]. Cell Biol Int, 2016, 40(8): 861–872. DOI: 10.1002/cbin.v40.8 |
| [18] | PARK H J, LEE W Y, JEONG H Y, et al. Regeneration of bovine mammary gland in immunodeficient mice by transplantation of bovine mammary epithelial cells mixed with matrigel[J]. Int J Stem Cells, 2016, 9(2): 186–191. DOI: 10.15283/ijsc16044 |
| [19] | TAYLOR A, ROBSON A, HOUGHTON B C, et al. Epididymal specific, selenium-independent GPx5 protects cells from oxidative stress-induced lipid peroxidation and DNA mutation[J]. Hum Reprod, 2013, 28(9): 2332–2342. DOI: 10.1093/humrep/det237 |
| [20] | MAREMANDA K P, KHAN S, JENA G B. Role of zinc supplementation in testicular and epididymal damages in diabetic rat:involvement of Nrf2, SOD1, and GPX5[J]. Biol Trace Elem Res, 2016, 173(2): 452–464. DOI: 10.1007/s12011-016-0674-7 |
| [21] |
曹冬梅. 内毒素对大鼠附睾特异基因Bin1b表达的影响、机制及生物学意义[D]. 上海: 第二军医大学, 2008.
CAO D M. Effect of LPS on expression of epididymis-specific gene Bin1b and its mechanisms and biological significance[D]. Shanghai:The Second Military Medical University, 2008. (in Chinese) |
| [22] | LEFEBVRE S, ADRIAN F, MOREAU P, et al. Modulation of HLA-G expression in human thymic and amniotic epithelial cells[J]. Hum Immunol, 2000, 61(11): 1095–1101. DOI: 10.1016/S0198-8859(00)00192-0 |
| [23] |
祁燕, 李燕舞, 王汝俊, 等. 大鼠结肠上皮细胞分离及培养方法的建立[J]. 世界华人消化杂志, 2012, 20(22): 2030–2035.
QI Y, LI Y W, WANG R J, et al. Establishment of a method for isolation and primary culture of rat colonic epithelial cells[J]. World Chinese Journal of Digestology, 2012, 20(22): 2030–2035. (in Chinese) |
| [24] | STAMMLER A, MÜLLER D, TABUCHI Y, et al. TGFβs modulate permeability of the blood-epididymis barrier in an in vitro model[J]. PLoS One, 2013, 8(11): e80611. DOI: 10.1371/journal.pone.0080611 |
| [25] | BASSOLS J, KÁDÁR E, BRIZ M, et al. Effect of culture conditions on the obtention of boar epididymal epithelial cell monolayers[J]. Anim Reprod Sci, 2006, 95(3-4): 262–272. DOI: 10.1016/j.anireprosci.2005.10.005 |
| [26] | AKHONDI M A, CHAPPLE C, MOORE H D. Prolonged survival of human spermatozoa when co-incubated with epididymal cell cultures[J]. Hum Reprod, 1997, 12(3): 514–522. DOI: 10.1093/humrep/12.3.514 |
| [27] | LIN M, ZHANG X, MURDOCH R, et al. In vitro culture of brushtail possum (Trichosurus vulpecula) epididymal epithelium and induction of epididymal sperm maturation in co-culture[J]. J Reprod Fertil, 2000, 119(1): 1–14. |
| [28] | TIPTANAVATTANA N, TECHAKUMPHU M, THARASANIT T. Simplified isolation and enrichment of spermatogonial stem-like cells from pubertal domestic cats (Felis catus)[J]. J Vet Med Sci, 2015, 77(11): 1347–1353. DOI: 10.1292/jvms.15-0207 |
| [29] | BÜYÜKLEBLEBICI S, TAŞDEMIR U, TUNCER P B, et al. Can linoleic acid improve the quality of frozen thawed bull sperm?[J]. Cryo Lett, 2014, 35(6): 473–481. |



