2. 青藏高原动物遗传资源保护与利用四川省重点实验室, 成都 610041
2. Key Laboratory of Sichuan Province for Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Exploitation, Chengdu 610041, China
近些年来,由于养禽业集约化养殖的发展,养殖密度的增加和高能饲料的广泛应用,畜牧业生产中往往伴随着过多的脂肪沉积现象,这不仅会降低饲料利用率,造成能量浪费,更会影响肉产品的品质。其中肌内脂肪(Intramuscular fat,IMF)含量是影响动物肉质的重要因素之一,适量的IMF含量可调节肉的嫩度、风味与多汁性[1],IMF含量受环境和遗传因素共同调控,因此近年来畜牧工作者从基因调控角度对IMF沉积做了大量的研究工作,期望提高养殖经济效益及生产符合消费者口味的优质肉产品。
FTO(Fat mass and obesity associated)是2007年由T.M. Frayling等[2]发现与机体肥胖之间呈显著相关的基因。T. Gerken等[3]指出,FTO基因在组织中广泛表达,特别是在控制能量平衡起关键作用的下丘脑区域表达水平最高,且有研究指出FTO与肥胖的相关性是通过对能量摄取的调节来实现的[4]。研究发现,含有调节食欲神经元的下丘脑弓状核FTO mRNA的表达由饮食量介导,但小鼠和大鼠的FTO的调节方向却相反;禁食条件下,位于小鼠下丘脑FTO mRNA的表达水平明显下降,喂食条件下其表达量显著上升[5]。但禁食后,大鼠下丘脑FTO mRNA的表达水平明显增加[6]。造成这样差异的原因可能是不同物种对饥饿的敏感度不同以及样本的采集时间不同[7]。同时有研究表明,FTO敲除小鼠(FTO-/-和FTO1367F)的体重下降[8-9],而过表达FTO的小鼠则表现为摄食量、体重和体脂增加[10]。这些表达差异说明FTO基因在肥胖与机体能量代谢间起到非常重要的作用。
以往关于FTO基因的研究多集中于哺乳动物,而禽类的能量代谢调节系统又与哺乳动物存在诸多差异,因此哺乳动物的研究结论可能并不适用于禽类。王玉峰[11]系统分析了鸡FTO组织表达、中枢核团定位及禁食对其表达的影响,但尚未揭示FTO基因与鸡IMF含量的关系。藏鸡是中国青藏高原地区和川西北地区人民重要的生产资料,与其他品种鸡相比具有自己独特的特征,因此本试验首先利用RT-PCR方法克隆获得藏鸡FTO基因序列,然后利用生物信息学进行序列分析,同时利用实时定量PCR(Real-time quantitative PCR, qPCR)构建该基因的组织表达谱及在肌肉组织中的时序表达谱,并分析FTO在胸肌和腿肌中的表达水平与IMF含量的关系,旨在明确藏鸡FTO基因的结构、功能及与IMF沉积的关系,为进一步研究FTO基因在藏鸡生长发育过程中的调控作用提供重要的理论数据和支撑。
1 材料与方法 1.1 试验材料Trizol试剂、pMD-19T载体与荧光定量试剂盒SYBR® Premix Ex TaqTM(2×)均购自TaKaRa公司(美国),2×Long Taq PCR Master Mix、感受态细胞DH5α和DNA纯化回收试剂盒(Universal DNA Purification Kit)均购自天根生化科技有限公司(北京),反转录试剂盒(RevertAid First Strand cDNA Synthesis Kit)购自Thermo公司(美国)。
1.2 试验样品采集选取成都益生康健农业有限公司藏鸡养殖基地孵化1、81、119、154和210日龄的健康藏鸡为试验对象(屠宰年龄段结合优质肉鸡与本地鸡的出栏时间以及本实验室前期试验而设定[12])。屠宰前禁食12 h,于清晨采用放血屠宰,而后采集其右侧胸肌和腿肌,去除结缔组织后装于样品袋中于-20 ℃保存,后用于测定肌内脂肪含量。同时采集154日龄的心、肝、脾、肺、肾、皮下脂肪以及各日龄鸡的胸肌和腿肌组织样品,用DEPC水清洗后,置于无RNA酶的冻存管中,于液氮中保存备用。
利用Trizol法提取组织总RNA,并用1%的琼脂糖凝胶电泳检测RNA完整性。采用紫外分光光度计测定RNA样品的浓度以及OD260 nm/OD280 nm值,并控制在1.9~2.1。按照RevertAid First Strand cDNA Synthesis Kit说明书,取2 μg总RNA进行cDNA链的合成。
1.3 试验方法 1.3.1 藏鸡FTO基因克隆根据GenBank上原鸡FTO基因序列(NM_001185147),利用Primer Premier 5.0软件设计PCR克隆引物(表 1)。PCR反应总体系:2×Long Taq PCR Master Mix 12.5 μL,模板cDNA 1 μL,10 μmol·L-1上、下游引物各1 μL,最后加ddH2O至25 μL。扩增条件:预变性(94 ℃ 4 min);变性(94 ℃ 30 s),退火(61 ℃ 30 s),延伸(72 ℃ 90 s),38个循环;延伸(72 ℃ 10 min)。1%的琼脂糖凝胶电泳检测扩增产物,Universal DNA Purification Kit纯化目的片段,然后再将产物与pMD-19T载体于16 ℃连接2 h,并转化至DH5α中,氨苄抗性平板挑选阳性菌落并进行菌液PCR鉴定,最后送成都擎科梓熙生物技术有限公司测序。
|
|
表 1 克隆和荧光定量PCR引物 Table 1 Primers for cloning and quantitative real-time PCR(qPCR) |
利用ExPASy ProtParam分析蛋白理化性质;DNAMAN进行序列比对;使用NetPhos 3.1、NetOGlyc 1.0和NetNGlyc 3.1分析预测磷酸化位点、O糖基化位点、N糖基化位点;应用SignaIP 4.1 Server进行信号肽分析,TMHMM预测跨膜结构域,PSORT II进行亚细胞定位;利用NCBI的Conserved Domain程序进行结构域的预测;运用Hopfield、Swiss-model分别预测蛋白质二级结构和三级结构;NCBI中Blast进行同源性分析,clustalx 1.83和MEGA 5.0构建进化树。
1.3.3 藏鸡FTO基因组织表达差异分析提取154日龄藏鸡(公母各5只,共10只)心、肝、脾、肺、肾、皮下脂肪、胸肌和腿肌8种组织的总RNA,并反转录成cDNA。利用Primer Premier 5.0软件,根据获得的藏鸡FTO序列(KY366175) 和鸡GAPDH基因序列(K01458) 设计PCR特异引物(表 1)。采用qPCR检测FTO基因在各组织中的表达差异。PCR反应体系为20 μL:模板cDNA 1 μL,10 μmol·L-1上下游引物各1 μL,SYBR® Premix Ex TaqTM (2×) PCR 10 μL,ddH2O 7 μL。PCR反应条件:预变性(95 ℃ 3 min);变性(95 ℃ 10 s),退火(60 ℃ 10 s),延伸(72 ℃ 15 s),38个循环。每个组织样品设3个重复,阴性对照设置3个无cDNA模板的样本。
1.3.4 藏鸡FTO基因在胸肌和腿肌中的时序表达差异提取1、81、119、154和210日龄藏鸡(公母各10只,共100只)胸肌和腿肌的总RNA,反转录成cDNA。利用qPCR检测FTO基因在藏鸡不同发育年龄胸肌和腿肌中的表达差异。反应体系及条件同1.3.3。
1.3.5 数据处理与分析数据用“平均值±标准差(x±SD)”表示,用2-ΔΔCt对实时定量PCR数据进行均一化处理,其中ΔCT(目的基因)= CT(目的基因)-CT(内参基因),ΔΔCT=ΔCT(样品组)-ΔCT(对照组)。利用SPSS 18.0软件中的One-way ANOVA进行显著性检验分析,采用Duncan法对各组织间mRNA表达进行多重比较。FTO mRNA的表达水平与IMF含量的相关性使用SPSS 18.0中双变量相关中的皮尔逊系数(Pearson)进行分析。当P < 0.05时,认为差异有统计学意义。
2 结果 2.1 藏鸡FTO基因克隆以藏鸡皮下脂肪组织cDNA为模板经PCR扩增,通过琼脂糖凝胶电泳检测,获得与预期目的片段大小相符的克隆产物条带,送成都擎科梓熙生物技术有限公司测序后获得FTO基因序列全长1 585 bp,其中包含CDS区1 524 bp,5′ UTR序列35 bp和3′ UTR序列26 bp,其终止密码子为TAG,编码507个氨基酸残基。提交GenBank获得登录号为KY366175。
2.2 藏鸡FTO理化性质分析ExPASy在线工具对藏鸡FTO氨基酸序列的理化性质进行分析,结果显示,该蛋白分子式为C2626H4078N708O779S27,分子质量为58.897 ku,理论等电点为5.74,不稳定指数为50.49,亲水性总平均值为-0.524,说明为不稳定亲水酸性蛋白。氨基酸组成结果显示,亮氨酸(Leu)所占的比例最高为12.2%(62个氨基酸),同时带正电荷的氨基酸残基(Arg+Lys)总数为60,带负电荷的氨基酸残基(Asp+Glu)总数为73。
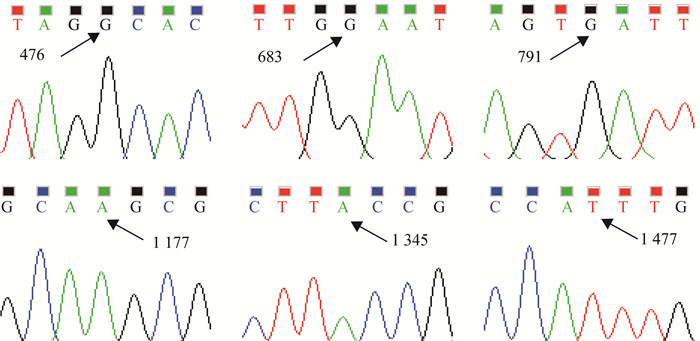
2.3 藏鸡FTO序列分析通过DNAMAN软件比对发现,藏鸡FTO与原鸡(NM_001185147.1) 的核苷酸序列一致性为99.61%,氨基酸序列为98.82%(图 1),共检测到6个碱基突变(图 2),分别为c.476A> G(p.Asp159Gly),c.683A>G(p.Glu228Gly),c.791C>G(p.Thr264Ser),c.1177G>A(p. Glu393Lys),c.1345G>A(p. Ala449Thr)和c.1477C>T(p. Leu493Phe)。

|
图 1 藏鸡与原鸡、绿头鸭、人、小鼠FTO氨基酸序列同源性比对 Figure 1 Comparison of the FTO amino acid sequences among Tibetan chicken, Gallus gallus, Anas platyrhynchos, Homo sapiens, Mus musculus |
|
图 2 藏鸡FTO基因碱基突变测序峰图 Figure 2 Sequencing peak of mutations of Tibetan chicken FTO gene |
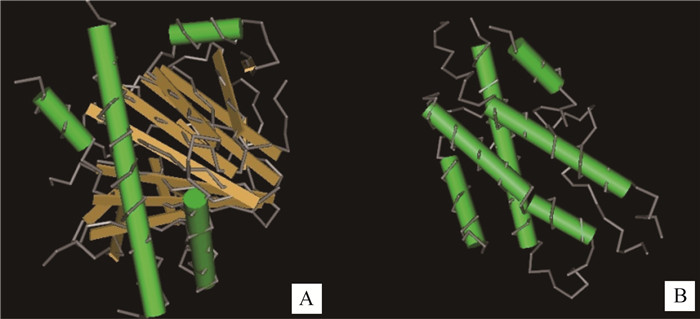
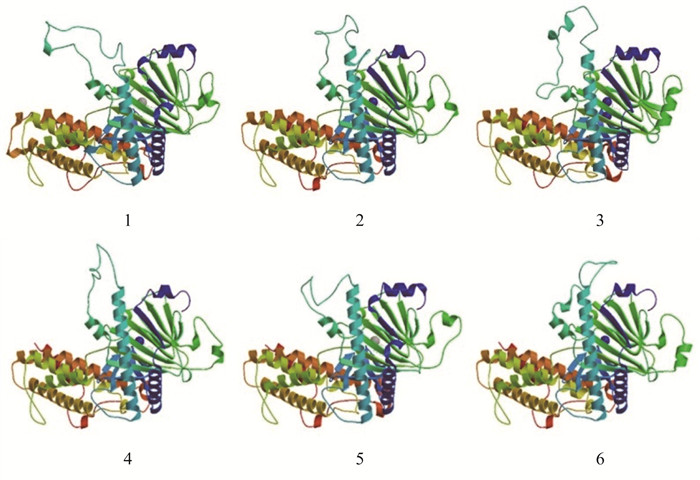
磷酸化位点预测结果显示,藏鸡FTO蛋白有20个丝氨酸(Ser)磷酸化位点:18个苏氨酸(Thr)磷酸化位点、7个酪氨酸(Tyr)磷酸化位点,存在4个N-糖基化位点,不存在O-糖基化位点;SignaIP和TMHMM预测FTO蛋白无信号肽序列和跨膜结构域,PSORT II进行亚细胞定位,发现其主要在线粒体(39.1%)、细胞核(34.8%)和细胞质(26.1%)中发挥生物学作用;生物学功能预测显示,FTO具有一个N端结构域(34~331位氨基酸)和一个C端结构域(335~504位氨基酸),见图 3;FTO蛋白二级结构预测结果显示,203(40.04%)个氨基酸可能形成α-螺旋,77(15.19%)个氨基酸可能形成延伸链,227(44.77%)个氨基酸可能形成无规则卷曲;三级结构分析结果显示,FTO基因在藏鸡、原鸡、绿头鸭、人、小鼠和猪等物种间的蛋白结构具有较高的相似性(图 4)。
|
A. N端结构域;B. C端结构域 A. N-terminal domain; B. C-terminal domain 图 3 藏鸡FTO蛋白的两个结构域 Figure 3 Two domains in Tibetan chicken FTO protein |
|
1.藏鸡;2.原鸡;3.绿头鸭;4.人;5.小鼠;6.猪 1. Tibetan chicken; 2. Jungle fowl; 3. Mallard; 4. Human; 5. Mice; 6. Pig 图 4 不同物种间FTO蛋白的三级结构比较 Figure 4 Structure comparing of FTO protein among different species |
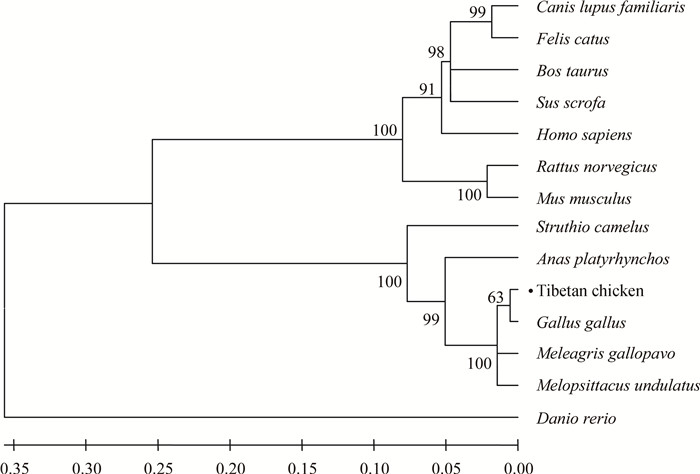
通过NCBI中Blast进行氨基酸同源性比对发现,藏鸡FTO氨基酸序列与原鸡(NP_00117 2076.1)、火鸡(XP_019475299.1)、绿头鸭(XP_012952476.1)、虎皮鹦鹉(ADH51655.1)、鸵鸟(XP_009676702.1)、人(NP_001073901.1)、大鼠(NP_001034802.1)、小鼠(NP_036066.2)、牛(NP_001091611.1)、猪(NP_001106162.1)、狗(XP_535301.4)、猫(XP_003998090.1) 和斑马鱼(XP_001345910.4) 的同源性依次是98.82%、96.08%、87.84%、96.45%、83.83%、59.06%、57.31%、57.50%、59.26%、58.28%、54.48%、59.65%和43.18%。系统进化树分析表明藏鸡与原鸡的亲缘关系最近(图 5),符合物种进化规律和分类学。
|
图 5 NJ法构建FTO氨基酸系统进化树 Figure 5 Phylogenetic tree constructed based on FTO amino acid with Neighbor-joining method |
qPCR检测FTO mRNA在藏鸡不同组织中的相对表达量(图 6A、B),结果显示,FTO mRNA在公藏鸡的脾组织中表达水平最高,其次在肺组织中的表达水平较高,都极显著的高于其他组织(P < 0.01)。在皮下脂肪和肝组织中也存在较高水平的表达,但是差异不显著,皮下脂肪和肝组织中FTO mRNA表达显著高于心和肌肉组织(P < 0.05)。在母藏鸡中同样是在脾组织中的表达水平最高,极显著高于其他组织(P < 0.01),其次在皮下脂肪中的表达水平较高,同样极显著高于其他组织(P < 0.01)。
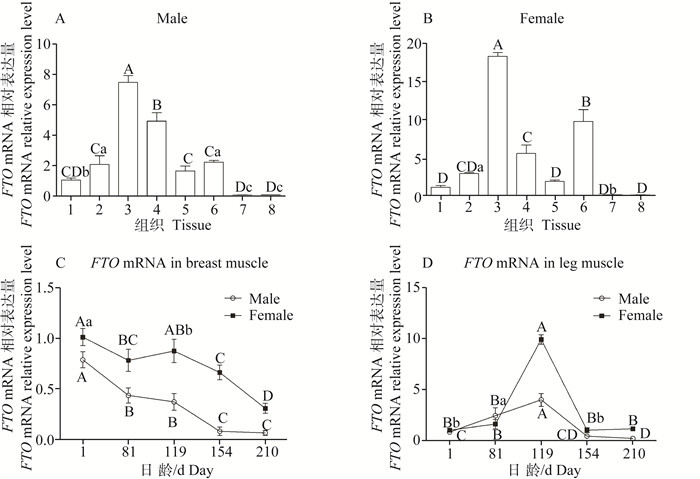
|
A和B分别表示荧光定量PCR检测FTO mRNA在154日龄公、母藏鸡各组织中的相对表达量,以心组织的表达水平为对照,n=5:1.心;2.肝;3.脾;4.肺;5.肾;6.皮下脂肪;7.胸肌;8.腿肌。C和D分别表示荧光定量检测FTO mRNA在不同年龄段(1、81、119、154和210日龄)的公母藏鸡胸肌和腿肌中的相对表达量,以1日龄藏鸡的FTO mRNA表达水平为对照,n=10,同一性别做组间比较;GAPDH作为内参;不同小写字母表示差异显著(P < 0.05),不同大写字母表示差异极显著(P < 0.01),相同字母表示差异不显著(P>0.05) Figure A and B show the relative expression levels of FTO mRNA in the different tissues of 154 days old male and female Tibetan chickens by real-time quantitative PCR, compared with the expression level of the heart tissue, n=5:1. heart; 2. liver; 3. spleen; 4. lung; 5. kidney; 6. subcutaneous fat; 7. breast muscle; 8. leg muscle. Figure C and D show the relative expression of FTO mRNA in breast muscle and leg muscle of male and female Tibetan chickens in different ages(1, 81, 119, 154 and 210 days old) by real-time quantitative PCR, compared with the expression level of 1 day old, n=10, and the same sex is compared among the groups; GAPDH is used as internal reference gene; Different superscript lowercase and capital letters respectively show significant difference (P < 0.05) and extremely significant difference (P < 0.01), the same letter show no significant difference(P>0.05) 图 6 FTO mRNA在藏鸡不同组织及不同年龄段的胸肌和腿肌中的相对表达水平 Figure 6 Relative expression level of FTO mRNA in different tissues and different ages of Tibetan chickens |
时序表达差异结果显示(图 6C、D),藏鸡FTO mRNA在胸肌中的表达水平随生长日龄的增加呈逐渐下降的趋势,1日龄公藏鸡FTO mRNA表达水平极显著高于其他日龄(P < 0.01)。1日龄母藏鸡FTO mRNA表达水平显著高于119日龄(P < 0.05),极显著高于其他日龄(P < 0.01)。在腿肌中的表达水平随生长日龄的增加呈先上升后下降的趋势,在119日龄时FTO mRNA表达水平达到峰值,且极显著高于其他日龄(P < 0.01)。
2.6 藏鸡FTO mRNA表达水平与IMF含量的相关性分析根据本实验室前期研究获得的藏鸡IMF含量数据(81、119、154和210年龄段公母各10只)[12]以及本试验藏鸡FTO基因的时序表达结果,对藏鸡不同年龄段胸肌及腿肌中FTO mRNA表达水平与IMF含量进行相关性分析,结果表明,藏鸡不同发育阶段不同肌肉组织中FTO mRNA表达水平与其IMF含量呈不同程度的相关,其中在81~210日龄段藏鸡胸肌中,FTO mRNA表达水平与其IMF含量均呈负相关,在母鸡上的相关性为-0.457(P < 0.05)。在81~119日龄藏鸡腿肌中FTO mRNA表达水平与其IMF含量的显著性无性别上的差异,119~210日龄,公藏鸡腿肌中FTO mRNA表达水平与IMF含量呈显著正相关(r=0.601,P < 0.05),而母藏鸡则呈负相关(表 2)。
|
|
表 2 藏鸡FTO mRNA表达水平与IMF含量的相关性分析 Table 2 The correlation between FTO mRNA expression level and IMF content in Tibetan chickens |
人过量摄取动物性脂肪不仅会导致肥胖,还会引起机体脂质代谢异常,导致糖尿病、心脑血管等多种疾病的发生。近年来,随着对肥胖发生及能量代谢分子水平研究的愈发深入,肥胖易感基因FTO备受畜牧工作者的关注。已有的研究表明,FTO基因与肥胖[13-14]、饮食[15-16]和能量代谢[4, 17]等紧密相关。但目前尚未见在藏鸡中的相关研究,为了阐明该基因在藏鸡脂肪沉积中的作用,在基于NCBI中原鸡FTO基因序列的基础上,克隆获得藏鸡FTO基因序列,检测其在藏鸡不同组织及不同发育阶段胸肌和腿肌中的时序表达情况,分析FTO mRNA在胸肌和腿肌中的表达水平与IMF含量的关系,为后续研究FTO基因在藏鸡脂代谢中的作用提供参考。
本试验克隆获得藏鸡FTO基因序列长度为1 585 bp,其中包含CDS区1 524 bp,编码507个氨基酸,与原鸡(NM_001185147.1)FTO核苷酸相比存在有6个突变位点(c.476A>G(p.Asp159Gly)、c.683A>G(p.Glu228Gly)、c.791C>G(p.Thr264Ser)、c.1177G>A(p.Glu393Lys)、c.1345G>A(p.Ala449Thr)、c.1477C>T(p.Leu493Phe)),且均是错义突变,两者的分子量与等电点也随之改变。研究指出,FTO基因的变异将会提高肥胖和Ⅱ型糖尿病发生风险[18-19],但发生变异是否会影响其生物学功能需要后续的试验来证明。蛋白质的磷酸化与糖基化是蛋白翻译后重要的修饰方式[20-21],本试验预测结果显示,藏鸡FTO蛋白有45个磷酸化位点,4个糖基化位点,这些位点可能对调节FTO蛋白功能起关键作用。FTO蛋白包含N端结构域(NTD)和C端结构域(CTD)[22],其中NTD与AlkB(Alkylation DNA repair protein)家族的活性中心具有相似的结构,该结构域能够催化去甲基酶活性参与脂肪酸代谢、翻译后修饰和核酸的损伤修复[23]。CTD能够与NTD缔合起相互作用,如果CTD中某些氨基酸的突变会导致FTO蛋白活性的降低,暗示CTD在稳定NTD结构和催化功能上起着重要作用[3]。蛋白质三级结构对比显示,禽类与哺乳动物间的FTO蛋白具有较高的相似性,但并不完全一致,表明其具有物种特异性。氨基酸序列同源比对分析显示,FTO基因在人、鼠、猪等哺乳动物中高度保守,从进化树中也可以看出禽类和哺乳动物FTO基因处在两条不同的进化支线上,FTO基因在禽类中也高度保守,推测其生物学功能可能在禽类与哺乳动物之间存在着一定的差异。
获得基因在生物体内的表达特点是了解其具体功能机制不可或缺的一项内容。本研究结果指出,FTO基因广泛表达于藏鸡的各个组织中,且在脾组织中的表达水平最高,这可能与脾参与FTO影响细胞内的脂质代谢途径有关[24],同样在皮下脂肪和肝组织中也有较高的表达水平,王玉峰的试验研究结果显示,FTO在罗斯肉鸡与莱航蛋鸡的下丘脑、内脏脂肪和肝组织中表达水平较高[11],这与本研究的结果存在相似及不同之处。该基因在禽类脂肪和肝组织中的较高水平表达可能与这两个组织是禽类能量代谢的主要场所有关。总之,这和藏鸡作为一种青藏高原动物,可能具有自己特别的调控方式有关。FTO在其他动物组织表达中具有不同的报道,T.M. Frayling等[2]研究指出,FTO在人下丘脑弓状核的表达水平较高,T. Gerken和R. Fredriksson等[3, 6]指出,FTO mRNA主要在大鼠和小鼠的中枢和外周组织中表达,林亚秋等[25]指出,FTO mRNA主要表达于山羊脂肪、脾和肺组织,X.L.Chen等[26]研究指出,FTO主要表达于猪的肺和皮下脂肪组织。综上,无论是哺乳动物还是禽类,FTO 普遍都高表达于管理能量平衡的下丘脑区域以及能量代谢组织器官,提示,FTO可能在调节机体能量平衡中发挥着重要作用。本研究中时序表达谱显示,FTO在藏鸡同一部位肌肉组织中表达模式不存在性别差异,但在藏鸡胸肌和腿肌具有不同的表达模式,提示不同部位肌肉组织发育的潜在分子机制可能存在差异。C. Song等[27]研究指出,清远麻鸡和隐性白鸡下丘脑中FTO基因的表达量在1周龄时最高,胸肌中FTO基因的表达量在20胚龄、1周龄和8周龄时隐性白鸡均显著高于清远麻鸡。由此可知,不同组织部位、饲喂条件、年龄和品种等都会影响FTO的表达。然而,FTO基因在空间和时间上的广泛表达,是否预示着FTO功能的普遍性,除了参与肥胖及能量代谢,其是否还涉及其他生物学功能,这些都需要后续的研究来证明。
哺乳动物上的研究指出,FTO基因与肥胖及相关生产性能指标有一定的关系。T.M. Frayling等[2]发现,FTO多态性可通过影响BMI促进Ⅱ型糖尿病的患病风险,牛FTO基因的多个SNPs位点与胴体性状存在紧密关联,尤其与瘦肉百分比[28]和大理石纹[29]有着显著相关,猪FTO基因表达水平与瘦肉率、肌间脂肪含量及背膘厚密切相关[30-31]。研究表明,随着3T3-L1脂肪细胞分化的进行,FTO的表达水平呈上升趋势[32],FTO-/-小鼠脂肪细胞较小且白色脂肪组织较少[8],FTO表达能促进猪细胞内的脂质代谢和脂质堆积[33]。以上研究表明,FTO基因可能在脂肪沉积过程中发挥重要作用,为了揭示该基因与藏鸡IMF沉积的关系,本研究对藏鸡不同日龄胸肌和腿肌中FTO mRNA表达水平与IMF含量进行了相关分析,结果显示,藏鸡不同发育阶段不同肌肉组织中FTO mRNA表达水平与其IMF含量呈不同程度的相关,但存在性别差异。本实验室下一步将以体外培养的藏鸡肌内前体脂肪细胞为研究对象,通过超表达和干扰的手段来进一步阐明该基因对脂肪沉积的调控作用及其可能的作用机制。
4 结论本试验克隆得到藏鸡FTO基因序列1 585 bp,编码507个氨基酸,具有一个N端结构域和一个C端结构域。组织表达谱显示, FTO基因广泛表达于藏鸡的各个组织中,在脾组织中表达水平最高;时序表达谱显示,FTO基因在藏鸡胸肌和腿肌具有不同的表达模式,存在部位和年龄差异。相关分析指出,FTO基因的表达水平与IMF含量具有不同程度的相关性。本试验研究结果为最终阐明FTO基因在藏鸡肌内脂肪沉积和脂质代谢中的作用提供基础数据。
| [1] | WANG Y H, BYRNE K A, REVERTER A, et al. Transcriptional profiling of skeletal muscle tissue from two breeds of cattle[J]. Mamm Genome, 2005, 16(3): 201–210. DOI: 10.1007/s00335-004-2419-8 |
| [2] | FRAYLING T M, TIMPSON N J, WEEDON M N, et al. A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity[J]. Science, 2007, 316(5826): 889–894. DOI: 10.1126/science.1141634 |
| [3] | GERKEN T, GIRARD C A, TUNG Y C L, et al. The obesity-associated FTO gene encodes a 2-oxoglutarate-dependent nucleic acid demethylase[J]. Science, 2007, 318(5855): 1469–1472. DOI: 10.1126/science.1151710 |
| [4] | HAUPT A, THAMER C, STAIGER H, et al. Variation in the FTO gene influences food intake but not energy expenditure[J]. Exp Clin Endocrinol Diabetes, 2009, 117(4): 194–197. |
| [5] | STRATIGOPOULOS G, PADILLA S L, LEDUC C A, et al. Regulation of Fto/Ftm gene expression in mice and humans[J]. Am J Physiol Regul Integr Comp Physiol, 2008, 294(4): R1185–R1196. DOI: 10.1152/ajpregu.00839.2007 |
| [6] | FREDRIKSSON R, HÄGGLUND M, OLSZEWSKI P K, et al. The obesity gene, FTO, is of ancient origin, up-regulated during food deprivation and expressed in neurons of feeding-related nuclei of the brain[J]. Endocrinology, 2008, 149(5): 2062–2071. DOI: 10.1210/en.2007-1457 |
| [7] | FAWCETT K A, BARROSO I. The genetics of obesity:FTO leads the way[J]. Tends Genet, 2010, 26(6): 266–274. DOI: 10.1016/j.tig.2010.02.006 |
| [8] | FISCHER J, KOCH L, EMMERLING C, et al. Inactivation of the Fto gene protects from obesity[J]. Nature, 2009, 458(7240): 894–898. DOI: 10.1038/nature07848 |
| [9] | CHURCH C, LEE S, BAGG E A L, et al. A mouse model for the metabolic effects of the human fat mass and obesity associated FTO gene[J]. PLoS Genet, 2009, 5(8): e1000599. DOI: 10.1371/journal.pgen.1000599 |
| [10] | CHURCH C, MOIR L, MEMURRAY F, et al. Overexpression of Fto leads to increased food intake and results in obesity[J]. Nat Genet, 2010, 42(12): 1086–1092. DOI: 10.1038/ng.713 |
| [11] |
王玉峰. 鸡FTO基因: 组织特异性表达、中枢核团定位、品种差异以及禁食的影响[D]. 南京: 南京农业大学, 2009.
WANG Y F. Chicken FTO gene:tissue-specific expression, brain distribution, breed difference and effect of fasting[D]. Nanjing:Nanjing Agricultural University, 2009. (in Chinese) |
| [12] |
林亚秋, 徐亚欧, 张润锋, 等. 藏鸡Chemerin和ChemR23基因时序表达及其与肌内脂肪含量的相关性研究[J]. 畜牧兽医学报, 2015, 46(8): 1290–1299.
LIN Y Q, XU Y O, ZHANG R F, et al. Association analysis of sequential expression of Chemerin and ChemR23 with intramuscular fat contents in Tibetan chicken[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(8): 1290–1299. (in Chinese) |
| [13] | DE LUIS D A, ALLER R, CONDE R, et al. Relation of the rs9939609 gene variant in FTO with metabolic syndrome in obese female patients[J]. J Diabetes Complications, 2013, 27(4): 346–350. DOI: 10.1016/j.jdiacomp.2013.02.003 |
| [14] | WEN W Q, CHO Y S, ZHENG W, et al. Meta-analysis identifies common variants associated with body mass index in east Asians[J]. Nat Genet, 2012, 44(3): 307–311. DOI: 10.1038/ng.1087 |
| [15] | WARDLE J, CARNELL S, HAWORTH C M A, et al. Obesity associated genetic variation in FTO is associated with diminished satiety[J]. J Clin Endocrinol Metab, 2008, 93(9): 3640–3643. DOI: 10.1210/jc.2008-0472 |
| [16] | JOHNSON L, VAN JAARSVELD C H M, EMMETT P M, et al. Dietary energy density affects fat mass in early adolescence and is not modified by FTO variants[J]. PLoS One, 2009, 4(3): e4594. DOI: 10.1371/journal.pone.0004594 |
| [17] | CECIL J E, TAVENDALE R, WATT P. An obesity-associated FTO gene variant and increased energy intake in children[J]. N Engl J Med, 2008, 359(24): 2558–2566. DOI: 10.1056/NEJMoa0803839 |
| [18] | WÅHLÉN K, SJÖLIN E, HOFFSTEDT J. The common rs9939609 gene variant of the fat mass-and obesity-associated gene FTO is related to fat cell lipolysis[J]. J Lipid Res, 2008, 49(3): 607–611. DOI: 10.1194/jlr.M700448-JLR200 |
| [19] | LI H, KILPELÄINEN T O, LIU C, et al. Association of genetic variation in FTO with risk of obesity and type 2 diabetes with data from 96, 551 East and South Asians[J]. Diabetologia, 2012, 55(4): 981–995. DOI: 10.1007/s00125-011-2370-7 |
| [20] | KIM J H, LEE J, OH B, et al. Prediction of phosphorylation sites using SVMs[J]. Bioinformatics, 2004, 20(17): 3179–3184. DOI: 10.1093/bioinformatics/bth382 |
| [21] | GUPTA R, BRUNAK S. Prediction of glycosylation across the human proteome and the correlation to protein function[J]. Pac Symp Biocomput, 2002, 7: 310–322. |
| [22] | HAN Z F, NIU T H, CHANG J B, et al. Crystal structure of the FTO protein reveals basis for its substrate specificity[J]. Nature, 2010, 464(7292): 1205–1209. DOI: 10.1038/nature08921 |
| [23] | OZER A, BRUICK R K. Non-heme dioxygenases:cellular sensors and regulators jelly rolled into one?[J]. Nat Chem Biol, 2007, 3(3): 144–153. DOI: 10.1038/nchembio863 |
| [24] |
孙春亮, 季兵, 付海波, 等. 脾切除对脂质代谢影响的临床研究[J]. 肝胆胰外科杂志, 2002, 14(3): 154–156.
SUN C L, JI B, FU H B, et al. Clinical study of the effect of splenectomy on lipid metabolism[J]. Journal of Hepatopancreatobiliary Surgery, 2002, 14(3): 154–156. (in Chinese) |
| [25] |
林亚秋, 廖红海, 贺庆华, 等. 山羊FTO基因克隆及其表达谱[J]. 畜牧兽医学报, 2016, 47(5): 888–898.
LIN Y Q, LIAO H H, HE Q H, et al. Cloning and expression profiling of FTO gene of goat[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(5): 888–898. (in Chinese) |
| [26] | CHEN X L, ZHOU B, LUO Y L, et al. Tissue distribution of porcine FTO and its effect on porcine intramuscular preadipocytes proliferation and differentiation[J]. PLoS One, 2016, 11(3): e0151056. DOI: 10.1371/journal.pone.0151056 |
| [27] | SONG C, SONG W T, SHU J T, et al. Tissue-and breed-specific expression of the chicken fat mass-and obesity-associated gene (FTO)[J]. Genet Mol Res, 2015, 14(3): 10500–10506. DOI: 10.4238/2015.September.8.11 |
| [28] | JEVSINEK SKOK D, KUNEJ T, KOVAC M, et al. FTO gene variants are associated with growth and carcass traits in cattle[J]. Anim Genet, 2016, 47(2): 219–222. DOI: 10.1111/age.2016.47.issue-2 |
| [29] | CHUNG E R. Novel SNP in the coding region of the FTO gene is associated with marbling score in Hanwoo (Korean cattle)[J]. J Anim Sci Technol, 2014, 56: 27. DOI: 10.1186/2055-0391-56-27 |
| [30] | FONTANESI L, SCOTTI E, BUTTAZZONI L, et al. Confirmed association between a single nucleotide polymorphism in the FTO gene and obesity-related traits in heavy pigs[J]. Mol Biol Rep, 2010, 37(1): 461–466. DOI: 10.1007/s11033-009-9638-8 |
| [31] | DVOŘÁKOVÁ V, BARTENSCHLAGER H, STRATIL A, et al. Association between polymorphism in the FTO gene and growth and carcass traits in pig crosses[J]. Genet Sel Evol, 2012, 44: 13. DOI: 10.1186/1297-9686-44-13 |
| [32] |
徐心祥, 刘峰. FTO基因在3T3-L1前体脂肪细胞成脂分化中的表达趋势[J]. 实用临床医药杂志, 2009, 13(11): 76–77.
XU X X, LIU F. Expression of FTO gene in adipogenic differentiation of 3T3-L1 preadipocytes[J]. Journal of Clinical Medicine in Practice, 2009, 13(11): 76–77. (in Chinese) |
| [33] |
牛丛丛. 脂肪和肥胖相关基因(FTO)的转录调控及其功能研究[D]. 武汉: 华中农业大学, 2012.
NIU C C. The transcriptional regulation and functional research of fat mass and obesity associated gene FTO[D]. Wuhan:Huazhong Agricultural University, 2012. (in Chinese) http://www.docin.com/p-1003086550.html |



