原产于东南亚、非洲南部等地的藤黄果因其果皮富含大量的酸性成分而被广泛用于制作食品防腐剂、调味剂或食物添加剂[1]。在许多亚洲国家,藤黄果自古以来一直被用于辅助治疗风湿症和肠道疾病,同时也常常被使用作为泻药、利尿剂、驱虫剂和催吐剂[2];同时,因其含有高浓度的维生素C而被用于治疗各种心脏病[3]。藤黄果因其在医药方面重要的生物学价值,尤其是食用、保健等功效而越来越引起人们的关注。
(一)-羟基柠檬酸(HCA)是藤黄果中最主要的有机酸,也是其最主要的活性成分。(一)-HCA主要以无机盐或内酯的形式存在于藤黄果果皮中[2],与柠檬酸具有类似的结构[4]。在体内,(一)-HCA作为柠檬酸裂解酶的竞争性抑制剂调节碳水化合物的代谢,从而降低机体脂肪酸的合成[5]。大量研究表明,(一)-HCA具有抗肥胖、抑制食欲[6]、降血脂[7]和抗癌等广泛的生物学活性。以往的研究表明,(一)-HCA可抑制机体脂肪酸的合成,并减少体重的增加,但其具体的生物学机制还不完全清楚,且其对家禽脂肪代谢调节的研究也鲜有报道。笔者实验室前期研究表明,日粮中添加不同剂量的(一)-HCA可通过调节机体脂代谢相关基因的表达而减少肉鸡腹脂的沉积[8]。
机体过量脂肪沉积造成的肥胖是引发各种代谢疾病(胰岛素抵抗、心血管疾病、糖尿病等)的重要因素,而脂肪沉积主要表现为增生(细胞数增加)和肥大(细胞体积增加)两种形式[9]。肝作为家禽脂肪代谢的主要场所,其在脂肪酸的合成与氧化分解过程中均发挥了重要作用。因此,本试验以鸡胚原代肝细胞为研究对象,探讨不同剂量(一)-HCA对鸡胚原代肝细胞增殖和线粒体功能的影响,旨在从细胞生物学特性的角度阐明(一)-HCA调节家禽脂肪代谢的机制,以其为(一)-HCA作为降脂调节剂的应用研究提供理论基础。
1 材料与方法 1.1 实验材料(一)-HCA购于USP Reference Standard公司;氢化可的松、MTT、胰蛋白酶购于GIBCO公司;基础培养液M199购于Hyclone公司;HEPES、转铁蛋白、L-谷氨酰胺和青链霉素购于Sigma公司;Trizol购于Invitrogen公司;SYBR Premix Ex Taq试剂盒购于南京博飞科技有限公司;反转录试剂盒购于南京诺唯赞生物技术有限公司;JC-1线粒体膜电位检测试剂盒、BCA蛋白浓度测定试剂盒购于碧云天生物科技有限公司;琥珀酸脱氢酶(SDH)检测试剂盒购于南京建成生物工程研究所;PCR引物由上海英俊生物技术有限公司合成;柠檬酸合酶(CS)ELISA试剂盒购于上海恒远生物科技有限公司。
1.2 试验方法 1.2.1 肝细胞的分离和培养参照S. W. Kennedy等[10]报道的鸡胚原代肝细胞分离培养方法,并加以改进。简述如下,取9胚龄鸡胚剖腹取出肝,4 ℃预冷的PBS漂洗3次后将肝组织剪成1 mm见方的组织小块,悬浮于PBS中静置1~2 min后去除上清。组织沉淀加入0.25%胰蛋白酶液37 ℃水浴孵育10 min后,用含10%胎牛血清的M199培养液漂洗,无菌吸管吹打使细胞分散、脱落,细胞悬液分别经100目、200目和400目细胞网筛过滤。收集细胞液离心2次(1 100 r·min-1×3 min);弃上清后悬浮于适量无血清M199培养液离心2次(650 r·min-1×3 min);弃上清后加入无血清M199培养液将细胞混匀制备成肝细胞悬液,培养液中含100 IU·mL-1青霉素、100 μg·mL-1链霉素、1 μg·mL-1氢化可的松、1.75 mmol·L-1 HEPES、2 mmol·L-1 L-谷氨酰胺、5 μg·mL-1转铁蛋白。取新鲜分离的肝细胞,台盼蓝拒染法染色,倒置显微镜下计数200个细胞,观察细胞即时存活率,细胞存活率大于95%,进行以下试验。
1.2.2 细胞生长曲线的测定将500 μL鸡胚原代肝细胞悬浮液(1×106·mL-1)接种于24孔细胞培养板培养24 h,以终浓度分别为0、1、10、50 μmol·L-1的(一)-HCA处理,并于处理1、3、6、12、24和48 h后收集细胞,吹散为单个细胞,每个处理组取六孔细胞分别计数,计数结果取六孔平均值。以培养时间为横坐标,细胞数量为纵坐标,绘制细胞生长曲线。
1.2.3 流式细胞术检测细胞周期将2 mL鸡胚原代肝细胞(1×106·mL-1)接种于6孔细胞培养板培养24 h后,以终浓度分别为0、1、10、50 μmol·L-1的(一)-HCA处理24 h,收集细胞于1.5 mL EP管内。4 ℃,1 500 r·min-1离心10 min,预冷PBS清洗细胞2次后,加入预冷70%乙醇固定,4 ℃,1 500 r·min-1离心10 min后弃去上清,加入周期测定试剂(含50 μg·mL-1 PI,100 μg·mL-1 RNaseA,0.2% TritonX-100),4 ℃避光孵育30 min,流式细胞术测定各期细胞比例。
1.2.4 电镜样品制备及线粒体数量分析细胞细胞处理同“1.2.3 ”。以终浓度分别为0、1、10、50 μmol·L-1 (一)-HCA处理48 h后,收集细胞于1.5 mL EP管内。1 000 r·min-1离心5 min,使细胞聚集成团块,滴加预冷的4%戊二醛固定细胞,4 ℃过夜后经PBS漂洗,1%饿酸固定、PBS漂洗、丙酮脱水、Epon812包埋,制作超薄切片,铅铀染色,透射电镜观察。
线粒体计数:每个试验处理组拍摄细胞透射电镜照片20张,每张照片随机选取15个独立细胞,计算鸡胚原代肝细胞内平均线粒体的数量。
1.2.5 线粒体膜电位测定细胞处理同“1.2.3 ”。以终浓度分别为0、1、10、50 μmol·L-1 (一)-HCA处理24 h后收集细胞,加入JC-1工作液,37 ℃孵育20 min,PBS清洗去除多余染料,上机待测。当线粒体膜电位较高时,JC-1聚集于线粒体基质中形成聚合物,发出红色荧光;当线粒体膜电位较低时,JC-1为单体,发出绿色荧光,激发波长为590 nm,发射波长为530 nm。线粒体膜电位的结果以590 nm/530 nm的平均荧光强度表示。
1.2.6 线粒体琥珀酸脱氢酶(SDH)的检测细胞培养和处理同“1.2.3 ”。以终浓度分别为0、1、10、50 μmol·L-1 (一)-HCA处理24 h后收集细胞,加入300 μL生理盐水,冰浴超声破碎,4 ℃,3 000 r·min-1离心20 min。按照试剂盒说明配制工作液,避光37 ℃孵育5 min,取100 μL待测样品于1 cm比色皿中,加入预热工作液,600 nm处检测吸光度,5 s后读取OD1,65 s后读取OD2。同时,以BCA法测定待测样品的蛋白质浓度。SDH活性以每分钟内,每毫克蛋白质在上述反应体系内OD600nm处吸光值的增加量来表示,即SDH活性(U·mg-1 protein)=(OD1-OD2)/反应时间(1 min)/[取样量(0.1 mL)×蛋白质浓度]。
1.2.7 柠檬酸合酶(CS)的检测细胞培养和处理同“1.2.3 ”。以终浓度分别为0、1、10、50 μmol·L-1 (一)-HCA处理24 h后收集细胞,加入300 μL细胞生理盐水,冰浴超声破碎,4 ℃,3 000 r·min-1离心20 min,收集上清。采用酶联免疫吸附法(ELISA)检测鸡胚原代肝细胞中柠檬酸合酶的活性。按照试剂盒说明书方法稀释标准品,空白孔不加样、标准孔加标准品50 μL,样品孔加稀释液40 μL和样品10 μL,37 ℃温育30 min后洗涤5次,拍干后加入酶标试剂50 μL,37 ℃温育30 min后洗涤5次,拍干后加入显色液A、B各50 μL后混匀、避光37 ℃孵育15 min,加入终止液50 μL,酶标仪450 nm处读取OD值,计算柠檬酸合酶活性。
1.2.8 Real-time PCR法检测细胞周期蛋白mRNA转录水平 1.2.8.1 总RNA提取细胞培养及处理同“1.2.3 ”。Trizol试剂盒提取鸡胚原代肝细胞总RNA,生物分光光度法测定RNA浓度和纯度(OD260 nm/OD280 nm =1.8~2.0)。
1.2.8.2 反转录按试剂盒说明进行,即10 μL体系内总RNA最大含量不超过500 ng,加入2 μL 5×PrimeScript RT Master Mix,DEPC水补足10 μL。轻轻混匀后进行反转录,反转录程序为37 ℃ 15 min;85 ℃ 5 min。
1.2.8.3 目的基因和内参引物参考GenBank上鸡的相关cDNA序列,用Primer Premier 5软件设计β-actin和目的基因的引物,由上海英骏生物技术有限公司合成,目的基因和内参引物序列见表 1。
|
|
表 1 目的基因及β-actin引物序列 Table 1 Prime sequence of targeted genes and β-actin |
采用20 μL定量反应体系(2 μL cDNA模板,10 μL SYBR Green Real-time PCR Master Mix,β-actin或目的基因引物2 μL,DEPC水补足20 μL)。反应条件为95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,重复40个循环。目的基因转录量采用2-△△Ct法进行统计。
1.3 统计分析数据以“x±sx”表示,用Graphpad prism 5和SPSS 16.0软件对试验数据进行One-Way ANOVA方差分析。
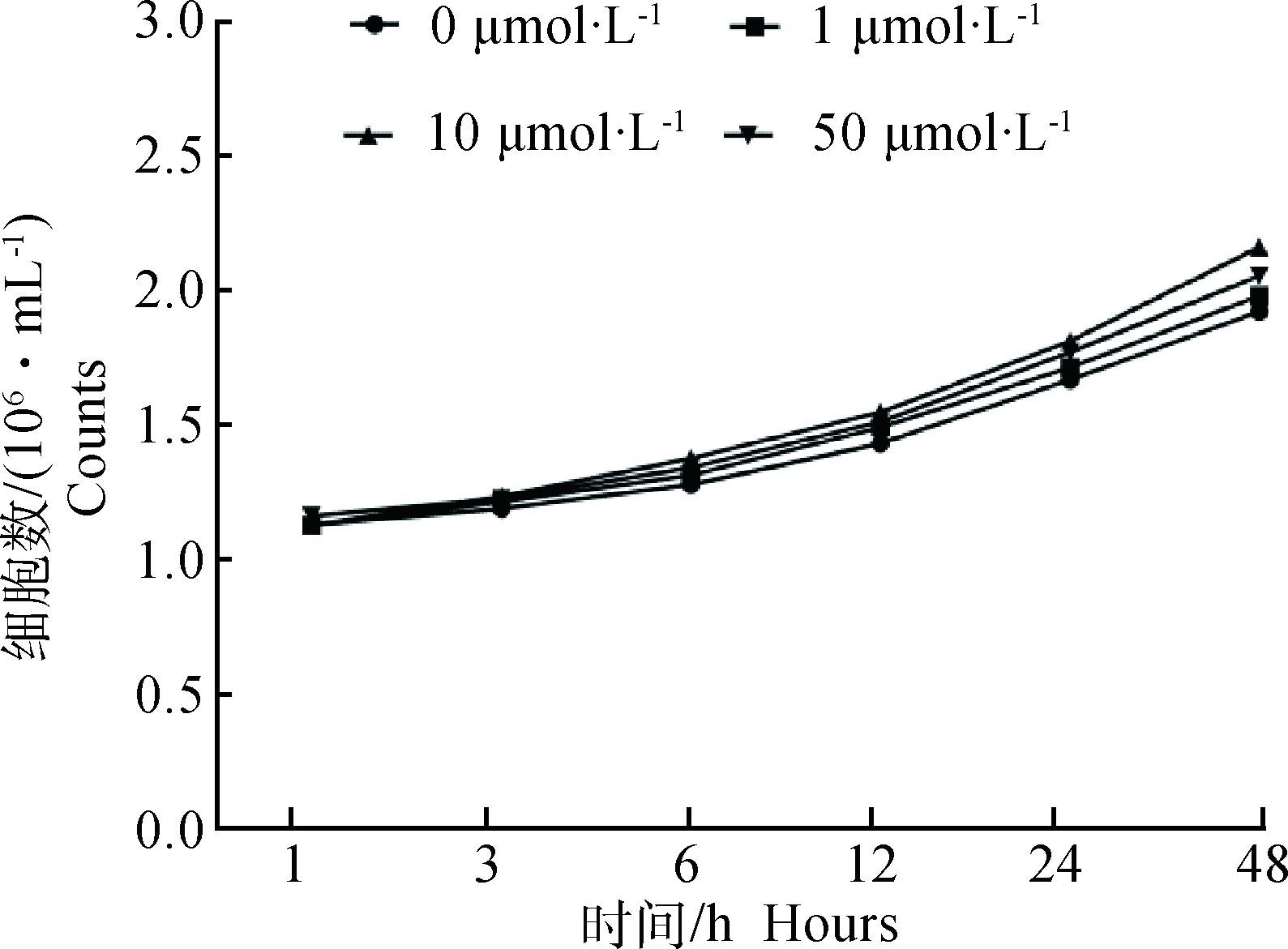
2 结果 2.1 (一)-HCA对鸡胚原代肝细胞生长的影响由图 1可知,与对照相比,1 μmol·L-1 (一)-HCA处理在1~48 h范围内对鸡胚原代肝细胞的数量无显著影响;10和50 μmol·L-1的(一)-HCA处理鸡胚原代肝细胞24~48 h时间范围内,增加了肝细胞的总数量,促进了细胞增殖,但并无统计学上的显著性差异。
|
图 1 不同浓度(一)-HCA处理下鸡胚原代肝细胞生长曲线 Figure 1 Difference concentrations (一)-HCA treatment on the growth curve of primary chicken hepatocytes |
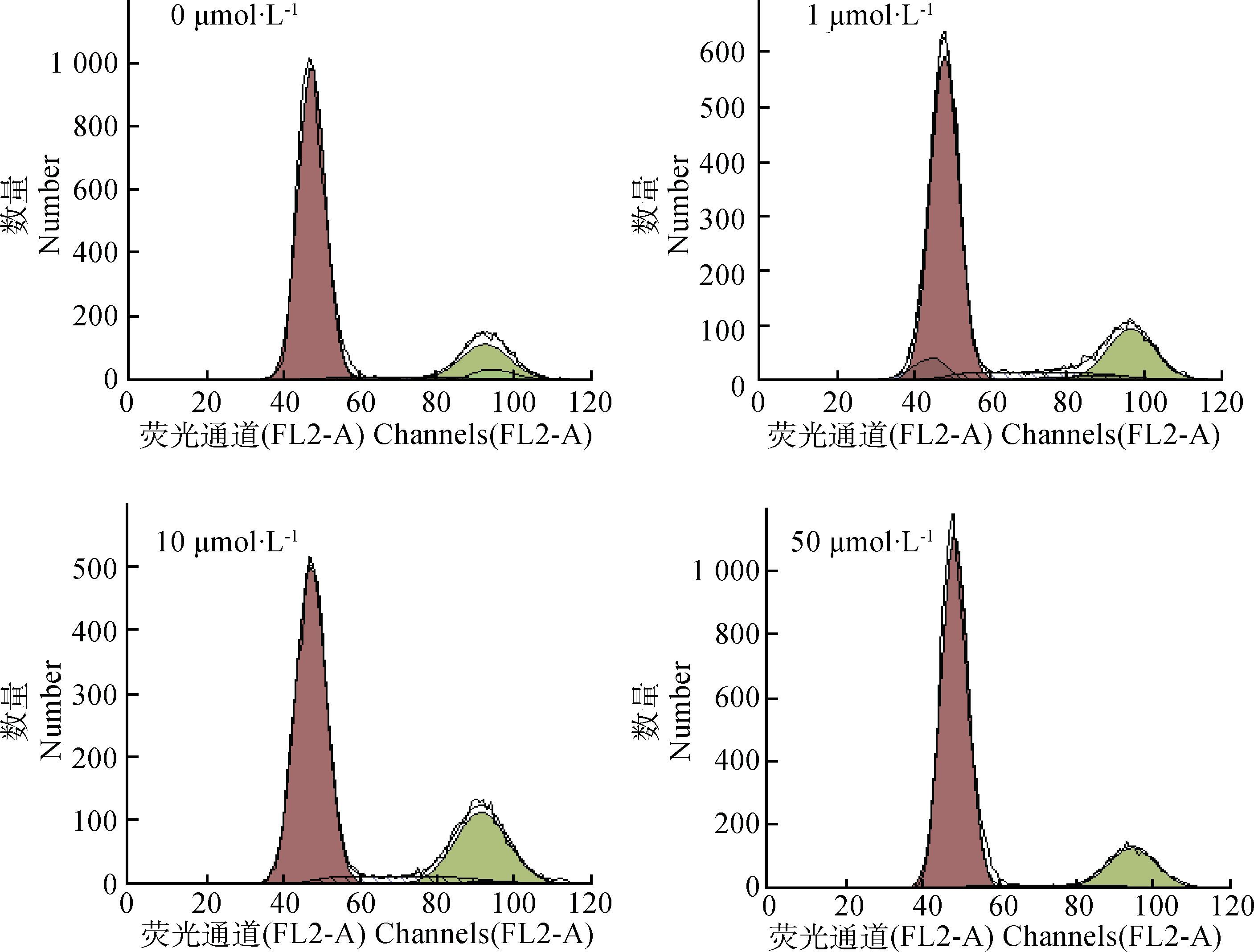
由图 2和表 2可知,与对照组相比,1 μmol·L-1 (一)-HCA处理对鸡胚原代肝细胞各期细胞比例并无显著性影响;10 μmol·L-1 (一)-HCA处理可极显著升高S期和G2/M期细胞比例(P<0.01);50 μmol·L-1 (一)-HCA处理可极显著升高S期细胞比例(P<0.01)。
|
图 2 细胞周期图 Figure 2 The figures of Flow cytometry |
|
|
表 2 (一)-HCA对鸡胚原代肝细胞周期的影响(x±sx) Table 2 Effect of (一)-HCA on primary chicken hepatocytes cycle (x±sx) |
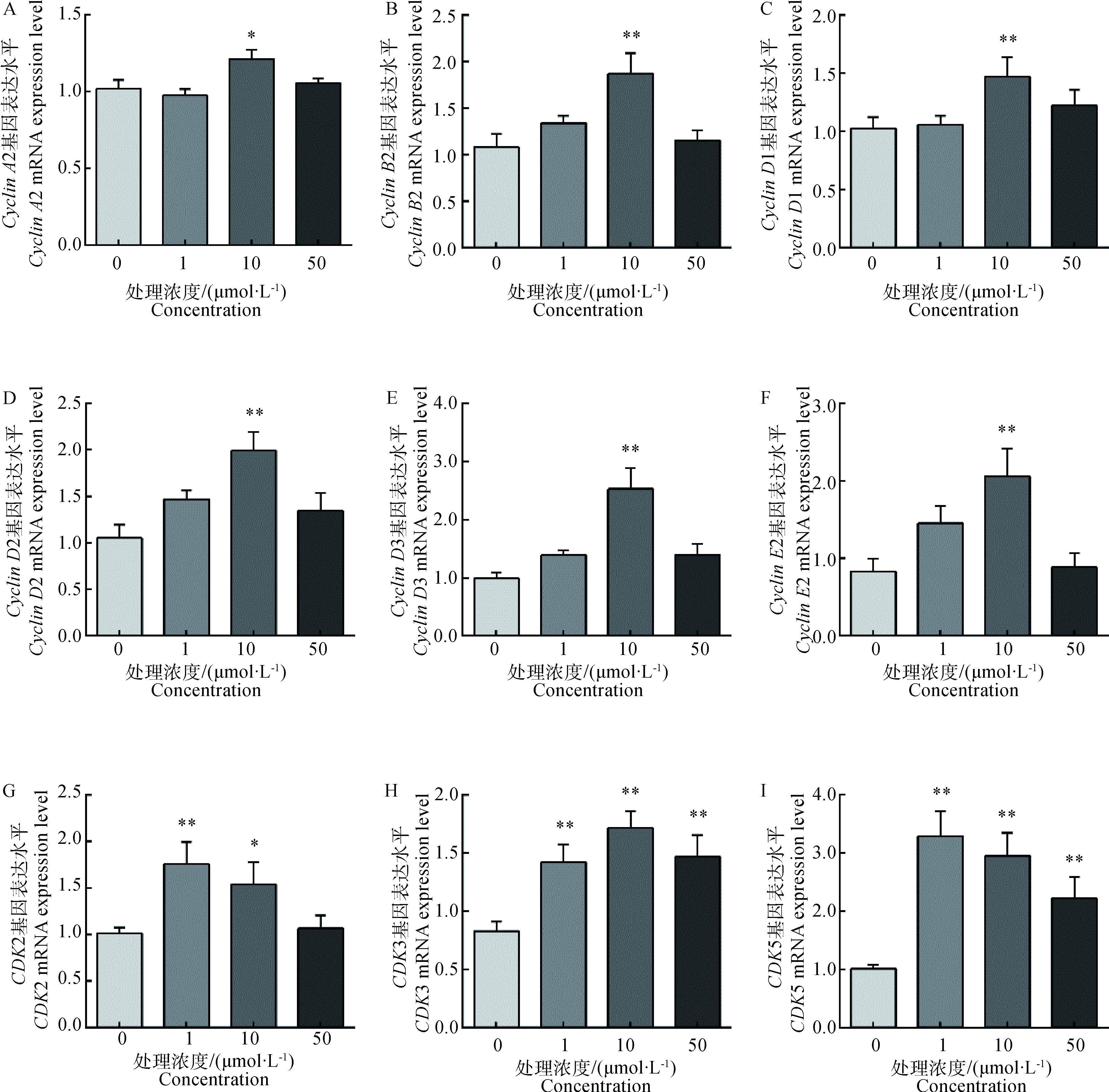
由图 3可知,与对照组相比,10 μmol·L-1 (一)-HCA处理可显著提高鸡胚原代肝细胞中Cyclin A2基因转录水平(P<0.05),极显著提高Cyclin B2、Cyclin D1、Cyclin D2、Cyclin D3和Cyclin E2基因转录水平(P<0.01);1和10 μmol·L-1 (一)-HCA处理可显著提高鸡胚原代肝CDK2基因的转录水平(P<0.05或P<0.01);1、10和50 μmol·L-1 (一)-HCA处理均可极显著提高鸡胚原代肝细胞中CDK3和CDK5的基因转录水平(P<0.01)。
|
A. CyclinA2基因; B. CyclinB2基因;C. CyclinD1基因; D. CyclinD2基因; E. CyclinD3基因; F. CyclinE2基因; G. CDK2基因; H. CDK3基因; I. CDK5基因。图中数据均以“x±sx”表示,与对照相比,**.P<0.01, *.P<0.05 A. CyclinA2; B. CyclinB2; C. CyclinD1; D. CyclinD2; E. CyclinD3; F. CyclinE2; G. CDK2; H. CDK3; I. CDK5. Data are expressed in "x±sx". Compared with control group, **.P < 0.01, *.P < 0.05 图 3 (一)-HCA对肉鸡原代肝细胞中周期相关因子基因转录的影响 Figure 3 Effect of (一)-HCA on cyclins mRNA expression in primary chicken hepatocytes |
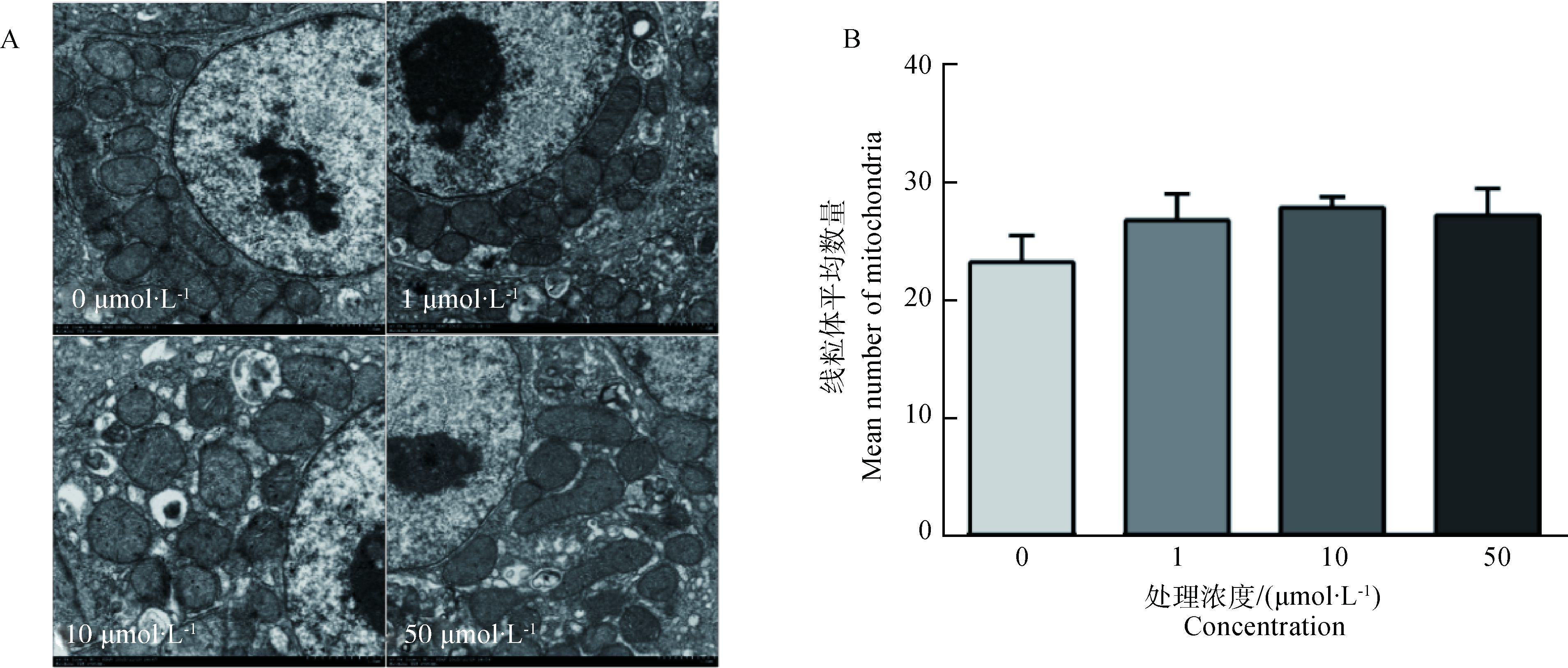
由图 4可知,不同浓度的(一)-HCA处理对鸡胚原代肝细胞线粒体超微结构无显著影响。线粒体数量统计结果表明,与对照组相比,不同浓度的(一)-HCA处理可提高原代鸡胚肝细胞中线粒体数量,但并无统计学上的显著性差异(P>0.05)。
|
A.透射电镜图(5 000×);B:线粒体数量(x±sx) A. Electron micrographs of mitochondria (5 000×); B. The mean number of mitochondria, data are expressed in "x±sx" 图 4 原代肝细胞透射电镜照片及线粒体数量 Figure 4 Effect of (一)-HCA on electron micrographs and the mean number of mitochondria in primary chicken hepatocytes |
如图 5所示,与对照组相比,不同浓度(一)-HCA处理对鸡胚原代肝细胞线粒体膜电位无统计学上的显著性影响(P>0.05)。
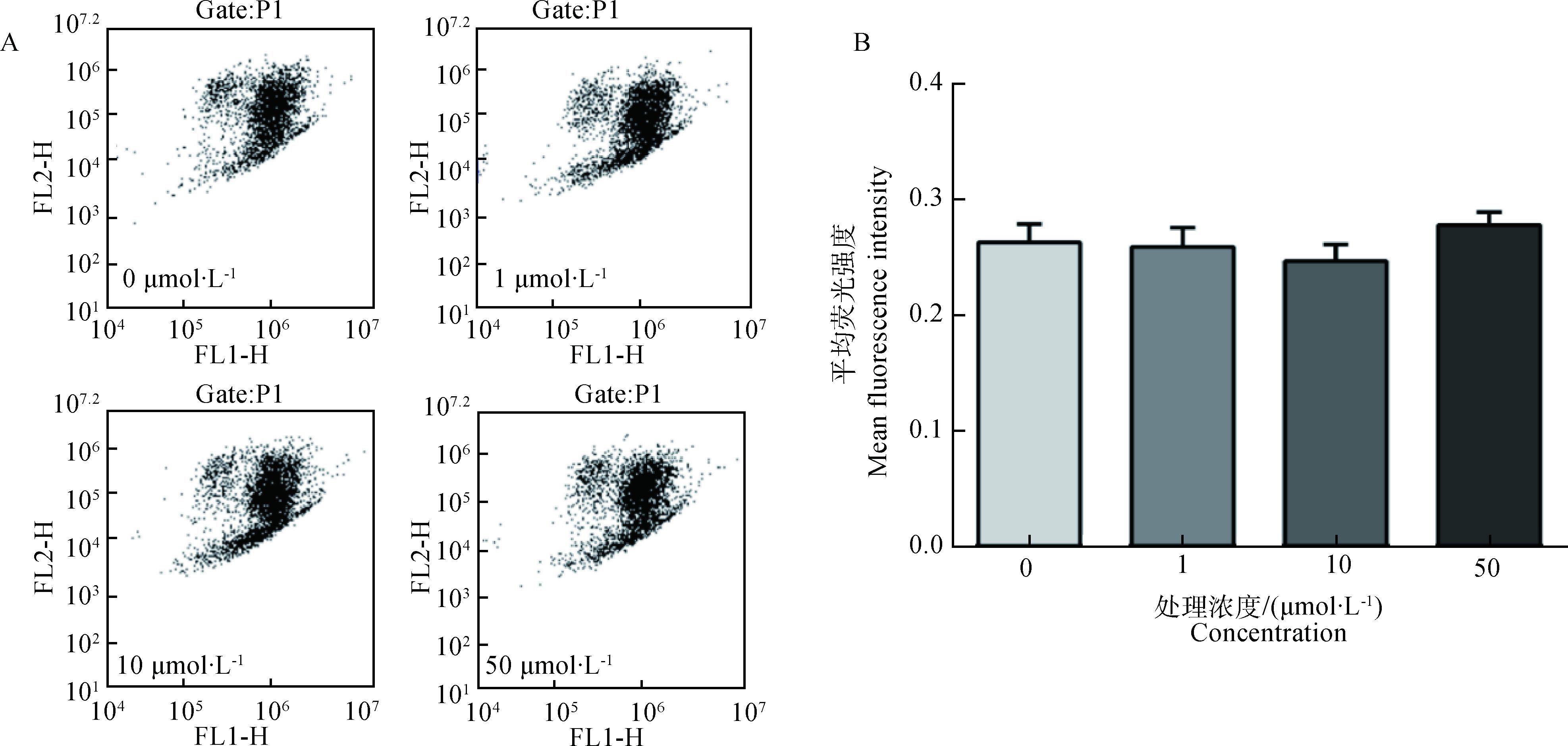
|
A.流式细胞图;B.线粒体膜电位(x±sx) A. Figure of flow cytometry detection; B. Mitochondria membrane potential, data are expressed in "x±sx" 图 5 (一)-HCA对鸡胚原代肝细胞线粒体膜电位的影响 Figure 5 Effect of (一)-HCA on the mitochondrial membrane potential in primary chicken hepatocytes |
由图 6A可知,与对照组相比,1~50 μmol·L-1 (一)-HCA处理均可极显著提高鸡胚原代肝细胞中柠檬酸合酶(CS)活性(P<0.01)。由图 6B可知,与对照组相比,10 μmol·L-1 (一)-HCA处理可显著升高鸡胚原代肝细胞线粒体中琥珀酸脱氢酶(SDH)活性(P<0.05),50 μmol·L-1 (一)-HCA处理可极显著升高原代鸡胚肝细胞线粒体中琥珀酸脱氢酶(SDH)的活性(P<0.01)。提示,(一)-HCA处理可通过提高原代鸡胚肝细胞线粒体中CS和SDH的活性而加速能量代谢,最终增强线粒体的氧化代谢功能。
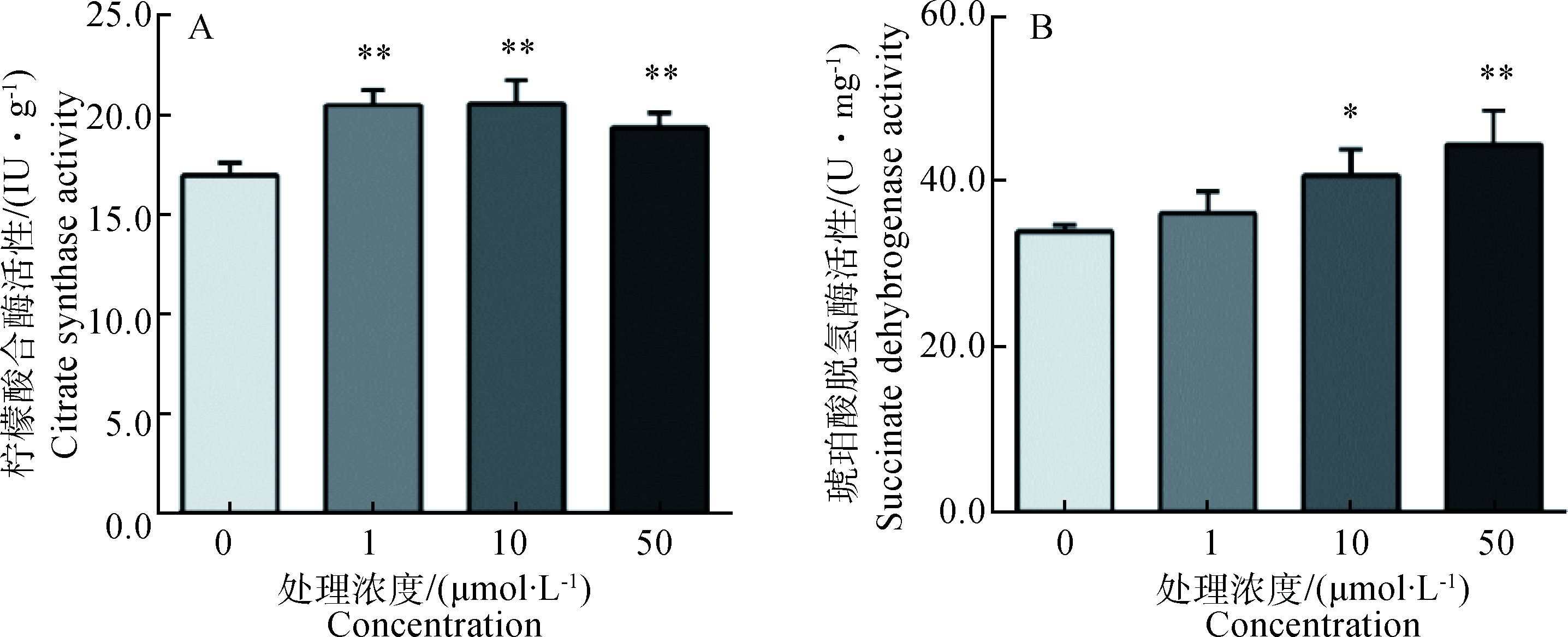
|
A.柠檬酸合酶活性;B.琥珀酸脱氢酶活性。图中数据均以“x±sx”表示,与对照相比,**.P<0.01, *.P<0.05 A. Citrate synthase activity; B. Succinate dehydrogenase activity. Data are expressed in "x±sx". Compared with control group, **.P < 0.01, *.P < 0.05 图 6 (一)-HCA对鸡胚原代肝细胞三羧酸循环关键酶活性的影响 Figure 6 Effect of (一)-HCA on the tricarboxylic acid cycle in primary chicken hepatocytes |
研究表明,(一)-HCA作为营养调节剂在控制体重增加、降低脂肪沉积等方面具有积极的作用。本实验室前期研究结果发现,日粮中添加不同浓度的(一)-HCA在不影响肉鸡品质的前提下,可降低肉鸡的体重和腹脂沉积[8]。家禽不同于哺乳动物,肝是家禽脂肪代谢的主要场所[11],肝细胞增殖及肝细胞内脂肪合成的强弱直接影响到家禽体内脂肪的沉积。
本试验研究结果显示,10和50 μmol·L-1的(一)-HCA在处理鸡胚原代肝细胞后的24~48 h明显促进了鸡胚原代肝细胞的生长。细胞周期也称细胞增殖周期,包括G1期、S期、G2期、M期四个时期。细胞周期是细胞生命活动的基本过程,由细胞周期素(cyclin)依次激活相应的细胞周期蛋白依赖激酶(CDK)所推动[12]。细胞周期高速有序的运转依赖于Cyclins/CDKs复合物来实现。CDK是一类丝氨酸/苏氨酸激酶,单独存在没有活性,Cyclins在细胞周期的不同阶段与CDKs结合,形成有活性的Cyclin-CDKs复合物,从而激活CDK分子。在G1期,细胞表达三种周期素D(D1、D2、D3)。周期素E也表达于G1期,它与CDK2结合,使细胞完成G1/S期的转换。S期的向前推进需要周期素A和CDK2形成的激酶复合物。G1/S期的转变和G0期的退出均受到CDK3的调控。
本试验结果表明,50 μmol·L-1 (一)-HCA处理鸡胚原代肝细胞后可极显著升高S期细胞比例,而10 μmol·L-1 (一)-HCA处理鸡胚原代肝细胞后可显著升高S期和G2/M期细胞比例,促进了细胞的增殖。10 μmol·L-1 (一)-HCA处理鸡胚原代肝细胞后显著上调Cyclin A2、Cyclin B2、Cyclin D1、Cyclin D2、Cyclin D3、Cyclin E2、CDK2、CDK3、CDK5基因的转录水平。说明(一)-HCA处理可以上调鸡胚原代肝细胞S期、G2期和M期相关因子的表达水平,从而促进细胞由G0/G1期向S期和G2/M期的转换。这与流式结果S期和G2/M期比例增高的结果相一致。由此可以推测,(一)-HCA可以通过提高相关周期因子mRNA转录水平,促进S期和G2/M期比例,从而促进细胞的增殖。
笔者实验室前期研究表明,日粮中添加不同剂量的(一)-HCA可减少肉鸡脂肪沉积和体增重[8]。同时,(一)-HCA可增加高脂诱导大鼠的能量代谢并提高蛋白质的合成[13]。线粒体作为细胞能量代谢的场所,其主要的功能在于合成ATP,为机体各种生命活动提供能量[14]。线粒体数目与细胞代谢水平密切相关,代谢旺盛时往往线粒体较多[15]。透射电镜结果显示,(一)-HCA处理鸡胚原代肝细胞后,线粒体形态、数量均未发生明显改变。此外,线粒体在调节钙离子和渗透压等方面也发挥着重要功能[16]。线粒体膜电位改变直接反应线粒体膜通透性的变化。本试验结果证实,1~50 μmol·L-1 (一)-HCA处理对鸡胚原代肝细胞膜电位无显著性影响。正常的线粒体膜电位是维持线粒体进行氧化磷酸化、形成ATP的前提,而线粒体膜的完整性对于细胞代谢至关重要。综合以上结果,笔者推测(一)-HCA并不是通过影响线粒体形态、数量和线粒体膜的通透性而影响鸡胚原代肝细胞的代谢。
三羧酸循环在细胞能量代谢中起着重要的作用。柠檬酸合酶是三羧酸循环入口的关键酶,催化乙酰辅酶A和草酰乙酸缩合生成柠檬酸和辅酶A。本试验结果显示,1~50 μmol·L-1 (一)-HCA处理可显著提高原代鸡胚肝细胞中柠檬酸合酶活性。同时,10和50 μmol·L-1 (一)-HCA处理可显著提高原代鸡胚肝细胞中琥珀酸脱氢酶活性。琥珀酸脱氢酶是一种黄素酶类,是唯一一个存在于三羧酸循环和呼吸链的酶,其活性与细胞内能量的生成有密切的关系,其活性的高低可间接反映线粒体功能情况[17]。本实验室近期研究结果表明,日粮中添加(一)-HCA可通过促进丙酮酸脱氢酶α和β亚基(PDHA1和PDHB)的表达进而增强机体的三羧酸循环,且可通过提高线粒体复合体Ⅰ的不同亚基(NDUFS3和NDUF10) 的表达而增强机体能量的产生[18]。综合以上结果提示,(一)-HCA处理可能通过加快三羧酸循环进而促进鸡胚原代肝细胞线粒体能量代谢水平。
综合以上结果分析,(一)-HCA处理可通过调节周期相关因子的表达而促进鸡胚原代肝细胞的增殖,并且其可通过提高柠檬酸合酶及琥珀酸脱氢酶活性进而加速三羧酸循环,最终增加细胞的能量代谢水平。该研究结果提示,(一)-HCA减少肉鸡脂肪沉积可能是由于加快代谢过程,导致了对能量更大的需求,这一结果对于探讨(一)-HCA调控畜禽脂肪沉积机制的研究提供了新的研究思路。
4 结论(一)-羟基柠檬酸(HCA)可通过调节周期相关因子的表达而促进鸡胚原代肝细胞增殖,可通过提高柠檬酸合酶及琥珀酸脱氢酶活性进而加速三羧酸循环,最终增加细胞的能量代谢水平。
| [1] | ROY S, RINK C, KHANNA S, et al. Body weight and abdominal fat gene expression profile in response to a novel hydroxycitric acid-based dietary supplement[J]. Gene Expr, 2003, 11(5-6): 251–262. |
| [2] | SEMWAL R B, SEMWAL D K, VERMAAK I, et al. A comprehensive scientific overview ofGarcinia cambogia[J]. Fitoterapia, 2015, 102: 134–148. DOI: 10.1016/j.fitote.2015.02.012 |
| [3] | PANDEY M M, RASTOGI S, RAWAT A K. Indian traditional ayurvedic system of medicine and nutritional supplementation[J]. Evid Based Complement Alternat Med, 2013, 2013: 376327. |
| [4] | JENA B S, JAYAPRAKASHA G K, SINGH R P, et al. Chemistry and biochemistry of (一)-hydroxycitric acid fromGarcinia[J]. J Agric Food Chem, 2002, 50(1): 10–22. DOI: 10.1021/jf010753k |
| [5] | SULLIVAN A C, TRISCARI J, HAMILTON J G, et al. Effect of (一)-hydroxycitrate upon the accumulation of lipid in the rat: Ⅱ. Appetite[J]. Lipids, 1974, 9(2): 129–134. DOI: 10.1007/BF02532137 |
| [6] | ASTELL K J, MATHAI M L, SU X Q, et al. A review on botanical species and chemical compounds with appetite suppressing properties for body weight control[J]. Plant Foods Hum Nutr, 2013, 68(3): 213–221. DOI: 10.1007/s11130-013-0361-1 |
| [7] | CHUAH L O, HO W Y, BEH B K, et al. Updates on antiobesity effect ofGarcinia origin (一)-HCA[J]. Evid Based Complement Alternat Med, 2013, 2013: 751658. |
| [8] | HAN J, LI L L, WANG D, et al. (一)-Hydroxycitric acid reduced fat deposition via regulating lipidmetabolism-related gene expression in broiler chickens[J]. Lipids Health Dis, 2016, 15: 37. DOI: 10.1186/s12944-016-0208-5 |
| [9] | JO J, GAVRILOVA O, PACK S, et al. Hypertrophy and/or hyperplasia: dynamics of adipose tissue growth[J]. PLoS Comput Biol, 2009, 5(3): e1000324. DOI: 10.1371/journal.pcbi.1000324 |
| [10] | KENNEDY S W, LORENZEN A, JAMES C A, et al. Ethoxyresorufin-O-deethylase and porphyrin analysis in chicken embryo hepatocyte cultures with a fluorescence multiwell plate reader[J]. Anal Biochem, 1993, 211(1): 102–112. DOI: 10.1006/abio.1993.1239 |
| [11] | JONES J G. Hepatic glucose and lipid metabolism[J]. Diabetologia, 2016, 59(6): 1098–1103. DOI: 10.1007/s00125-016-3940-5 |
| [12] | WANG W Q, HEIDEMAN L, CHUNG C S, et al. Cell-cycle arrest at G2/M and growth inhibition by apigenin in human colon carcinoma cell lines[J]. Mol Carcinog, 2000, 28(2): 102–110. DOI: 10.1002/(ISSN)1098-2744 |
| [13] | HAN N N, LI L L, PENG M L, et al. (一)-Hydroxycitric acid nourishes protein synthesis via altering metabolic directions of amino acids in male rats[J]. Phytother Res, 2016, 30(8): 1316–1329. DOI: 10.1002/ptr.v30.8 |
| [14] | CHENG Z Y, RISTOW M. Mitochondria and metabolic homeostasis[J]. Antioxid Redox Signal, 2013, 19(3): 240–242. DOI: 10.1089/ars.2013.5255 |
| [15] | BOZHKO A P, SUKHORUKOVA T A, ARCHAKOVA L I. Stress-induced changes in the relative area and number of mitochondria and myofibrils in the myocardium and their correction by thyroid hormones[J]. Bull Exp Biol Med, 1987, 103(1): 30–33. DOI: 10.1007/BF00840128 |
| [16] | BOKMAN E, LAUGHLIN R B Jr. A study of steady state and kinetic regulation of chloride ion and osmotic pressure in hemolymph of oysters, Crassostrea virginica, exposed to tri-n-butyltin[J]. Arch Environ Contam Toxicol, 1989, 18(6): 832–838. DOI: 10.1007/BF01160297 |
| [17] | RUTTER J, WINGE D R, SCHIFFMAN J D. Succinate dehydrogenase-assembly, regulation and role in human disease[J]. Mitochondrion, 2010, 10(4): 393–401. DOI: 10.1016/j.mito.2010.03.001 |
| [18] | PENG M L, HAN J, LI L L, et al. Suppression of fat deposition in broiler chickens by (一)-hydroxycitric acid supplementation: a proteomics perspective[J]. Sci Rep, 2016, 6: 32580. DOI: 10.1038/srep32580 |



