2. 西北农林科技大学动物科技学院, 杨凌 712100;
3. 河北科技师范学院, 秦皇岛 066600;
4. 中国农业科学院北京畜牧研究所, 北京 100193
2. College of Animal Science and Technology, Northwest A & F University, Yangling 712100, China;
3. Hebei Normal University of Science & Technology, Qinhuangdao 066600, China;
4. Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China
禽白血病病毒是引起禽类各种造血细胞肿瘤性增生的一类逆转录酶病毒。根据寄主、抗体反应以及受体类型,鸡白血病病毒分为六种亚型(A、B、C、D、E和J),其中E型白血病病毒(ALVE)为内源性病毒,在鸡驯养前整合于鸡细胞基因组中,并遵循孟德尔遗传规律随鸡基因组复制而复制。鸡基因组中有50多种ALV-E,许多内源ALV-E病毒由于不完整或甲基化或位置效应而转录沉默,但有些病毒元件是完整的,具备转录活性[1]。ALV-E表达不仅影响外源病毒的感染和疾病发生,并对家禽的重要经济性状(如产蛋量、蛋重和蛋比重等)产生较大影响[2],同时干扰外源病毒的鉴别诊断准确率[3-4]。S. Ka等对鸡脑组织进行cDNA全阵列分析,发现低体重鸡与高体重鸡的主要差异表达基因为内源白血病病毒ALV-E[5]。携带有ev3、ev6或ev9缺陷表达的家禽对外源病毒ALV的易感性降低[6],ev1病毒插入鸡TYR基因内含子4导致隐性白突变[7]。ev21是ALV-E的一种,慢羽白来航鸡及其后代均表现出的对外源淋巴白血病病毒免疫性能减退、生产性能下降、死亡率升高等不良性状与慢羽基因中ev21的插入有关[8]。
引发商业蛋鸡血管瘤和髓细胞瘤的病毒是由内源白血病病毒3′UTR与ALV-J重组形成的[9],M. Feng等利用免疫沉淀等试验发现慢羽ev21并不能与外源病毒ALV-J形成整合活性[10]。禽白血病病毒基因的两端LTR(long terminal repeats)区,负责控制病毒基因的转录,起RNA加工、调节、组装成病毒颗粒的作用,其结构依次为U3、R和U5[11],内源病毒LTR的启动子活性比外源病毒低10倍[12]。LTR之间为结构基因编码区,依次为gag-pol-env,gag编码核心蛋白,pol编码反转录酶、整合酶和蛋白酶,env编码囊膜蛋白。内源和外源病毒相同的结构特征导致病毒的鉴定区分存在很大障碍。M. H. Tixier-Boichard等首次提出应用PCR技术检测鸡内源ev21,通过扩增占位区390 bp片段以鉴定ev21的存在[13],完整ev21病毒基因组序列未见报道。本试验通过长片段PCR扩增7 590 bp序列,准确地鉴定鸡基因组中内源白血病病毒ev21的存在,并分析ev21与慢羽的连锁关系,建立筛选无ev21病毒慢羽种鸡的检测方法。研究LTR区启动子活性分析揭示ev21潜在致病性的分子基础,对认识其他脊椎动物内源病毒特征,分析其调控寄主生理都有重要作用。
1 材料与方法 1.1 试验材料太行鸡、坝上长尾鸡、海兰褐、海兰灰及其祖代五个品种/品系259份血液DNA样品,其中快羽146份,慢羽113份。
1.2 试验试剂Trans Start Taq DNA Polymerase、DNA Marker、血液DNA提取试剂盒、PCR产物纯化试剂盒为北京全式金公司产品;TaKaRa LA Taq、T4 DNA连接酶、限制性内切酶SacⅠ、限制性内切酶XhoⅠ、pMD19-simple载体为大连宝生物公司产品;质粒DNA小量提取试剂盒、无内毒素质粒DNA大量提取试剂盒为上海生工公司产品;pGL3-Basic与pRL-TK载体、双荧光素酶报告基因检测试剂盒、T4 DNA Ligase为美国Promega公司产品。引物合成和测序由北京六合华大基因公司完成。
1.3 试验方法 1.3.1 内源ev21病毒序列和检测 1.3.1.1 ev21长片段PCR扩增和群体检测参考K. Wimmer等引物[6],ev21 S:5′-GGAGGGAGACTATTTTTACACG-3′,ev21 A:5′-GTTTAACGGACCAACAGGCTAGTCTCTCG-3′。PCR反应体系:10×PCR Buffer 2 μL,dNTP(2.5 mmol·L-1)1.6 μL,上、下游引物(10 μmol·L-1)各0.5 μL,DNA模板0.5 μL,TaKaRa LA Taq酶(5 U·μL-1)0.2 μL,H2O补足至20 μL。PCR反应程序:94 ℃ 90 s;98 ℃ 10 s,68 ℃ 7 min,32个循环;72 ℃ 10 min,4 ℃终止反应。琼脂糖检测阳性产物送华大基因测序。
长片段PCR扩增259份基因组样品检测ev21病毒在不同品种/品系快慢羽鸡中的分布情况。
1.3.1.2 ev21病毒基因组3′末端克隆和序列分析用Primer Premier 5.0以“1.3.1.1 ”获得序列和NCBI数据库中X54094序列为模板设计引物,扩增ev21病毒3′末端及其与Z染色体连接序列。引物1648S:5′-AAACGACCACGATTCTCC-3′,1648A:5′-GGGACTGGCAATCTTTCT-3′,PCR反应体系:2×Es Mix 5 μL,1648S和1648A各0.4 μL,DNA模板0.5 μL,H2O补足至10 μL,PCR反应程序:95 ℃ 5 min;95 ℃ 30 s,61 ℃ 30 s,72 ℃ 110 s,32个循环;72 ℃ 10 min,4 ℃终止反应。长片段PCR和1648引物对获得序列拼接后与NCBI数据库中Nucleotide序列和Chicken Reference genomic sequences序列Blast比对,分析ev21病毒基因组结构特征,及其在鸡基因组中的插入位点和连接序列。
1.3.2 ev21病毒LTR区启动子活性分析 1.3.2.1 LTR区目的片段获取以“1.3.1.1”和“1.3.1.2”拼接序列为模板设计引物扩增ev21基因5′和3′ LTR序列(表 1),检测其启动子活性。
|
|
表 1 LTR区启动子活性检测引物 Table 1 Primers for promoter amplification of LTR region |
以长片段PCR扩增阳性的基因组,用Trans Start Taq酶扩增5′和3′ LTR片段,将目的片段纯化回收并与pMD19-Simple载体连接克隆。
1.3.2.2 报告基因载体的构建阳性菌液进行质粒小提,用SacⅠ/XhoⅠ对质粒和荧光素酶报告基因载体pGL3-Basic进行双酶切,酶切体系:质粒DNA 400~1 000 ng,10×M Buffer 6 μL,SacⅠ和XhoⅠ各1.5 μL,加水补足至60 μL,37 ℃酶切3~4 h。琼脂糖凝胶电泳检测后回收目的片段。用T4 DNA连接酶连接目的片段和表达载体片段,构建报告基因重组质粒。连接体系:表达载体与目的片段的质量比为1:1~1:5,T4 DNA连接酶0.5 μL,Ligation Buffer 1 μL,加水补足至10 μL。经PCR和双酶切鉴定阳性的重组质粒进行质粒大提。
1.3.2.3 细胞瞬时转染与双荧光素酶检测A375细胞接种于含20%胎牛血清的DMEM培养基进行培养,细胞融合度达到90%,根据Lipofectamine® 2000 Reagent脂质体转染说明开始转染。脂质体与质粒DNA比例为1:1,重组质粒与内参pRL-TK载体比例为9:1。转染6 h后,用含血清的正常细胞培养液换液,继续培养48 h后裂解细胞,利用双荧光素酶检测试剂盒,GloMax-MultiJr单管型多功能检测仪检测荧光素酶活性。
2 结果 2.1 内源ev21病毒检测PCR扩增 2.1.1 长片段PCR扩增和群体分析由图 1可见不同品种鸡ev21S和ev21A引物长片段PCR的扩增产物。
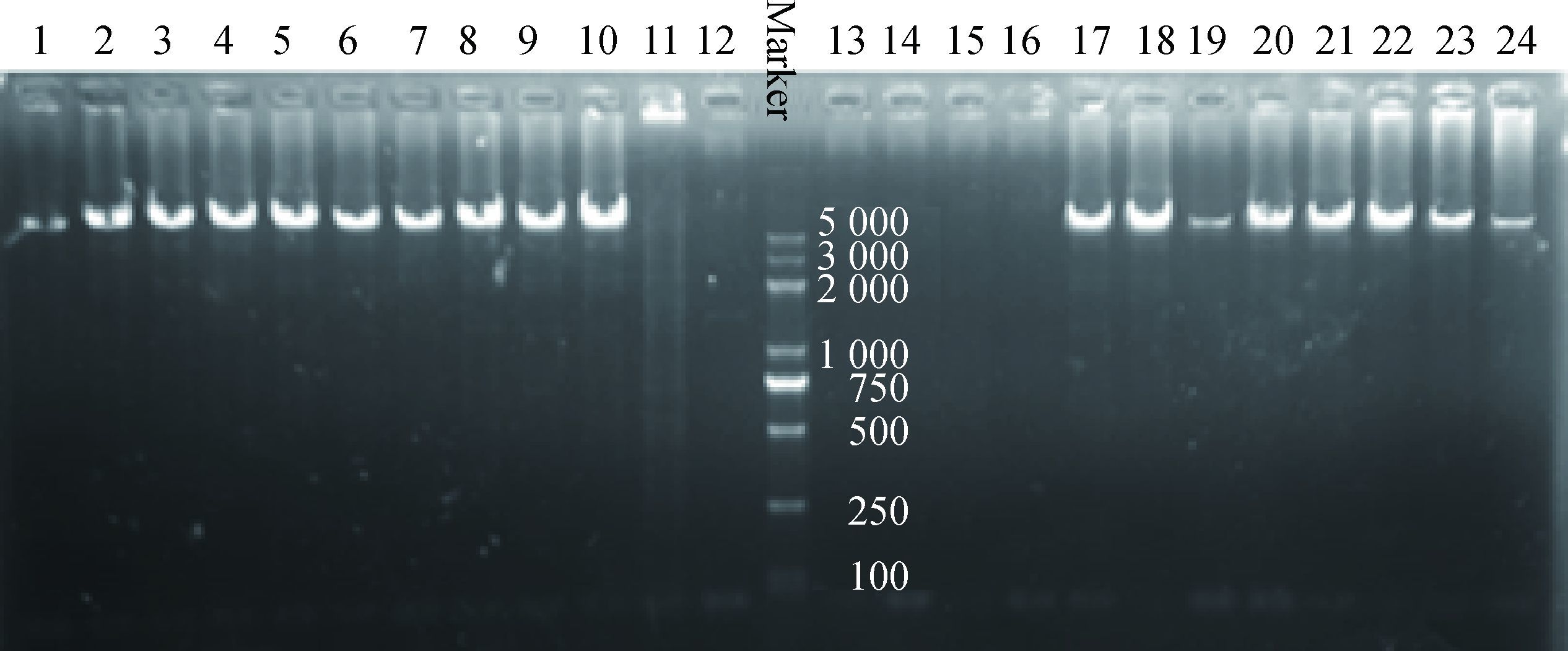
|
1和11~15.太行鸡;2~10.海兰灰;16~20.坝上长尾鸡;21~24.海兰褐 1 and 11-15. Taihang chicken; 2-10. Hy-line Gray; 16-20. Bashang chicken; 21-24. Hy-line Brown 图 1 长片段PCR产物(7 590 bp) Figure 1 Agarose gel electrophoretogram of long-sequence PCR product (7 590 bp) |
图 1中1泳道为太行慢羽公鸡,扩增出目的条带,11~15泳道为太行快羽公鸡,均未扩增出目的条带;2~10泳道为海兰灰慢羽公鸡,均扩增出目的条带;16~20泳道为坝上长尾鸡慢羽公鸡,16泳道未扩增出目的条带,17~20泳道均扩增出目的条带;21~24泳道为海兰褐慢羽公鸡,均扩增出目的条带。目的条带经测序获得长7 590 bp基因序列,分析该序列发现其g.977-7590区域与ev1(DQ118701) 序列相似度99%,g.1-976区域与慢羽鸡ev21非占区序列(X54093) 相似度99%。259份基因组样品ev21检测结果见表 2。
|
|
表 2 ev21内源白血病病毒在不同鸡种群中的分布情况 Table 2 Distribution of ev21 in various chicken strains |
由表 2可知,太行鸡和坝上长尾鸡慢羽公鸡ev21阳性率高于90.0%,太行慢羽母鸡阳性率为65.5%,海兰灰及其祖代慢羽公鸡阳性率为100.0%,海兰褐慢羽公母鸡阳性率为100.0%;太行快羽公母鸡、海兰灰祖代快羽公母鸡和海兰褐快羽母鸡ev21阳性率均为0.0%,而海兰褐快羽公鸡阳性率为100.0%。表明海兰灰及其祖代慢羽公鸡与ev21内源白血病病毒完全连锁,海兰褐慢羽公母鸡和快羽公鸡全部携带ev21,但太行鸡和坝上长尾鸡慢羽鸡与ev21并不完全连锁。
2.1.2 ev21病毒3′末端扩增和病毒结构分析以太行鸡、坝上长尾鸡和海兰灰祖代C系7 590 bp扩增阳性基因组为模板,用1648S和1648A引物扩增ev21病毒基因组3′末端序列,扩增产物用1.0%琼脂糖凝胶电泳检测,结果见图 2,扩增区域见图 3。阳性片段测序获得1 648 bp的碱基序列,其g.118-1648区域与鸡内源病毒ev21占位区序列(X54094) 相似度99%。
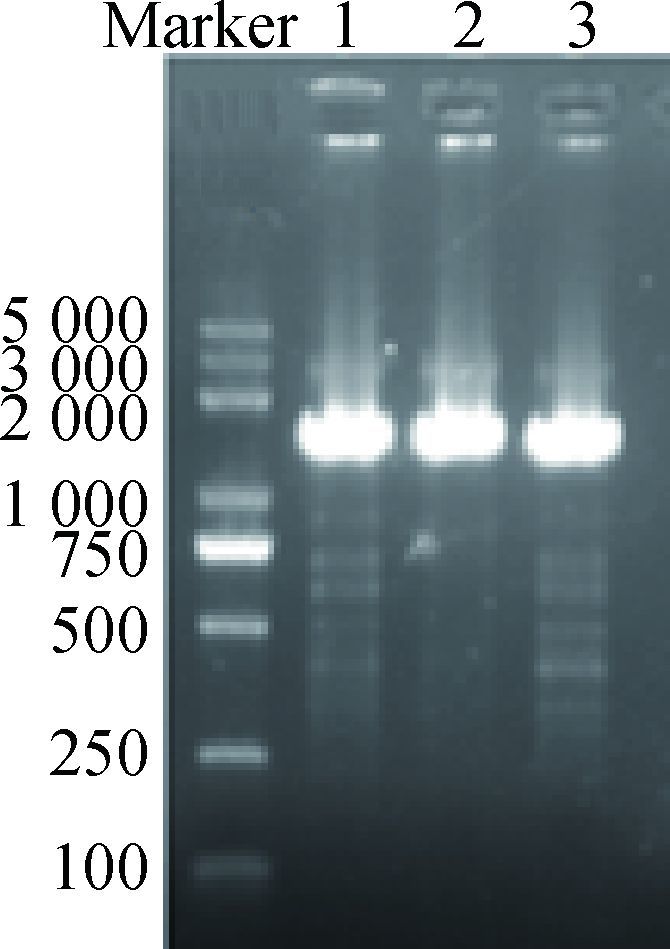
|
1.太行鸡; 2.坝上长尾鸡; 3.海兰灰祖代C系 1. Taihang chicken; 2. Bashang chicken; 3. C line of progenitor Hy-line Gray 图 2 三个品系鸡ev21 3′末端PCR产物(1 648 bp) Figure 2 PCR product of 3′ terminal fragment of ev21 in three chicken strains(1 648 bp) |
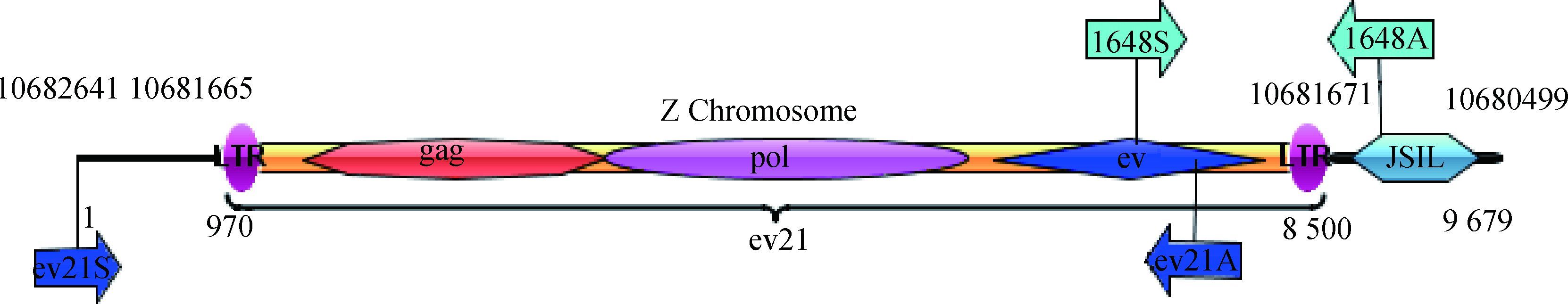
|
上方数字. Z染色体NC_006127位点; 下方数字. 9 679 bp序列位点; 箭头标记.引物起始位点; 结构标注. ev21的基因和特殊结构 The figures at top. Locus of NC_006127 in Z chromosome; The subjacent figures. Locus of 9 679 bp sequence; Arrows marked. Location for primer binding; Label in structure. Genes and special structure of ev21 图 3 鸡Z染色体包含ev21病毒的9 679 bp序列结构 Figure 3 Structure chart of 9 679 bp sequence contained ev21 virus genes in Z chromosome of chicken |
拼接长片段扩增7 590 bp、ev21病毒3′末端1 648 bp和JSIL检测1 450 bp片段(本实验室数据),获得包括ev21病毒基因全长7 524 bp及其上下游序列共9 679 bp,该序列提交NCBI,序列号KY235336,具体结构见图 3。该序列与鸡Z染色体序列NC_006127.4比对成功,其中g.1-976为鸡Z染色体序列,g.977-8500为ev21病毒7 524 bp全长序列,g.977-1250为长274 bp的5′LTR区,g.8227-8500为3′LTR区,LTR之间依次为位于g.1530-3605长2 076 bp的gag基因、g.3574-6042长2 469 bp的pol基因和位于g.6228-8060长1 833 bp的env基因,g.8501-9679为鸡Z染色体序列。比对分析发现ev21反向插入在Z染色体的g.10681671-10681672(GenBank登录号:NC_006127) 之间。
ev21病毒插入位点Z染色反义链序列为CTACCC(NC_006127的g.10681666-10681671),9 596 bp序列的g.971-976和g.8501-8506均为CTACCC,即ev21内源病毒序列5′和3′LTR区与Z染色体连接域为六个碱基重复,这符合逆转录病毒的基因结构特征。
2.2 ev21病毒LTR区启动子活性分析 2.2.1 目的片段的扩增和报告基因载体的构建选取长片段PCR扩增阳性的太行鸡DNA为模板,扩增ev21序列5′ LTR区和3′ LTR区片段序列。由图 4A可见,扩增片段大小与预期结果一致。将5′ LTR的514 bp和3′ LTR的614 bp目的片段克隆质粒与pGL3-basic载体质粒分别进行双酶切,回收纯化酶切产物后构建目的片段的pGL3-basic重组质粒,测序鉴定阳性克隆进行双酶切(图 4B),测序结果显示阳性克隆片段序列和插入方向与预期一致。
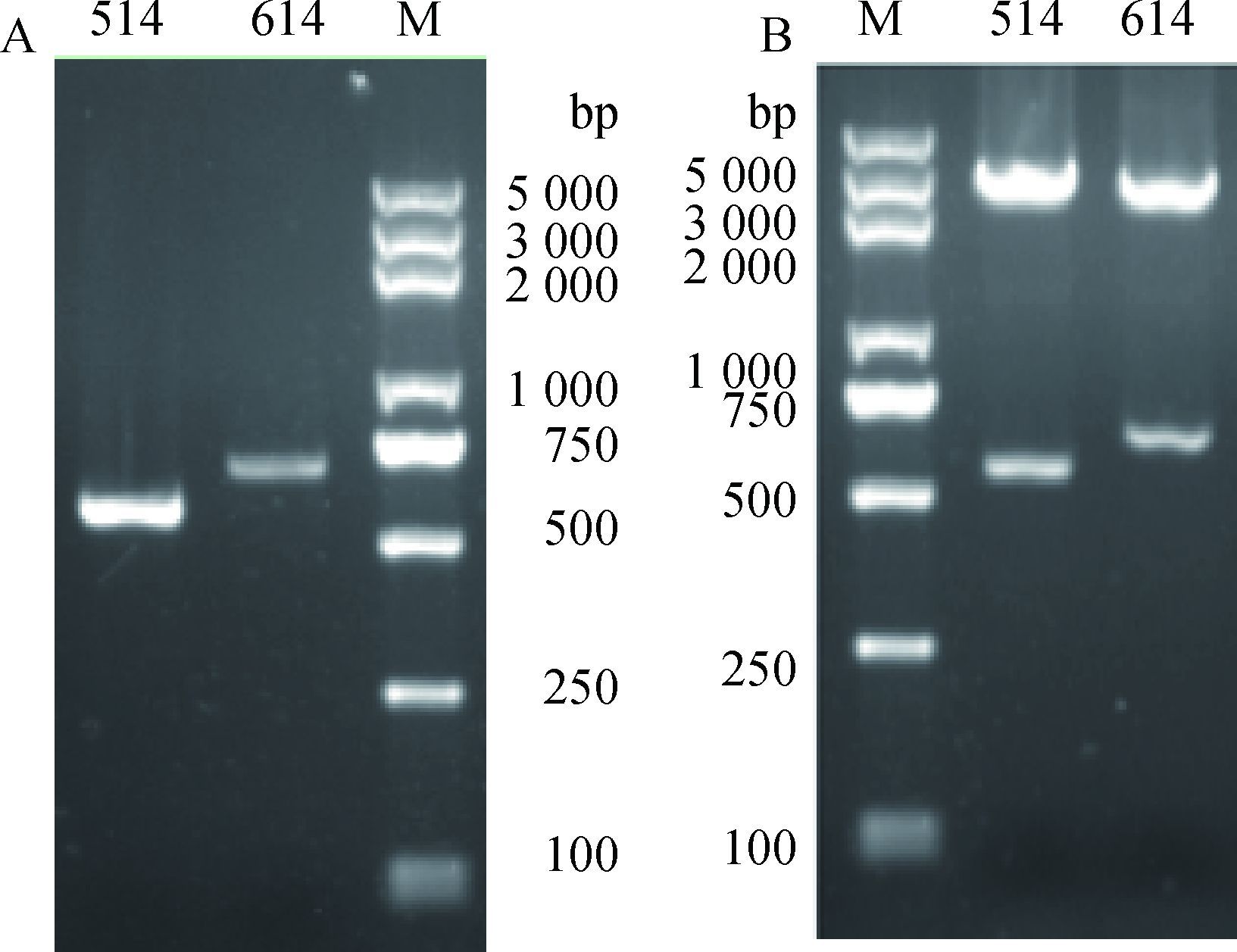
|
A.514和614 bp PCR产物;B.514和614 bp重组质粒双酶切产物 A. 514 and 614 bp PCR product; B. Result of 514 and 614 bp recombinant plasmid by digestion 图 4 514和614 bp PCR产物和重组质粒双酶切结果 Figure 4 Products of PCR and recombinant plasmid by digestion of 514 and 614 bp fragments |
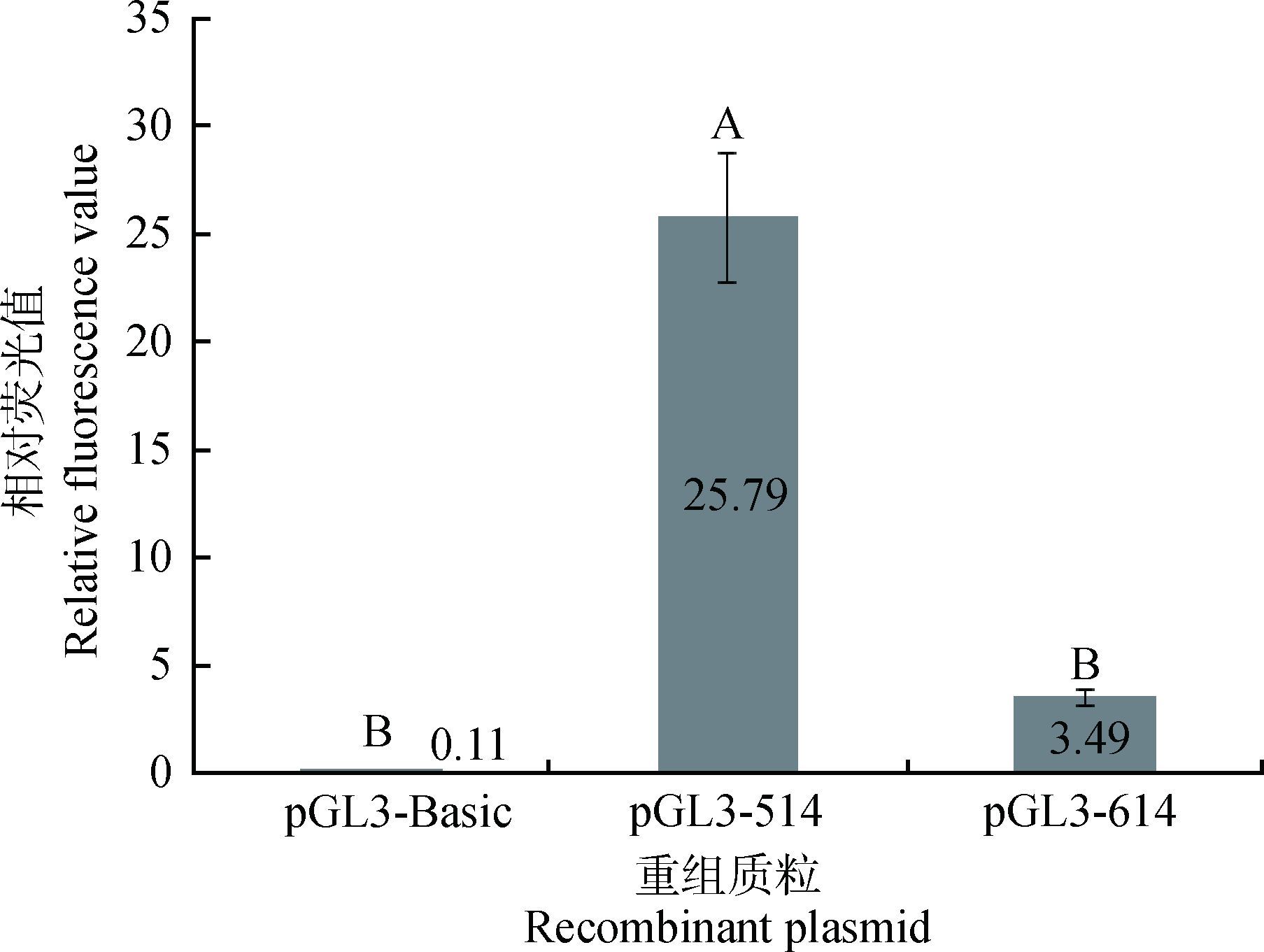
A375细胞接种到24孔板24 h后,细胞状态良好,将重组质粒和pRL-TK载体共转染A375细胞。转染6 h后,用正常培养基换液培养,再过48 h,用细胞裂解缓冲液裂解细胞,检测萤火虫荧光信号和海肾荧光信号,二者比值即为重组质粒启动子活性。分析结果表明,5′和3′ LTR区域片段启动子活性比阴性对照分别高260倍和33倍,5′末端的514 bp片段活性比对照高260倍,极显著高于3′末端614 bp片段活性(P<0.01),但3′末端片段活性虽然比对照高33倍,但差异不显著(P>0.05)(图 5)。
|
图 5 514和614 bp片段的启动子活性 Figure 5 Relative promoter activity of 514 and 614 bp fragments |
笔者利用长片段PCR扩增一次获得7 590 bp序列,包含ev21基因组的6 614 bp,通过序列比对发现该序列中g.977-7590与ev1基因(GenBank登录号:AY013303)、g.1-976与慢羽ev21病毒未占位序列(GenBank登录号:X54093)、g.7318-7590与慢羽ev21病毒占位序列(GenBank登录号:X54094) 相似度均为99%。设计1648A和1648S引物扩增ev21病毒的3′末端序列,并利用ev21病毒鉴定用的占位区1 450 bp序列拼接后获得包含完整ev21病毒基因组(7 524 bp)的9 679 bp序列。陈孜孟等在海兰鸡基因组中发现4 663 bp内源白血病病毒缺陷型ALV基因组片段[14],谭利强等在麻黄肉种鸡蛋清中检测到内源白血病毒的基因片段[15]。
利用7 590 bp长片段扩增检测了ev21在五个品种/品系鸡群259份基因组中的分布情况,发现太行慢羽母鸡阳性率为65.5%,太行鸡和坝上长尾鸡慢羽公鸡阳性率90%以上,海兰灰及其祖代慢羽公鸡、海兰褐慢羽公母鸡和快羽公鸡病毒携带率均为100%,而太行鸡、坝上长尾鸡和海兰灰的快羽鸡,以及海兰褐的快羽母鸡阳性率均为0%。这一结果说明内源白血病病毒ev21与海兰灰及其祖代慢羽鸡完全连锁,但与太行鸡和坝上长尾鸡慢羽鸡并不完全连锁,尤其是海兰褐快羽公鸡也全部携带ev21。利用7 590 bp长片段扩增可以准确地鉴定鸡内源ev21病毒的存在情况,通过该方法可以简单有效的筛选ev21阴性个体,以便建立ev21阴性的慢羽种鸡群。
将9 679 bp序列与鸡基因组序列比对发现ev21病毒反向插入在鸡Z染色体的g.10681671-10681672之间,明确了ev21在鸡染色体中的具体位置。鸡慢羽表型的基因定位于Z染色体,本实验室研究发现慢羽性状与位于Z染色体g.10611410-10633009区域的PRLR基因重复完全相关,ev21病毒基因与PRLR基因间距48 663 bp。
3.2 ev21病毒LTR区启动子活性分析感染病毒细胞RNA中有高达20%的病毒mRNA和基因组RNA转录体,LTR区的U3是强转录调控单位,内源白血病病毒的弱致癌性被认为是由于LTR区弱的转录活性引起的,但本试验发现ev21的5′ LTR区具有很强的转录启动子活性,而3′ LTR也具有较弱的启动活性。B. R. Cullen等指出活化的5′ LTR存在时,禽白血病病毒3′ LTR不能有效启动转录[16]。通过在线软件Softberry[17] (http://www.softberry.com/berry.phtml?topic=nsite&group=programs&subgroup=promoter)分析,发现5′ LTR区514 bp片段存在3个TATA盒子,而3′ LTR区614 bp片段只有1个TATA盒子;同时发现514 bp片段存在8个miRNA,而614 bp片段只发现2个miRNA。这可能是5′ LTR上下游的调控元件参与了病毒的转录,导致其启动子活性极显著高于3′ LTR。朱文奇等体外试验发现miR-155显著下调内源白血病毒ev1的表达[18]。S. A. Herman等研究发现感染病毒的成纤维细胞中没有检测到由3′ LTR启动的转录本,然而由5′ LTR启动的转录本占总RNA的15%[19]。这一结果与本试验检测的514 bp片段高活性而614 bp片段低活性一致。K. F. Conklin将ev1、ev2和ev3的LTR区U3域插入到劳斯氏肉瘤病毒中,发现三种内源病毒的启动活性没有变化,认为三者在鸡体内的差异表达与LTR区U3域的单核苷酸变异没有关系[20]。内源病毒ev21在正常鸡体细胞内转录活性极低,而试验却发现LTR区出现很高的启动子活性,说明鸡基因组序列中可能存在其他负调控元件。Y. Yu等指出ALV-E的高甲基化可能与其致瘤阴性相关[21], 用EMBOSS Cpgplot(http://www.ebi.ac.uk/Tools/seqstats/emboss_cpgplot/)对7 524 bp序列进行分析发现整个ev21病毒基因序列中存在长度为238~526 bp的六处CpG岛,占整个病毒序列的29.9%,分散在病毒基因的5′ UTR区和基因结构域,这可能是ev21低转录活性弱致瘤性的关键。
4 结论试验成功获得了ev21基因7 524 bp的全长序列,该病毒反向插入在鸡Z染色体的g. 10681671-10681672之间,并且7 590 bp序列长片段PCR扩增可以作为鉴定鸡内源白血病病毒ev21的检测方法。ev21与海兰灰慢羽鸡完全连锁,但与太行鸡、坝上长尾鸡并不完全连锁。ev21病毒5′ LTR区具有高强度的启动子活性。
| [1] | RUTHERFORD K, BENKEL B F. Characterization of insertion sites and development of locus-specific assays for three broiler-derived subgroup E avian leukosis virus proviruses[J]. Avian Pathol, 2013, 42(4): 373–378. DOI: 10.1080/03079457.2013.809694 |
| [2] | GAVORA J S, KUHNLEIN U, CRITTENDEN L B, et al. Endogenous viral genes: association with reduced egg production rate and egg size in white leghorns[J]. Poult Sci, 1991, 70(3): 618–623. DOI: 10.3382/ps.0700618 |
| [3] |
徐海鹏, 孟凡峰, 董宣, 等. 种蛋中内源性禽白血病病毒的检测和鉴定[J]. 畜牧兽医学报, 2014, 45(8): 1317–1323.
XU H P, MENG F F, DONG X, et al. Detection and identification of an endogenous subgroup E Avian Leukosis virus in a chicken breeder embryo[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(8): 1317–1323. (in Chinese) |
| [4] |
郝建勇, 秦建如, 邱倩倩, 等. 不同样品对黄羽种鸡禽白血病病毒净化检测效果的影响[J]. 华南农业大学学报, 2015, 36(6): 29–34.
HAO J Y, QIN J R, QIU Q Q, et al. Effects of different samples on avian leukosis virus eradication and detection in yellow feather breeders[J]. Journal of South China Agricultural University, 2015, 36(6): 29–34. DOI: 10.7671/j.issn.1001-411X.2015.06.005 (in Chinese) |
| [5] | KA S, KERJE S, BORNOLD L, et al. Proviral integrations and expression of endogenous Avian leucosis virus during long term selection for high and low body weight in two chicken lines[J]. Retrovirology, 2009, 6: 68. DOI: 10.1186/1742-4690-6-68 |
| [6] | WIMMER K, SCHMIDT S P, VALLE-ZARATE A, et al. Molecular analysis of a new variant of the ev21 insertion/K-gene complex in the super slow feathering Nunukan chicken[J]. J Anim Breed Genet, 1996, 113(1-6): 323–329. DOI: 10.1111/jbg.1996.113.issue-1-6 |
| [7] | CHANG C M, COVILLE J L, COQUERELLE G, et al. Complete association between a retroviral insertion in the tyrosinase gene and the recessive white mutation in chickens[J]. BMC Genomics, 2006, 7: 19. DOI: 10.1186/1471-2164-7-19 |
| [8] | LEVIN I, SMITH E J. Molecular analysis of endogenous virus ev21-slow feathering complex of chickens.: 1.cloning of proviral-cell junction fragment and unoccupied integration Site[J]. Poult Sci, 1990, 69(11): 2017–2026. DOI: 10.3382/ps.0692017 |
| [9] | LIU C N, ZHENG S M, WANG Y Q, et al. Detection and molecular characterization of recombinant avian leukosis viruses in commercial egg-type chickens in China[J]. Avian Pathol, 2011, 40(3): 269–275. DOI: 10.1080/03079457.2011.560932 |
| [10] | FENG M, TAN Y, DAI M M, et al. Endogenous retrovirus ev21 dose not recombine with ALV-J and induces the expression of ISGs in the host[J]. Front Cell Infect Microbiol, 2016, 6: 140. |
| [11] | NORTON P A, COFFIN J M. Characterization of Rous sarcoma virus sequences essential for Viral gene expression[J]. J Virol, 1987, 61(4): 1171–1179. |
| [12] | CULLEN B R, SKALKA A M, JU G. Endogenous avian retroviruses contain deficient promoter and leader sequences[J]. Proc Natl Acad Sci U S A, 1983, 80(10): 2946–2950. DOI: 10.1073/pnas.80.10.2946 |
| [13] | TIXIER-BOICHARD M H, BENKEL B F, CHAMBERS J R, et al. Screening chickens for endogenous virus ev21 Viral element by the polymerase chain reaction[J]. Poult Sci, 1994, 73(10): 1612–1616. DOI: 10.3382/ps.0731612 |
| [14] |
陈孜孟, 董宣, 苏帅, 等. 海兰鸡内源性白血病病毒位点序列鉴定与分析[J]. 畜牧兽医学报, 2015, 46(11): 2050–2055.
CHEN Z M, DONG X, SU S, et al. Identification and sequence analysis of endogenous Avian leukosis virus element in genome of hy-line brown layers[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(11): 2050–2055. (in Chinese) |
| [15] |
谭利强, 冯敏, 郝建勇, 等. 麻黄肉种鸡蛋清中内源性禽白血病病毒的分离与遗传鉴定[J]. 中国兽医杂志, 2015, 51(3): 3–5, 8.
TAN L Q, FENG M, HAO J Y, et al. Isolation and genetic identification of endogenous Avian leukosis virus strain from albumen of partridge breeder chicken[J]. Chinese Journal of Veterinary Medicine, 2015, 51(3): 3–5, 8. (in Chinese) |
| [16] | CULLEN B R, LOMEDICO P T, JU G. Transcriptional interference in avian retroviruses-implications for the promoter insertion model of leukaemogenesis[J]. Nature, 1984, 307(5948): 241–245. DOI: 10.1038/307241a0 |
| [17] | SHAHMURADOV I A, SOLOVYEV V V. Nsite, NsiteH and NsiteM computer tools for studying transcription regulatory elements[J]. Bioinformatics, 2015, 31(21): 3544–3545. DOI: 10.1093/bioinformatics/btv404 |
| [18] |
朱文奇, 胡序明, 陈世豪, 等. MiR-155体外特异性靶向鸡内源性反转录病毒ALVE1env转录物的研究[J]. 畜牧与兽医, 2016, 48(5): 7–11.
ZHU W Q, HU X M, CHEN S H, et al. Studies on avian endogenous retrovirus ALVE1 env transcripts specifically targeted by miR-155 in vitro[J]. Animal Husbandry & Veterinary Medicine, 2016, 48(5): 7–11. (in Chinese) |
| [19] | HERMAN S A, COFFIN J M. Differential transcription from the long terminal repeats of integrated avian leukosis virus DNA[J]. J Virol, 1986, 60(2): 497–505. |
| [20] | CONKLIN K F. Activation of an endogenous retrovirus enhancer by insertion into a heterologous context[J]. J Virol, 1991, 65(5): 2525–2532. |
| [21] | YU Y, ZHANG H M, TIAN F, et al. Quantitative evaluation of DNA methylation patterns for ALVE and TVB genes in a neoplastic disease susceptible and resistant chicken model[J]. PLoS One, 2008, 3(3): e1731. DOI: 10.1371/journal.pone.0001731 |



