2. 中国农业大学动物医学院国家动物传染性海绵状脑病实验室, 北京 100193
2. National Animal Transmissible Spongiform Encephalopathy Laboratory, College of Veterinary Medicine, China Agricultural University, Beijing 100193, China
环磷酸鸟苷-磷酸腺苷合酶(cyclic GMP-AMP synthase, cGAS)属于核苷酸转移酶家族,是一种新发现的胞内DNA感应器。cGAS与双链DNA结合后被激活,并以GTP或ATP为底物合成环化二核苷酸(cyclic GMP-AMP,cGAMP),cGAMP与内质网膜上的衔接蛋白STING具有较高亲和力,从而激活下游的蛋白TBK1、IRF3磷酸化,最终诱导Ⅰ型干扰素的产生[1]。cGAS信号通路在先天免疫中起着至关重要的作用,特别是对胞内菌的识别和清除作用。牛分枝杆菌(Mycobacterium bovis,M. bovis)是一种典型的胞内菌,可引发人畜共患病,不仅给全球养牛业造成巨大损失,而且还严重威胁食品安全与公共卫生。报道显示,cGAS信号通路在自身免疫病方面已得到验证[2],但在树突状细胞和牛分枝杆菌中尚未明了。为了更好地探究牛分枝杆菌感染后cGAS信号通路调节小鼠髓源树突状细胞(murine bone marrow derived dendritic cell, BMDC)成熟及细胞因子分泌的调节机制,本试验建立了牛分枝杆菌与BMDC感染模型,应用siRNA沉默技术抑制cGAS基因的表达,进而探究cGAS信号通路对BMDC成熟及活化的影响。
1 材料与方法 1.1 材料 1.1.1 主要试剂牛分枝杆菌(菌株号C68004) 由中国农业大学动物海绵状脑病实验室保存;C57BL/6雌性6~8周龄小鼠(北京维通利华公司,SPF级);ON-TARGETplus Mb21d1 siRNA(Thermo Scientific Dharmacon);RPMI-1640培养液,胎牛血清(Gibco);cGAS抗体(Cell Signaling Technology);β-actin抗体(Abcam);rmGM-CSF集落刺激因子(Peprotech)PE-CD11c,FITC-CD86、CD80、CD40、MHC-Ⅱ抗体(eBioscience);TBK1抗体,STING抗体(武汉三鹰生物技术公司);ELISA试剂盒(Cusabio)。
1.1.2 主要仪器设备恒温CO2培养箱(日本三洋公司);Western blot电泳仪、成像仪(Bio-Rad);流式细胞仪(BD);-80 ℃超低温冰箱,全自动酶标仪(Thermo Fisher);离心机(Sigma);倒置显微镜、激光扫描共聚焦显微镜(Olympus);细胞培养板(Corning)。
1.2 方法 1.2.1 树突状细胞的原代培养C57BL/6小鼠颈椎脱臼法处死后浸入75%酒精5~10 min,无菌分离出股骨、胫骨,尽可能去除表面结缔组织和肌肉,PBS清洗两遍后,浸入RPMI1640备用。分别剪断骨头两端,用1 mL无菌注射器吸取RPMI1640培养液反复吹洗髓腔,直至变白为止。以1 000 r·min-1,离心10 min,弃去上清,重复操作两次。收集沉淀放入含有10%胎牛血清、双抗、GM-CSF的15 mL RPMI1640完全培养液中,放置于37 ℃、5%CO2培养箱中培养,以分离当天记为第0天,分别于第3天添加15 mL完全培养液,第6天半量换液[3]。第7天收获后用流式细胞术鉴定。
1.2.2 分组及处理本研究设置三组:对照组BMDC,在培养过程中不加任何刺激;感染组BMDC,在培养第7天用牛分枝杆菌以感染复数(MOI)=5:1感染,相互作用3 h后更换全新RPMI1640完全培养液,此时记作0 h;cGAS沉默组BMDC,在培养第7天转染siRNA沉默cGAS基因表达,后续感染及处理步骤与感染组相同。
1.2.3 siRNA转染用无RNA酶水稀释siRNA至工作浓度,收集对数生长期的BMDC铺于24孔板,RPMI1640完全培养液调整至每孔1×105细胞·mL-1,置于37 ℃稳定培养24 h后。每孔加入5 μL siRNA工作液,再加入3 μL转染液,轻微振荡混匀,室温孵育5~10 min后置于37 ℃培养48 h,更换正常完全培养液,然后按照感染组操作流程进行感染。
1.2.4 BMDC表面标志物检测分别将正常培养及感染后24 h的BMDC离心收集(1 000 r·min-1,5 min),PBS洗涤悬浮,调整每管5×105细胞·100 μL-1,分别加入CD86、CD80、CD40、CD11c、MHC-Ⅱ荧光标记抗体,终质量浓度为3 μg·mL-1。置于4 ℃避光孵育45 min,PBS洗涤2次,以同型IgG作为对照,流式细胞仪检测。
1.2.5 Western blot检测cGAS信号通路蛋白根据本实验室之前的方法,分别收集24 h对照组BMDC、24和48 h感染组BMDC、24 h沉默组BMDC细胞,用细胞裂解液冰上裂解5~10 min,提取总蛋白质。配制10%分离胶和5%浓缩胶的SDS-PAGE,80 V电泳90 min后将蛋白凝胶转移至硝酸纤维素膜上。5%脱脂牛奶37 ℃封闭1 h,分别用cGAS、TBK1、p-TBK1、STING、β-actin抗体为一抗,以1:1 000比例稀释,5 mL TBST加入5 μL抗体,4 ℃孵育过夜。分别用对应HRP标记的山羊抗兔IgG为二抗,37 ℃孵育1 h。暗室中ECL发光液孵育硝酸纤维素膜1 min后曝光显影。
1.2.6 免疫荧光检测IRF3入核分别将正常培养24 h及感染24 h的细胞玻片用PBS清洗3次,每次3 min,用4%多聚甲醛固定30 min,PBS清洗3次,每次3 min。加入免疫染色封闭液,室温封闭1 h,避免非特异性结合。PBS清洗后,以1:1 000比例稀释IRF3抗体4 ℃湿盒内孵育过夜,PBST清洗玻片3次,每次3 min。避光加入1:5 000山羊抗兔荧光二抗2 μL,37 ℃孵育1 h后用PBST清洗。滴加DAPI避光孵育10 min染核,用含抗荧光淬灭剂封片液封片,激光扫描共聚焦显微镜下采集图像。
1.2.7 ELISA检测细胞因子分别收集对照组BMDC、感染组BMDC、沉默组BMDC细胞培养液上清,运用间接ELISA试剂盒检测上清中IFN-β、TNF-α、IL-12p70、IL-6的含量,检测方法严格按照试剂盒操作手册进行。终止反应后,立刻通过酶标仪检测其OD值,并绘制出标准曲线,得出相应细胞因子浓度。
1.2.8 数据处理使用GraphPad Prism 6统计软件分析数据和作图,两组之间数据比较用t检验,多组数据采用方差分析,结果以“x±s”表示。*P<0.05,**P<0.01,表示差异具有统计学意义。
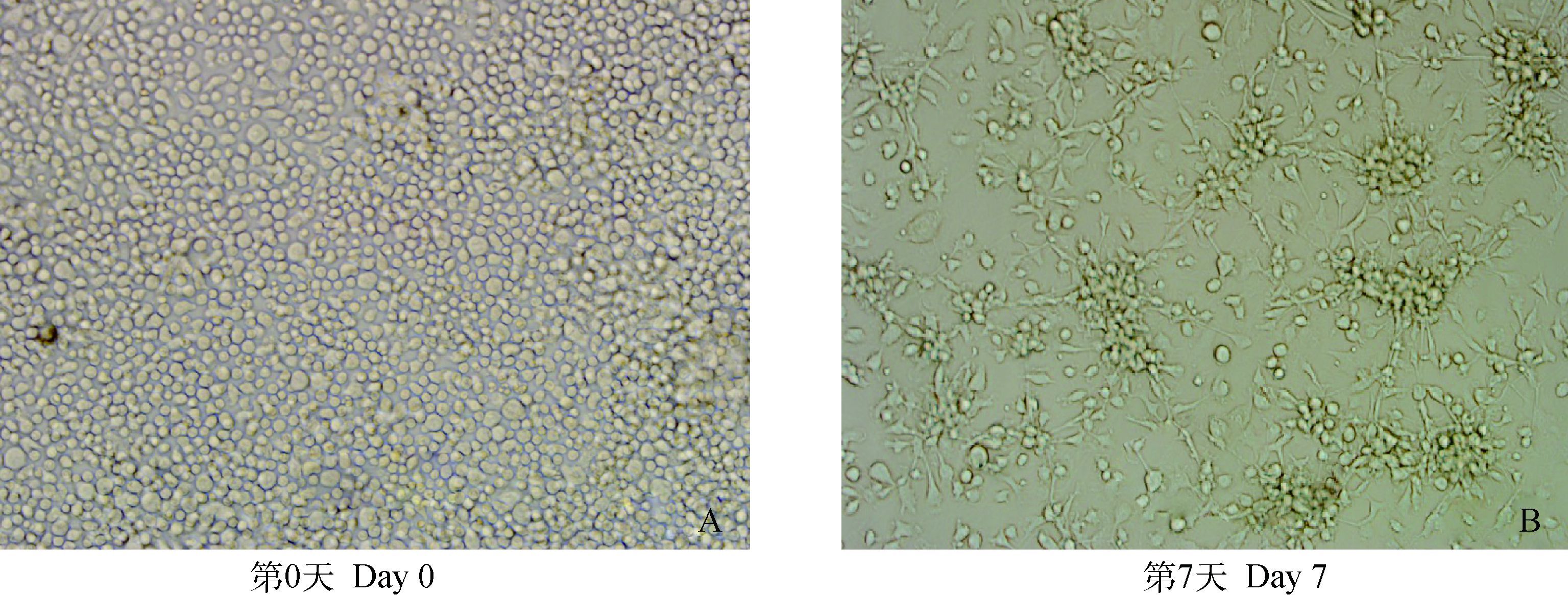
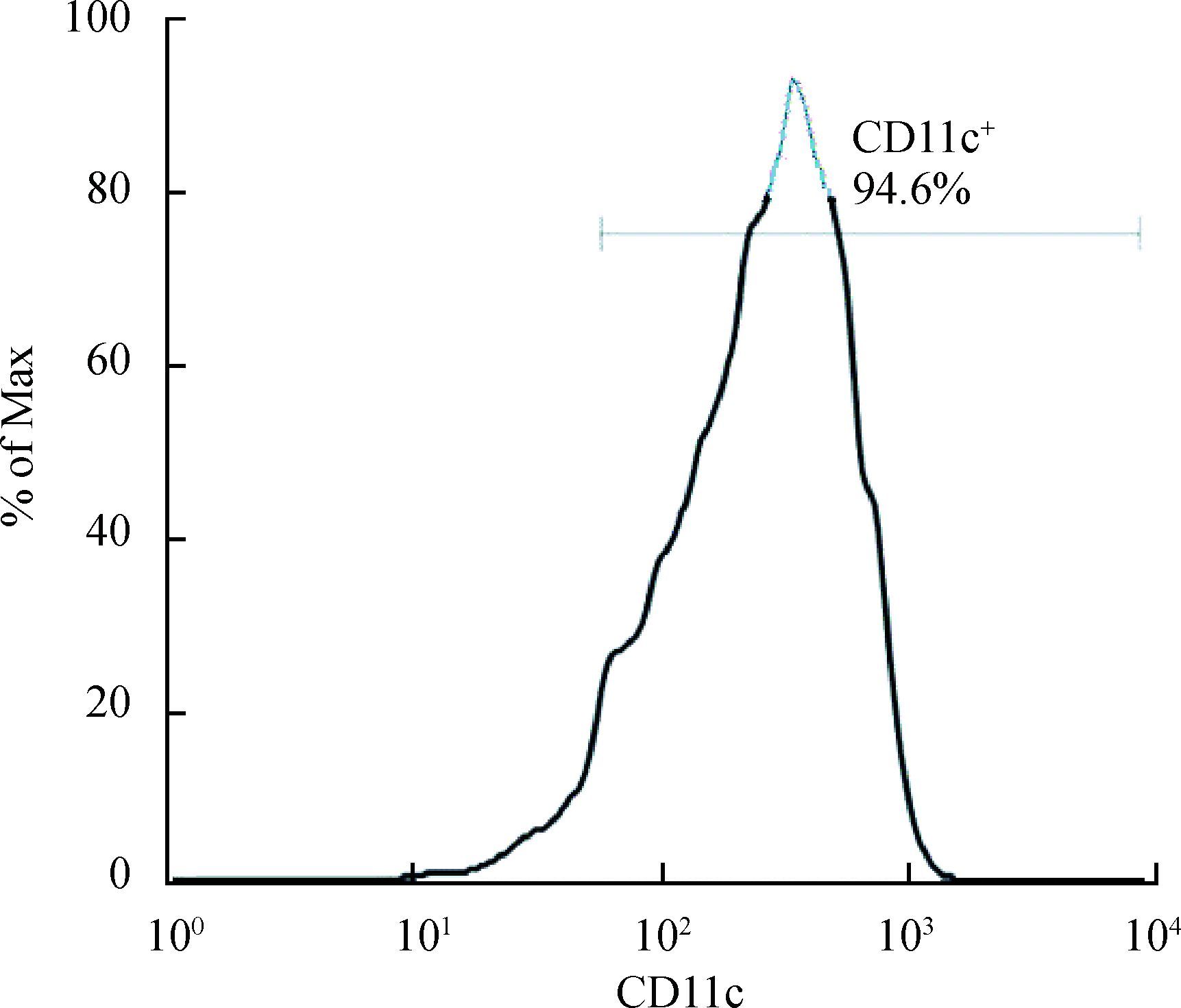
2 结果 2.1 BMDC的培养及鉴定图 1A示分离第0天的髓源树突状细胞,呈圆形,表面光滑无突起。培养至第7天(图 1B),可见细胞表面形成长短不一的质膜突起,呈集落生长。针对BMDC,采用抗小鼠PE-CD11c mAb对树突状细胞进行标记,通过流式细胞仪检测纯度。当细胞纯度达到90%以上可用于后续试验,细胞纯度结果见图 2。
|
图 1 BMDC体外培养形态(200×) Figure 1 Morphology of BMDC culture in vitro(200×) |
|
图 2 流式细胞术检测BMDC的纯度 Figure 2 Flow cytometry analysis purity of CD11c+ BMDC |
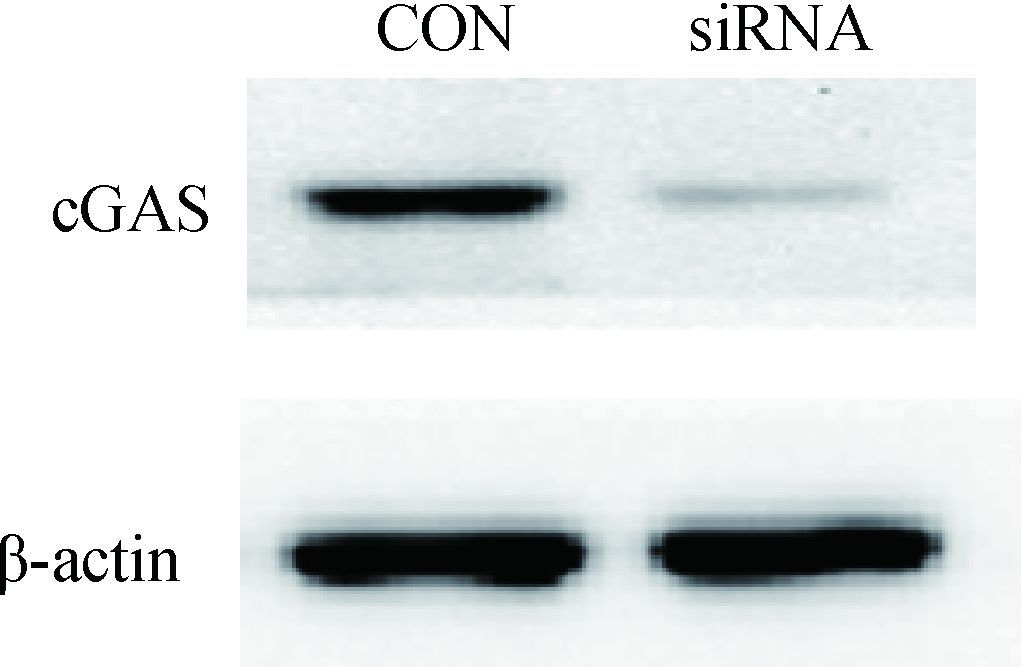
利用Western blot技术分别检测正常培养与siRNA沉默48 h后cGAS的蛋白质表达量。由图 3可知,利用siRNA沉默cGAS后,其蛋白质表达量受到抑制,较对照组显著降低。结果表明该siRNA可有效沉默cGAS蛋白在BMDC中的表达,为后续试验奠定基础。
|
CON.对照组;siRNA. cGAS基因沉默组 CON. Control group; siRNA. cGAS gene silence group 图 3 Western blot检测siRNA沉默后cGAS的表达 Figure 3 Western blot analysis of cGAS expression after knock down by siRNA |
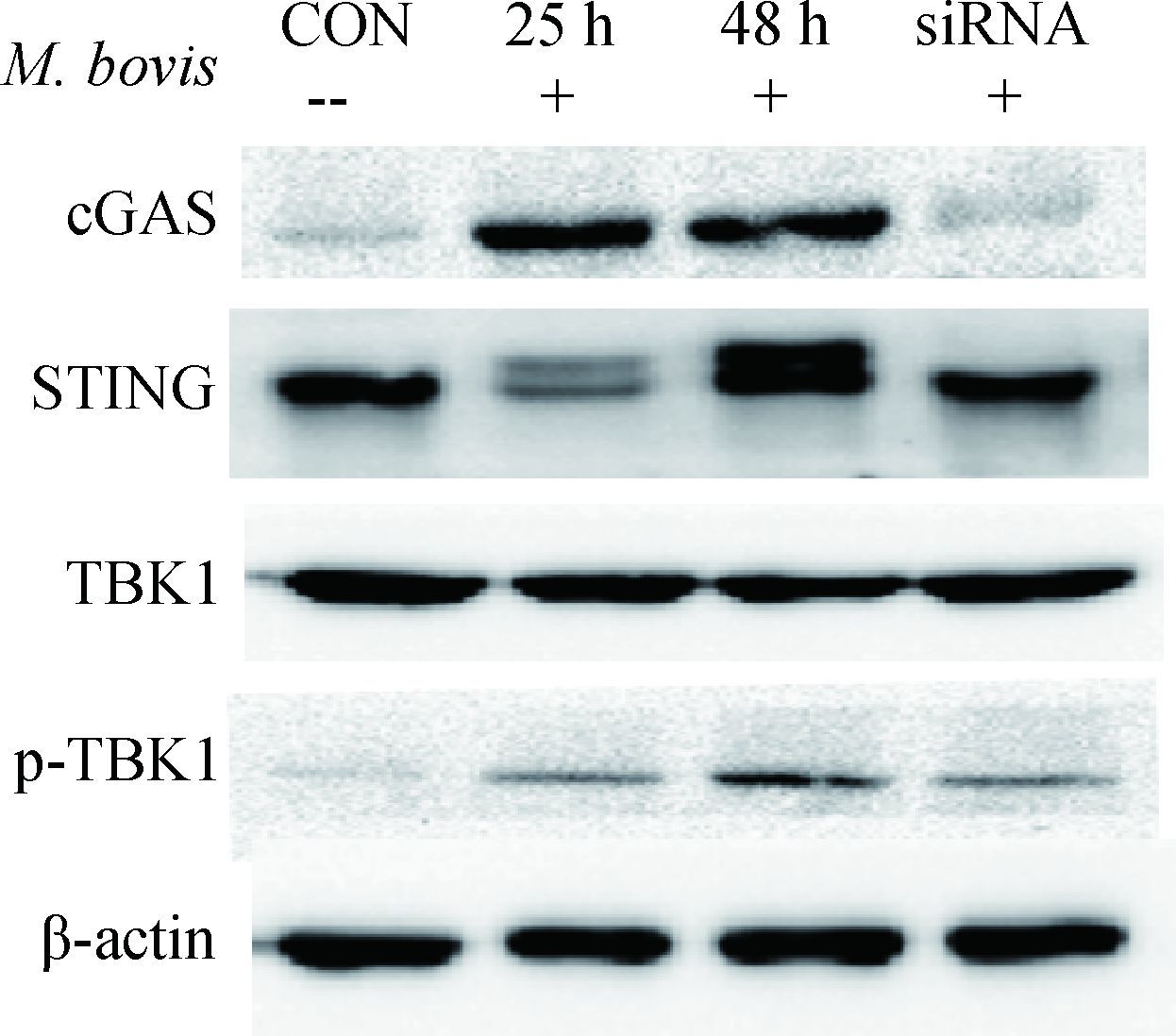
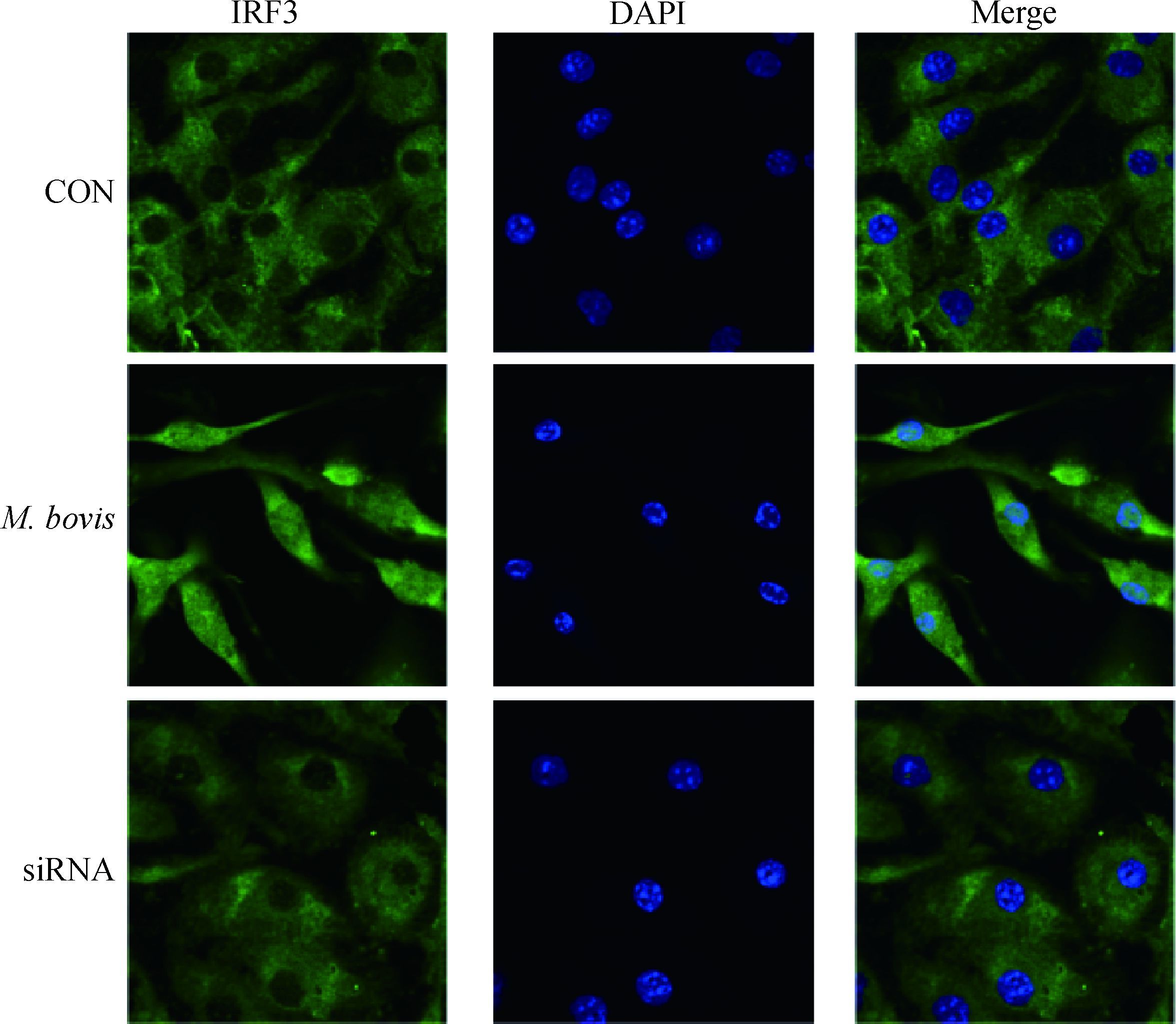
利用Western blot和免疫细胞化学技术分别检测对照组BMDC、感染组BMDC、沉默组BMDC中cGAS信号通路相关蛋白TBK1、p-TBK1、STING和IRF3的表达变化情况。由图 4可知,BMDC感染牛分枝杆菌后,感染组较对照组cGAS的表达量显著上升,说明感染后cGAS被激活,而沉默组siRNA使cGAS表达量显著下降。STING作为cGAS下游的衔接蛋白,在cGAS激活后可与其相关信使(cGAMP)结合形成稳定的同源二聚体结构,可见在感染组中STING表现为双条带,而对照组和沉默组只表现出单一条带,说明STING被激活。TBK1位于STING下游,广泛存在于细胞质中,三组之间的表达量未见显著差异,进而检测其磷酸化蛋白p-TBK1,可见随感染时间增长其表达量逐渐增高,而沉默组则略有下降。IRF3是干扰素调节蛋白,处于TBK1下游,被激活后有入核现象。由图 5可知,感染组较对照组有明显的入核现象,而沉默组入核现象受到抑制。以上结果表明,牛分枝杆菌感染BMDC后,胞内cGAS效应器受到刺激,进而激活cGAS信号通路及下游相关蛋白的活化。
|
CON.对照组;24 h.感染后24 h;48 h.感染后48 h;siRNA. cGAS基因沉默组 CON. Control group; 24 h. 24 hours post infection; 48 h. 48 hours post infection; siRNA. cGAS gene silence group 图 4 Western blot检测cGAS信号通路相关蛋白的表达 Figure 4 Western blot analysis of related protein expressions in cGAS pathway |
|
CON.对照组;M. bovis.感染组;siRNA. cGAS基因沉默组 CON. Control group; M. bovis. Infection group; siRNA. cGAS gene silence group 图 5 免疫荧光检测IRF3进入细胞核现象 Figure 5 Immunofluorescence analysis phenomena of IRF3 enter the nucleus |
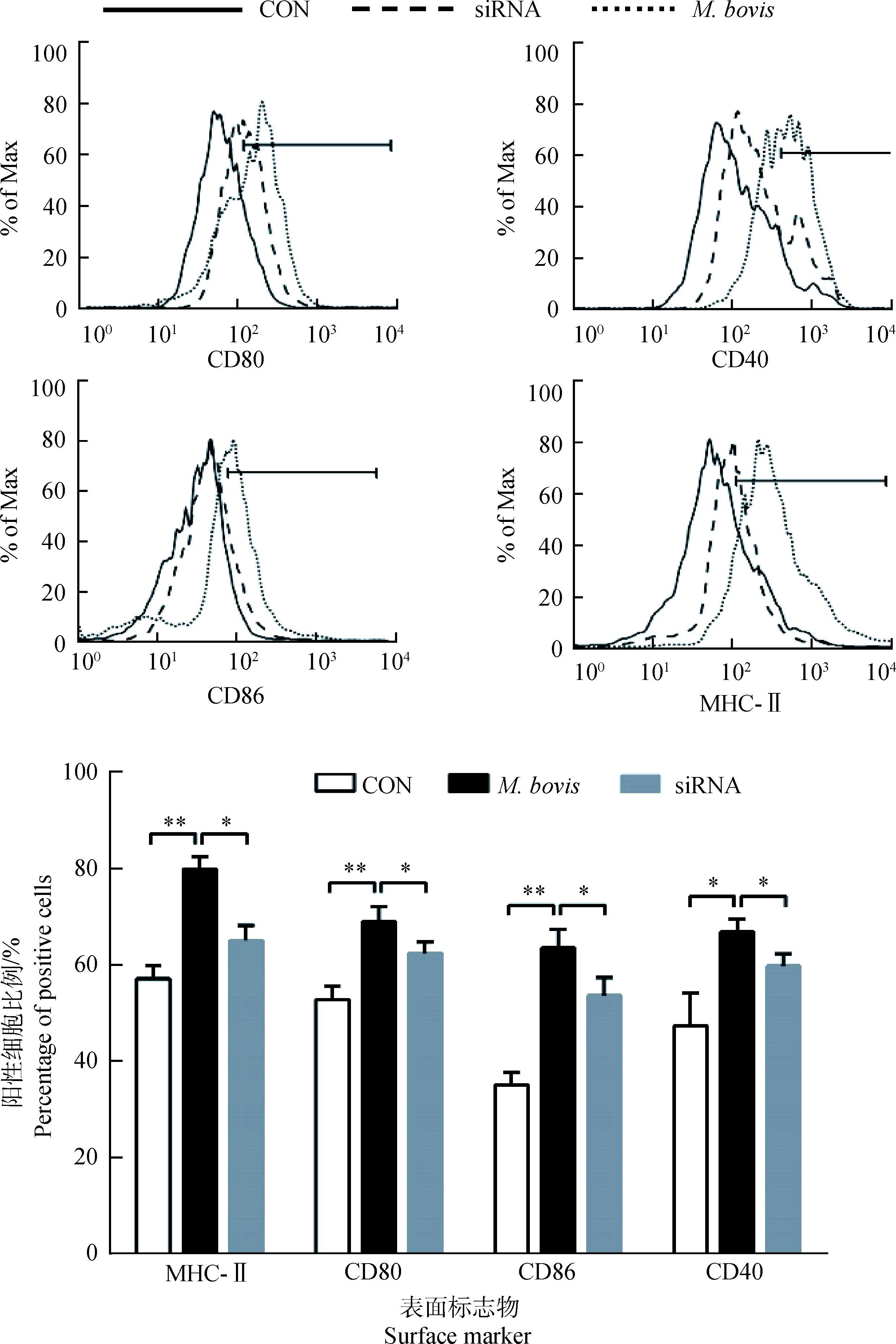
由图 6可知,通过流式细胞仪检测相关表面标志物CD80、CD86、CD40和MHC-Ⅱ,感染组与对照组差异极显著(P<0.01),表达量大幅提升,说明BMDC感染后,细胞由未成熟或半成熟状态转变为成熟状态。其中MHC-Ⅱ表达量的提升进一步说明在感染后细胞抗原提呈能力的增强。沉默组与感染组相比差异显著(P<0.05),表面标志物的表达量均有一定下调。以上结果说明,牛分枝杆菌可诱导BMDC的成熟及抗原提呈能力的增强,而沉默cGAS后表达量下调,可知cGAS对BMDC的成熟有促进作用。
|
CON.对照组;M. bovis.感染组;siRNA. cGAS基因沉默组。*.差异显著(P<0.05),**.差异极显著(P<0.01),下同 CON. Control group; M. bovis. Infection group; siRNA. cGAS gene silence group. * represents significant difference (P < 0.05), * * represents great significant difference (P < 0.01).The same as below 图 6 流式细胞术检测BMDC表面标志物的表达 Figure 6 Flow cytometry analysis of surface marker expressions on BMDC |
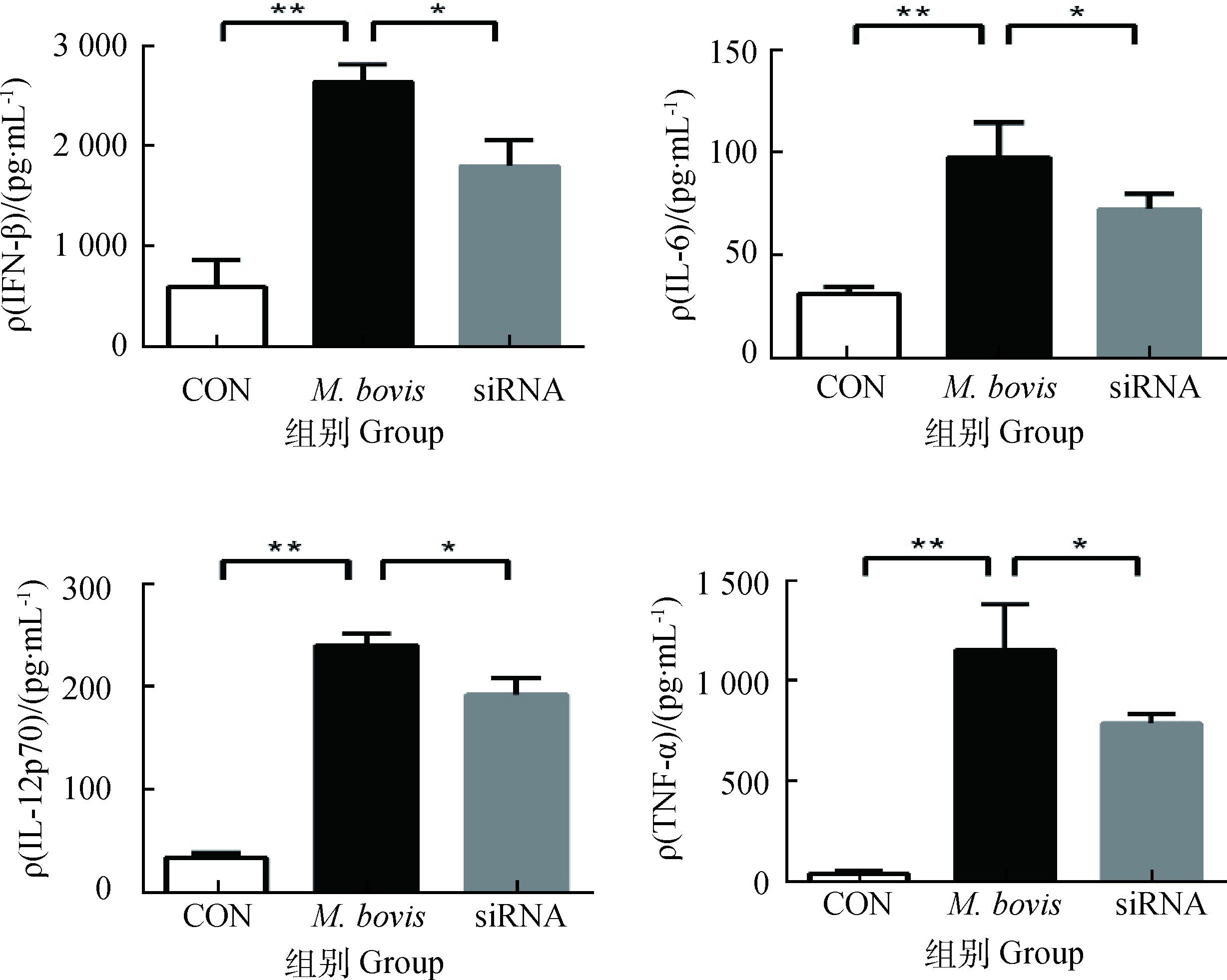
图 7为通过ELISA试剂盒检测三组上清液中IFN-β、TNF-α、IL-12p70、IL-6细胞因子的含量。可见在感染后分泌量均明显升高,感染组与对照组相比差异极显著(P<0.01),经siRNA沉默后分泌量则明显减少,沉默组较感染组相比差异显著(P<0.05)。以上结果说明,牛分枝杆菌可诱导BMDC细胞因子中IFN-β、TNF-α、IL-12p70、IL-6表达量升高,且cGAS具有促进作用。
|
CON.对照组;M. bovis.感染组;siRNA. cGAS基因沉默组 CON. Control group; M. bovis. Infection group; siRNA. cGAS gene silence group 图 7 ELISA检测BMDC细胞因子的分泌 Figure 7 ELISA analysis of cytokines production in BMDC |
树突状细胞作为连接固有免疫与适应性免疫的桥梁,其意义在于通过MHC-抗原复合物与T细胞表面受体相结合,以及CD80、CD86等共刺激分子与T细胞表型CD28相结合,伴随相关细胞因子的产生,从而激活T细胞,启动适应性免疫应答,对胞内菌的清除至关重要[4]。cGAS是最近在哺乳动物细胞质内发现的一种核苷酸转移酶,作为细胞内一种重要的DNA感应器。cGAS可与双链DNA直接结合,催化合成第二信使cGAMP,后者与内质网跨膜蛋白STING相互作用,使其构象发生改变,形成稳定的同源二聚体结构[5]。下游蛋白TBK1被招募至细胞核周围,进而诱导下游蛋白IRF3磷酸化、二聚化,被激活的IRF3向细胞核内转移,从而激活Ⅰ型干扰素基因转录,启动Ⅰ型干扰素释放[6]。
R. Wassermann等[7]通过细胞化学染色法研究发现结核分枝杆菌可诱导cGAS的表达上调。转染DNA发现与cGAS共定位,在较多区域两者均有聚合现象[8]。J. W. Schoggins等[9]最近研究认定cGAS基因为关键干扰素刺激基因(ISG)。此外,cGAS的第二信使cGAMP可激活临近STING蛋白并诱导Ⅰ型干扰素产生[10],本试验中感染牛分枝杆菌后cGAS及下游相关蛋白质表达上调同以上报道相一致。R. O. Watson等[11]研究中利用基因敲除技术,分别敲除cGAS基因和STING基因,发现IFN-β mRNA显著下降,并且cGAS信号通路下游蛋白质表达受到抑制,本试验中沉默组Western blot结果与之相同。沉默组中siRNA干扰cGAS后BMDC表面标志物下调现象与E. C. Carroll等[12]和H. F. Zhang等[13]的研究结果相似,发现在敲除或阻断Ⅰ型干扰素受体(IFNAR)后相关表面标志物也表现出下调,说明除了已知的Toll样受体外,Ⅰ型干扰素同样参与树突状细胞成熟的调节。
根据F. Ma等[14]的试验结果及推测可知,cGAS信号通路可启动IFN-β的产生,产生的IFN-β与IFNAR受体相结合,进而诱导下游STAT1和STAT2磷酸化,再与其他相关信号通路相结合,例如IRF9、MicroRNA-155、NF-κB等,共同调节树突状细胞的成熟。但树突状细胞表面标志物的调节机制较多,不同信号通路之间的相互联系有待进一步明确。细胞因子方面,C. Bode等[15]已经证实人浆样树突状细胞可通过cGAS-STING信号通路诱导IFN-β的产生,而经典途径中由TLR3和TLR9识别牛分枝杆菌所启动的信号转导同样可诱导IFN-β的产生[16]。因此本试验中cGAS基因被沉默后,虽然IFN-β表达量下降,但并未完全消失,可能与其他信号通路的激活有关。T. J. Li等[17]研究发现在抗肿瘤免疫中,cGAMP可通过cGAS-STING-IRF3信号通路促使IL-2、IL-12、TNF-α等相关细胞因子表达上调,本试验中感染组结果与其相同。R. O. Watson等[11]和J. Lienard等[18]的研究结果显示结核分枝杆菌可通过cGAS信号通路诱发自噬现象,进而激活IL-6、IL-12表达,敲除cGAS则自噬减弱,IL-6、IL-12表达量随之下调,本试验中沉默组细胞因子分泌减少现象与之相似。而TNF-α结果不尽相同,K. M. Storek等[19]分别敲除cGAS、STING、IFI204后感染弗朗西斯菌,发现TNF-α表达量同对照组并无显著差异,即TNF-α不受cGAS的调控,该结果的差异可能与感染不同病原菌相关。例如,李斯特菌、沙眼衣原体等胞内微生物具有独特的环核苷酸,可绕过cGAS感受器直接活化STING,诱导IFN-β产生[20-21]。并且研究发现李斯特菌在小鼠髓源巨噬细胞缺失cGAS情况下仍能诱发IFN-β的产生,而在人源单核巨噬细胞系中则不能产生[22]。由此可见cGAS信号通路是否被激活不仅与病原体的种类有关,而且也与宿主的细胞类型有关。目前国外关于cGAS信号通路的研究主要集中于结核分枝杆菌和巨噬细胞,而国内相关报道较少。
笔者建立了牛分枝杆菌感染BMDC试验模型,利用siRNA沉默技术抑制cGAS的表达,进而探索cGAS信号通路在牛分枝杆菌刺激下对BMDC的调控作用。结果表明,受到感染后树突状细胞相关表面标志物及细胞因子表达量显著上调,由未成熟转向成熟。此外,本研究证明了cGAS信号通路在BMDC中的存在,感染牛分枝杆菌后cGAS被激活,进而诱导下游相关蛋白活化。由沉默组中相关蛋白质和细胞因子表达量下调可知,cGAS信号通路有助于树突状细胞的成熟和活化,在免疫应答中发挥重要作用。本试验阐明了在体外感染牛分枝杆菌后,cGAS信号通路对BMDC成熟的调控机制,以及对IFN-β、TNF-α、IL-12p70、IL-6细胞因子的调节情况,为今后cGAS信号通路的研究奠定基础。但cGAS与牛分枝杆菌之间通过何种方式相互作用,以及IFN-β对其他相关细胞因子如何调节,同其他信号通路之间如何联系等相关机制问题,有待进一步探讨研究。
4 结论牛分枝杆菌可刺激BMDC引起细胞表面标志物CD86、CD80、CD40、MHC-Ⅱ表达升高,相关细胞因子IFN-β、TNF-α、IL-12p70、IL-6分泌增加,BMDC的抗原提呈能力增强;同时cGAS信号通路被激活,下游STING、p-TBK1、IRF3蛋白活化,而沉默cGAS基因后相关指标均显著下调。牛分枝杆菌感染BMDC可激活cGAS信号通路,且cGAS有助于BMDC的成熟和活化。
| [1] |
谢欣, 王孝伟, 刘俊义. 免疫途径抗HIV信号通路: cGAS-STING研究进展[J]. 国际药学研究杂志, 2014, 41(5): 528–532.
XIE X, WANG X W, LIU J Y. Research advance in cGAS-STING pathway: a pathway unlock the anti-HIV function of immune system[J]. Journal of International Pharmaceutical Research, 2014, 41(5): 528–532. (in Chinese) |
| [2] | GAO D X, LI T, LI X D, et al. Activation of cyclic GMP-AMP synthase by self-DNA causes autoimmune diseases[J]. Proc Natl Acad Sci U S A, 2015, 112(42): E5699–E5705. DOI: 10.1073/pnas.1516465112 |
| [3] | LUTZ M B, KUKUTSCH N, OGILVIE A L J, et al. An advanced culture method for generating large quantities of highly pure dendritic cells from mouse bone marrow[J]. J Immunol Methods, 1999, 223(1): 77–92. DOI: 10.1016/S0022-1759(98)00204-X |
| [4] | KIM W S, KIM J S, CHA S B, et al. Mycobacterium tuberculosis PE27 activates dendritic cells and contributes to Th1-polarized memory immune responses during in vivo infection[J]. Immunobiology, 2016, 221(3): 440–453. DOI: 10.1016/j.imbio.2015.11.006 |
| [5] | MAJLESSI L, BROSCH R. Mycobacterium tuberculosis meets the cytosol: the role of cGAS in anti-mycobacterial immunity[J]. Cell Host Microbe, 2015, 17(6): 733–735. DOI: 10.1016/j.chom.2015.05.017 |
| [6] |
吴俊娇. cGAS/STING信号通路关键因子在SLE中的表达及Ⅰ型IFNs与疾病活动指标的相关性分析[D]. 长沙: 中南大学, 2014.
WU J J. Expression of the key factors of cGAS/STING signaling pathway in SLE and correlation analysis between type Ⅰ interferons and indicators of disease activity[D]. Changsha: Central South University, 2014. (in Chinese) (in Chinese) |
| [7] | WASSERMANN R, GULEN M F, SALA C, et al. Mycobacterium tuberculosis differentially activates cGAS-and inflammasome-dependent intracellular immune responses through ESX-1[J]. Cell Host Microbe, 2015, 17(6): 799–810. DOI: 10.1016/j.chom.2015.05.003 |
| [8] | SUN L J, WU J X, DU F H, et al. Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type Ⅰ interferon pathway[J]. Science, 2013, 339(6121): 786–791. DOI: 10.1126/science.1232458 |
| [9] | SCHOGGINS J W, MACDUFF D A, IMANAKA N, et al. Pan-viral specificity of IFN-induced genes reveals new roles for cGAS in innate immunity[J]. Nature, 2014, 505(7485): 691–695. |
| [10] | ABLASSER A, SCHMID-BURGK J L, HEMMERLING Ⅰ, et al. Cell intrinsic immunity spreads to bystander cells via the intercellular transfer of cGAMP[J]. Nature, 2013, 503(7477): 530–534. DOI: 10.1038/nature12640 |
| [11] | WATSON R O, BELL S L, MACDUFF D A, et al. The cytosolic sensor cGAS detects Mycobacterium tuberculosis DNA to induce type Ⅰ interferons and activate autophagy[J]. Cell Host Microbe, 2015, 17(6): 811–819. DOI: 10.1016/j.chom.2015.05.004 |
| [12] | CARROLL E C, JIN L, MORI A, et al. The vaccine adjuvant chitosan promotes cellular immunity via DNA sensor cGAS-STING-dependent induction of type Ⅰ interferons[J]. Immunity, 2016, 44(3): 597–608. DOI: 10.1016/j.immuni.2016.02.004 |
| [13] | ZHANG H F, TANG K, ZHANG Y, et al. Cell-free tumor microparticle vaccines stimulate dendritic cells via cGAS/STING signaling[J]. Cancer Immunol Res, 2015, 3(2): 196–205. DOI: 10.1158/2326-6066.CIR-14-0177 |
| [14] | MA F, LI B, LIU S Y, et al. Positive feedback regulation of type Ⅰ IFN production by the IFN-inducible DNA sensor cGAS[J]. J Immunol, 2015, 194(4): 1545–1554. DOI: 10.4049/jimmunol.1402066 |
| [15] | BODE C, FOX M, TEWARY P, et al. Human plasmacytoid dendritic cells elicit a type Ⅰ interferon response by sensing DNA via the cGAS-STING signaling pathway[J]. Eur J Immunol, 2016, 46(7): 1615–1621. DOI: 10.1002/eji.201546113 |
| [16] | SCHIAVONI G, MATTEI F, GABRIELE L. Type Ⅰ interferons as stimulators of DC-mediated cross-priming: impact on anti-tumor response[J]. Front Immunol, 2013, 4: 483. |
| [17] | LI T J, CHENG H, YUAN H, et al. Antitumor activity of cGAMP via stimulation of cGAS-cGAMP-STING-IRF3 mediated innate immune response[J]. Sci Rep, 2016, 6: 19049. DOI: 10.1038/srep19049 |
| [18] | LIENARD J, MOVERT E, VALFRIDSSON C, et al. ESX-1 exploits type Ⅰ IFN-signalling to promote a regulatory macrophage phenotype refractory to IFNγ-mediated autophagy and growth restriction of intracellular mycobacteria[J]. Cell Microbiol, 2016, 18(10): 1471–1485. DOI: 10.1111/cmi.v18.10 |
| [19] | STOREK K M, GERTSVOLF N A, OHLSON M B, et al. cGAS and Ifi204 cooperate to produce type Ⅰ IFNs in response to Francisella infection[J]. J Immunol, 2015, 194(7): 3236–3245. DOI: 10.4049/jimmunol.1402764 |
| [20] |
丁亮, 泥艳红, 胡勤刚, 等. 新型胞质DNA感受通路: cGAS-STING的研究进展[J]. 生物化学与生物物理进展, 2014, 41(9): 830–838.
DING L, NI Y H, HU Q G, et al. cGAS-STING: the novel mechanism of cytosolic DNA sensing pathways[J]. Progress in Biochemistry and Biophysics, 2014, 41(9): 830–838. (in Chinese) |
| [21] | WOODWARD J J, IAVARONE A T, PORTNOY D A. c-di-AMP secreted by intracellular Listeria monocytogenes activates a host type Ⅰ interferon response[J]. Science, 2010, 328(5986): 1703–1705. DOI: 10.1126/science.1189801 |
| [22] | HANSEN K, PRABAKARAN T, LAUSTSEN A, et al. Listeria monocytogenes induces IFNβ expression through an IFI16-, cGAS-and STING-dependent pathway[J]. EMBO J, 2014, 33(15): 1654–1666. DOI: 10.15252/embj.201488029 |



