H9N2亚型禽流感病毒(avian influenza virus, AIV)属于低致病性AIV,被感染鸡一般无明显临床症状,但本实验室于2012年从临床病鸡体内分离到一毒株(A/chicken/Shandong/818/2012, SD/818),以106EID50静脉接种6周龄SPF鸡,其致死率为80%,表明该毒株与临床常见毒株相比,具有较强的致病性[1]。
AIV的致病性不仅与病毒自身的基因组成有关,还与其诱导机体产生的抗病毒天然免疫反应密切相关[2]。Ⅰ型干扰素(Ⅰ-type interferon,IFN-Ⅰ)作为机体抗病毒天然免疫的重要组成成分,在高致病性H5N1亚型AIV感染过程中其表达被抑制,机体的抗病毒能力被削弱,导致病毒大量复制,这与H5N1亚型AIV对宿主的高致病性有关[3-4],故IFN-Ⅰ是宿主方面决定AIV致病性的主要因素之一。
Toll样受体(toll like receptor, TLR)-7作为禽类识别AIV的重要受体,可明显诱导IFN-Ⅰ的产生[5]。INF-Ⅰ的抗病毒生物学功能主要是通过自分泌或旁分泌途径,与细胞膜上的特异性受体结合后,活化一系列细胞信号分子,如黏病毒抗性蛋白(myxovirus resistance,Mx)、双链RNA依赖性蛋白激酶(dsRNA-dependent protein kinase,PKR)和2′, 5′-寡聚腺苷酸合成酶(2′, 5′-oligoadenylate synthetase,OAS)等来产生抗病毒效应[6-7]。
本实验室前期研究发现不同致病性H9N2亚型AIV毒株SD/818和SD/196明显诱导了IFN-Ⅰ的表达,且两毒株间存在明显差异,这两毒株诱导IFN-Ⅰ产生的上游TLR-7及其下游Mx的表达是否也存在差异,有待于研究证实。故本研究拟对不同致病性毒株SD/818和SD/196诱导SPF鸡主要病变差异组织、SPF鸡胚和鸡胚成纤维细胞TLR-7和Mx基因mRNA转录水平的动态变化进行研究,拟为不同致病性H9N2亚型AIV诱导IFN-Ⅰ产生差异的机制提供依据,也为H9N2亚型AIV致病性增强机制的研究奠定基础。
1 材料与方法 1.1 试验材料 1.1.1 实验动物6周龄SPF鸡:购自山东SPF鸡实验种鸡场;SPF鸡胚:购自北京梅里亚维通实验动物技术有限公司。
1.1.2 病毒不同致病性H9N2亚型AIV毒株C/SD/196/11(GenBank: KR002648~KR002655;EID50:10-6.67·0.1 mL-1; IVPI: 0; TCID50:10-5.50·0.1 mL-1)和C/SD/818/12 (GenBank:KM285394~KM285401; EID50: 10-7.33·0.1 mL-1; IVPI:1.0; TCID50:10-6.68·0.1 mL-1)由本实验室分离、鉴定和保存。
1.1.3 主要试剂和仪器Trizol试剂、反转录酶、RNA酶抑制剂、FastStart Universal SYBR Green Master购自青岛赛尚科贸有限公司,实时荧光定量RT-PCR仪为杭州博日公司产品。
1.1.4 引物的设计及合成根据GenBank上鸡TLR-7、Mx和β-actin基因的序列,使用保守序列设计并合成各自的特异引物,由北京六合华大基因科技股份有限公司合成(表 1)。
|
|
表 1 TLR-7、Mx和β-actin基因引物序列 Table 1 Primers of TLR-7, Mx and β-actin gene |
150只6周龄SPF鸡随机分为对照组、SD/196组和SD/818组,每组50只,饲养于隔离器中;SD/196组和SD/818组SPF鸡分别静脉接种105EID50毒株C/SD/196/11和C/SD/818/12,对照组接种0.2 mL PBS;分别于感染后的第1、3、5、7和10天每组剖杀8只,采集具有明显病变差异的组织加PBS进行研磨用于细胞因子表达研究。
1.2.2 SPF鸡胚感染试验180枚10日龄SPF鸡胚随机分为对照组、SD/196组和SD/818组,每组60枚,分别尿囊腔接种PBS、104EID50的毒株C/SD/196/11和C/SD/818/12各0.1 mL;分别于接种后的第4、8、16、24、32和48小时收集鸡胚,采集胚体加PBS研磨,用于细胞因子表达研究。
1.2.3 鸡胚成纤维细胞感染试验11日龄SPF鸡胚胚体去除头、四肢和内脏,将胚体剪成碎块用Hank’s液和PBS洗涤液冲洗两次,加入0.25%的胰蛋白酶进行消化,用Hank’s液和营养液进行洗涤、吹打,将细胞悬液进行细胞计数。用营养液将细胞悬液稀释到约50万·mL-1,37 ℃ 5%CO2培养箱内培养直至细胞贴壁并观察。取生长良好的鸡胚成纤维细胞,分别接种PBS、SD/196和SD/818毒株病毒液(1 moi)37 ℃培养,于病毒感染后第4、8、16、24、32和48小时收集细胞用于细胞因子表达研究。
1.2.4 总RNA的提取及cDNA的合成匀浆的组织和细胞用Trizol-氯仿-异丙醇法提取其总RNA。反转录反应体系:5×Buffer 4 μL、10 mmol·μL-1 dNTP 2 μL、反转录M-MLV 1 μL、RNA酶抑制剂0.5 μL、oligo dT引物(25 pmol·μL-1)各0.75 μL,加DEPC双蒸水11 μL至20 μL,混匀后,溶解提取的RNA,然后37.5 ℃水浴1 h。反转录的cDNA -20 ℃保存备用,以便用于实时荧光定量RT-PCR。
1.2.5 SYBR Green Ⅰ RT-PCR扩增根据曹志伟等报道的方法[8]进行SYBR Green Ⅰ RT-PCR扩增,50 μL反应体系:FastStart Universal SYBR Green Master(ROX)25 μL、上下游引物各0.5 μL、模板8 μL,加双蒸水16 μL。扩增参数:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 15 s、60 ℃ 60 s,40个循环。经实时荧光定量RT-PCR检测后,计算Ct值。
1.3 统计学分析利用管家基因β-actin作校正,采用2-ΔΔCt法对各组织中TLR-7和Mx基因mRNA表达变化进行定量,数据采用SPSS 17.0统计软件,试验结果采用T检验法进行分析处理,P<0.05为差异显著,P<0.01为差异极显著。
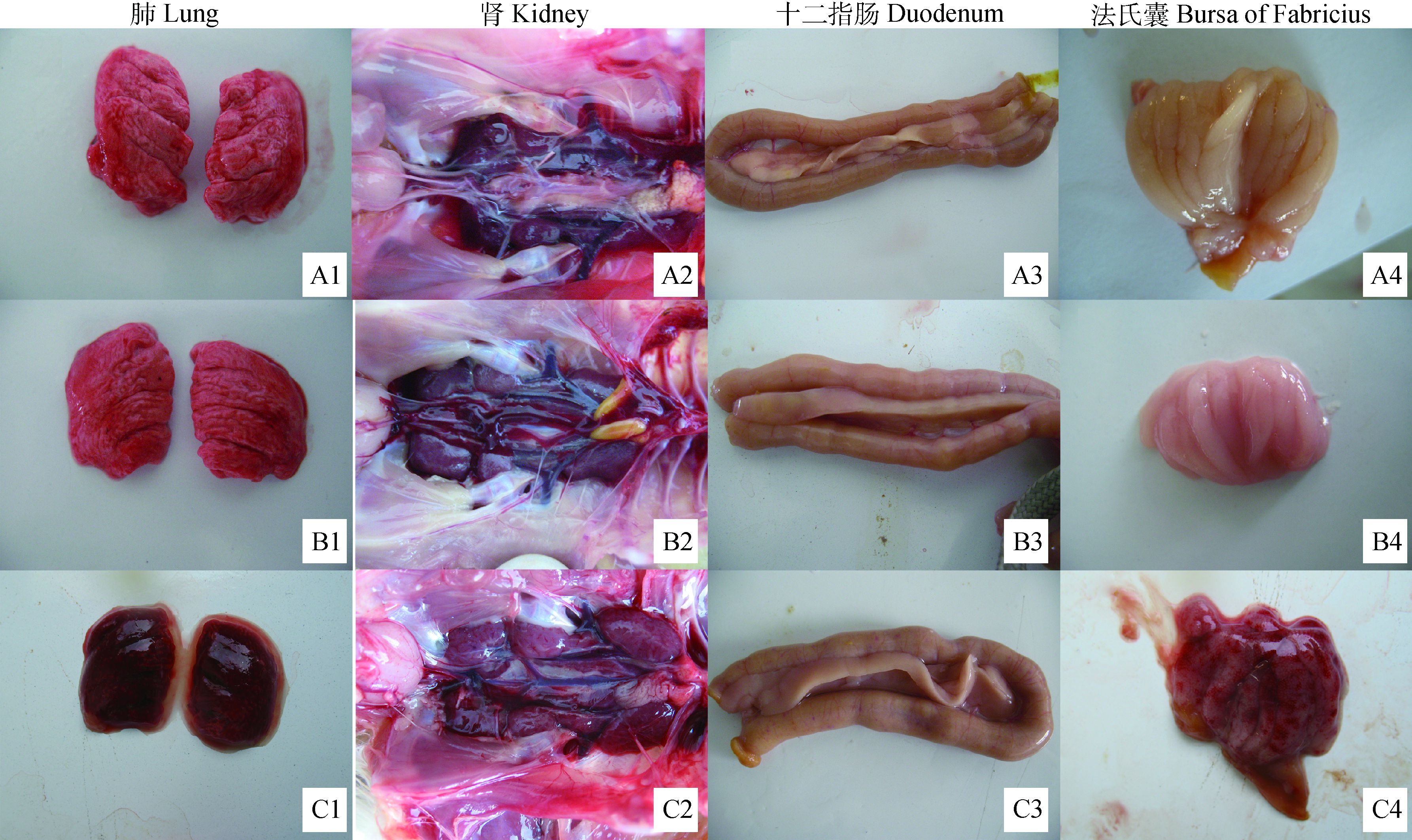
2 结果 2.1 不同致病性毒株感染SPF鸡的主要病理变化研究结果显示,不同致病性毒株SD/196和SD/818感染SPF鸡后,肺、肾、十二指肠和法氏囊为主要病变差异组织。毒株SD/196感染组(图 1B1~4)SPF鸡除肺出现轻度水肿外,其他组织与对照组(图 1A1~4)相似,无明显眼观变化;毒株SD/818感染组(图 1C)SPF鸡主要病变表现为肺明显水肿和淤血(图 1C1),肾肿大、淤血(图 1C2),十二指肠浆膜面出血(图 1C3),法氏囊严重出血(图 1C4)。
|
A、B、C分别为对照组、毒株SD/196感染组和SD/818感染组 A-C. Tissues of SPF chicken in control group, infected with strains SD/196 and SD/818 图 1 毒株SD/196和SD/818感染SPF鸡后主要组织器官病变特征 Figure 1 Pathological manifestations in different organs of SPF chicken infected with strains of SD/196 and SD/818 |
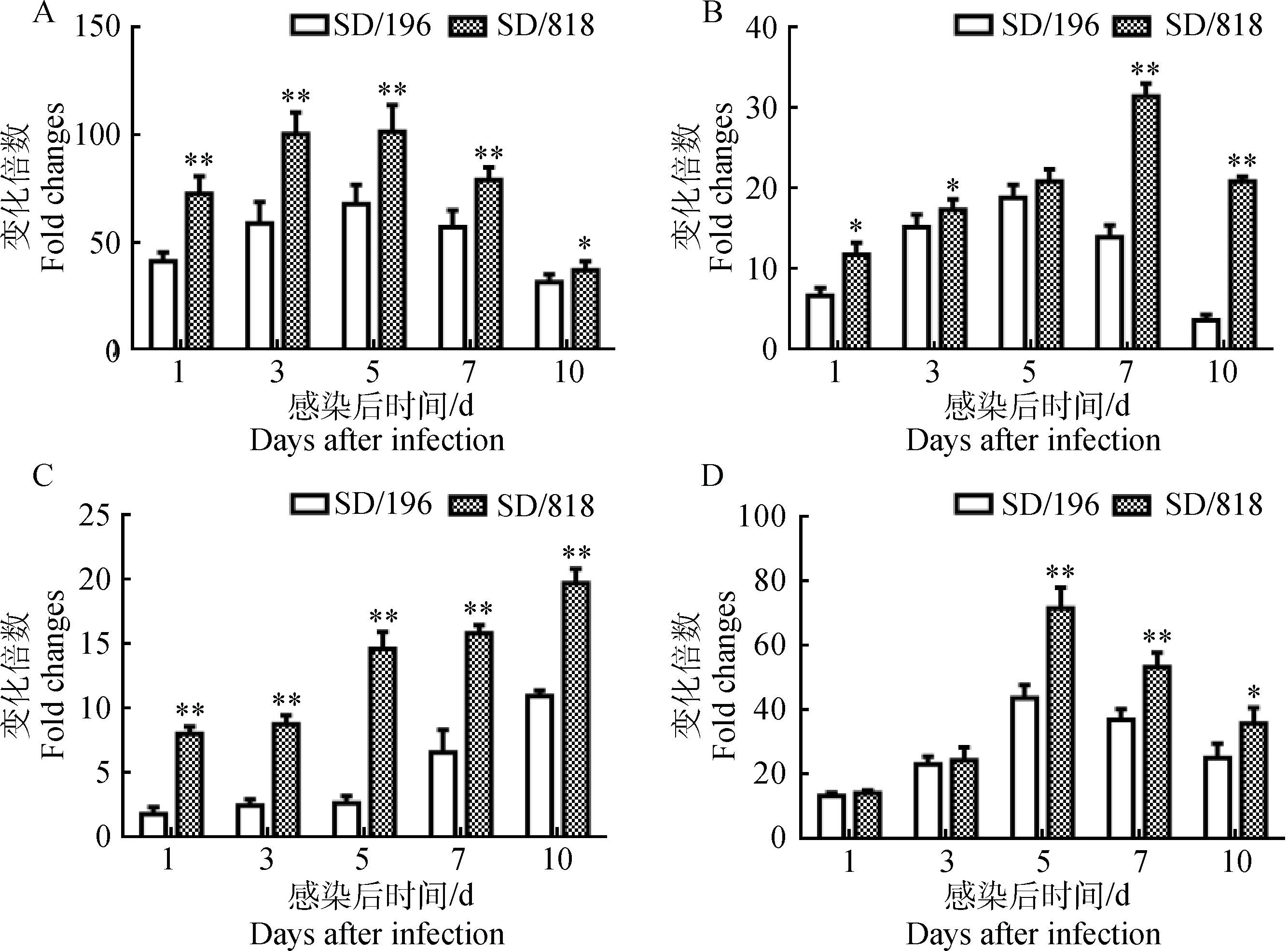
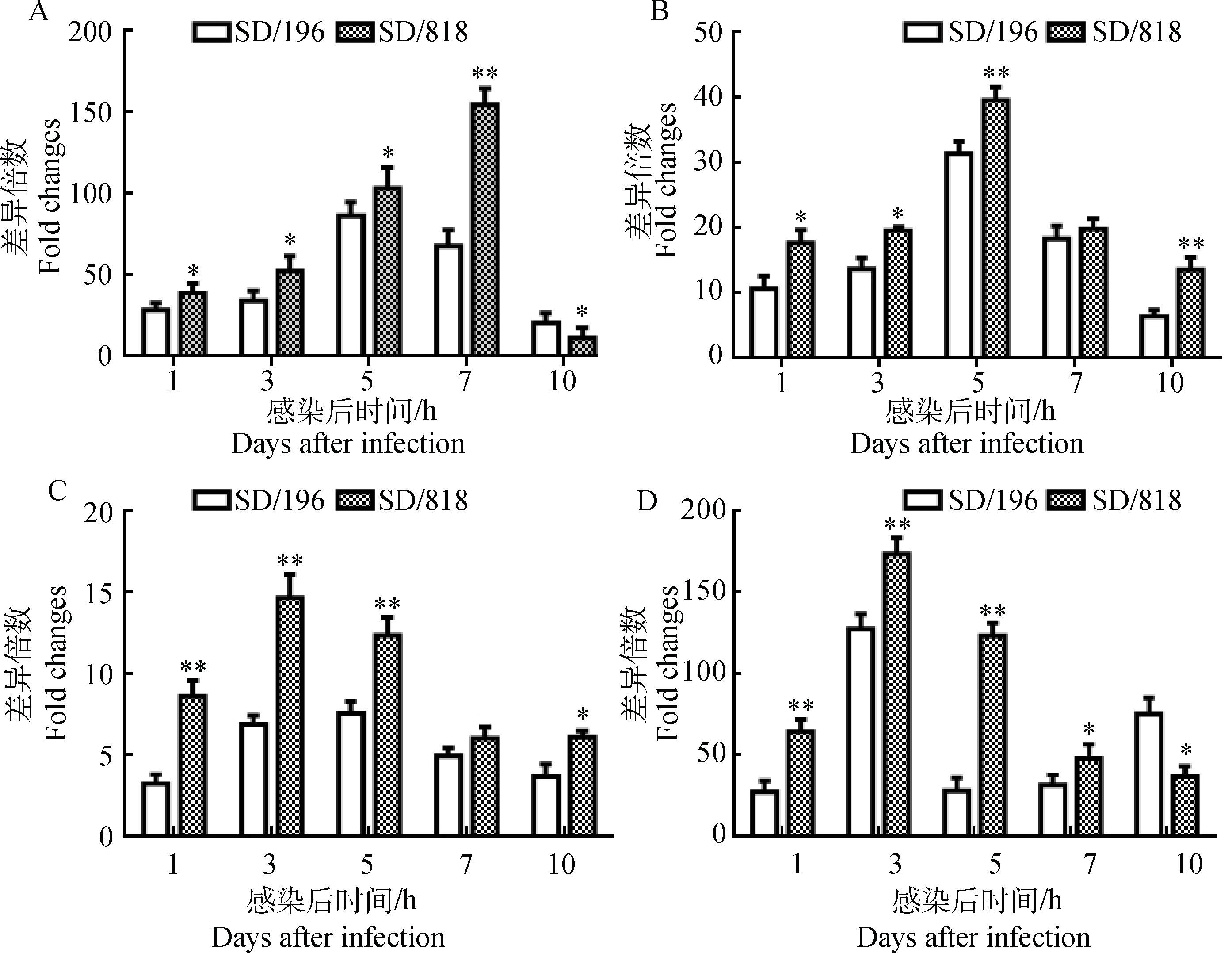
采集主要病变差异组织进行TLR-7和Mx基因mRNA表达研究,结果显示不同致病性毒株SD/196和SD/818均可诱导SPF鸡主要病变差异组织TLR-7和Mx基因mRNA的表达。在整个试验期间SD/818毒株诱导肺TLR-7和Mx基因mRNA的表达显著高于SD/196毒株(P<0.05或P<0.01)(图 2A和图 3A)。如图 2B和图 3B所示,除第5天外,毒株SD/818诱导肾TLR-7基因mRNA的表达显著高于SD/196毒株(P<0.05或P<0.01),除第7天外,较强毒株诱导肾Mx基因mRNA的表达显著高于弱毒株(P<0.05或P<0.01)。SD/818毒株诱导TLR-7和Mx基因mRNA在十二指肠的表达变化趋势与SD/196毒株的诱导表达基本一致,且除感染后第7天Mx基因mRNA的表达外,其余时间SD/818毒株诱导TLR-7与Mx基因mRNA的表达都显著高于SD/196(P<0.05或P<0.01)(图 2C和图 3C)。如图 2D和图 3D所示,SD/818毒株诱导法氏囊TLR-7基因mRNA的表达在第5—10天显著高于SD/196毒株(P<0.05或P<0.01);SD/818毒株诱导法氏囊Mx基因mRNA的表达在第1—7天显著高于SD/196毒株(P<0.05或P<0.01),而在第10天显著低于SD/196毒株(P<0.05)。
|
A.肺;B.肾;C.十二指肠;D.法氏囊。与SD/196相比,*.P<0.05;**.P<0.01 A. Lung; B. Kidney; C. Duodenum; D. Bursa of Fabricius. Compared with SD/196, *.P < 0.05;**.P < 0.01 图 2 不同致病性毒株诱导不同组织TLR-7基因mRNA的表达 Figure 2 Expression of TLR-7 mRNA in different tissues of chicken infected with H9N2 influenza virus with different pathogenicity |
|
A.肺;B.肾;C.十二指肠;D.法氏囊。与SD/196相比,*.P<0.05;**.P<0.01 A. Lung; B. Kidney; C. Duodenum; D. Bursa of Fabricius. Compared with SD/196, *.P < 0.05;**.P < 0.01 图 3 不同致病性毒株诱导不同组织Mx基因mRNA的表达 Figure 3 Expression of Mx mRNA in different tissues of chicken infected with H9N2 influenza virus with different pathogenicity |
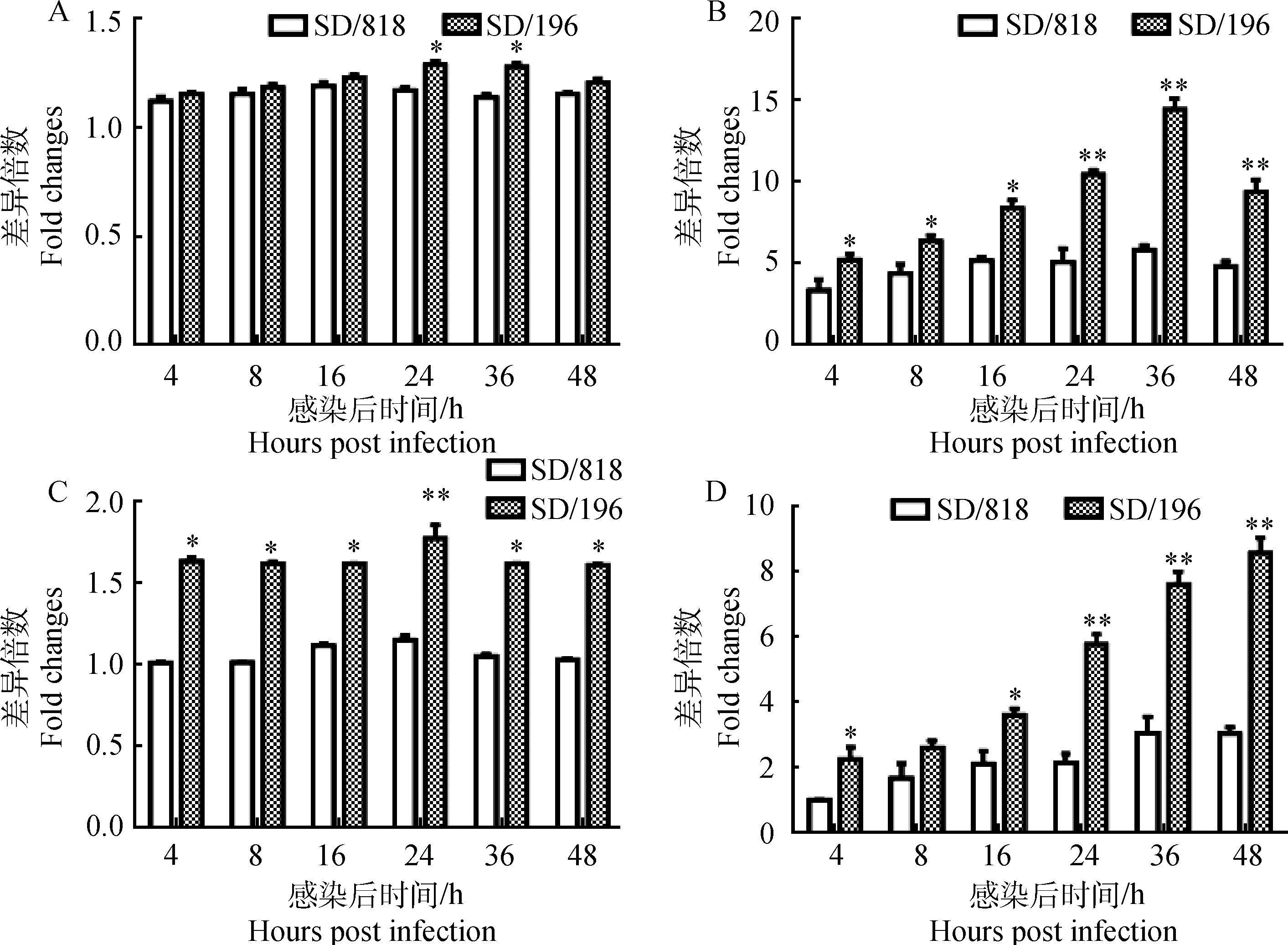
如图 4A和4C所示,不同致病性毒株SD/196和SD/818均可诱导SPF鸡胚中TLR-7和Mx基因mRNA的表达,毒株SD/818诱导SPF鸡胚TLR-7基因mRNA的表达在第24—36小时较毒株SD/196明显升高(P<0.05);而SD/818诱导表达的Mx基因mRNA在整个研究阶段较SD/196明显升高(P<0.05或P<0.01)。
|
A. TLR-7,SPF鸡胚;B. TLR-7,鸡胚成纤维细胞;C. Mx,SPF鸡胚;D. Mx,鸡胚成纤维细胞。与SD/196相比,*.P<0.05;**.P<0.01 A. TLR-7, SPF chicken embryo; B. TLR-7, primary chicken embryo fibroblasts; C. Mx, SPF chicken embryo; D. Mx, primary chicken embryo fibroblasts. Compared with SD/196, *.P < 0.05;**.P < 0.01 图 4 不同致病性毒株诱导SPF鸡胚和鸡胚成纤维细胞TLR-7和Mx基因mRNA的表达 Figure 4 Expression of TLR-7 and Mx mRNA in SPF chicken embryo and primary chicken embryo fibroblasts infected with H9N2 influenza virus with different pathogenicity |
不同致病性毒株SD/196和SD/818感染鸡胚成纤维细胞的研究结果显示,除Mx基因mRNA在感染后的第8小时外,毒株SD/818诱导鸡胚成纤维细胞产生的TLR-7和Mx基因mRNA在整个研究阶段显著高于毒株SD/196(P<0.05或P<0.01)(图 4B、D)。
3 讨论根据病毒的分子特征和致病特性,H9N2亚型AIV被认为是低致病性AIV,但本实验室从临床患鸡分离的少数毒株出现致病性改变的现象[9]。毒株SD/818和SD/196是不同时间从同一地方分离的病毒,通过NA和HA基因分析,同属于欧亚大陆禽分支,均在BJ/94分支内,属于Y280亚系[10],但两毒株具有明显的致病性差异(静脉接种指数分别为1.0和0)。SD/818感染SPF鸡后,其主要病变集中于肺、肾、十二指肠和法氏囊,而SD/196感染SPF鸡后,仅肺出现轻度水肿。为从宿主方面研究H9N2亚型AIV致病性增强的机制,笔者选用SD/818和SD/196作为不同致病性代表毒株,以两毒株致SPF鸡病变差异组织、SPF鸡胚和原代鸡胚成纤维细胞为宿主,动态测定病毒感染后宿主TLR-7和Mx基因mRNA转录水平的变化。
天然免疫系统是机体抵御病原微生物感染的第一道防线,模式识别受体(pattern recognition receptor,PRR)是天然免疫系统执行识别潜在的病原微生物并清除病原微生物的重要组成成分。PRR包括多种类型,TLR是最为重要的受体,在天然免疫反应中扮演着重要的角色。TLR-7是TLR家族的重要成员之一,研究认为流感病毒诱导IFN-Ⅰ的产生是通过TLR-7来完成的,流感病毒感染后TLR-7表达明显升高[10]。鸡与人和鼠的TLR-7相似,可在多种组织表达,H9N2亚型AIV感染鸡巨噬细胞的早期明显诱导了TLR-7的表达,对IFN-Ⅰ和IFN诱导基因的表达具有重要调控作用[11-12]。本研究对不同致病性H9N2亚型AIV感染SPF鸡的主要病变组织肺、肾、十二指肠和法氏囊以及SPF鸡胚和原代鸡胚成纤维细胞中TLR-7基因mRNA的表达进行动态测定,结果表明不同致病性毒株都明显诱导了各组织TLR-7基因mRNA的表达,且大部分组织中高致病性毒株SD/818诱导TLR-7基因mRNA的表达明显高于较弱毒株SD/196(仅SPF鸡胚和法氏囊少部分时间段差异不显著),结合前期各组织细胞中不同致病性毒株诱导IFN-Ⅰ表达的研究[13],认为不同致病性毒株诱导SPF鸡IFN-Ⅰ的表达与TLR-7基因mRNA的表达相关,且较强毒株SD/818诱导IFN-Ⅰ和TLR-7基因mRNA的表达明显高于较弱毒株SD/196。
Mx蛋白是一种抗病毒GTP酶,由IFN-Ⅰ诱导宿主细胞所产生,在大部分脊椎动物中存在,如哺乳动物、家禽和鱼类等。鸡只存在一种Mx蛋白,其作为主要的IFN刺激基因可在鸡DF-1细胞中外源IFN-Ⅰ的作用下大量产生[14]。本研究中,不同致病性H9N2亚型AIV明显诱导了SPF鸡主要病变组织、SPF鸡胚及原代鸡胚成纤维细胞中Mx基因mRNA的表达,且较高致病性毒株SD/818诱导Mx基因mRNA的表达明显高于较弱毒株SD/196。前期研究结果中,较高致病性毒株SD/818诱导各组织和细胞产生的IFN-Ⅰ高于较低致病性毒株SD/196,表明不同致病性毒株之间Mx基因mRNA的表达与IFN-Ⅰ的表达一致。但不同致病性H5N1亚型AIV诱导SPF肺IFN-β的表达无明显变化,而Mx的表达在较弱毒株较高[15]。这一差别可能与不同亚型毒株之间的生物学特性有关,研究认为高致病性H5N1亚型AIV中的NS1基因可明显抑制IFN-Ⅰ的产生而逃逸机体的抗病毒作用[4]。
Mx为IFN-Ⅰ和IFN-Ⅲ系统的重要抗病毒蛋白,可明显抑制多种病毒的复制,主要作用于病毒复制的早期[16]。但研究认为鸡Mx并不可抑制AIV的复制[17],故其生物学功能仍不确定。其抗病毒活性可能与第631位氨基酸(Asn/Ser)有密切关系,Mx基因编码705个氨基酸,第631位为Asn使抗病性明显加强[18]。本研究结果中,高致病性毒株SD/818诱导Mx基因mRNA的表达显著高于较弱毒株SD/196,结合本实验室前期研究结果,高致病性毒株SD/818在各组织和细胞中的复制及其诱导IFN-Ⅰ的表达显著高于较弱毒株SD/196,初步认为不同致病性毒株诱导Mx基因mRNA的表达与病毒的复制及其诱导的IFN-Ⅰ的产生有关,而其在较高致病性毒株SD/818中大量表达的生物学作用有待于进一步研究。
4 结论不同致病性H9N2亚型AIV明显诱导了SPF鸡主要病变差异组织、SPF鸡胚和原代鸡胚成纤维细胞中TLR-7和Mx基因mRNA的差异表达,表明毒株SD/818诱导TLR-7和Mx基因mRNA的大量表达与IFN-Ⅰ高表达及其较高致病性有关,为H9N2亚型AIV致病性增强机制的研究奠定基础。
| [1] | ZHANG Y, GUO X J, QI J, et al. Complete genome sequence of an H9N2 influenza virus lethal to chickens[J]. Genome Announc, 2014, 2(6): e00929–14. |
| [2] | SZRETTER K J, GANGAPPA S, LU X H, et al. Role of host cytokine responses in the pathogenesis of avian H5N1 influenza viruses in mice[J]. J Virol, 2007, 81(6): 2736–2744. DOI: 10.1128/JVI.02336-06 |
| [3] | ZENG H, GOLDSMITH C, THAWATSUPHA P, et al. Highly pathogenic avian influenza H5N1 viruses elicit an attenuated type Ⅰ interferon response in polarized human bronchial epithelial cells[J]. J Virol, 2007, 81(22): 12439–12449. DOI: 10.1128/JVI.01134-07 |
| [4] | LI Z J, JIANG Y P, JIAO P R, et al. The NS1 gene contributes to the virulence of H5N1 avian influenza viruses[J]. J Virol, 2006, 80(22): 11115–11123. DOI: 10.1128/JVI.00993-06 |
| [5] | CHEN S, CHENG A C, WANG M S. Innate sensing of viruses by pattern recognition receptors in birds[J]. Vet Res, 2013, 44: 82. DOI: 10.1186/1297-9716-44-82 |
| [6] | CHENG Y Q, SUN Y J, WANG H G, et al. Chicken STING mediates activation of the IFN gene independently of the RIG-I Gene[J]. J Immunol, 2015, 195(8): 3922–3936. DOI: 10.4049/jimmunol.1500638 |
| [7] | KAWAI T, AKIRA S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors[J]. Nat Immunol, 2010, 11(5): 373–384. DOI: 10.1038/ni.1863 |
| [8] |
曹志伟, 孙忠晟, 郭学金, 等. 鸡Ⅰ型IFN及TLR-3和TLR-7实时荧光定量RT-PCR检测方法的建立[J]. 中国兽医杂志, 2016, 52(2): 25–27, 30.
CAO Z W, SUN Z C, GUO X J, et al. Development of real-time quantitative PCR for chicken IFN type Ⅰ, TLR-3 and TLR-7[J]. Chinese Journal of Veterinary Medicine, 2016, 52(2): 25–27, 30. (in Chinese) |
| [9] |
王守春, 张毅, 卢春晓, 等. 2007年~2010年H9N2亚型禽流感病毒分离株对SPF鸡的致病特性研究[J]. 中国兽医杂志, 2013, 49(3): 3–6.
WANG S C, ZHANG Y, LU C X, et al. Pathogenic effects of H9N2 avian influenza viruses between 2007 and 2010 on chickens[J]. Chinese Journal of Veterinary Medicine, 2013, 49(3): 3–6. (in Chinese) |
| [10] |
刘琳琳, 张毅, 郭学金, 等. 两株不同致病力H9N2亚型禽流感病毒全基因组序列分析[J]. 动物医学进展, 2015, 36(9): 37–42.
LIU L L, ZHANG Y, GUO X J, et al. Complete genome sequence analysis of two H9N2 subtype avian influenza virus strains bearing different virulences[J]. Progress in Veterinary Medicine, 2015, 36(9): 37–42. (in Chinese) |
| [11] | BROWNLIE R, ALLAN B. Avian toll-like receptors[J]. Cell Tissue Res, 2011, 343(1): 121–130. DOI: 10.1007/s00441-010-1026-0 |
| [12] | XING Z, CARDONA C J, LI J L, et al. Modulation of the immune responses in chickens by low-pathogenicity avian influenza virus H9N2[J]. J Gen Virol, 2008, 89(5): 1288–1299. DOI: 10.1099/vir.0.83362-0 |
| [13] | WANG J L, CAO Z W, GUO X J, et al. Cytokine expression in three chicken host systems infected with H9N2 influenza viruses with different pathogenicities[J]. Avian Pathol, 2016, 45(6): 630–639. DOI: 10.1080/03079457.2016.1193665 |
| [14] | QU H R, YANG L M, MENG S S, et al. The differential antiviral activities of chicken interferon α (ChIFN-α) and ChIFN-β are related to distinct interferon-stimulated gene expression[J]. PLoS One, 2013, 8(3): e59307. DOI: 10.1371/journal.pone.0059307 |
| [15] | MATSUU A, KOBAYASHI T, PATCHIMASIRI T, et al. Pathogenicity of genetically similar, H5N1 highly pathogenic avian influenza virus strains in chicken and the differences in sensitivity among different chicken breeds[J]. PLoS One, 2016, 11(4): e0153649. DOI: 10.1371/journal.pone.0153649 |
| [16] | HALLER O, STAEHELI P, SCHWEMMLE M, et al. Mx GTPases: dynamin-like antiviral machines of innate immunity[J]. Trends Microbiol, 2015, 23(3): 154–163. DOI: 10.1016/j.tim.2014.12.003 |
| [17] | SCHUSSER B, REUTER A, VON DER MALSBURG A, et al. Mx is dispensable for interferon-mediated resistance of chicken cells against influenza A virus[J]. J Virol, 2011, 85(16): 8307–8315. DOI: 10.1128/JVI.00535-11 |
| [18] |
尹春光, 杜立新, 李善刚, 等. 鸡Mx基因的克隆与原核表达[J]. 畜牧兽医学报, 2009, 40(7): 978–981.
YIN C G, DU L X, LI S G, et al. Cloning and expression of chicken Mx cDNA in Escherichia coli[J]. Acta Veterinaria et Zootechnica Sinica, 2009, 40(7): 978–981. (in Chinese) |



