2. 动物营养学国家重点实验室, 北京 100193
2. State Key Laboratory of Animal Nutrition, Beijing 100193, China
畜禽的体重性状属于数量性状,由多基因控制。全基因组关联分析(Genome-wide association study, GWAS)在疾病研究方面已经取得了极大的成功[1]。目前,GWAS在鸡复杂数量性状的研究中已经取得了一定的进展。明星鸡和丝羽乌骨鸡F2群体全基因组关联分析显示LDB2基因与鸡7~12周体重和6~12周日增重相关联[2]。LDB2基因在北京油鸡被证实与体重相关联[3]。单个SNP位点的关联分析能够在大量的SNP标记中找到与性状相关的SNP,进而确定影响性状的基因。GWAS的检测效率有限,当达到全基因组显著性阈值的SNP位点较少或没有时,则得不到与性状相关联的基因。考虑到传统单标记关联分析的局限性,许多替代及补充传统GWAS的分析方法陆续出现,如使用多个SNP位点进行关联分析[4-6],采用估算的基因型进行关联分析[7],基于连锁信息进行关联分析[8]以及基于通路的关联方法[9]等。SRT(SNP ratio test)是一种基于通路的关联分析方法,联合显著关联的SNP和通路中的SNP两个指标得到与性状关联的通路[10]。
本研究以北京油鸡和科宝肉鸡构建的F2资源群体为试验材料,通过对F2群体14、28、56、93日龄体重及0~14、14~28、28~56、56~93日龄日增重等表型进行基于通路信息的关联分析,以期筛选出影响鸡体重性状的通路,为挖掘鸡体重性状的候选基因及分子标记提供科学依据。
1 材料与方法 1.1 试验材料本研究中表型数据取自中国农业科学院北京畜牧兽医研究所构建的北京油鸡与科宝肉鸡F2资源群体[2, 11]。表型性状包括:14、28、56、93日龄体重及0~14、14~28、28~56、56~93日龄日增重。F2资源群体328个个体的基因型数据用于GWAS及SRT。基因型数据通过鸡的60K芯片获得。
1.2 体重性状GWAS数据前处理基因型数据整理:首先对SNP进行质量控制(Quality control,QC),删除样本检出率小于90%的个体,同时对质量不合格的SNP进行剔除,具体条件:SNP检出率(Call rate)<90%,最小等位基因频率(Minor allele frequency, MAF)<0.03, 哈代-温伯格平衡检验P值小于1×10-6的SNP。表型数据处理:采用SAS 8.0统计软件(SAS Institute Inc., Gary, N.C., USA)的Mean过程对表型数据进行初步的统计分析。运用Kolmogorov-Smirnov(D)方法对表型数据进行正态分布检验, 当P>0.15时, 数据呈正态分布。
1.3 全基因组关联分析:关联分析:使用Tassel 3.0软件中的广义线性模型(General linear model, GLM)进行SNPs-表型性状的全基因组关联分析。以raw P-value<0.05为标准筛选显著性的SNP(https://sourceforge.net/projects/snpratiotest/),用于后续的分析。
1.4 SRT(SNP ratio test)根据galGal3(http://support.illumina.com/sequencing/sequencing_software/igenome.html)坐标将SNPs比对到鸡基因组中。具体而言,若SNP定位于基因中,则SNP与基因对应,若SNP位于基因上下游50 kb以内,那么SNP与相邻该基因对应。鸡的通路信息从KEGG(http://www.genome.jp/)中提取。根据鸡SNP图谱和鸡通路信息构建Pathway-SNP矩阵。SNP based pathway分析通过SRT完成[10],具体分析方法参照《SNP ratio test documentation》(https://sourceforge.net/projects/snpratiotest/)进行。
2 结果 2.1 F2群体体重及日增重变化由图 1可以看出,F2资源群体增重速度随日龄的增加逐渐变快,在42~56日龄达到高峰,然后放缓。F2资源群体日增重在14~28日龄左右开始出现性状分离,体重性状在28日龄开始出现性状分离,表现为标准差扩大,并且个体间体重及生长速度的差异没有随着日龄的增加而缩小。其中42~56日龄为体重快速增长期,且在F2资源群体中,个体间差异较大,给GWAS及后期的通路分析提供了良好的素材。
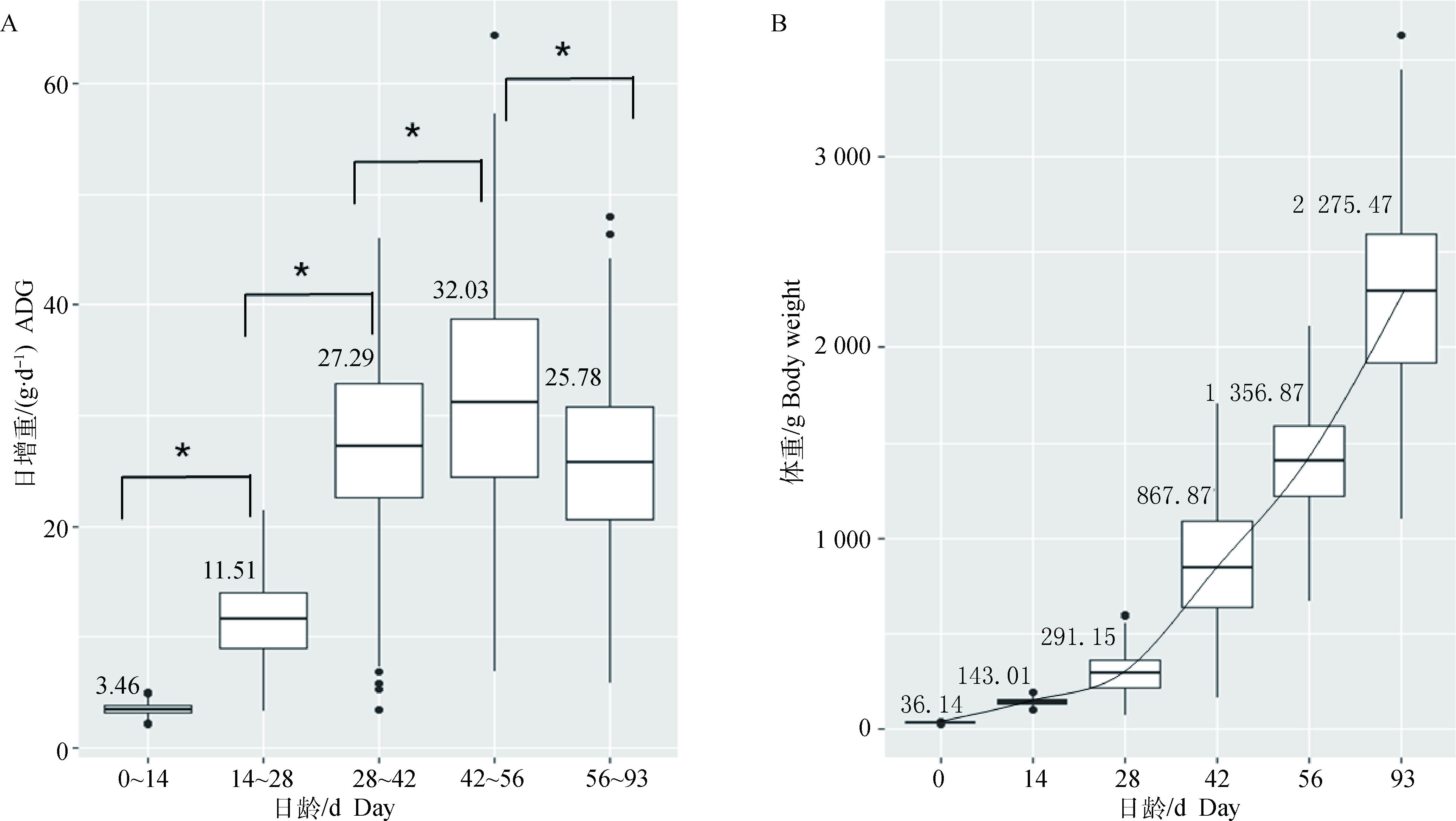
|
A.日增重变化;B.体重变化。*.表示两者之间差异显著(P < 0.05) A. Average daily gain variation; B. Body weight variation. *. Means significant difference(P < 0.05) 图 1 日增重及体重变化 Figure 1 Average daily gain and body weight variation |
以P-value<0.05为标准筛选显著性的SNP数目,其中与日增重性状相关SNP:0~14日龄4 114个、14~28日龄4 612个、28~42日龄5 829个、42~56日龄2 012个、56~93日龄5 851个。体重性状相关SNP:14日龄4 056个、28日龄4 697个、42日龄7 188个、56日龄4 996个、93日龄5 428个(图 2)。
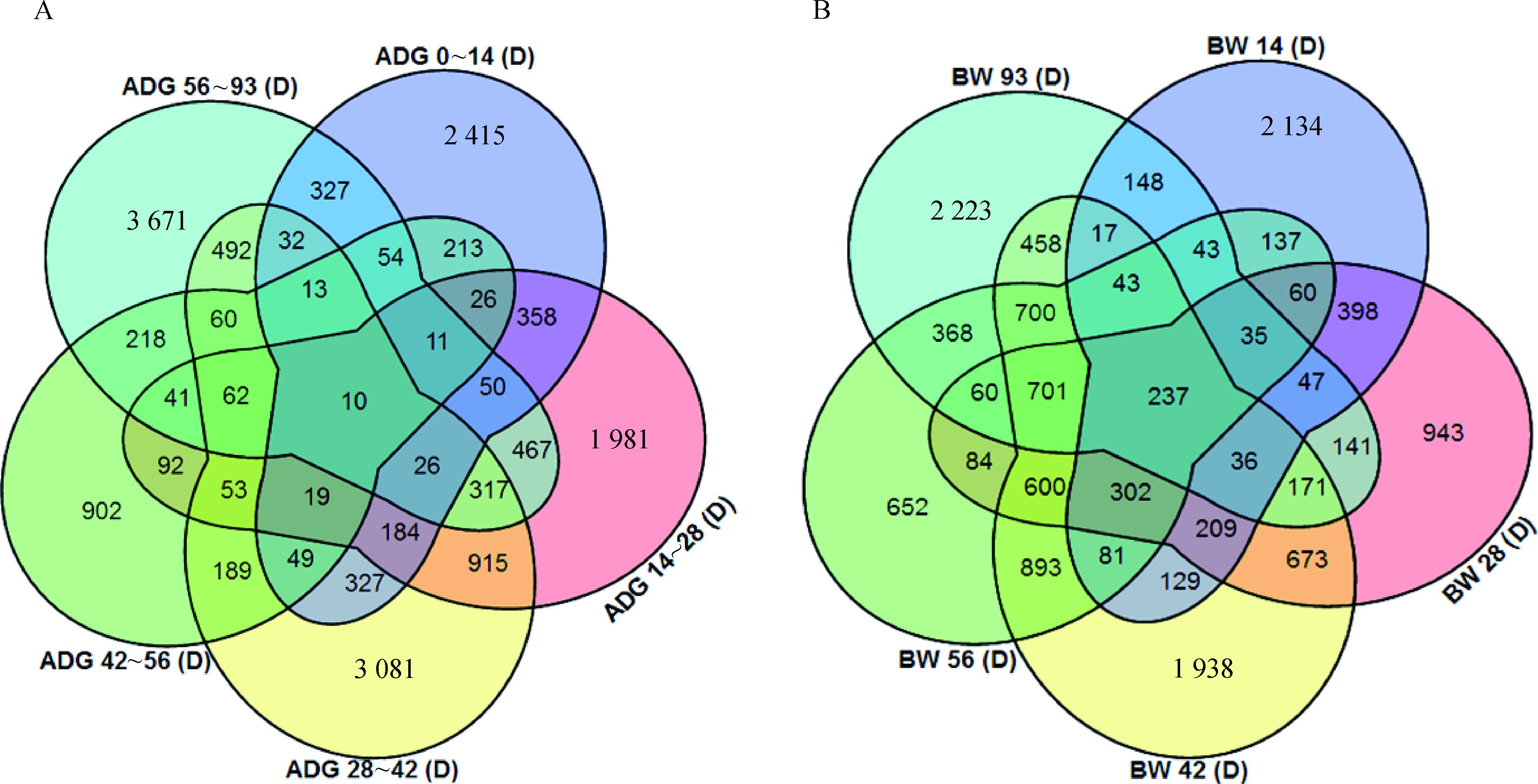
|
图 2 日增重(A)及体重(B)性状相关显著性SNPs位点 Figure 2 Significant SNP loci associated with ADG(A) and BW(B) |
由表 1可以看出,各阶段体重相关的通路大都与氨基酸的代谢相关,丙氨酸、天冬氨酸、谷氨酸、酪氨酸和色氨酸等氨基酸的代谢过程与体重的增加相关联(P < 0.05)。14日龄体重与类固醇激素的生物合成相关联(P < 0.05),56日龄体重与烟酸和烟酰胺的代谢相关联(P < 0.05)。93日龄体重与糖酵解/糖异生相关(P < 0.05)。
|
|
表 1 体重相关信号通路 Table 1 Signal pathways related to body weight |
由表 2可以看出,在增重最快的42~56日龄,与日增重相关的SNP富集到的通路最多,说明有大量的生物学过程在这个阶段处于活跃状态。与42~56日龄日增重相关(P < 0.05) 的通路主要集中在TCA循环、类固醇合成、类固醇激素的生物合成、氧化磷酸化、磷酸肌醇代谢、甘油磷脂代谢等过程。其中,类固醇激素的生物合成起到了重要的作用,大量的氨基酸代谢过程与日增重相关联。在体重迅速增长的阶段,与脂肪代谢相关的通路也处于活跃状态。
|
|
表 2 日增重相关信号通路 Table 2 Average daily gain related signal pathways |
本课题组前期的GWAS研究发现,与体重相关的SNP位点主要集中在4号染色体78.11~84.94 Mb的区间内,其中包括78.11 Mb处的rs14490907、78.12 Mb处的rs14490909、83.28 Mb处的rs14495766和80.20 Mb处的rs14492276,定位到可能与体重性状相关联的基因SLIT2(Slit homolog 2(Drosophila))、AFAP1(Actin filament-associated protein 1) 和NKX3-2(NK3 homeobox 2)[11]。体重性状作为复杂的数量性状由微效多基因控制,而GWAS研究得到的相关基因较少,并不能够很好的解释影响体重性状的分子机制。
体重增长与肌肉、脂肪以及骨的增长相关。同时消化系统的发育也与体重增长关系密切。本研究发现类固醇激素生物合成过程在机体发育的过程中起到了至关重要的作用。肾上腺皮质、性腺及胎盘分泌的激素都属于类固醇激素,重要的类固醇激素包括肾上腺皮质激素、雌性性激素和雄性性激素。研究表明,睾酮可以促进肌肉发育[12], 睾酮是一种能够促进动物蛋白质合成的激素, 对肌纤维的增粗和增长具有显著的作用, 最终表现为促进肌肉生长[13-15]。血清中睾酮水平与肉鸡的肌肉生长发育有密切的联系[16]。同时类固醇激素对骨骼的生长、发育以及骨量维持有重要的作用,雄激素可刺激成骨细胞的增殖和分化。睾酮和双氢睾酮能够降低破骨细胞介导的骨吸收过程[17]。糖皮质激素对肌肉的生长发育具有重要的作用。糖皮质激素能够改变促生长因子的量进而引起骨骼肌的萎缩,研究表明糖皮质激素能够抑制骨骼肌细胞产生IGF-Ⅰ[18],而骨骼肌中过表达IGF-Ⅰ能够缓解由糖皮质激素引发的骨骼肌萎缩。采用皮质酮处理小鼠能降低其腓肠肌中IGF-Ⅰ和IGF-Ⅱ mRNA的表达量[19]。糖皮质激素能降低大鼠骨骼肌的重量并且上调MSTN mRNA的表达量[20]。糖皮质激素能够促进骨骼肌的蛋白质分解, 能引起小鼠肌肉中FOXO的表达上调[21]。FOXO1是一个与肌肉萎缩有重要关系的调节因子,会诱导多种形式的肌肉萎缩。而IGF-Ⅰ可以通过激活AKT而抑制FOXO的活性[22]。
大量氨基酸代谢过程与日增重相关联,研究发现谷氨酰胺能够显著增加肠道对亮氨酸和脯氨酸的吸收量,显著增加肠道组织游离亮氨酸和脯氨酸量,并显著增加肠道蛋白质的合成量[23]。饲粮中添加谷氨酰胺可以促进鸡肠道黏膜发育,提高小肠绒毛密度和宽度,增加肠细胞数量[24]。谷氨酰胺可通过激活mTOR信号通路来促进肠细胞蛋白质合成和肠细胞的生长[25]。色氨酸调节蛋白质的合成和降解可能与其参与调节蛋白质合成和降解的信号途径有关,在鹅上的研究表明,色氨酸是通过上调参与调控蛋白质合成基因的mRNA表达量、蛋白合成量及磷酸化水平,降低促进蛋白质降解基因的表达来促进腿肌蛋白质沉积的[26],色氨酸还可通过调节体内激素分泌,例如提高血液中IGF-Ⅰ水平来调节蛋白质代谢[27]。
研究与性状相关的通路对于寻找性状相关的功能基因同样具有指导意义。已知代谢通路与性状相关联,那么该通路中相关的节点基因有可能对该性状具有调控作用。色氨酸代谢通路中有HADHA、AANAT等关键基因,类固醇激素合成途径中有CYP1B1、SULT1E1等关键基因。王红杨利用蛋白质组学技术鉴定出HADHA蛋白可能是影响机体发育早期肌内脂肪沉积的关键蛋白[28]。研究表明,褪黑素能够显著的影响试验动物(大鼠)的日均采食量和平均日增重[29],AANAT活性决定着褪黑激素的合成和分泌节律,从而影响生物的生殖性状和生产性能[30-31]。CYP1B1基因敲除能够对小鼠的营养性肥胖起到保护作用,表明CYP1B1基因可能参与脂肪代谢进而影响动物的体重[32]。雌激素作为具有广泛生物活性的类固醇化合物对机体的代谢、骨骼的生长和成熟以及体脂的分布具有重要影响。雌激素硫酸转移酶SULT1E1是雌激素合成的关键酶, 对于雌激素的合成及功能的发挥具有重要的意义[33]。以上结果从侧面证明了本试验结果的可靠性。因此,本研究为功能基因的挖掘提供了一个新的思路。
4 结论本试验基于通路分析的方法分析肉鸡体重性状全基因组关联研究,发现在体重迅速增长阶段类固醇激素的生物合成起到了重要的作用,且氨基酸代谢过程与日增重显著相关。
| [1] | MANOLIO T A, BROOKS L D, COLLINS F S. A HapMap harvest of insights into the genetics of common disease[J]. J Clin Invest, 2008, 118(5): 1590–1605. DOI: 10.1172/JCI34772 |
| [2] | GU X R, FENG C G, MA L, et al. Genome-wide association study of body weight in chicken F2 resource population[J]. PLoS One, 2011, 6(7): e21872. DOI: 10.1371/journal.pone.0021872 |
| [3] |
吴丹, 刘冉冉, 赵桂苹, 等. 鸡体质量性状基因的全基因组关联研究[J]. 畜牧兽医学报, 2012, 43(12): 1887–1896.
WU D, LIU R R, ZHAO G P, et al. Genome-wide association study of genes affecting body weight in chicken[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(12): 1887–1896. (in Chinese) |
| [4] | LI M Y, WANG K, GRANT S F A, et al. ATOM: a powerful gene-based association test by combining optimally weighted markers[J]. Bioinformatics, 2009, 25(4): 497–503. DOI: 10.1093/bioinformatics/btn641 |
| [5] | GAUDERMAN W J, MURCRAY C, GILLILAND F, et al. Testing association between disease and multiple SNPs in a candidate gene[J]. Genet Epidemiol, 2007, 31(5): 383–395. DOI: 10.1002/gepi.v31:5 |
| [6] | WANG K, ABBOTT D. A principal components regression approach to multilocus genetic association studies[J]. Genet Epidemiol, 2008, 32(2): 108–118. DOI: 10.1002/(ISSN)1098-2272 |
| [7] | MARCHINI J, HOWIE B. Genotype imputation for genome-wide association studies[J]. Nat Rev Genet, 2010, 11(7): 499–511. DOI: 10.1038/nrg2796 |
| [8] | ROEDER K, BACANU S A, WASSERMAN L, et al. Using linkage genome scans to improve power of association in genome scans[J]. Am J Hum Genet, 2006, 78(2): 243–252. DOI: 10.1086/500026 |
| [9] | WANG K, LI M Y, BUCAN M. Pathway-based approaches for analysis of genomewide association studies[J]. Am J Hum Genet, 2007, 81(6): 1278–1283. DOI: 10.1086/522374 |
| [10] | O'DUSHLAINE C, KENNY E, HERON E A, et al. The SNP ratio test: pathway analysis of genome-wide association datasets[J]. Bioinformatics, 2009, 25(20): 2762–2763. DOI: 10.1093/bioinformatics/btp448 |
| [11] |
孙艳发. 基于全基因组关联研究技术筛选鸡产肉和肉品质性状相关候选基因[D]. 扬州: 扬州大学, 2013.
SUN Y F. Filtration of candidate gene related to meat production and quality traits based on genome-wide association study technique in chickens[D]. Yangzhou: Yangzhou University, 2013. (in Chinese) (in Chinese) |
| [12] | HEFFNER L J, SCHUST D J. The reproductive system at a glance[M]. New York: John Wiley & Sons, 2010. |
| [13] | SINHA-HIKIM I, ROTH S M, LEE M I, et al. Testosterone-induced muscle hypertrophy is associated with an increase in satellite cell number in healthy, young men[J]. Am J Physiol Endocrinol Metab, 2003, 285(1). |
| [14] | SOLOMON A M, BOULOUX P M G. Modifying muscle mass-the endocrine perspective[J]. J Endocrinol, 2006, 191(2): 349–360. DOI: 10.1677/joe.1.06837 |
| [15] | ÜSTÜNEL İ, AKKOYUNLU G, DEMIR R. The effect of testosterone on gastrocnemius muscle fibres in growing and adult male and female rats: a histochemical, morphometric and ultrastructural study[J]. Anatom Histol Embryol, 2003, 32(2): 70–79. DOI: 10.1046/j.1439-0264.2003.00441.x |
| [16] |
刘文杰, 陈耀星, 王子旭, 等. 单色光对肉鸡肌肉生长、肌纤维发育及血清睾酮水平的影响[J]. 畜牧兽医学报, 2008, 39(12): 1759–1764.
LIU W J, CHEN Y X, WANG Z X, et al. Effect of monochromatic light on the muscle growth and muscle fiber development and testosterone secretion in broilers[J]. Acta Veterinaria et Zootechnica Sinica, 2008, 39(12): 1759–1764. DOI: 10.3321/j.issn:0366-6964.2008.12.021 (in Chinese) |
| [17] |
孟迅吾, 夏维波. 类固醇激素与骨[J]. 中国医学科学院学报, 2003, 25(3): 237–239.
MENG X W, XIA W B. Steroids hormone and bone[J]. Acta Academiae Medicinae Sinicae, 2003, 25(3): 237–239. (in Chinese) |
| [18] | GAYAN-RAMIREZ G, VANDERHOYDONC F, VERHOEVEN G, et al. Acute treatment with corticosteroids decreases IGF-1 and IGF-2 expression in the rat diaphragm and gastrocnemius[J]. Am J Respir Crit Care Med, 1999, 159(1): 283–289. DOI: 10.1164/ajrccm.159.1.9803021 |
| [19] | SCHAKMAN O, GILSON H, DE CONINCK V, et al. Insulin-like growth factor-Ⅰ gene transfer by electroporation prevents skeletal muscle atrophy in glucocorticoid-treated rats[J]. Endocrinology, 2005, 146(4): 1789–1797. DOI: 10.1210/en.2004-1594 |
| [20] | MA K, MALLIDIS C, BHASIN S, et al. Glucocorticoid-induced skeletal muscle atrophy is associated with upregulation of myostatin gene expression[J]. Am J Physiol Endocrinol Metab, 2003, 285(2): E363–E371. DOI: 10.1152/ajpendo.00487.2002 |
| [21] | AUCLAIR D, GARREL D R, ZEROUALA A C, et al. Activation of the ubiquitin pathway in rat skeletal muscle by catabolic doses of glucocorticoids[J]. Am J Physiol Cell Physiol, 1997, 272(3): C1007–C1016. |
| [22] | SANDRI M, SANDRI C, GILBERT A, et al. Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy[J]. Cell, 2004, 117(3): 399–412. DOI: 10.1016/S0092-8674(04)00400-3 |
| [23] |
叶元土, 王永玲, 蔡春芳, 等. 谷氨酰胺对草鱼肠道L-亮氨酸、L-脯氨酸吸收及肠道蛋白质合成的影响[J]. 动物营养学报, 2007, 19(1): 28–32.
YE Y T, WANG Y L, CAI C F, et al. Effects of the L-glutamine on the absorption of L-leucine, L-proline and the protein synthesis in intestine of grass carp (Ctenopharyngodon idellus) in vitro[J]. Chinese Journal of Animal Nutrition, 2007, 19(1): 28–32. (in Chinese) |
| [24] | MURAKAMI A E, SAKAMOTO M I, NATALI M R M, et al. Supplementation of glutamine and vitamin E on the morphometry of the intestinal mucosa in broiler chickens[J]. Poult Sci, 2007, 86(3): 488–495. DOI: 10.1093/ps/86.3.488 |
| [25] |
席鹏彬, 蒋宗勇, 戴兆来, 等. L-谷氨酰胺对猪肠上皮细胞蛋白质周转的调控[C]//第六次全国饲料营养学术研讨会[A]. 杨凌: 中国畜牧兽医学会, 2010.
XI P B, JIANG Z Y, DAI Z L, et al. Regulation of protein turnover in porcine intestinal cells by L-glutamine[C]//The Sixth National Symposium on Feed and Nutrition[A]. Yangling: Chinese Association of Animal Science and Veterinary Medicine, 2010. (in Chinese) (in Chinese) |
| [26] |
魏宗友. 色氨酸对鹅组织蛋白质代谢调控机制的影响[D]. 扬州: 扬州大学, 2012.
WEI Z Y. Effect of dietary tryptophan levels on tissue protein metabolism and its manipulating mechanism in goslings[D]. Yangzhou: Yangzhou University, 2012. (in Chinese) (in Chinese) |
| [27] |
张华伟, 尹靖东, 周玄. 限饲和自由采食条件下色氨酸对断奶仔猪血清IGF-1浓度的影响[J]. 中国畜牧杂志, 2006, 42(23): 19–22.
ZHANG H W, YIN J D, ZHOU X. Effect of dietary tryptophan levels on serum IGF-1 in limited and adlib fed weaned piglets[J]. Chinese Journal of Animal Science, 2006, 42(23): 19–22. DOI: 10.3969/j.issn.0258-7033.2006.23.007 (in Chinese) |
| [28] |
王红杨. 胚胎期至生长早期鸡肌肉发育及肌内脂肪沉积蛋白质组研究[D]. 北京: 中国农业科学院, 2015.
WANG H Y. The proteomic study of muscle development and intramuscular fat deposition of chickens at embryonic and early growth stages[D]. Beijing: Chinese Academy of Agricultural Sciences, 2015. (in Chinese) (in Chinese) |
| [29] |
王林枫, 柳如意, 杨改青, 等. 褪黑素对大鼠生长及脂肪代谢、分配的影响[J]. 动物营养学报, 2015, 27(8): 2456–2465.
WANG L F, LIU R Y, YANG G Q, et al. Effects of melatonin on growth, and lipometabolism and partition of fat in rat[J]. Chinese Journal of Animal Nutrition, 2015, 27(8): 2456–2465. (in Chinese) |
| [30] | KLEIN D C, COON S L, ROSEBOOM P H, et al. The melatonin rhythm-generating enzyme: molecular regulation of serotonin N-acetyltransferase in the pineal gland[J]. Recent Prog Horm Res, 1997, 52: 307–358. |
| [31] | FOULKES N S, WHITMORE D, SASSONE-CORSI P. Rhythmic transcription: the molecular basis of circadian melatonin synthesis[J]. Biol Cell, 1997, 89(8): 487–494. DOI: 10.1016/S0248-4900(98)80004-X |
| [32] |
姚聪, 赵显茂, COLINR J, 等. CYP1B1基因敲除对高脂膳食诱导小鼠肥胖的抑制作用[J]. 环境与健康杂志, 2011, 28(4): 288–292.
YAO C, ZHAO X M, COLIN R J, et al. Inhibition effect of CYP1B1 deficiency on obesity mice caused by high fat diet[J]. Journal of Environment and Health, 2011, 28(4): 288–292. (in Chinese) |
| [33] | HUI Y, YASUDA T, YASUDA S, et al. Inhibitory effects of nitrative stress on the sulfation of 17β-estradiol and 4-methoxyestradiol by human MCF 10A mammary epithelial cells[J]. Biol Pharm Bull, 2010, 33(9): 1633–1637. DOI: 10.1248/bpb.33.1633 |



