2. 信阳师范学院 生命科学学院, 信阳 464000;
3. 西北农林科技大学 动物脂肪沉积与肌肉发育实验室, 杨凌 712100
2. College of Life Science, Xinyang Normal University, Xinyang 464000, China;
3. Laboratory of Animal Fat Deposition and Muscle Development, Northwest A & F University, Yangling 712100, China
肌内脂肪存在于肌肉组织的肌外膜、肌束膜甚至肌内膜上[1]。在畜牧生产上,肌内脂肪的含量与肉的嫩度、多汁性及风味水平等肉品质密切相关,因此被认为是评定肉品质的一个关键因素[2]。之前的研究表明,能量、蛋白质、脂肪酸、维生素和矿物质等均可以提高肌内脂肪的含量;动物的脂肪组织形成除了受遗传、环境、营养水平等影响外,更多的取决于基因的控制[3-6]。但是目前基因调控肌内脂肪含量的相关研究并不太多。因此,从基因层面探究调控肌内脂肪沉积的分子机制非常必要。
甲硫氨酸腺苷转移酶(MAT)催化蛋氨酸与ATP形成生物体内重要的甲基化供体:S-腺苷甲硫氨酸(SAM)[7]。在哺乳动物体内,MAT有两个不同的基因产物,MAT1A(编码MATI/Ⅲ)和MAT2A (编码MATⅡ),他们分别只在肝或各组织内广泛地表达[8]。MAT2B编码β调控亚基,与MAT2A编码的α2催化亚基一起调控MATⅡ的酶活性[9]。目前,MAT2B研究主要集中在肝癌细胞的增殖与凋亡等方面[10-11]。然而,MAT2B是否调控猪脂肪细胞分化尚未见报道。前期利用基因芯片技术发现腺苷甲硫氨酸转移酶2B基因(MAT2B)与猪肌内脂肪含量密切相关[12]。进一步研究发现,MAT2B在脂肪型猪和瘦肉型猪的脂肪和肌肉组织中存在着显著的差异表达[13],推测其可能在脂肪细胞分化过程中发挥重要作用。
本研究通过构建腺病毒介导的MAT2B超表达载体,探究其对猪前体脂肪细胞分化的影响,进一步研究MAT2B调控猪脂肪细胞分化的分子机制奠定了基础。
1 材料与方法 1.1 试验材料1~3日龄健康的关中黑猪,取样前用0.5%新洁尔灭清洗,75%酒精擦拭,电击处死。腺病毒骨架载体pAdEasy-1和穿梭载体pAdTrack-CMV (Stratagene公司,美国)及E. coli菌株BJ5183和293A细胞系由本实验室保存。限制性内切酶(Kpn Ⅰ和Xho Ⅰ)、Taq酶和T4连接酶试剂盒购于日本TaKaRa公司; 线性化酶Pme Ⅰ和Pac Ⅰ购于New England Biolabs公司(美国); 反转录试剂盒购于Vazyme公司(美国);质粒小提试剂盒和凝胶回收试剂盒购于Omega公司(美国); DMEM/F12、I型胶原酶、Opti-MEM、LipofectamineTM3000购于Invitrogen公司;胎牛血清购于Science Cell公司(美国);MAT2B抗体购于Abcam公司;其他试剂均为国产或进口分析纯。
1.2 重组腺病毒pAd-MAT2B表达载体构建与鉴定根据GenBank中猪MAT2B基因序列(Accession No. : NM_001142832.1),设计带有Kpn Ⅰ和Xho Ⅰ酶切位点D的扩增引物,MAT2B-F:5′-GG-GGTACCAATGGTGGGGCGGGAGAA-3′, MAT2B-R:5′-CCGCTCGAGATGAAAAACTGTTTGTCTCC-3′(下划线部分为内切酶Kpn Ⅰ和Xho Ⅰ酶切位点,并加入保护碱基)。以猪脂肪组织mRNA为模板,MAT2B和pAd Track-CMV分别经Kpn Ⅰ和Xho Ⅰ双酶切,胶回收后采用T4连接酶16 ℃连接过夜,连接产物转化E. coli DH5α感受态,转化的菌液均匀涂布于含100 mg·L-1卡那霉素的LB平板上,37 ℃过夜培养,挑取5个克隆在卡那霉素LB培养基摇菌过夜,提取质粒,经Kpn Ⅰ和Xho Ⅰ双酶切验证后,将获得的阳性克隆质粒(命名为pAdTrack-CMV-MAT2B)进行测序。
将重组质粒pAdTrack-CMV-MAT2B用Pme Ⅰ酶切完全线性化后转化到含有pAdEasy-1的BJ5183感受态中,与骨架载体pAdEasy-1进行同源重组,并在含有100 mg·L-1卡那霉素的LB平板上进行筛选,挑取单克隆过夜摇菌,抽提质粒,进行Pac Ⅰ酶切和PCR鉴定后,将测序正确的重组质粒命名为pAd-MAT2B。
1.3 重组腺病毒pAd-MAT2B包装、扩繁及滴度测定293A细胞在含10%胎牛血清的DMEM培养液中培养。待细胞密度达到约90%时,将pAd-MAT2B经过Pac Ⅰ酶切线性化,酚/氯仿抽提,乙醇沉淀后,采用LipofectamineTM3000转染试剂转染293A细胞,转染24 h后开始在荧光显微镜下观察绿色荧光蛋白的表达情况,待细胞出现明显病变效应后,收集细胞,离心弃去上清液,于液氮/37 ℃条件下反复冻融3次,采用病毒原液感染293A细胞,进行扩繁病毒,收集的病毒颗粒储存于-80 ℃。
以每孔3×103个293A细胞接种于96孔板中,采用10% FBS DMEM培养液培养24 h后,将得到浓缩的病毒颗粒按照10倍比例稀释病毒,得到100~10-6浓度梯度,分别感染293A细胞(每个梯度设置10个重复),2 d后统计荧光表达情况,病毒滴度(pfu·mL-1)通过公式:GFP阳性细胞数×病毒稀释倍数/0.01 mL计算。
1.4 猪肌内脂肪细胞的分离与培养无菌状态下采集3~7日龄仔猪的背最长肌组织,用含双倍双抗的PBS清洗3次,去除肉眼可见的结缔组织或血管后,剪成1~2 mm3组织块;每克组织加入12 500 U的Ⅰ型/Ⅱ型胶原酶进行消化,37 ℃水浴摇床上消化1~2 h;消化后消化液用10% FBS的培养基等体积中和,200目不锈钢筛网过滤,收集滤液;所收集滤液1 500 g离心10 min,弃上清,加入无血清DMEM培养基1 500 g离心清洗细胞2次;含10% FBS的F12/ DMEM培养基重新悬浮细胞;37 ℃, 5% CO2培养箱培养1 h后,换液,无菌的PBS清洗3次,移去未贴壁的细胞;换新鲜的F12/ DMEM液后细胞置37 ℃, 5% CO2培养箱中培养。
1.5 油红O染色及定量分析取分化第8天的猪肌内脂肪细胞,PBS清洗3次;4%多聚甲醛室温固定20~30 min;PBS清洗3次。用油红O工作液在室温下浸染细胞30 min,PBS清洗3次;显微镜下观察照相。进一步定量分析,采用适量100%异丙醇萃取与脂滴结合的油红O,在波长为510 nm的分光光度计下测定其吸光值(A)。
1.6 RNA提取和Real-time PCR定量分析按照TRIzol试剂盒提取不同时间点收集的猪肌内脂肪细胞的RNA。根据NCBI中GenBank发表的基因序列,采用Primer 5. 0设计PCR定量引物,引物相关参数见表 1。按照Vazyme反转录试剂盒操作说明进行反转录,合成cDNA第一链;然后以此作为模板,采用IQ5 (Bio-Rad公司)实时定量PCR系统检测基因表达情况。荧光定量反应体系为20 μL: SYBR Mix为10 μL,上下游引物各0.8 μL(10 μmol·L-1),cDNA模板为2 μL,用ddH2O补至20 μL。扩增程序:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火20 s,共40个循环。基因相对表达量采用2-△△Ct法计算,以β-actin作为内参基因。每组试验至少重复3次。
1.7 蛋白提取及Western印迹分析取处理的猪肌内脂肪细胞加入RIPA蛋白裂解液(含1 mmol·L-1 PMSF),BCA法测定蛋白浓度,用5×上样缓冲液将蛋白浓度调整一致,煮沸10 min,上样量为20 μg。12% SDS-PAGE胶电泳,将胶上条带转移至PVDF膜上,5%脱脂奶粉常温封闭2 h。一抗4 ℃孵育过夜,二抗4 ℃ 1.5 h。用Bio-Rad ChemiDoxXRS+曝光系统检测目的条带。
1.8 数据分析试验数据以“平均值±标准误(mean±SE)”表示,采用SPSS13.0统计分析软件One-way ANOVA进行方差分析,用t检验(t-test)对不同试验处理之间的差异进行显著性分析。
|
|
表 1 实时定量PCR扩增所用的引物序列 Table 1 Specific primers for real-time quantitative PCR |
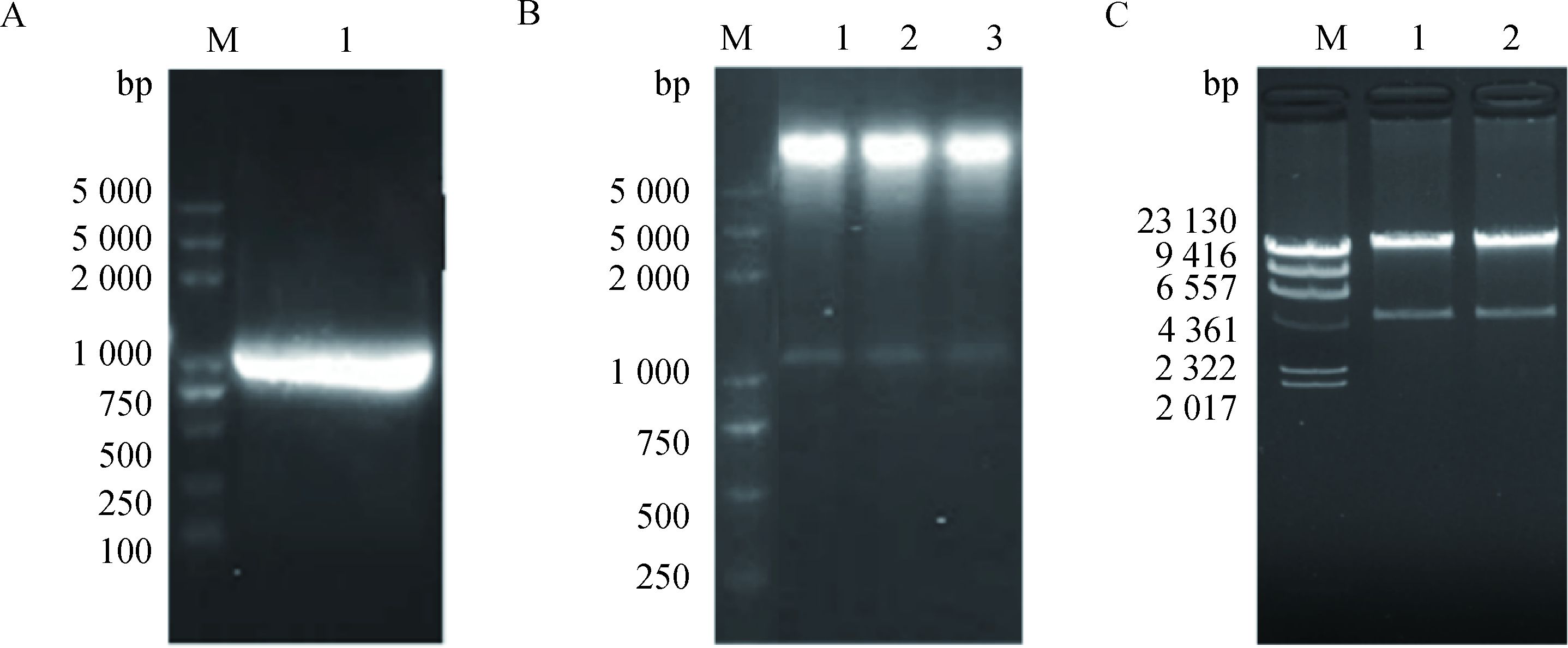
以猪肌肉组织cDNA为模板,设计MAT2B PCR引物扩增CDS全长,琼脂糖电泳结果显示其目的条带单一,片段大小为1 005 bp(图 1A),对克隆片段与pAdTrack-CMV空载进行Kpn Ⅰ和Xho Ⅰ双酶切后,过夜连接。对构建的重组质粒再进行Kpn Ⅰ和Xho Ⅰ双酶切鉴定。如图 1所示,出现约为9和1 kb的两个片段,分别为pAdTrack-CMV和1 005 bp的MAT2B(图 1B)。将胶回收的小片段测序后,与GenBank中猪基因组序列(Accession No.:NM_001142832.1) 进行同源性比较,序列的同源性为100%,证明pAdTrack-MAT2B载体构建成功。将构建的pAdTrack-CMV-MAT2B载体进行Pme Ⅰ酶切线性化,与pAd-Easy-1同源重组,筛选2个阳性克隆经过Pac Ⅰ酶切后,电泳检测发现其释放出一条大小为4 500 bp的片段(图 1C),与预期结果相符,证明pAd-MAT2B载体构建成功。
|
A. MAT2B的PCR凝胶电泳检测:1. 1 005 bp的MAT2B片段; B. Kpn Ⅰ和Xho Ⅰ的双酶切电泳检测:1~3. pAdTrack-CMV-MAT2B经双酶切电泳检测,释放出1 005 bp的片段;C. MAT2B的Pac Ⅰ酶切电泳检测:1~2.经Pac Ⅰ酶切后,MAT2B重组质粒释放出4.5 kb的基因片段。M. DNA相对分子质量标准 A. Agarose gel electrophoresis of MAT2B PCR product: M. DNA marker (DL 5000); 1. PCR product of MAT2B. B. pAdTrack-CMV-MAT2B was digested by Kpn Ⅰ and Xho Ⅰ: M. DNA marker (DL 5000); 1-3. Three clones of pAd-Track-CMV-MAT2B, all released about 1 005 bp fragment after Kpn Ⅰ and Xho Ⅰ digestion. C. pAd-MAT2B was digested with Pac Ⅰ: M. λ Hind Ⅲ marker; 1-2. Both of clones released a 4.5 kb fragment after Pac Ⅰ digestion 图 1 pAd-MAT2B重组腺病毒表达载体的构建与鉴定 Figure 1 Construction and identification of recombinant plasmid pAdTrack-CMV-MAT2B |
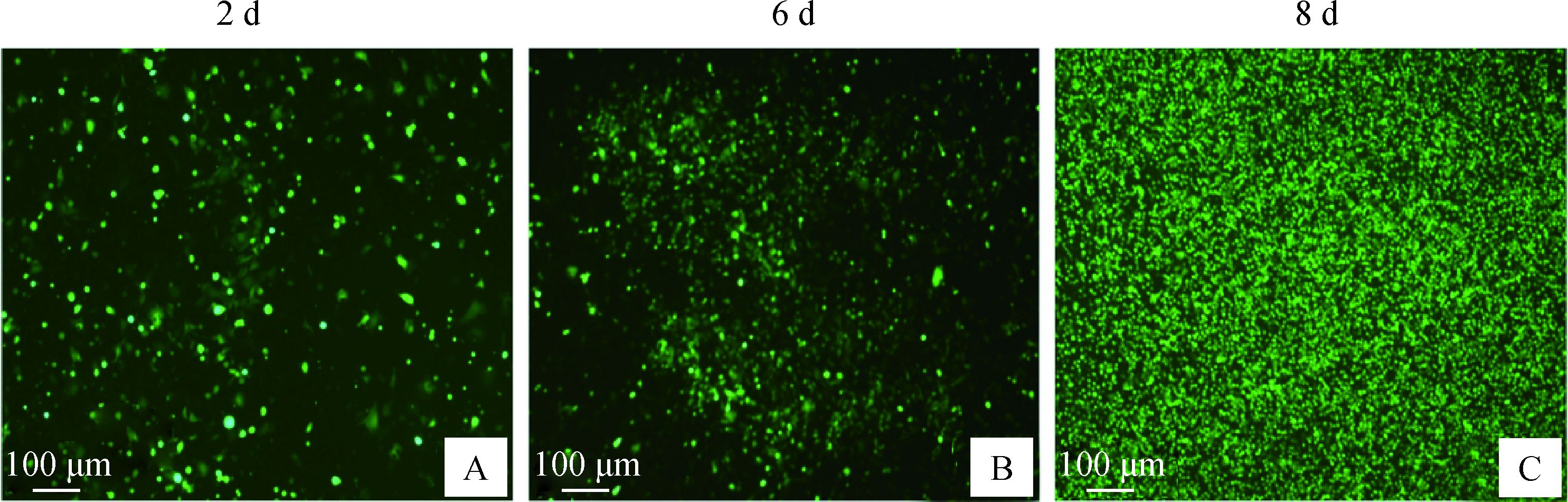
用Pac Ⅰ酶切重组pAd-MAT2B质粒,乙醇沉淀法纯化质粒后,转染生长密度为90%左右的293A细胞。转染2 d后荧光显微镜下观察有绿色荧光蛋白(GFP)表达(图 2A)。4 d后成熟的病毒颗粒开始释放,感染周围的细胞。6 d后出现腺病毒包装过程中典型的“彗星尾”现象(图 2B)。7 d成片的彗星尾区域重叠且GFP面积范围扩增。8 d后整个视野的GFP荧光数量显著增加,90%以上出现典型的CPE现象,即细胞已经开始发生肿胀,变园,皱缩及从皿底脱落(图 2C)。将包装好的重组腺病毒Ad-MAT2B经5次扩增和纯化后,滴度可达到1×109 pfu·mL-1。
|
A.腺病毒包装第2天,出现GFP; B.腺病毒包装第6天,GFP荧光剧增; C.包装第8天,细胞全部表达GFP,细胞出现细胞病变效应(CPE)现象 A. The GFP expression increased rapidly after the 293A cells were transfected by pAd-MAT2B for 2 days; B. The "comet tail" occurred after transfected with pAd-MAT2B for 6 days; C. 293A cells appeared CPE after transfected with pAd-MAT2B for 8 days 图 2 pAd-MAT2B重组腺病毒的包装 Figure 2 The package of recombinant adenovirus pAd-MAT2B |
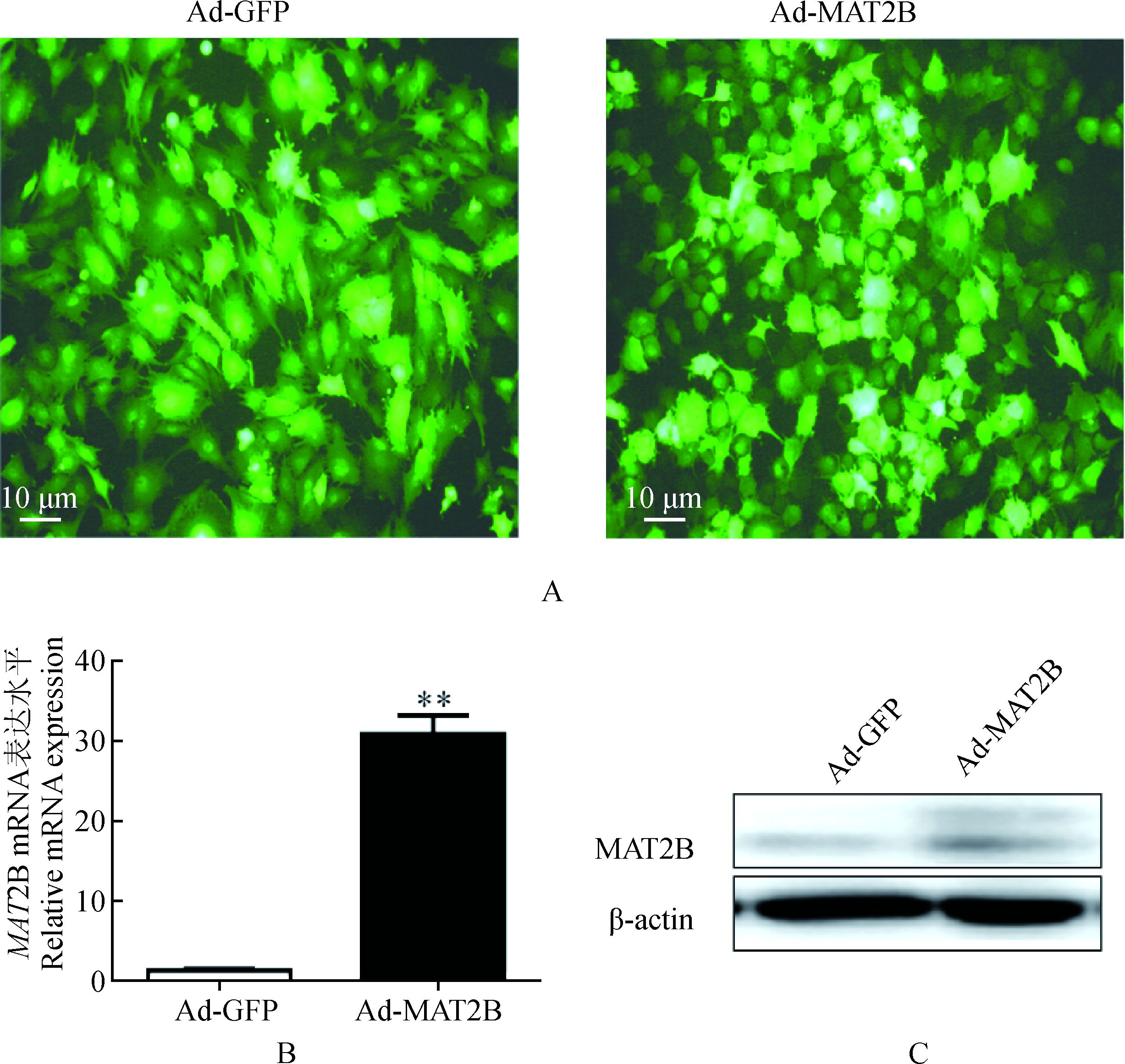
经过纯化的腺病毒侵染猪前体脂肪细胞48 h后,荧光显微镜下观察70%左右的细胞能成功表达GFP(图 3A)。分别提取其RNA和蛋白,进行RT-qPCR和Western blot试验发现,与Ad-GFP相比,Ad-MAT2B mRNA水平上升了约30倍(图 3B)。这些结果表明,构建的Ad-MAT2B腺病毒载体可以显著的上调猪肌内脂肪细胞中MAT2B表达,此为开展MAT2B调控猪肌内脂肪细胞的功能鉴定奠定了基础。
|
A.感染Ad-GFP和Ad-MAT2B的猪前体脂肪细胞;B.分别检测感染腺病毒后,MAT2B mRNA表达水平;C.检测感染腺病毒后,MAT2B的蛋白表达水平(n=3, *.P<0.05, **.P<0.01) A. Porcine preadipocytes were separately infected by Ad-GFP (as a control) and Ad-MAT2B for 48 h; B. Expression of MAT2B mRNA in porcine preadipocytes infected by Ad-MAT2B; C. Expression of MAT2B protein in porcine preadipocytes infected by Ad-MAT2B. Data are presented as means ±SEM, n=3. *.P < 0.05, **.P < 0.01 图 3 pAd-MAT2B重组腺病毒侵染猪肌内脂肪细胞 Figure 3 Porcine intramuscular preadipocytes infected by Ad-MAT2B recombinant adenovirus |
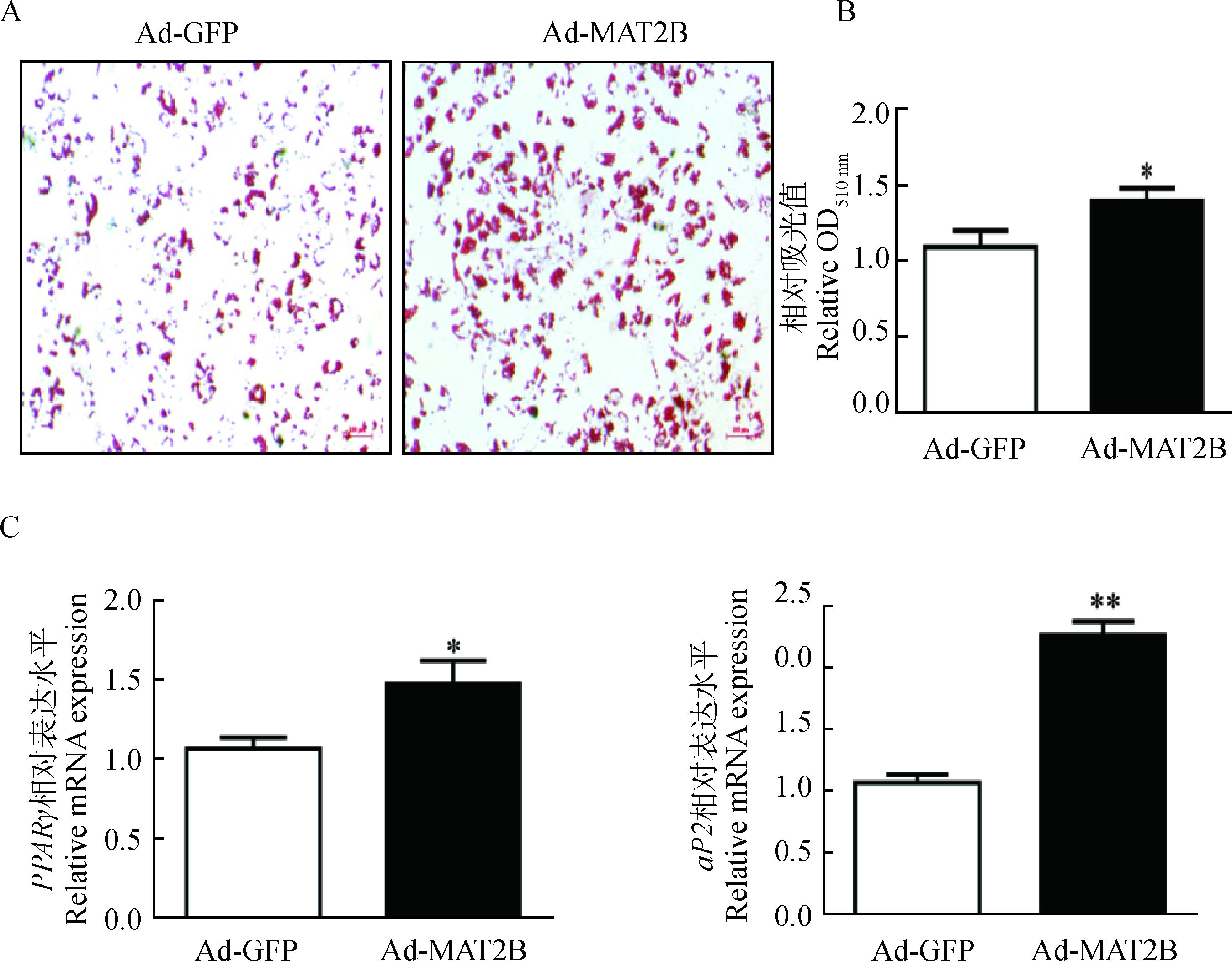
腺病毒侵染猪肌内脂肪细胞后,收取成脂诱导分化第8天的细胞,进行油红O染色。对脂质聚集及统计分析发现,Ad-MAT2B处理组显著的增加了脂质积累(图 4A和B)。同时,进行Real-time PCR检测发现,与Ad-GFP组相比,Ad-MAT2B处理组的成脂标志基因PPARγ和aP2 mRNA水平均显著地上调(图 4C)。结果表明,过表达MAT2B能够显著的促进猪肌内脂肪细胞的分化。
|
A.猪肌内脂肪细胞在侵染Ad-GFP或Ad-MAT2B后,诱导分化8天,油红O染色图(200×);B.吸光度510 nm处定量分析脂质合成;C. Real-time qPCR检测成脂标记基因PPARγ和aP2表达(n=3, *.P<0.05, **.P<0.01) A. Porcine intramuscular preadipocytes were infected with Ad-GFP or Ad-MAT2B, the cells were induced differentiation with MDI at day 8, Oil Red O staining (200×); B. Quantitative analysis with Oil Red O extraction as the optical density (OD) value at 510 nm; C. Relative PPARγ and aP2 mRNA expression during intramuscular adipogenesis detected by real-time PCR. Data are presented as means ±SEM, n=3, *.P < 0.05, **.P < 0.01 图 4 超表达MAT2B促进猪肌内脂肪细胞分化 Figure 4 MAT2B promoting porcine intramuscular preadipocyte differentiation |
甲硫氨酸腺苷转移酶(MAT)以蛋氨酸为底物,在ATP酶的作用下生成生物体内重要的甲基化供体:S-腺苷甲硫氨酸(SAM)[7]。SAM可以增加骨骼肌中线粒体DNA密度以及整个机体的胰岛素敏感性[14]。骨骼肌是体内葡萄糖代谢的重要场所,所以骨骼肌组织中的胰岛素抵抗是造成Ⅱ型糖尿病的主要原因之一。临床以及糖尿病动物模型的研究均说明,骨骼肌中胰岛素抵抗与肌肉中的脂肪含量高度相关[15-17]。这些研究说明,SAM代谢与肌内脂肪沉积、骨骼肌胰岛素抵抗、Ⅱ型糖尿病的发生存在着联系。
基因芯片技术发现腺苷甲硫氨酸转移酶2B基因表达(MAT2B)与猪肌内脂肪含量密切相关[12];进一步研究发现,MAT2B在脂肪型猪和瘦肉型猪的脂肪和肌肉组织中存在显著的差异表达[13],推测其可能与猪肌内脂肪成脂分化有一定的关系。由于质粒转染原代脂肪细胞效率较低[18],我们采用了可以多次扩繁,且稳定性较好的腺病毒载体。以腺病毒为载体来实现动物细胞内目标基因过表达的研究也在逐步发展[19-20]。本试验成功的构建了Ad-MAT2B腺病毒载体,其病毒滴度可以达到1×109 pfu·mL-1。感染猪肌内前体脂肪细胞后,其MAT2B mRNA水平发生了显著的上调;且诱导成脂分化第8天仍保持8倍倍数的增加(数据未显示)。这些结果为下一步研究MAT2B在成脂分化过程中的作用提供了有力的支持。
成脂的发生是一系列分子事件的级联反应,在成脂发生的早期阶段,C/EBPβ显著的上调,进一步激活C/EBPα和PPARγ表达;C/EBPα和PPARγ显著上调并彼此互相调控进一步激活了aP2、FASN、Glut4等下游成脂基因,进一步促进了成熟脂肪的形成[21-23]。油红O染色结果发现,过表达MAT2B显著的促进了脂质的形成。Rea-time qPCR结果显示,Ad-MAT2B显著的上调了成脂基因PPARγ和aP2的表达,这些结果初步证明MAT2B可以作为调控猪肌内脂肪细胞分化的一个正向调控因子。
在肝癌细胞中,TNF-α激活MAT2B V1的启动子活性并通过NF-κB和Ap1促进了肝癌细胞的增殖[4]。脂肪细胞分泌因子瘦素能够诱导MAT2B基因的表达[24]。此外,MAT2B与GIT1互作并激活MEK和ERK信号通路促进肿瘤细胞的增殖和发生[10-11]。然而,在脂肪细胞中,MAT2B如何调控猪肌内脂肪细胞分化需要进一步探讨。
综上所述,通过腺病毒介导超表达技术成功的实现了MAT2B基因在猪肌内脂肪细胞中的过表达,并初步验证MAT2B促进了猪肌内脂肪细胞的分化。这些结果为进一步研究MAT2B调控肌内脂肪成脂分化的分子机制奠定了基础,并为猪生产过程中提高肌内脂肪含量提供了一定的理论基础。
4 结论本研究成功的构建了可以侵染猪肌内脂肪细胞的MAT2B基因重组腺病毒载体;超表达MAT2B基因后,促进猪肌内脂肪细胞脂质的积累以及成脂关键基因的表达,这为进一步探索MAT2B调控肌内脂肪成脂分化的分子机制奠定了基础。
| [1] | HOCQUETTE J F, GONDRET F, BÁEZA E, et al. Intramuscular fat content in meat-producing animal development, genetic and nutritional control, and identification of putative markers[J]. Animal, 2010, 4(2): 303–319. DOI: 10.1017/S1751731109991091 |
| [2] | FORTIN A, ROBERTSON W M, TONG A K W. The eating quality of Canadian pork and its relationship with intramuscular fat[J]. Meat Sci, 2005, 69(2): 297–305. DOI: 10.1016/j.meatsci.2004.07.011 |
| [3] | CHEN X, FENG Y, YANG W J, et al. Effects of dietary thiazolidinedione supplementation on growth performance, intramuscular fat and related genes mRNA abundance in the longissimus dorsi muscleof finishing pigs[J]. Asian-Australas J Anim Sci, 2013, 26(7): 1012–1020. DOI: 10.5713/ajas.2012.12722 |
| [4] | D'SOUZA D N, PETHICK D W, DUNSHEA F R, et al. Nutritional manipulation increases intramuscular fat levels in the Longissimus muscle of female finisher pigs[J]. Aust J Agric Res, 2003, 54(8): 745–749. DOI: 10.1071/AR03009 |
| [5] | BARNES K M, WINSLOW N R, SHELTON A G, et al. Effect of dietary conjugated linoleic acid on marbling and intramuscular adipocytes in pork[J]. J Anim Sci, 2012, 90(4): 1142–1149. DOI: 10.2527/jas.2011-4642 |
| [6] | GOROCICA-BUENFIL M A, FLUHARTY F L, REYNOLDS C K, et al. Effect of dietary vitamin A restriction on marbling and conjugated linoleic acid content in Holstein steers[J]. J Anim Sci, 2007, 85(9): 2243–2255. DOI: 10.2527/jas.2006-781 |
| [7] | RAMANI K, MATO J M, LU S C. Role of methionine adenosyltransferase genes in hepatocarcinogenesis[J]. Cancers, 2011, 3(2): 1480–1497. |
| [8] | RAMANI K, YANG H P, KUHLENKAMP J, et al. Changes in the expression of methionine adenosyltransferase genes and S-adenosylmethionine homeostasis during hepatic stellate cell activation[J]. Hepatology, 2010, 51(3): 986–995. |
| [9] | DE LA ROSA J, OSTROWSKI J, HRYNIEWICZ M M, et al. Chromosomal localization and catalytic properties of the recombinant α subunit of human lymphocyte methionine adenosyltransferase[J]. J Biol Chem, 1995, 270(37): 21860–21868. DOI: 10.1074/jbc.270.37.21860 |
| [10] | YANG H P, ARA A I, MAGILNICK N, et al. Expression pattern, regulation, and functions of methionine adenosyltransferase 2β splicing variants in hepatoma cells[J]. Gastroenterology, 2008, 134(1): 281–291. DOI: 10.1053/j.gastro.2007.10.027 |
| [11] | PENG H, DARA L, LI T W H, et al. MAT2B-GIT1 interplay activates MEK1/ERK 1 and 2 to induce growth in human liver and colon cancer[J]. Hepatology, 2013, 57(6): 2299–2313. DOI: 10.1002/hep.26258 |
| [12] | LIU L, YIN J D, LI W, et al. Construction of a bacterial artificial chromosome library for the Rongchang pig breed and its use for the identification of genes involved in intramuscular fat deposition[J]. Biochem Biophys Res Commun, 2010, 391(2): 1280–1284. DOI: 10.1016/j.bbrc.2009.12.060 |
| [13] | FANG Q, YIN J D, LI F N, et al. Characterization of methionine adenosyltransferase 2β gene expression in skeletal muscle and subcutaneous adipose tissue from obese and lean pigs[J]. Mol Biol Rep, 2010, 37(5): 2517–2524. DOI: 10.1007/s11033-009-9767-0 |
| [14] | JIN C J, PARK H K, CHO Y M, et al. S-adenosyl-L-methionine increases skeletal muscle mitochondrial DNA density and whole body insulin sensitivity in OLETF rats[J]. J Nutr, 2007, 137(2): 339–344. |
| [15] | DOBBINS R L, SZCZEPANIAK L S, BENTLEY B, et al. Prolonged inhibition of muscle carnitine palmitoyltransferase-1 promotes intramyocellular lipid accumulation and insulin resistance in rats[J]. Diabetes, 2001, 50(1): 123–130. DOI: 10.2337/diabetes.50.1.123 |
| [16] | KOYAMA K, CHEN G X, LEE Y, et al. Tissue triglycerides, insulin resistance, and insulin production: implications for hyperinsulinemia of obesity[J]. Am J Physiol-Endocrinol Metab, 1997, 273(4): E708–E713. |
| [17] | PHILLIPS D I W, CADDY S, ILIC V, et al. Intramuscular triglyceride and muscle insulin sensitivity: evidence for a relationship in nondiabetic subjects[J]. Metabolism, 1996, 45(8): 947–950. DOI: 10.1016/S0026-0495(96)90260-7 |
| [18] | YANG S J, XU C Q, WU J W, et al. Construction of SOCS3 recombinant adenovirus and its expression in porcine primary adipocytes[J]. Chin J Biotechnol, 2010, 26(4): 462–469. |
| [19] |
付常振, 昝林森, 王虹, 等. 秦川牛SREBP1基因重组腺病毒载体的构建与病毒包装[J]. 畜牧兽医学报, 2013, 44(8): 1323–1329.
FU C Z, ZAN L S, WANG H, et al. Construction of recombinant adenovirus vector specific to SREBP1 gene of Qinchuan cattle and the packaging and amplifying of the corresponding adenovirus[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(8): 1323–1329. DOI: 10.11843/j.issn.0366-6964.2013.08.022 (in Chinese) |
| [20] |
张存芳, 王令, 任刚, 等. 靶向绵羊MSTN基因的锌指核酸酶腺病毒表达载体的构建及活性验证[J]. 畜牧兽医学报, 2012, 43(8): 1192–1199.
ZHANG C F, WANG L, REN G, et al. Construction and detection of the adenoviral vector encoding zinc-finger nucleases targeted to MSTN in sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(8): 1192–1199. (in Chinese) |
| [21] | TANG Q Q, LANE M D. Activation and centromeric localization of CCAAT/enhancer-binding proteins during the mitotic clonal expansion of adipocyte differentiation[J]. Genes Dev, 1999, 13(17): 2231–2241. DOI: 10.1101/gad.13.17.2231 |
| [22] | TANG Q Q, OTTO T C, LANE M D. CCAAT/enhancer-binding protein β is required for mitotic clonal expansion during adipogenesis[J]. Proc Natl Acad Sci USA, 2003, 100(3): 850–855. DOI: 10.1073/pnas.0337434100 |
| [23] | TANG Q Q, ZHANG J W, LANE M D. Sequential gene promoter interactions by C/EBP β, C/EBP α, and PPAR γ during adipogenesis[J]. Biochem Biophys Res Commun, 2004, 318(1): 213–218. DOI: 10.1016/j.bbrc.2004.04.017 |
| [24] | RAMANI K, YANG H P, XIA M, et al. Leptin'mitogenic effect in human liver cancer cells requires induction of both methionine adenosyltransferase 2A and 2β[J]. Hepatology, 2008, 47(2): 521–531. |



