动物舍环境中的微生物及其代谢产物形成的气溶胶不仅能够导致环境污染,影响动物和人的健康[1-3],而且还能引起气源性传染病的流行,导致动物生产能力下降。当微生物气溶胶粒径大于10 μm时,粒子几乎完全沉积于鼻咽部位; 粒径2~5 μm范围内的粒子约10%沉积于支气管部位; 粒径小于2 μm的粒子主要沉积于肺泡组织中; 粒径在1~2 μm范围内时约50%的颗粒物沉积在肺泡中,粒径越小沉积量越大[4]。动物舍空气中病原微生物达到一定阈值,导致呼吸系统的感染,特别是下呼吸道的感染[5],引起疾病的暴发。空气中其他微生物含量高,也会对动物体或人体产生免疫抑制[6]。由于猪舍空气微生物在动物生产成绩、动物福利、从业者健康以及环境污染等方面的重要作用,人们对于猪舍空气中气溶胶的研究越来越多。近年来,微生物宏基因组和高通量测序技术的迅猛发展,使我们能从一个样品中获得数万条基因序列,一次性获得样品中几乎全部微生物群落组成和相对丰度的信息[7-8]。本研究利用高通量测序技术对秋季保育猪舍不同粒径悬浮颗粒物细菌群落组成进行初步分析,探究不同粒径悬浮颗粒物细菌群落组成的异同,了解其中的病原微生物及其在不同悬浮颗粒上的分布情况,为改善猪舍内空气环境奠定基础,对养猪生产有一定指导意义。
1 材料与方法 1.1 猪舍情况实验猪场位于山东省寿光市,猪场总占地面积达200亩(1亩约等于667平方米),存栏母猪1 500头,该猪场采用种猪-保育-育肥一体化的标准自繁自养单点式生产方式。采样猪舍为保育舍,舍长度120 m,宽度15 m,共存栏保育猪1 000头。由于本场母猪存栏数量无法满足单批次1 000头断奶仔猪,所以本舍情况较为特别,舍内有不同批次的断奶猪群。仔猪断奶后初期对温度要求较高,本猪舍未采用任何机械通风,只是根据天气情况进行部分开窗通风。猪群采用湿拌料和干料饲喂结合的方式进行饲养,饲料为山东某公司全价保育料。在采样前3 d时间内未进行舍内消毒,舍内猪群咳嗽情况普遍,少量保育仔猪存在呼吸喘促,采食量略低,死亡率不高;部分猪存在皮肤结痂,尤其转群后一段时间。
1.2 材料与设备Andersen-6级撞击式空气微生物样品收集器(型号FA-1),购自辽阳市康洁仪器研究所;电热恒温培养箱(型号DHP-9272),购自上海一恒科技有限公司;无菌超净工作台(型号SW-CJ-2D),购自苏州净化设备有限公司;90 mm直径5%的公绵羊血-琼脂培养基,购自济南百博生物技术股份有限公司;E.Z.N.A. Soil DNA Kit试剂盒,购自OMEGA。
1.3 空气微生物采样及培养采用Andersen-6级撞击式空气微生物样品收集器,空气流速率为28.3 L·min-1,选用5%的公绵羊血-琼脂培养基为采样介质。采样时间为2016年10月7日,天气阴,室外温度较低,猪舍未进行通风。在猪舍内随机选择三点作为采样地点,7:00、12:00、17:00三个时间点进行采样,采样器高度为60 cm左右(等高于保育床上猪的鼻腔),驱动时间为1.5 min。采样时舍内温度25 ℃左右,相对湿度80%以上。采样后将采样培养基置于恒温箱37 ℃需氧培养24 h。
1.4 总DNA的提取培养结束后,用生理盐水将54个样品培养基上的细菌进行洗脱,并将不同时间、地点但同一采样层级的样品进行混合,分别命名为3_1s(>7.0 μm)、3_2s(4.7~7.0 μm)、3_3s(3.3~4.7 μm)、3_4s(2.1~3.3 μm)、3_5s(1.1~2.1 μm)、3_6s(0.65~1.1 μm)。参照试剂盒使用说明书提取总DNA。
1.5 高通量测序与序列分析将总DNA送至生工生物工程(上海)股份有限公司进行PCR扩增及高通量测序,测序使用了Illumina Miseq 2×300 bp平台,对16S rDNA的V3-V4区进行测序,使用统计分析方法,分别从门、属水平观测不同直径悬浮颗粒物细菌样本在不同分类水平上的群落结构。
2 结果 2.1 高通量测序结果测序结果经过剔除和筛选后,6个样品共得到16S rDNA高质量序列301 065条。按照序列相似度97%的标准对高质量序列进行OTU的划分,并去除“稀有”OTU后,16S rDNA序列得到2 104个OTU。
2.2 菌群α多样性分析通过Chao 1、ACE、Shannon、Simpson和Coverage指数对单个样品进行分析(Alpha多样性分析),其中Chao 1指数和ACE指数侧重于体现群落的丰富度,即估计群落中OTU数目;Shannon和Simpson多样性指数则综合考虑群落的丰富度和均匀度,即群落中各OTU之间丰度差异的大小;Coverage指数则反映了测序结果是否代表样本的真实情况[9-10]。
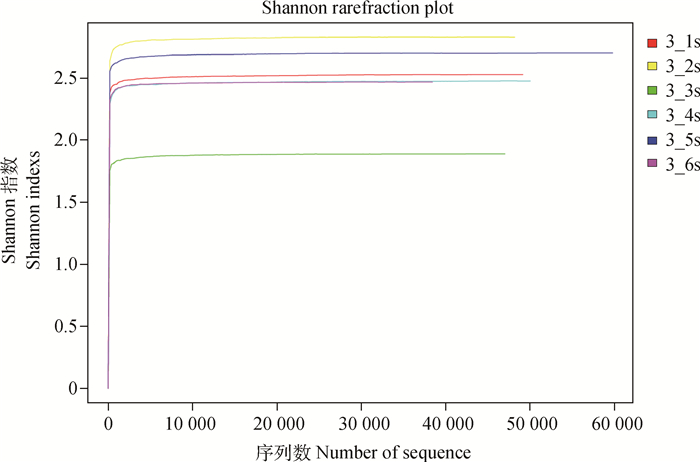
表 1给出了α多样性分析指数,各样品获得99.6%以上的高覆盖度,本次高通量测序能较全面地反映本研究菌群的多样性。在图 1中Shannon曲线趋于平坦,说明此次测序数据量足够大,可以反映样本中绝大多数的微生物信息,表示此次测序的结果可以代表样本的真实情况。
|
|
表 1 不同粒径悬浮颗粒菌群的16S rDNA多样性指数 Table 1 16S rDNA richness index of different particle size of suspended particles flora |
|
图 1 不同粒径悬浮颗粒菌群的Shannon指数稀释曲线 Figure 1 Shannon curve of different particle size of suspended particles flora |
物种丰富度指数Chao 1指数的范围为325.37~626.62,ACE指数的范围为349.45~674.65,丰富度指数由大及小依次为3_4s、3_2s、3_1s、3_6s、3_5s、3_3s。通过Shannon指数可以看出,菌群群落多样性依次为3_2s、3_5s、3_1s、3_4s、3_6s、3_3s,Simpson指数可以看出,菌群群落多样性依次为3_2s、3_5s、3_6s、3_4s、3_1s、3_3s。
2.3 细菌群落组成分析序列结果分析表明,细菌主要来自4个门(表 2),其中丰度最高的是变形菌门(Proteobacteria,48.87%),厚壁菌门(Firmicutes,39.93%);总比例较高的菌属(表 3)为变形菌门的不动杆菌属(Acinetobacter)和丛毛单胞菌属(Comamonas),放线菌门的葡萄球菌属(Staphylococcus)以及拟杆菌门的类香味菌属(Myroides)。主要类群与文献报道[11-12]中微生物类群是基本一致的。
|
|
表 2 不同粒径悬浮颗粒菌群所属菌门 Table 2 Phylum of different particle size of suspended particles flora |
|
|
表 3 不同粒径悬浮颗粒菌群所属菌属 Table 3 Species of different particle size of suspended particles flora |
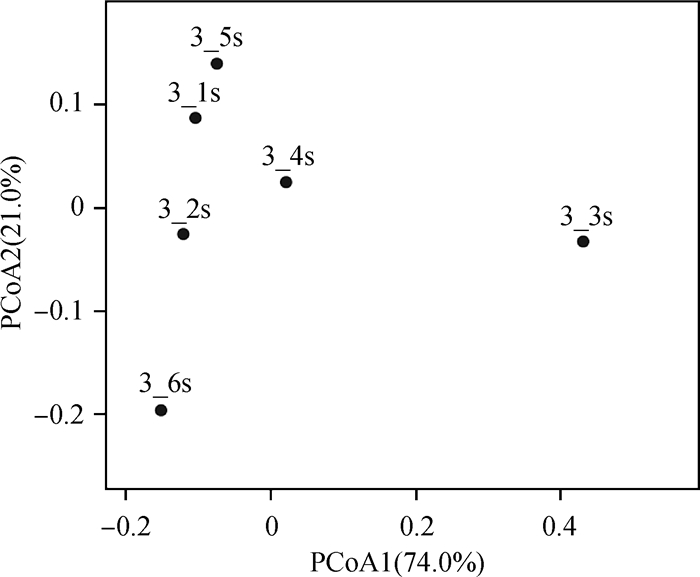
在本研究中,我们利用UniFrac的PCoA分析对不同粒径悬浮颗粒物细菌群落结构差异进行了研究,通过系统进化距离来衡量样品间的距离,是细菌群落结构差异的表征,将这种差异显示在二维空间的图上(图 2),图中距离越近的点表示两个样品的菌群结构越相似。由图 2可知,基于加权主坐标分析其第一主成分和第二主成分的贡献率分别为74%和21%,不同粒径悬浮颗粒物细菌群落结构差异明显,彼此间可以很好地分隔开。图中3_1s、3_5s、3_4s、3_2s接近,菌群相似度较高;3_6s、3_3s与四者距离较远,菌群结构差异明显,尤其3_3s与其余五个样品的距离最远,菌群结构差异非常明显。
|
图 2 不同粒径悬浮颗粒菌群结构组成的PCoA分析 Figure 2 PCoA analysis of bacterial community composition of different particle size of suspended particulates |
通过Chao 1指数和ACE指数分析,与部分文献结果[13]相似,一二层级之和,微生物数量最多,4.7 μm以上粒径的悬浮颗粒携带需氧菌的数量最多;但与部分文献不同的是,通过高通量测序技术,保育舍第四层级(2.1~3.3 μm)微生物数量最多,也就是说明保育舍中微生物主要富集于PM2.5粒子上。文献[13]通过细菌计数的方法测定的仔猪舍的需氧微生物情况,本研究侧重秋季保育舍,部分保育仔猪饲养过程中喜食粉料,并且在养殖过程中由于保温的需要通风较少,导致环境中PM2.5的数值增大,在试验过程中本文作者也进行了PM2.5、PM5、PM10粒子数的测定,结果显示,PM2.5离子数远远大于其他两者,3.3~4.7 μm粒径悬浮颗粒携带的细菌最少。
通过Shannon和Simpson多样性指数,菌群多样性最高的为4.7~7.0 μm粒径悬浮颗粒携带的细菌;与Chao 1指数和ACE指数分析相似,3.3~4.7 μm粒径悬浮颗粒携带的细菌种类也最少。
3.2通过细菌群落分析,6个层级的需氧菌共来自4个菌门,39个菌属和一个未分类情况。4个菌门在不同粒径悬浮颗粒上量有所不同,除3.3~4.7 μm颗粒外,厚壁菌门和变形菌门为优势菌群,而3.3~4.7 μm颗粒上,变形菌门和拟杆菌门为优势菌群。在39个菌属中,其中报道过有致病性的菌属有14个菌属,不同粒径悬浮颗粒上优势菌属有异同,在4.7~7.0 μm、0.65~1.1 μm颗粒上优势菌属为不动杆菌属;>7.0、2.1~3.3、1.1~2.1 μm颗粒上的优势菌属为葡萄球菌属;在3.3~4.7 μm颗粒上的优势菌属为类香味菌属。这三种优势菌属均被报道具有致病性,不动杆菌属和类香味菌属对人具有致病性,在一些病人组织中分离成功[14],葡萄球菌具有人畜致病性。所以在养猪生产中一定要注意从业者的福利。对养猪场影响较大的链球菌属在空气中存在较少,不是优势种群,通过分析,可以看出链球菌主要存在于4.7~7.0、1.1~2.1 μm层级,其中1.1~2.1 μm层级很容易进入深部呼吸道,对人畜构成较大危害,下一步应该结合猪群呼吸道细菌群落情况进行综合分析。
葡萄球菌在大于7 μm的悬浮颗粒上占比44.58%,为最主要的菌属,很容易沉降到猪皮肤表面,由于保育猪在刚转群时需要通过打架建立新秩序,导致皮肤伤口较多,再加上舍内环境中葡萄球菌较多,导致保育猪皮肤疾病的发生,因此应该加强舍内环境消毒。后期与猪场交流,消毒后皮肤结痂的发病情况大大下降。
3.3通过UniFrac的PCoA分析,不同粒径悬浮颗粒上菌群通过分析没有重合,说明各层级菌群群落结构存在一定差异,表明粒径大小在群落结构差异方面发挥重要作用。并且粒径大小相邻的悬浮颗粒菌群群落结构相似性差别较大,说明细菌对悬浮颗粒也有一定的选择性,下一步应选定部分病原微生物对悬浮颗粒吸附性并结合猪群呼吸道群落结构进行详细研究。
本研究主要通过Andersen-6级撞击式空气微生物样品收集器采集保育猪舍空气微生物,然后采用Illumina MiSeq高通量测序研究保育猪舍不同粒径悬浮颗粒物细菌群落组成。研究结果显示2.1~3.3 μm粒径悬浮颗粒细菌菌群丰富度最高,有14个菌属的细菌被报道对人和动物具有致病性,且各层级群落结构存在差异,相邻层级差别较大。对改善猪舍内空气环境、指导养猪生产有一定现实意义。
4 结论自保育猪舍各级采得样品研究不同粒径悬浮颗粒物细菌群落组成。共获得高质量序列301 065条,得到2 104个OUT;菌群丰富度由大及小依次为3_4s、3_2s、3_1s、3_6s、3_5s、3_3s;细菌主要来自4个门、40个菌属,其中丰度最高的是变形菌门、厚壁菌门,总比例较高的菌属为变形菌门的不动杆菌属和丛毛单胞菌属,放线菌门的葡萄球菌属以及拟杆菌门的类香味菌属;UniFrac的PCoA分析表明3_1s、3_5s、3_4s、3_2s菌群相似度较高。可见,2.1~3.3 μm粒径悬浮颗粒细菌菌群丰富度最高,有14个菌属的细菌被报道对人和动物具有致病性,且各层级群落结构存在差异,相邻层级差别较大。
| [1] | GYLES C L. Escherichia coli in domestic animals and humans[M]. Wallingford, Oxon: CAB International, 1994. |
| [2] |
李超, 郝海玉, 孙玲玉, 等. 猪舍环境气载微生物监测[J]. 畜牧兽医学报, 2014, 45(10): 1684–1692.
LI C, HAO H Y, SUN L Y, et al. Airborne microbiological of swine houses monitoring[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(10): 1684–1692. (in Chinese) |
| [3] |
高玉红, 郭建军, 李宏双, 等. 寒区奶牛舍环境温湿度、粉尘和气载细菌的季节性变化及其相关性研究[J]. 畜牧兽医学报, 2016, 47(3): 620–629.
GAO Y H, GUO J J, LI H S, et al. Seasonal variation of ambient temperature, relative humidity, dust and airborne bacteria in dairy cowshed and their correlation in chill region[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(3): 620–629. (in Chinese) |
| [4] |
郭艳萍. 气溶胶与人类健康[J]. 周口师范学院学报, 2006, 23(5): 97–100.
GUO Y P. Aerosols and human health[J]. Journal of Zhoukou Normal University, 2006, 23(5): 97–100. (in Chinese) |
| [5] | DONALDSON A. Airborne spread of foot-and-mouth disease[J]. Microbiol Today, 1999, 26: 118–119. |
| [6] |
张红双, 秦梅, 柴同杰, 等. 不同养殖环境对商品肉鸡免疫功能的影响[J]. 华中农业大学学报, 2011, 30(1): 34–38.
ZHANG H S, QIN M, CHAI T J, et al. Effects of different breeding environments on broilers' immune function[J]. Journal of Huazhong Agricultural University, 2011, 30(1): 34–38. (in Chinese) |
| [7] | SHENDURE J, JI H. Next-generation DNA sequencing[J]. Nat Biotechnol, 2008, 26(10): 1135–1145. DOI: 10.1038/nbt1486 |
| [8] | BÄCKHED F, ROSWALL J, PENG Y Q, et al. Dynamics and stabilization of the human gut microbiome during the first year of life[J]. Cell Host Microbe, 2015, 17(5): 690–703. DOI: 10.1016/j.chom.2015.04.004 |
| [9] |
温崇庆, 何瑶瑶, 薛明, 等. 高通量测序分析DNA提取引起的对虾肠道菌群结构偏差[J]. 微生物学报, 2016, 56(1): 130–142.
WEN C Q, HE Y Y, XUE M, et al. Biases on community structure during DNA extraction of shrimp intestinal microbiota revealed by high-throughput sequencing[J]. Acta Microbiologica Sinica, 2016, 56(1): 130–142. (in Chinese) |
| [10] |
刘波, 王阶平, 陈倩倩, 等. 养猪发酵床微生物宏基因组基本分析方法[J]. 福建农业学报, 2016, 31(6): 630–648.
LIU B, WANG J P, CHEN Q Q, et al. Metagenomic analysis of microbial community in a microbial fermentation-bed for pig raising[J]. Fujian Journal of Agricultural Sciences, 2016, 31(6): 630–648. (in Chinese) |
| [11] |
李红梅, 白林, 姜冬梅, 等. 基于16SrDNA高通量测序方法检测猪舍空气微生物多样性[J]. 中国畜牧杂志, 2015, 51(3): 81–84.
LI H M, BAI L, JIANG D M, et al. Microbial diversity of piggery air detected by 16S rDNA high-throughput sequencing[J]. Chinese Journal of Animal Science, 2015, 51(3): 81–84. (in Chinese) |
| [12] | KRISTIANSEN A, PEDERSEN K H, NIELSEN P H, et al. Bacterial community structure of a full-scale biofilter treating pig house exhaust air[J]. Syst Appl Microbiol, 2011, 34(5): 344–352. DOI: 10.1016/j.syapm.2010.11.022 |
| [13] |
黄藏宇, 李永明, 徐子伟, 等. 猪舍内不同季节微生物气溶胶含量及其空气动力学分析[J]. 家畜生态学报, 2016, 37(11): 47–51.
HUANG C Y, LI Y M, XU Z W, et al. Microbial aerosol content in the piggery in different seasons and its aerodynamic ananlysis[J]. Acta Ecologiae Animalis Domastici, 2016, 37(11): 47–51. DOI: 10.3969/j.issn.1673-1182.2016.11.009 (in Chinese) |
| [14] | BENEDETTI P, RASSU M, PAVAN G, et al. Septic shock, pneumonia, and soft tissue infection due to Myroides odoratimimus: report of a case and review of Myroides infections[J]. Infection, 2011, 39(2): 161–165. DOI: 10.1007/s15010-010-0077-1 |



