2. 湖南农业大学东方科技学院, 长沙 410128;
3. 湖南畜禽安全生产协同创新中心, 长沙 410128
2. College of Oriental Science & Technology, Hunan Agricultural University, Changsha 410128, China;
3. Hunan Co-Innovation Center of Animal Production Safety, Changsha 410128, China
绵羊虱蝇(Melophagus ovinus)是属于双翅目、虱蝇科、蜱蝇属的一种无翅、以吸血为生的绵羊体外寄生虫[1],胎生,其生命周期包括幼虫、蛹、若虫、成虫4个阶段,雌成虫每6~8 d产出1个完全发育的幼虫;幼虫产出后粘附在宿主体表,经过6~12 h后化蛹;在夏季与冬季蛹分别经历19和30 d后孵出若虫;若虫继续发育为成虫[2],成虫主要寄生于绵羊的颈部、肩背部、臀部等部位,蛹主要粘附于颈腹侧及臀部油脂较多的部位[3]。绵羊虱蝇广泛分布于蒙古、印度、日本、澳大利亚等地[4],在我国的青海、山东、新疆等地[2, 5-6]也发现有此寄生虫的流行。绵羊虱蝇主要寄生于绵羊,但在狗[6]、山羊[7]、红狐[8]、家兔及人类[9]体表也偶有寄生。绵羊感染绵羊虱蝇时,通常会出现“被毛脱落,产毛量及体重减少,贫血”等症状,与此同时绵羊虱蝇还可传播蓝舌病病毒[10]、虱蝇锥虫(Trypanosoma melophagium)[1]、巴尔通氏体(Bartonella)[11]、立克次体(Rickettsia)[6]、绵羊无浆体(Anaplasma ovis)和不动杆菌(Acinetobacter)[12]等病原体,对养羊业危害较大。目前,国内外学者对绵羊虱蝇形态结构已有部分研究,如姜昌武等[13]、薛晶等[14]对其外形特征进行了报道;D. Zhang等[15]运用扫描电镜对绵羊虱蝇触角进行了观察;B. Kumsa等[3]对绵羊虱蝇蛹的外形特征进行了描述,但以上研究均未对绵羊虱蝇形态结构进行全面而详尽的观察,提供的影像资料较少。18S rRNA是真核生物核蛋白体小亚基中的核酸部分[16],序列高度保守,是研究寄生虫属间水平种系进化关系的分子标记之一[17-18]。本研究通过超景深三维显微系统、扫描电镜观察绵羊虱蝇雌、雄成虫形态结构特征,并通过18S rRNA基因序列比对分析进行分子学鉴定,为快速、准确辨识此寄生虫提供可靠依据。
1 材料与方法 1.1 材料 1.1.1 试剂及仪器无水乙醇、冰醋酸、丙酮、醋酸异戊酯均购于国药集团化学试剂有限公司;2×EasyTaq PCR SuperMix购于北京全式金生物技术有限公司;DNA提取试剂盒和DNA片段快速纯化/回收试剂盒购于天根生化科技(北京)有限公司;PCR引物是根据GenBank中已公布的绵羊虱蝇18S rRNA (FN666411)部分基因进行设计,并交于上海生工生物工程有限公司合成(45F:5′-AACTTGTGCTTCATACGGG-3′;564R:5′-GCGACTGAGAGAGCCATAA-3′)。PCR仪(Gene Company Limited,美国);超景深三维显微系统(VHX-5000,基恩士,上海);扫描电子显微镜(JMS-6380LV,JEOL,日本);超声波清洗仪(KQ-500E,昆山舒美,江苏昆山)。
1.1.2 标本绵羊虱蝇雌、雄成虫均采自于甘肃酒泉绵羊体表。
1.2 方法 1.2.1 形态学观察 1.2.1.1 超景深三维显微系统观察成虫经卡诺氏固定液(Carnoy’s Fluid)(无水乙醇:冰醋酸=3:1)固定12 h,70%酒精保存。超声波清洗3次,每次20 s,超景深三维显微系统观察并拍照。
1.2.1.2 扫描电子显微镜观察固定的成虫样本经超声波清洗后,系列酒精梯度脱水,丙酮置换2次(30 min·次-1),醋酸异戊酯置换2次(30 min·次-1),干燥后,粘贴于双面导电胶,喷金,扫描电子显微镜15 kV下观察并拍照。
1.2.2 分子生物学鉴定 1.2.2.1 绵羊虱蝇总DNA提取取绵羊虱蝇雌成虫、雄成虫各10只,双蒸水漂洗2次;用灭菌研钵加入液氮研磨后,放入1.5 mL离心管;参照SDS-PK法提取总DNA。最后,以40 μL TE溶解,-20 ℃冻存、备用。
1.2.2.2 18S rRNA基因序列扩增以绵羊虱蝇总DNA为模板,以45F和564R为扩增引物。反应体系(50 μL):模板DNA 3 μL,45F、564R (10 μmol·L-1)各1.5 μl,EasyTaq mixture 25 μL,ddH2O 19 μL。反应程序:95 ℃ 5 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 45 s,共35个循环;72 ℃延伸5 min。PCR产物1.5%琼脂糖凝胶电泳检测。
1.2.2.3 PCR产物的回收和测序用DNA片段快速纯化/回收试剂盒纯化扩增产物,由深圳华大基因科技服务有限公司测序,并将测得的序列与GenBank中已公布的18S rRNA基因序列进行比对。
2 结果 2.1 形态学观察绵羊虱蝇体躯分为头、胸、腹三部分。头、胸部为深棕色,腹部新鲜标本为浅棕色或灰色,死后暗黑。头、胸部体壁骨化明显,腹部革质。翅完全退化,无平衡棒,周身布满刚毛(图 1)。分别测量30只雌成虫和30只雄成虫各体部的长度,发现雌成虫体长为5.46 mm±0.54 mm;头部与胸部长度较为恒定,均为1.0 mm;腹部长度变化较大,长度为3.54 mm±0.46 mm。雄成虫体长为4.01 mm±0.51 mm;头部和胸部长度与雌成虫一致,均为1.0 mm;腹部长度为2.02 mm±0.49 mm。

|
a.雌成虫背面观;b.雌成虫腹面观;c.雄成虫背面观;d.雄成虫腹面观;▲.背侧盾片; .腹侧盾片;Co.基节;Tr.转节;Fe.腿节;Ti.胫节;Ta.跗节;Pr.前跗节;Cl.爪
a. Dorsal view of the female; b. Ventral view of the female; c. Dorsal view of the male; d. Ventral view of the male; ▲. The scutum of dorsal side; .腹侧盾片;Co.基节;Tr.转节;Fe.腿节;Ti.胫节;Ta.跗节;Pr.前跗节;Cl.爪
a. Dorsal view of the female; b. Ventral view of the female; c. Dorsal view of the male; d. Ventral view of the male; ▲. The scutum of dorsal side;  . The scutum of veutro; Co. Coxa; Tr. Trochanter; Fe. Femur; Ti. Tibia; Ta. Tarsus; Pr. Pretarsus; Cl. Clam
图 1 绵羊虱蝇成虫整体观
Figure 1
Holistic view of Melophagus ovinus . The scutum of veutro; Co. Coxa; Tr. Trochanter; Fe. Femur; Ti. Tibia; Ta. Tarsus; Pr. Pretarsus; Cl. Clam
图 1 绵羊虱蝇成虫整体观
Figure 1
Holistic view of Melophagus ovinus
|
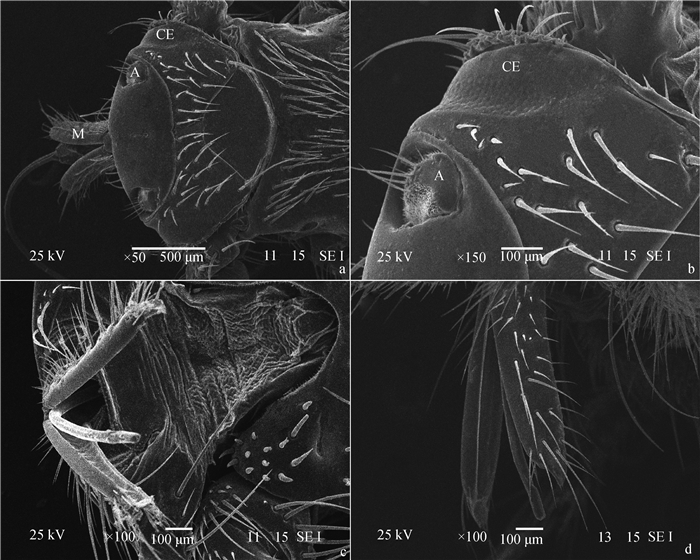
头部短小且阔扁,略呈三角形,嵌入胸部的一窝内,与胸部紧密相连,活动范围极小。头顶部两触角间光滑(图 2a)。无单眼。复眼小,呈新月形,位于头的两侧,两眼距离较宽。触角极短,位于复眼前内侧触角窝内,表面有少量刚毛(图 2a、b)。刺吸式口器,下颚须长,表面被覆短毛,其内缘紧贴喙的两侧,包于喙形成喙鞘(图 2c、d)。
|
a.绵羊虱蝇头部背面观;b.绵羊虱蝇复眼和触角;c.绵羊虱蝇刺吸式口器腹侧观;d.绵羊虱蝇刺吸式口器侧面观;CE.复眼;A.触角;M.口器 a. Dorsal view of the head of Melophagus ovinus; b. The compound eye and antennae of Melophagus ovinus; c. Ventral view of the piercing-sucking mouthparts of Melophagus ovinus; d. Lateral view of the piercing-sucking mouthparts of Melophagus ovinus; CE. Compound eyes; A. Antennae; M. Mouthparts 图 2 绵羊虱蝇头部扫描电镜图像 Figure 2 Scanning electron microscopy micrographs of the head of Melophagus ovinus |
胸部不分节。胸部两侧有3对足,粗壮,分别为前足、中足和后足,前足位置靠前,位于头的两侧,其余两足距离前足较远,位于胸后部的腹侧。每一个足均包含有基节、转节、腿节、胫节、跗节和前跗节6部分,表面被覆刚毛(图 1d)。基节粗壮,转节短小,腿节为最粗壮的1节,胫节、跗节和前跗节细长。由前向后的3对足,其基节、腿节、胫节的发达程度有显著变化,其中基节在前、中两足一般发达,而在后足较为发达;腿节在前足最为粗壮发达,中足一般粗壮,后足变细长;胫节在前、中两足较为粗短,后足变细长。前跗节末端有发达的爪,利于其牢固抓握羊毛而不易掉落。3对足之间,胸部背侧有2对较大的气门,第1对气门直径最大(图 3a),气门周缘密布高低不等的细毛(图 3b)。

|
a.绵羊虱蝇胸、腹部左侧面观,胸部背侧有2个较大的气门,腹前部背侧有2个较小的气门;b.绵羊虱蝇气门周缘布满细毛; .气门
a. Left lateral view of the chest and abdomen of Melophagus ovinus. Two larger stegmas at the dorsal side of the chest, and 2 smaller stegmas at the dorsal side of the front of abdomen; b. A large number of setaes were located around the stigma of Melophagus ovinus; .气门
a. Left lateral view of the chest and abdomen of Melophagus ovinus. Two larger stegmas at the dorsal side of the chest, and 2 smaller stegmas at the dorsal side of the front of abdomen; b. A large number of setaes were located around the stigma of Melophagus ovinus;  . Stegma
图 3 绵羊虱蝇气门
Figure 3
Stegma of the Melophagus ovinus . Stegma
图 3 绵羊虱蝇气门
Figure 3
Stegma of the Melophagus ovinus
|
腹部不分节,呈袋状,被覆细密的刚毛,无足。腹前部背侧有2对较小的气门,且前一气门较后一气门直径大(图 3a)。背侧有2片三角形盾片(图 1a、c)。腹侧有1盾片,雌成虫腹侧盾片后缘呈弧形,形似弯月(图 1b);雄成虫腹侧盾片后缘锐利,有明显夹角(图 1d)。雌成虫腹部大而圆,末端凹陷(图 4a)。雄成虫腹部小,末端凸出,阳茎呈长椎状,表面光滑,茎端锐利,阳茎两侧各有一个阳茎基侧突(图 4b)。

|
a.雌成虫腹后部;b.雄成虫腹后部;▲.阳茎基侧突; .阳茎
a. Posterior end of the female; b. Posterior end of the male; ▲. Paramere; .阳茎
a. Posterior end of the female; b. Posterior end of the male; ▲. Paramere;  . Aedoeagus
图 4 绵羊虱蝇腹后部
Figure 4
Posterior end of the Melophagus ovinus . Aedoeagus
图 4 绵羊虱蝇腹后部
Figure 4
Posterior end of the Melophagus ovinus
|
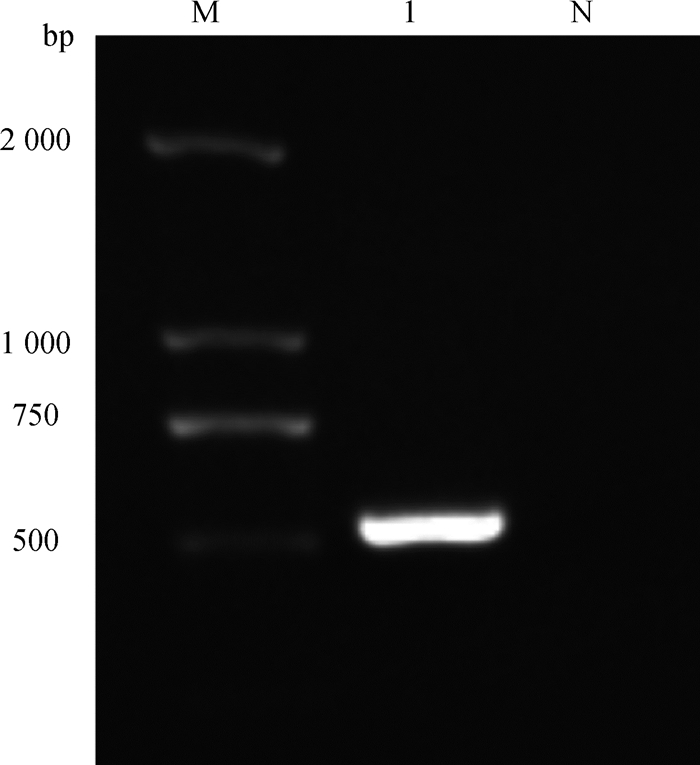
以绵羊虱蝇总DNA为模板,以45F和564R为引物进行PCR扩增,经1.5 %琼脂糖凝胶电泳鉴定PCR产物大小约为520 bp,与预期值相符(图 5)。
|
M. DL2000 DNA相对分子质量标准;1.绵羊虱蝇;N.阴性对照 M. DL2000 DNA marker; 1. Melophagus ovinus; N. Negative control 图 5 绵羊虱蝇18S rRNA扩增结果 Figure 5 The 18S rRNA amplification result of Melophagus ovinus |
本研究测得的18S rRNA基因序列(MF595983)与GenBank中W. Gibson等上传的序列(FN666411)相似度为99.59%,在474位由T突变为C。
3 讨论昆虫形态结构的研究,不仅可直观展示昆虫各部分的真实结构,也是对现代生物技术的一种补充,可为正确分类鉴别与确定谱系关系提供可靠依据。近年来,运用体视显微镜和扫描电镜技术对昆虫不同发育阶段的虫体形态结构已有大量的研究,M. L. Munguira等[19]研究了灰蝶科卵的形态;L. Jiang等[20]对四边蚊蝎蛉幼虫的形态进行了观察;M. Álvarez等[21]对利比里亚灰蝶蛹的发声器进行了研究。对成虫复眼、口器、触角、足、翅、外生殖器等结构的形态学观察也已有较多报道[22-24]。绵羊虱蝇的形态学特点已有部分研究[11-15],但之前的研究均未对绵羊虱蝇雌、雄成虫外部形态结构进行细致而全面的观察和描述。针对绵羊虱蝇形态学研究现状,以及超景深三维显微系统的优越性,本文运用此系统,结合扫描电镜对绵羊虱蝇雌、雄成虫形态结构进行了详细的观察,为辨别此寄生虫提供了直观、可靠的依据。
虱蝇科是寄生于鸟和哺乳动物的双翅目昆虫,不同种之间形态特征有相似之处,同时也略有差异,以犬虱蝇(Hippobosca capensis) [25]、马虱蝇(Hippobosca equina)[26]为例与绵羊虱蝇进行比较,详见表 1。除以上异同之外,本研究还观察到,绵羊虱蝇3对足不同节段具有显著特点,其中腿节以前足最为粗壮发达,胫节在后足变细长。绵羊虱蝇具有4对气门,其直径由前向后逐渐减小,2对较大的气门位于胸部背侧,其余2对位于腹前部背侧,且气门周缘密布高低不等的细毛。绵羊虱蝇雌、雄成虫腹侧盾片形态有明显差异,雌虫腹侧盾片后缘呈弧形,形似弯月,而雄虫腹侧盾片后缘锐利,有明显夹角。雄成虫阳茎呈长椎状,表面光滑,茎端锐利,阳茎两侧各有一个阳茎基侧突。上述绵羊虱蝇足、气门、腹侧盾片、雄虫阳茎等结构均属首次报道。
|
|
表 1 虱蝇科不同种间的形态学比较 Table 1 Morphological comparison of different species in Hippoboscidae |
18S rRNA基因是真核生物核蛋白体小亚基中的核酸部分,在生物体内含量较大,在蛋白质合成中具有重要的功能,由于其基因序列及二级结构高度保守,核苷酸替换率较低,基因点突变较少,在分类学中可作为一个科学可靠的指标[27]。为从分子生物学方面进一步确定所采集的标本为绵羊虱蝇,依据GenBank中已经公布的绵羊虱蝇18S rRNA基因部分序列,设计引物,PCR扩增并测序。通过比对发现,本研究的测序结果与公布的18S rRNA基因序列(FN666411)相似度为99.59%,说明采集样本为绵羊虱蝇。
4 结论从甘肃酒泉地区绵羊体表采集绵羊虱蝇,通过超景深三维显微系统和扫描电镜对其形态特点进行观察,并通过分析18S rRNA基因序列进行分子学鉴定。绵羊虱蝇具有直观、易于辨认的形态特征。绵羊虱蝇雌成虫和雄成虫在体长、腹侧部盾片、腹部末端等结构上有显著不同。
| [1] | GIBSON W, PILKINGTON J G, PEMBERTON J M. Trypanosoma melophagium from the sheep ked Melophagus ovinus on the island of St Kilda[J]. Parasitology, 2010, 137(12): 1799–1804. DOI: 10.1017/S0031182010000752 |
| [2] | SMALL R W. A review of Melophagus ovinus (L.), the sheep ked[J]. Vet Parasitol, 2005, 130(1-2): 141–155. DOI: 10.1016/j.vetpar.2005.03.005 |
| [3] | KUMSA B, PAROLA P, RAOULT D, et al. Bartonella melophagi in Melophagus ovinus (sheep ked) collected from sheep in northern Oromia, Ethiopia[J]. Comp Immunol Microbiol Infect Dis, 2014, 37(1): 69–76. DOI: 10.1016/j.cimid.2013.11.001 |
| [4] | KETTLE D S. Medical and veterinary entomology[M]. London: Croom Helm, 1984: 658. |
| [5] |
王勇, 孙宝杰, 于长友, 等. 临沂口岸截获加拿大入境蝇类:羊虱蝇[J]. 中国媒介生物学及控制杂志, 2010, 21(1): 35.
WANG Y, SUN B J, YU C Y, et al. Melophagus ovinus Linnaeus intercepted and captured from Canadian pickled goatskins at Linyi port[J]. Chinese Journal of Vector Biology and Control, 2010, 21(1): 35. (in Chinese) |
| [6] | LIU D, WANG Y Z, ZHANG H, et al. First report of Rickettsia raoultii and R. slovaca in Melophagus ovinus, the sheep ked[J]. Parasit Vectors, 2016, 9: 600. DOI: 10.1186/s13071-016-1885-7 |
| [7] | BEQUAERT J. A monograph of the Melophaginae, or ked-flies, of sheep, goats, deer and antelopes (Diptera, Hippoboscidae)[J]. Entomol Am, 1942, 22: 1–220. |
| [8] | TETLEY J H. The sheep ked, Melophagus ovinus L. I. Dissemination potential[J]. Parasitology, 1958, 48(3-4): 353–363. DOI: 10.1017/S0031182000021302 |
| [9] | LASSNIG H, PROSL H, HINTERDORFER F. Parasites of the red fox (Vulpes vulpes) in Styria[J]. Wien Tierarztl Monatsschr, 1998, 85(4): 116–122. |
| [10] | LUEDKE A J, JOCHIM M M, BOWNE J G. Preliminary bluetongue transmission with the sheep ked Melophagus ovinus (L.)[J]. Can J Comp Med Vet Sci, 1965, 29(9): 229–231. |
| [11] | CHU C Y, JIANG B G, QIU E C, et al. Borrelia burgdorferi sensu lato in sheep keds (Melophagus ovinus), Tibet, China[J]. Vet Microbiol, 2011, 149(3-4): 526–529. DOI: 10.1016/j.vetmic.2010.11.031 |
| [12] | HORNOK S, DE LA FUENTE J, BIRÓ N, et al. First molecular evidence of Anaplasma ovis and Rickettsia spp. in keds (Diptera: Hippoboscidae) of sheep and wild ruminants[J]. Vector Borne Zoonotic Dis, 2011, 11(10): 1319–1321. DOI: 10.1089/vbz.2011.0649 |
| [13] |
姜昌武, 张守发, 金钟羲. 绵羊的羊蜱蝇病诊疗观察[J]. 延边农学院学报, 1983, 5(2): 62–64.
JIANG C W, ZHANG S F, JIN Z X. Treatment and observation the disease of Melophagus ovinus on sheep[J]. Journal of Agricultural Science Yanbian University, 1983, 5(2): 62–64. (in Chinese) |
| [14] |
薛晶, 金映红, 王光雷, 等. 新疆青河县羊蜱(虱)蝇病的诊治报告[J]. 中国兽医杂志, 2016, 52(6): 51–52.
XUE J, JIN Y H, WANG G L, et al. Report on diagnosis and treatment of the disease of Melophagus ovinus in Qinggil County of Xinjiang[J]. Chinese Journal of Veterinary Medicine, 2016, 52(6): 51–52. (in Chinese) |
| [15] | ZHANG D, LIU X H, LI X Y, et al. Ultrastructural investigation of antennae in three cutaneous myiasis flies: Melophagus ovinus, Hippobosca equina, and Hippobosca longipennis (Diptera: Hippoboscidae)[J]. Parasitol Res, 2015, 114(5): 1887–1896. DOI: 10.1007/s00436-015-4376-4 |
| [16] | WATERS A P, MCCUTHAN T F. Ribosomal RNA: Nature's own polymerase-amplified target for diagnosis[J]. Parasitol Today, 1990, 6(2): 56–59. DOI: 10.1016/0169-4758(90)90071-B |
| [17] | COSSIO-BAYUGAR R, PILLARS R, SCHLATER J, et al. Theileria buffeli infection of a Michigan cow confirmed by small subunit ribosomal RNA gene analysis[J]. J Vet Parasitol, 2002, 105(2): 105–110. DOI: 10.1016/S0304-4017(02)00003-1 |
| [18] |
汪晓阳, 周志军, 黄原, 等. 基于18S rRNA基因序列的直翅目主要类群系统发育关系研究[J]. 动物分类学报, 2011, 36(3): 627–638.
WANG X Y, ZHOU Z J, HUANG Y, et al. The phylogenetic relationships of higher orthopteran categories inferred from 18S rRNA gene sequences[J]. Acta Zootaxonomica Sinica, 2011, 36(3): 627–638. (in Chinese) |
| [19] | MUNGUIRA M L, MARTíN J, GARCÍA-BARROS E, et al. Morphology and morphometry of Lycaenid eggs (Lepidoptera: Lycaenidae)[J]. Zootaxa, 2015, 3937(2): 201–247. DOI: 10.11646/zootaxa.3937.2 |
| [20] | JIANG L, GAO Q H, HUA B Z. Larval morphology of the hanging-fly Bittacus trapezoideus Huang & Hua (Insecta: Mecoptera: Bittacidae)[J]. Zootaxa, 2015, 3957(3): 324–333. DOI: 10.11646/zootaxa.3957.3 |
| [21] | ÁLVAREZ M, MUNGUIRA M L, MARTÍNEZ-IBÁÑEZ M D. Comparative study of the morphology of stridulatory organs of the Iberian Lycaenid butterfly pupae (Lepidoptera)[J]. J Morphol, 2014, 275(4): 414–430. DOI: 10.1002/jmor.v275.4 |
| [22] | ARIF Y, LOMBARKIA N. Morphological characteristics of the sensilla ovipositor, tarsus and antenna in dates moth female, Ectomyelois ceratoniae (Lepidoptera: Pyralidae)[J]. Acad J Entomol, 2015, 8(2): 34–37. |
| [23] | LEHNERT M S, MONAENKOVA D, ANDRUKH T, et al. Hydrophobic-hydrophilic dichotomy of the butterfly proboscis[J]. J R Soc Interface, 2013, 10(85): 20130336. DOI: 10.1098/rsif.2013.0336 |
| [24] | SEADA M A. Antennal morphology and sensillum distribution of female cotton leaf worm Spodoptera littoralis (Lepidoptera: Noctuidae)[J]. J Basic Appl Zool, 2015, 68: 10–18. DOI: 10.1016/j.jobaz.2015.01.005 |
| [25] |
黄兵, 沈杰.
中国畜禽寄生虫形态分类图谱[M]. 北京: 中国农业科学技术出版社, 2006.
HUANG B, SHEN J. Classific atlas of parasites for livestock and poultry in China[M]. Beijing: China Agricultural Science and Technology Press, 2006. (in Chinese) |
| [26] | SOKÓŁ R, MICHALSKI M M. Occurrence of Hippobosca equina in Polish primitive horses during the grazing season[J]. Ann Parasitol, 2015, 61(2): 119–124. |
| [27] |
刘进辉, 彭俊宇, 宋海燕, 等. 10株火鸡组织滴虫18S rRNA基因的克隆及进化分析[J]. 畜牧兽医学报, 2011, 42(3): 448–452.
LIU J H, PENG J Y, SONG H Y, et al. Cloning and phylogenetic analysis of the 18S rRNA of Histomonas meleagridis isolates from Hunan province[J]. Acta Veterinaria et Zootechnica Sinica, 2011, 42(3): 448–452. (in Chinese) |



