2. 中国农业科学院兰州兽医研究所/家畜疫病病原生物学 国家重点实验室/甘肃省动物寄生虫病重点实验室, 兰州 730046;
3. 江苏省动物重要疫病与人兽共患病防控协同创新中心, 扬州 225009
2. State Key Laboratory of Veterinary Etiological Biology/Key Laboratory of Veterinary Parasitology of Gansu Province/Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046, China;
3. Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China
O-糖基化(O-linked glycosylation)修饰是蛋白质翻译后糖基化的主要形式,发生于真核生物的Golgi体,也存在于细菌和古细菌[1-2]。其反应过程是在糖基转移酶(glycosyltransferase)家族不同酶催化下,将参与反应的各种糖链,如O-N-乙酰半乳糖胺(O-N-acetylgalactosamine, O-GalNAc)、O-岩藻糖(O-fucose)、O-葡萄糖(O-glucose)、O-N-乙酰葡糖胺(O-N-acetylglucosamine, O-GlcNAc)和O-甘露糖(O-mannose)等,转移到多肽链的丝、苏、酪、羟脯氨酸等残基上[3],是保证细胞内相关功能蛋白质正确折叠、维持结构稳定性和亲水性、发挥功能(如细胞黏附、配体识别等)所必须的生化过程,也是病原体的重要毒力因子或致病分子,如普遍存在于细菌的O-GlcNAc和锥虫、利什曼原虫等的O-甘露糖化[1, 4]。在真核生物,O-GalNAc糖基化修饰化最为普遍,是在多肽:N-乙酰半乳糖氨基转移酶(UDP-N-acetyl-D-galactosamine:polypeptide N-acetylgalactosaminyl-transferases, EC 2.4.1.41, ppGalNAc-Ts)的催化下将O-GalNAc转移到蛋白质分子中的丝氨酸或苏氨酸残基上[5]。该酶是黏蛋白O-糖基化反应途径的起始酶,在绝大数已研究过的物种都存在2个以上的基因所编码的ppGalNAc-Ts同种型(isoform),如人类有20个,啮齿动物19个,果蝇14个,C. elegans有9个同种型[6-8],这些同种型不仅其表达随发育阶段和组织分布有所差异,且在一级结构和空间构象上也有所差异,但在一级结构上都具有短的跨膜结构域、茎区、Gal/GalNAc结合区(包括GT1和Gal/GalNAc-T 2个模体)、Mn2+结合位点以及蓖麻毒蛋白样凝集素结构域的共同特征;各同种型催化GalNAc残基转移的酶动力学特征具有显著差异[9],使O-糖基化修饰成为真核生物中最丰富的糖基化形式,并由此而赋予O-糖基化反应在组织和细胞中巨大的差异调节潜能,成为抗肿瘤药物、抗感染药物、人工合成抗体等的重要靶标分子[10]。
艾美耳球虫(Eimeria spp.)是兽医学上最重要的病原体之一,可导致禽、兔、猪、牛、羊等养殖业生产的重大经济损失。据估计,球虫病每年可给全球养鸡业造成30亿美元以上的经济损失[11];而在我国,养鸡业因球虫病的经济损失高达60亿~70亿元,仅药物支出一项就高达12亿元以上[12]。现今,临床上鸡球虫病仍主要以药物防治为主,但鸡球虫对抗球虫药物的严重抗性及人们对动物性食品药物残留问题的日益关注[12-14],迫切需要发现新的药靶和新型高效药物。ppGalNAc-Ts与其他代谢关键酶一样,作为病原体生存所必需分子及与其宿主同源物在结构或生化特性方面的显著差异而成为理想的药靶分子[15]。尽管基因组数据揭示球虫存在糖基化修饰代谢途径,但对其蛋白质糖基化修饰谱及其酶类的研究迄今尚鲜见报道。为研究柔嫩艾美耳球虫(Eimeria tenella)O-糖基化修饰对球虫发育的表观遗传调控效应及其酶类的药靶效应(druggable target),根据EuPathDB数据库中的预测基因序列,进行了EtppGalNAc-T2的基因克隆表达及其不同发育阶段的相对表达动态分析,为进一步研究球虫的O-GalNAc化修饰建立实验基础。
1 材料与方法 1.1 材料 1.1.1 虫株E. tenella广东株,本实验室分离、保存。
1.1.2 菌株与质粒克隆载体pMD-19 T Vector、E. coli Trans5α和E. coli Transetta (DE3)购自北京全式金生物技术有限公司;表达载体pGEX-6p-1购自Amersham Pharmacia Biotech公司。
1.2 主要试剂Premix Ex Taq聚合酶、SYBR Premix ExTaqTM Ⅱ、EcoRⅠ、BamHⅠ、T4 DNA ligase、PrimerScripTM 1st Strand cDNA Synthsis Kit购自TaKaRa公司;E. Z. N. A胶回收试剂盒和质粒小提试剂盒Ⅰ购自OMEGA公司;脱氧胆酸盐和胰酶购自Sigma公司;TRIzol购自Invitrogen公司。
1.3 EtppGalNAc-T2基因的克隆和测序分析 1.3.1 引物设计与合成检索EuPathDB数据库获得EtppGalNAc-T2的基因编码序列(ETH_00029115),以在线工具BLASTx(http://www.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行比对、确认功能注释后[16],以此序列为模板,Primer Primer 5.0设计PCR引物(EtppGalNAc-T2-F: ATggCCCCAgggAgAgCC; EtppGalNAc-T2-R: TTACATTCTTgCTTTCATgTAg),由北京六合华大基因科技股份有限公司合成。
1.3.2 E. tenella不同发育阶段总RNA的提取与基因克隆纯化的子孢子(SZ)、第二代裂殖子(2nd MZ)、未孢子化卵囊(USO)、孢子化7 h卵囊(SO7 h)和孢子化卵囊(SO)液氮研磨后,按TRIzol试剂盒方法分别提取总RNA。提取的E. tenella 各阶段RNA用PrimerScripTM 1st Strand cDNA Synthsis Kit反转录成第一链cDNA,与设计合成的上下游引物建立PCR反应体系(Premix Ex Taq 25 μL;模板1 μL;上下游引物各1 μL;ddH2O 22 μL),按程序“94 ℃ 4 min→35次下列循环(94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min 30 s)→72 ℃ 7 min→4 ℃”进行PCR扩增。产物经1%琼脂糖凝胶电泳检测,E. Z. N. A胶回收试剂盒回收,与克隆载体pMD-19 T于16 ℃连接过夜,转化E. coli Trans5α感受态细胞后挑取阳性克隆测序鉴定。
1.3.3 EtppGalNAc-T2编码蛋白质的序列分析PCR产物的测序结果以DNAStar 7.0与预测基因ETH_00029115进行序列比对;以NCBI DELTA-BLAST(http://blast.ncbi.nlm.nih.gov)进行所编码蛋白质序列的比对和保守功能结构域分析;比对结果导入MEGA 6.0以MUSCLE进行系统进化分析[17],截取pp-GalNAc-T功能结构域的比对结果导入WebLogo(http://weblogo.berkeley.edu/logo.cgi)分析顶复门原虫间ppGalNAc-T2的氨基酸保守性[17-18]。
1.4 EtppGalNAc-T2的重组表达与鉴定 1.4.1 EtppGalNAc-T2的重组表达以测序正确的阳性菌液为模板,用表达引物(EtppGalNAc-T2-F:CgCggATCCATggCCCCAgggAgAgCC;EtppGalNAc-T2-R:CCggAATTCTTACATTCTTg-CTTTCATgTAg。下划线分别为BamHⅠ和EcoRⅠ的酶切位点)扩增目的基因,同“1.3.2 ”的程序进行PCR扩增。将表达载体pGEX-6p-1和带酶切位点的EtppGalNAc-T2扩增产物分别以BamHⅠ、EcoRⅠ酶切,16 ℃连接过夜构建重组表达质粒EtppGalNAc-T2-pGEX-6p-1并转化E. coli Trans5α,挑取单菌落于1 mL LB(AMP+)中37 ℃过夜;菌液PCR鉴定后,按1:100接种100 mL的LB(AMP+)37 ℃振荡培养至OD600 nm 为0.6~0.8后加终浓度为1 mmol·L-1的IPTG,取诱导前和诱导后4 h菌液各1 mL,沸水浴10 min,SDS-PAGE电泳检测。离心收集诱导后4 h的菌体以PBS重悬超声破碎,分别收集上清和沉淀进行SDS-PAGE检测。按Proteinlso GST Resin纯化柱说明书分离纯化rEtppGalNAc-T2。
1.4.2 重组表达EtppGalNAc-T2的鉴定Proteinlso GST Resin柱分离纯化的重组表达产物进行SDS-PAGE电泳,切取蛋白质条带送上海中科新生命生物技术有限公司以ABI 5800 MALDI-TOF/TOF串联质谱仪进行质谱鉴定。
1.5 荧光定量PCR检测 1.5.1 引物设计根据EtppGalNAc-T2的cDNA和内参基因Et18S rRNA序列,设计引物(Et18S-F: ATCgCAgTTggTTCTTTTgg, Et18S-R: CCTgCTgCCTTCCTTAgATg; EtppGalNAc-T2-F: gCgT-TTCTTTTCAgTggTTTgTg, EtppGalNAc-T2-R:gg-ATgTgCTTgAAgTCgTggTC),以NCBI的Primer-BLAST比对分析确定引物序列特异性。
1.5.2 目的基因的检测首先以SZ阶段的cDNA为模板分别作1×、4×、16×、126×梯度稀释进行反应(各三个重复),以仪器自带Mx3005p v4.10软件绘制标准曲线。以18S rRNA为内参,E. tenella USO、SO7 h、SO、SZ和2nd MZ等5个阶段虫体的cDNA为模板,进行qPCR反应检测目的基因转录水平,每组3个重复。反应程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。反应结束后用Mx3005p v4.10分析扩增曲线和熔解曲线,获取其Ct值。
1.5.3 数据处理和统计分析mRNA相对表达量根据K.J.Livak等的2-ΔΔCt法[19]计算。ΔΔCt =试验组Ct值(Ct目的基因-Ct内参基因)-对照组Ct值(Ct目的基因-Ct内参基因)。
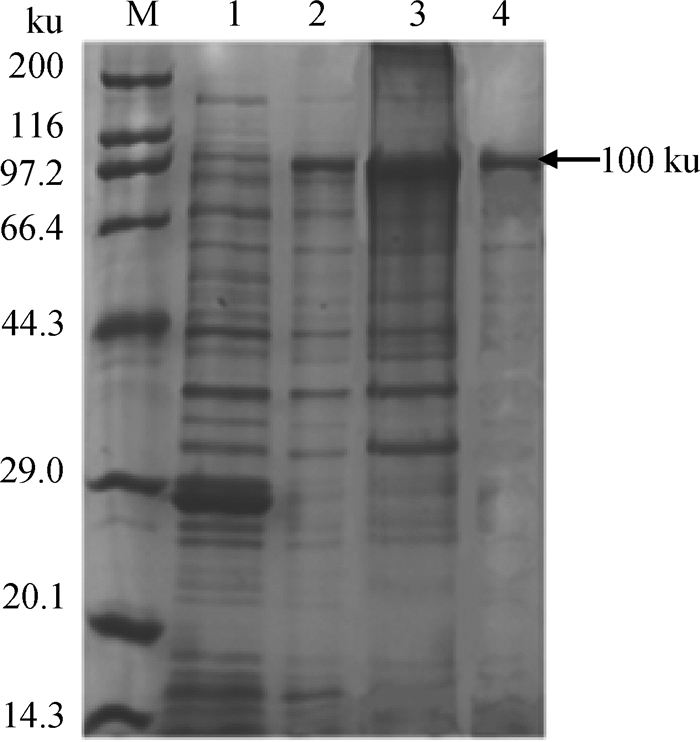
2 结果 2.1 EtppGalNAc-T2基因的扩增和重组表达及纯化以E. tenella 子孢子cDNA为模板,用RT-PCR扩增获得约2 000 bp目的基因(图 1),回收后测序结果显示扩增产物长为1 983 bp。重组表达载体EtppGalNAc-T2-pGEX-6p-1阳性菌液经1 mmol·L-1 IPTG 37 ℃诱导表达4 h后分别收集菌体超声破碎,产物进行SDS-PAGE电泳检测,结果表明EtppGalNAc-T2-pGEX-6p-1在上清和包涵体中都有表达,重组蛋白质大小约100 ku(图 2)。以Proteinlso GST Resin纯化柱结合菌液上清后按最大洗脱量GSH浓度为15 mmol·L-1进行洗脱。纯化后的融合蛋白质进行SDS-PAGE电泳,结果显示在约100 ku(图 2)处有明显条带,与预期结果相符。

|
M. DL5000 DNA相对分子质量标准; 1. EtppGalNAc-T2基因PCR产物 M. DNA marker DL5000; 1. PCR product of EtppGalNAc-T2 图 1 EtppGalNAc-T2基因PCR扩增 Figure 1 Cloning of gene coding for EtppGalNAc-T2 |
|
M.蛋白质相对分子质量标准;1. pGEX-6p-1空载体;2. EtppGalNAc-T2-pGEX-6p-1重组表达菌超声裂解上清液;3. EtppGalNAc-T2-pGEX-6p-1重组表达菌超声裂解沉淀;4. EtppGalNAc-T2-GST纯化后蛋白样品 M. Protein molecular weight marker; 1. Non-carrier vector pGEX-6p-1; 2. Lysate supernant of recombinant E. coli for expressing EtppGalNAc-T2-pGEX-6p-1; 3. Lysate sediment of recombinant E. coli for expressing EtppGalNAc-T2-pGEX-6p-1; 4. Purified EtppGalNAc-T2-GST with proteinlso GST resin 图 2 EtppGalNAc-T2的重组表达结果 Figure 2 Expressed recombinant EtppGalNAc-T2 in E. coli DE3 |
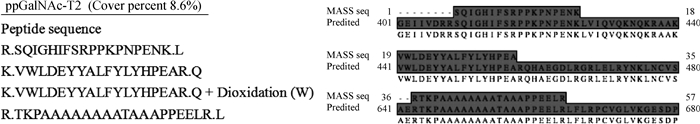
MALDI-TOF/TOF串联质谱仪鉴定结果表明,3个酶解肽段分别与UniProt数据库中根据E.tenella基因组数据预测的EtppGalNAc-T2 (XP_013229719.1)的R408-K426、K440-R458和R643-R664片段完全匹配,三者均位于保守结构域区,匹配率8.6%,在线比对分析指示重组表达产物为EtppGalNAc-T2(图 3)。
|
左图.重组EtppGalNAc-T2酶解片段的质谱鉴定结果;右图.质谱鉴定肽段的比对结果 Left. MALDI-TOF/TOF sequencing of recombinant EtppGalNAc-T2; Right. Alignment of peptide sequences identified by MALDI-TOF/TOF against the predicted EtppGalNAc-T2 sequence in UniProt database 图 3 EtppGalNAc-T2重组表达产物的质谱鉴定 Figure 3 Confirmation of recombinant EtppGalNAc-T2 by MALDI-TOF/TOF analysis |
DNAStar 7.0软件翻译克隆的EtppGalNAc-T2,表明EtppGalNAc-T2由660 AA组成,相对分子质量为75.14 ku。DELTA-BLAST分析显示,其氨基酸顺序与E. acervulina、T. gondii、N. caninum的相似性分别为99%、87%和87%,且含有完整的pp-GalNAc-T功能结构域。WebLogo分析揭示EtppGalNAc-T2功能结构域pp-GalNAc-T中具有参与结合UDP-Gal的GT1模体特征性DxH基序,酶活性所必须的D232和H234在这些原虫及其他物种间极其保守;同样在催化半乳糖基转移的活性中心Gal/GalNAc-T模体中,也包含有进化上高度保守且功能所必须的D319xxxxxWGGENxE331基序。此外活性中心所必须的其他氨基酸如F230、C235、Y318、G321、M322等在艾美耳球虫亚目的原虫间也高度保守(图 4)。

|
图中氨基酸符号的字体大小代表其保守程度 The conservation of amino acid in the activity sites was displayed by the symbol size of specific amino acid 图 4 球虫亚目原虫ppGalNAc-T2功能结构域AA保守性分析 Figure 4 WebLogo analysis of amino acid conservation within the ppGalNAc-T2 functional domain among Suborder Eimeriorina |
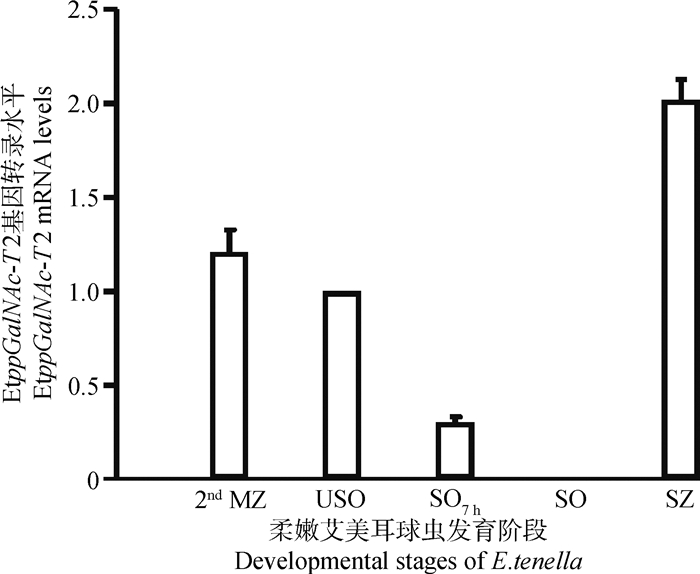
qRT-PCR法分析E. tenella USO、SO7 h、SO、SZ和2nd MZ的cDNA,同时检测目的基因和参照基因,试验数据用2-ΔΔCt 法计算各阶段的EtppGalNAc-T2基因转录的相对水平,结果显示,EtppGalNAc-T2基因在子孢子阶段转录水平最高,总体上侵袭阶段高于卵囊阶段;在孢子发育阶段则随着孢子化的进行逐渐降低,至孢子化卵囊几近不能检出(图 5)。
|
2nd MZ.第二代裂殖子;USO.未孢子化卵囊;SO7 h.孢子化7 h卵囊;SO.孢子化卵囊;SZ.子孢子 2nd MZ. Second merozoite; USO. Unsporolated oocyst; SO7 h. Occyst sporolating for 7 h; SO. Sporolated oocyst; SZ. Sporozoite 图 5 E. tenella不同发育阶段EtppGalNAc-T2的mRNA转录水平比较 Figure 5 Comparison of mRNA levels for EtppGalNAc-T2 among the different developmental stages of E. tenella |
柔嫩艾美耳球虫的生活史复杂,包括孢子生殖、裂殖生殖和配子生殖三个阶段。蛋白质翻译后的糖基化修饰作为一种重要的表观遗传调控方式,对某些蛋白质的折叠成熟、分泌、功能发挥具有不可或缺的作用,从而影响球虫的入侵、发育和致病过程[20],但相关研究甚少报道。R. A. Walker等[21]曾对E. tenella配子发育和合子形成过程中参与糖链合成和糖基转移过程的6种酶(葡糖胺:果糖-6-磷酸氨基转移酶,EtGFAT;葡糖胺-6-磷酸N-酰基转移酶,EtGNA;磷酸乙酰葡糖胺变位酶,EtAGM;UDP-N-葡糖胺焦磷酸酶,EtUAP;UDP-N-葡糖胺4-差向异构酶,EtUAE;多肽:N-乙酰葡糖氨基转移酶,EtppGlcNAc-T和EtppGalNAc-T)进行qRT-PCR检测,表明EtGFAT尽管在大配子发育早期即有转录,但EtGFAT仅在成熟大配子才可检测到;N-GalNAc合成的3种酶基因(EtAGM、EtUAP和EtUAN)在大配子发育中也有转录水平上调,使大配子中N-GalNAc水平显著升高,与此同时EtppGalNAc-T的转录水平则主要在未孢子化卵囊阶段上调,表明O-糖基化在卵囊形成时大配子糖蛋白向卵囊壁的转移中具有重要作用。但作者并未对EtppGalNAc-T的同种型进行专门检测。从基因组数据分析看,E. tenella具有5个ppGalNAc-T同种型编码基因,他们各自在不同发育阶段的差异表达有待深入研究。我们的结果显示EtppGalNAc-T2基因在SZ阶段最高、2nd MZ阶段次之,随着孢子化的进行,则逐渐降低到孢子化卵囊时期几近不能检测(图 5)。这提示O-糖基化修饰随E. tenella生活史发育过程而表现显著动态改变。孢子化卵囊是代谢相对静息阶段,而子孢子由于受胰酶、胆汁酸及其肠细胞信号刺激,代谢极为活跃,开始大量表达入侵所需要的糖蛋白(如MIC2、MIC4、RON2等)。已有报道证明糖缀合物是多种原虫和蠕虫入侵宿主细胞及与宿主相互作用过程所必须的,如虫体入侵时黏附细胞所需要的凝集素样蛋白[22]。笔者实验室对E. tenella不同发育阶段N-糖基化的定量修饰组分析表明,子孢子阶段入侵相关蛋白(RONs、MICs、SAGs)和糖苷合成酶激酶(glycan synthesis kinases, GSKs)家族部分成员(如磷酸激酶3,EtPK3)等20多种蛋白质的N-糖基化水平显著升高(待发表数据)。但O-糖基化质谱分析技术尚未成熟,球虫蛋白质O-糖基化修饰及其在不同发育阶段的动态变化有待后续研究。
ppGalNAc-Ts在一级和高级结构上高度保守,在催化区域都具有GT1和Gal/GalNAc-T模体[10, 23-26]。GT1中包含DxD或者DxH基序,在构象上类似于乳糖阻遏子(lactose repressor)的第一个结构域,为酶活性所必须,关键氨基酸突变会导致酶活性几乎完全丧失[24];Gal/GalNAc-T模体是半乳糖基转移酶活性中心,系统发生分析表明所有物种间ppGalNAc-T及其各种同种型都具有12个氨基酸组成的DxxxxxWGGENxE特征性基序,其C-端的D和N-端ENxN中的E发生突变也将导致酶活性丧失[27]。BLAST和WebLogo分析表明,EtppGalNAc-T2也存在GT1(DxH,D232-H234)和Gal/GalNAc-T(D319xxxxxWGGENxE331)功能基序(图 4),且230、232、234、235、318、319、321、322、325、326、327、328、329、331、333位氨基酸在T. gondii、N. caninum和7种鸡球虫间及各自的同种型间高度保守,提示ppGalNAc-T催化机制的同一性和O-糖基化反应在这些原虫的普遍性。尽管笔者的克隆结果与EuPathDB的预测序列相比缺失了ETH_00029115中的382—453 bp和787—1 038 bp 2个片段,但所缺失片段均具有GTxx—xxAG真核生物内含子的序列特征,表明预测基因序列存在错误拼接。笔者实验室近期完成的E. tenella基因组重测序结果(待发表数据)也与本试验克隆基因序列相一致。
4 结论本研究克隆表达了柔嫩艾美耳球虫的EtppGalNAc-T2基因,序列分析表明其表达产物具有ppGalNAc-T家族酶分子的典型功能结构域和保守氨基酸,其表达水平随E. tenella发育阶段不同而发生显著变化,提示EtppGalNAc-T2结构和功能的保守性及其对球虫发育的潜在调控作用,为进一步研究其酶动力学及作为新型抗球虫药的靶标有效性提供了试验基础。
| [1] | SPIRO R G. Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds[J]. Glycobiology, 2002, 12(4): 43R–56R. DOI: 10.1093/glycob/12.4.43R |
| [2] | STEPAN H, PABST M, ALTMANN F, et al. O-glycosylation of snails[J]. Glycoconj J, 2012, 29(4): 189–198. DOI: 10.1007/s10719-012-9391-4 |
| [3] | VAN DEN STEEN P, RUDD P M, DWEK R A, et al. Concepts and principles of O-linked glycosylation[J]. Crit Rev Biochem Mol Biol, 1998, 33(3): 151–208. DOI: 10.1080/10409239891204198 |
| [4] | LOMMEL M, STRAHL S. Protein O-mannosylation: conserved from bacteria to humans[J]. Glycobiology, 2009, 19(8): 816–828. DOI: 10.1093/glycob/cwp066 |
| [5] | TEN HAGEN K G, FRITZ T A, TABAK L A. All in the family: the UDP-GalNAc: polypeptide N-acetylgalactosaminyltransferases[J]. Glycobiology, 2003, 13(1): 1R–16R. DOI: 10.1093/glycob/cwg007 |
| [6] | BENNETT E P, MANDEL U, CLAUSEN H, et al. Control of mucin-type O-glycosylation: a classification of the polypeptide GalNAc-transferase gene family[J]. Glycobiology, 2012, 22(6): 736–756. DOI: 10.1093/glycob/cwr182 |
| [7] | WOJCZYK B S, STWORA-WOJCZYK M M, HAGEN F K, et al. cDNA cloning and expression of UDP-N-acetyl-D-galactosamine: polypeptide N-acetylgalactosaminyltransferase T1 from Toxoplasma gondii[J]. Mol Biochem Parasitol, 2003, 131(2): 93–107. DOI: 10.1016/S0166-6851(03)00196-8 |
| [8] | TAUS C, LUCINI C, SATO T, et al. Expression and characterization of the first snail-derived UDP-N-α-D-galactosamine: polypeptide N-acetylgalactosaminyltransferase[J]. Glycoconj J, 2013, 30(9): 825–833. DOI: 10.1007/s10719-013-9486-6 |
| [9] | RAMAN J, GUAN Y, PERRINE C L, et al. UDP-N-acetyl-α-D-galactosamine: polypeptide N-acetylgalactosaminyltransferases: completion of the family tree[J]. Glycobiology, 2012, 22(6): 768–777. DOI: 10.1093/glycob/cwr183 |
| [10] | JUNG S T, KANG T H, KELTON W, et al. Bypassing glycosylation: engineering aglycosylated full-length IgG antibodies for human therapy[J]. Curr Opin Biotechnol, 2011, 22(6): 858–867. DOI: 10.1016/j.copbio.2011.03.002 |
| [11] | DALLOUL R A, LILLEHOJ H S. Poultry coccidiosis: recent advancements in control measures and vaccine development[J]. Expert Rev Vaccines, 2006, 5(1): 143–163. DOI: 10.1586/14760584.5.1.143 |
| [12] |
范梅华, 徐步. 剖析鸡球虫病的流行特点及防控策略-访广东省农业科学院兽医研究所副所长蔡建平博士[J]. 中国禽业导刊, 2005, 22(24): 20–23.
FAN M H, XU B. Probing the epidemiological features of avian coccidiosis and strategies for its control in China[J]. Guide to Chinese Poultry, 2005, 22(24): 20–23. (in Chinese) |
| [13] | CHAPMAN H D. Biochenmical, genetic and applied aspects of drug resistance in Eimeria parasites of the fowl[J]. Avian Pathol, 1997, 26(2): 221–244. DOI: 10.1080/03079459708419208 |
| [14] | INNES E A, VERMEULEN A N. Vaccination as a control strategy against the coccidial parasites Eimeria, Toxoplasma and Neospora[J]. Parasitology, 2006, 133(S2): S145–S168. DOI: 10.1017/S0031182006001855 |
| [15] | STWORA-WOJCZYL M M, KISSINGER J C, SPITALNIK S L, et al. O-glycosylation in Toxoplasma gondii: identification and analysis of a family of UDP-GalNAc: polypeptide N-acetylgalactosaminyltransferases[J]. Int J Parasitol, 2004, 34(3): 309–322. DOI: 10.1016/j.ijpara.2003.11.016 |
| [16] | MARCHLER-BAUER A, DERBYSHIRE M K, GONZALES N R, et al. CDD: NCBI's conserved domain database[J]. Nucleic Acids Res, 2015, 43(D1): D222–D226. DOI: 10.1093/nar/gku1221 |
| [17] | TAMURA K, STECHER G, PETERSON D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Mol Biol Evol, 2013, 20(12): 2725–2729. |
| [18] | CROOKS G E, HON G, CHANDONIA J M, et al. WebLogo: a sequence logo generator[J]. Genome Res, 2004, 14(6): 1188–1190. DOI: 10.1101/gr.849004 |
| [19] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402–408. DOI: 10.1006/meth.2001.1262 |
| [20] | SCHNEIDER T D, STEPHENS R M. Sequence logos: a new way to display consensus sequences[J]. Nucleic Acids Res, 1990, 18(20): 6097–6100. DOI: 10.1093/nar/18.20.6097 |
| [21] | WALKER R A, SLAPETOVA I, SLAPETA J, et al. The glycosylation pathway of Eimeria tenella is upregulated during gametocyte development and may play a role in oocyst wall formation[J]. Eukaryot Cell, 2010, 9(1): 127–135. DOI: 10.1128/EC.00255-09 |
| [22] |
瓦尔基. 糖生物学基础[M]. 张树政, 朱正美, 王克夷, 译. 北京: 科学出版社, 2003: 495-507.
VARKI A. Essentials of glycobiology[M]. ZHANG S Z, ZHU Z M, WANG K Y, Trans. Beijing: Science Press, 2003: 495-507. (in Chinese) |
| [23] | GASTINEL L N, CAMBILLAU C, BOURNE Y. Crystal structures of the bovine β4-galactosyltransferase catalytic domain and its complex with uridine diphosphogalactose[J]. EMBO J, 1999, 18(13): 3546–3557. DOI: 10.1093/emboj/18.13.3546 |
| [24] | WANDALL H H, IRAZOQUI F, TARP M A, et al. The lectin domains of polypeptide GalNAc-transferases exhibit carbohydrate-binding specificity for GalNAc: lectin binding to GalNAc-glycopeptide substrates is required for high density GalNAc-O-glycosylation[J]. Glycobiology, 2007, 17(14): 374–387. |
| [25] | RAMAN J, FRITZ T A, GERKEN T A, et al. The Catalytic and lectin domains of UDP-GalNAc: polypeptide α-N-acetylgalactosaminyltransferase function in concert to direct glycosylation site selection[J]. J Biol Chem, 2008, 283(34): 22942–22951. DOI: 10.1074/jbc.M803387200 |
| [26] | GERKEN T A, REVOREDO L, THOME J J C, et al. The lectin domain of the Polypeptide GalNAc transferase family of glycosyltransferases (ppGalNAc Ts) acts as a switch directing glycopeptide substrate glycosylation in an N-or C-terminal direction, further controlling Mucin type O-glycosylation[J]. J Biol Chem, 2013, 288(27): 19900–19914. DOI: 10.1074/jbc.M113.477877 |
| [27] | HAGEN F K, HAZES B, RAFFO R, et al. Structure-function analysis of the UDP-N-acetyl-D-galactosamine: polypeptide N-acetylgalactosaminyltransferase: essential residues lie in a predicted active site cleft resembling a lactose repressor fold[J]. J Biol Chem, 1999, 274(10): 6797–6803. DOI: 10.1074/jbc.274.10.6797 |



