2. 山东大学生命科学学院, 济南 250100
2. School of Life Science, Shandong University, Jinan 250100, China
禽大肠杆菌病是由致病性大肠杆菌引起的禽类急慢性传染病[1],在鸡群中一般发病率为11%~69%,死亡率为3.8%~72.9%。目前针对大肠杆菌病多采用抗生素治疗和预防,而抗药性日益加剧的大肠杆菌给养禽业带来了严重损失,并对公共卫生、食品安全构成了严重威胁[2-3]。
噬菌体治疗细菌感染性疾病的历史由来已久[4],20世纪30年代就有了噬菌体成功治疗霍乱的报道[5]。然而抗生素的出现与大量使用阻碍着噬菌体治疗的研究与发展。但是,随着抗生素滥用产生的畜禽产品药物残留问题与耐药菌株的大量出现[6],以及新抗生素研发难度的增加,使噬菌体作为一种新兴的生物治疗制剂又重新受到了研究人员的关注[7]。噬菌体特异性强,治疗细菌感染时只针对相应的致病菌,而不会干扰机体正常的菌群平衡,且可以在细菌感染部位快速增殖使得噬菌体剂量得以放大,进而快速达到增强疗效的作用。噬菌体有很强的宿主依赖性[8],会随着宿主菌的清除而死亡[9],另外机体内本身就存在着种类繁多的噬菌体[10],所以噬菌体几乎没有任何毒副作用。
本试验测定了大肠杆菌噬菌体RZⅢ-3的基本生物学特性,并给SPF鸡口服大肠杆菌噬菌体RZⅢ-3及其特异宿主菌致病性大肠杆菌1019,观测粪便中宿主菌数量的变化,评估大肠杆菌噬菌体RZⅢ-3的裂解疗效。
1 材料与方法 1.1 材料 1.1.1 培养基和试剂固体LB培养基、半固体LB培养基、液体LB培养基、麦康凯固体培养基、MHB液体培养基、SM缓冲液(20 mmol·L-1 Tris-HCl,10 mmol·L-1 MgSO4,10 mmol·L-1 CaCl2,100 mmol·L-1NaCl,pH7.5)、OMEGA Bacterial DNA Kit (50)、Eric-PCR引物、PCR酶、琼脂糖粉、PEG8000、分光光度计等。
1.1.2 抗菌药物氟苯尼考、氨苄西林、头孢噻肟、头孢曲松、左氧氟沙星、环丙沙星、多西环素、庆大霉素、丁胺卡那霉素、硫酸黏菌素、恩诺沙星、头孢噻呋和新霉素,购自中国兽医药品监察所。
1.1.3 菌株和噬菌体大肠杆菌1019,分离自青岛病死鸡体;大肠杆菌噬菌体RZⅢ-3,分离自青岛病死鸡肠道;禽源致病性大肠杆菌(95株)、沙门菌(27株)、铜绿假单胞菌(38株)、耐甲氧西林金黄色葡萄球菌(47株)、金黄色葡萄球菌(42株),均为实验室保存。
1.1.4 实验动物健康的145日龄SPF鸡12只,购自山东省农业科学院家禽研究所SPF鸡场。
1.2 噬菌体RZⅢ-3的基本生物学特性 1.2.1 双层琼脂平板法测定噬菌体效价(滴度)参照文献[11]中的方法富集噬菌体RZⅢ-3,利用双层平板法测定效价。
1.2.2 噬菌体RZⅢ-3的电镜形态参照文献[12]中的方法,纯化得到噬菌体颗粒后进行透射电镜观察。
1.2.3 采用点滴法分析噬菌体的裂解谱测定噬菌体RZⅢ-3对实验室保存的禽源致病性大肠杆菌(95株)、沙门菌(27株)、铜绿假单胞菌(38株)、耐甲氧西林金黄色葡萄球菌(47株)、金黄色葡萄球菌(42株)的裂解能力。取100 μL过夜培养的待测菌液加入到0.6%半固体LB培养基中混匀,倒平板。取噬菌体悬液滴加到平皿的不同位置上,37 ℃培养4~6 h,观察有无噬菌斑。
1.2.4 噬菌体RZⅢ-3的最佳感染复数(optimal multiplicity of infection, MOI)将处于对数生长期的宿主菌用LB液体培养液洗涤,然后将细菌的浓度调整为1.0×108 cfu·mL-1。MOI分别为0.001、0.01、0.1、1、10,将相应数量的噬菌体液加入到已准备好的菌液中(二者体积分别为500 μL),混匀,37 ℃ 160 r·min-1振荡培养5 h。混合培养物10 000 r·min-1离心20 min,得到裂解液,测噬菌体效价。最高效价的感染复数即为最佳感染复数。
1.2.5 噬菌体RZⅢ-3的一步生长曲线噬菌体液与宿主菌液各500 μL以MOI的比例混合,37 ℃孵育15 min。10 000 r·min-1离心1 min,弃上清,LB液体洗涤3次。加入10 mL 37 ℃预热的LB液体培养基,充分混匀,迅速置于37 ℃摇床中振荡培养。每隔10 min取样一次,测噬菌体的效价。
1.2.6 噬菌体RZⅢ-3最适生长温度20、30、37、40、50 ℃,各取100 μL噬菌体稀释液与100 μL宿主菌,利用双层琼脂平板法计数噬菌斑。
1.2.7 噬菌体RZⅢ-3的热稳定性将噬菌体悬液放于30、40、50、60、70、80 ℃水浴锅中,持续30和60 min后,各取100 μL噬菌体液与100 μL宿主菌混合,利用双层琼脂平板法计数噬菌斑。
1.2.8 噬菌体RZⅢ-3的最适pH调整LB液体培养基的pH分别为3、4、5、6、7、8、9、10、11、12,每个pH均取100 μL,加入100 μL的108 pfu·mL-1的噬菌体液混匀,37 ℃作用2 h,双层平板法计数噬菌斑。
1.3 噬菌体RZⅢ-3裂解大肠杆菌1019的体外试验 1.3.1 SPF鸡粪中大肠杆菌与高抗性大肠杆菌1019的MIC测定参照CLSI标准,微量肉汤稀释法测定SPF鸡粪中的大肠杆菌以及大肠杆菌1019对13种药物的MIC值。
1.3.2 在SPF鸡肠道噬菌体RZⅢ-3裂解大肠杆菌1019的试验根据药敏结果选取新霉素药物制备麦康凯药板,配制麦康凯药板,质量浓度为128 μg·mL-1(大肠杆菌1019 MIC的一半,此浓度可以区分大肠杆菌1019和SPF鸡肠道原有的大肠杆菌)。
取5 g SPF鸡粪于200 mL液体LB培养基中,同时加入大肠杆菌噬菌体RZⅢ-3和大肠杆菌1019各100 μL 37 ℃摇床过夜培养。培养的菌液10倍梯度稀释涂布麦康凯药板,平板计数菌落;单菌落于液体LB中37 ℃摇床过夜培养,提取DNA,与原大肠杆菌1019的DNA同时作Eric-PCR,比对基因条带判定噬菌体作用前后大肠杆菌有无变化。
1.4 SPF鸡口服噬菌体RZⅢ-3治疗大肠杆菌1019感染的效果口服攻毒,大肠杆菌1019浓度109 cfu·mL-1,剂量为2 mL。试验组分3小组,即为只攻菌组、只攻噬菌体组、菌与噬菌体组,每小组3只鸡,口服噬菌体2 mL×109 pfu·mL-1,从0 h开始每隔2 h取粪样,直到第10小时。每个粪样取2 g溶于2 mL生理盐水中混匀,10倍梯度稀释,取稀释103、104和105倍的样品浓度涂布256 μg·mL-1的新霉素麦康凯药板,每个药板上加菌样100 μL,37 ℃过夜培养,菌落计数,统计经噬菌体治疗与未经噬菌体治疗的SPF鸡粪样中大肠杆菌1019数量。
2 结果 2.1 RZⅢ-3的效价图 1为噬菌体RZⅢ-3的生长情况。大肠杆菌噬菌体RZⅢ-3的效价测定结果如下:噬菌体RZⅢ-3双层板平均为210个噬菌斑,计算出噬菌体富集液的效价为2.1×109 pfu·mL-1。

|
图 1 稀释了106倍的噬菌斑生长情况 Figure 1 The growth rate of phage plaque (diluted 106 times) |
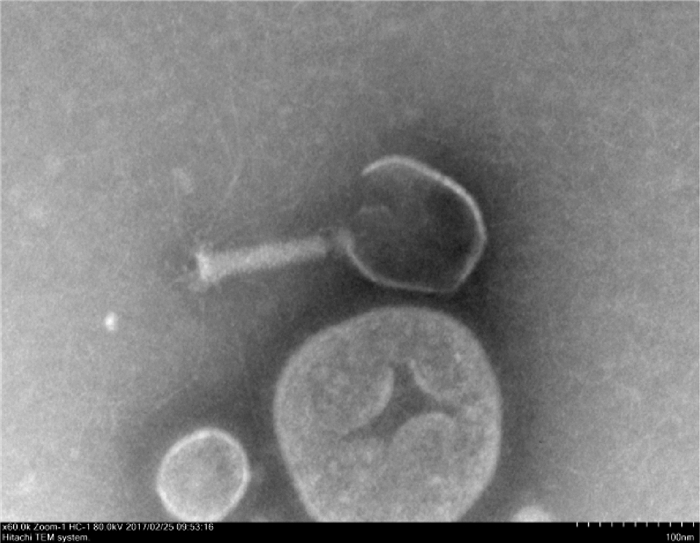
图 2为噬菌体RZⅢ-3的透射电镜图。结果显示噬菌体RZⅢ-3为有尾目噬菌体,由二十面体头部与尾部组成,头部直径约为117 nm,整个噬菌体长度约239 nm,属于T4噬菌体类型。
|
图 2 噬菌体RZⅢ-3透射电镜图 Figure 2 The transmission electron microscopy of E.coli phage RZⅢ-3 |
噬菌体RZⅢ-3的裂解谱显示大肠杆菌噬菌体的宿主特异性很强,几乎不裂解沙门菌、铜绿假单胞菌、金黄色葡萄球菌及耐甲氧西林金黄色葡萄球菌,但是可以裂解95株致病性大肠杆菌中的22株,裂解谱较宽。
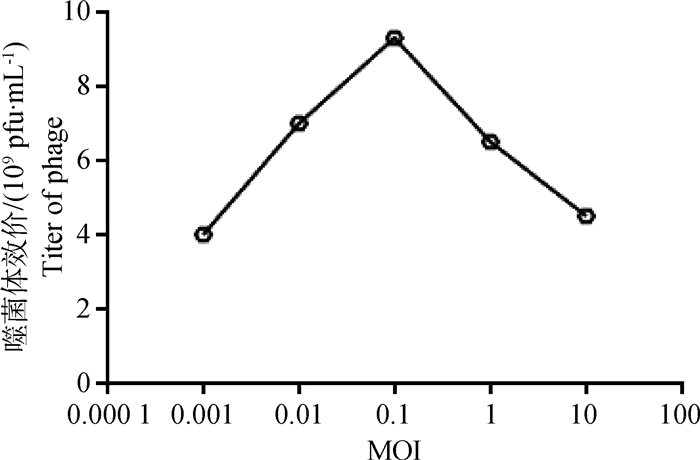
2.4 RZⅢ-3的最佳感染复数最佳感染复数结果(图 3)显示大肠杆菌噬菌体RZⅢ-3的MOI为0.1。
|
图 3 噬菌体RZⅢ-3的MOI Figure 3 The MOI of phage RZⅢ-3 |
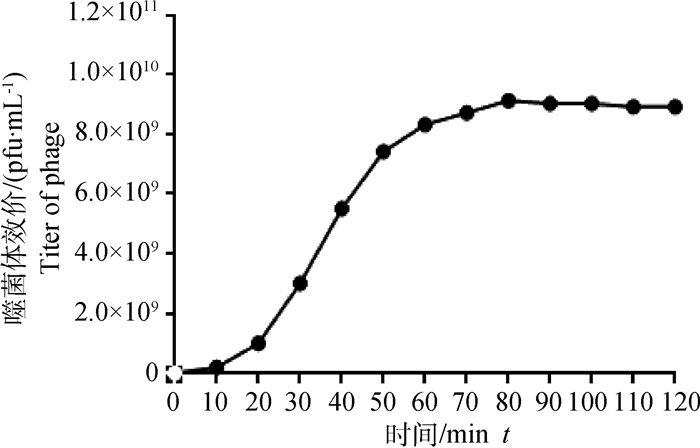
根据噬菌体RZⅢ-3的一步生长曲线(图 4),噬菌体RZⅢ-3感染宿主菌20 min内,噬菌体的量增加不大,这段时间称为潜伏期;感染宿主菌后20~90 min,噬菌体的量急速增加,这段时间称之为爆发期,即RZⅢ-3的爆发期约为70 min。
|
图 4 噬菌体RZⅢ-3的一步生长曲线 Figure 4 One step growth curve of phage RZⅢ-3 |
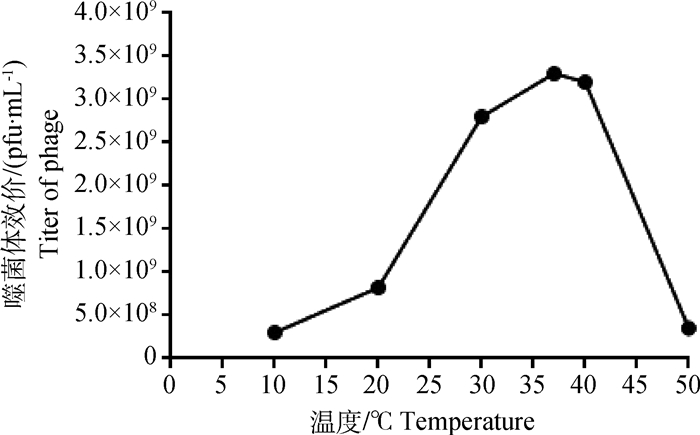
最适生长温度测定结果(图 5)显示噬菌体RZⅢ-3适合生长的温度在30~40 ℃,最适生长温度为37 ℃。
|
图 5 噬菌体RZⅢ-3的最适温度 Figure 5 Optimal temperature of phage RZ Ⅲ-3 |
热稳定性测定结果(图 6)显示噬菌体RZⅢ-3在30和40 ℃保温30 min和1 h后基本保持原活性,在50 ℃保温1 h后噬菌体的效价仍可维持在108 pfu·mL-1。在60 ℃保温1 h后效价可在107 pfu·mL-1以上,经70 ℃保温1 h后仍有噬菌体存活,而经80 ℃作用后噬菌体基本上被灭活(此部分结果因显示条件所限在图 6中未能体现)。由此可见这株噬菌体的热稳定性较好。
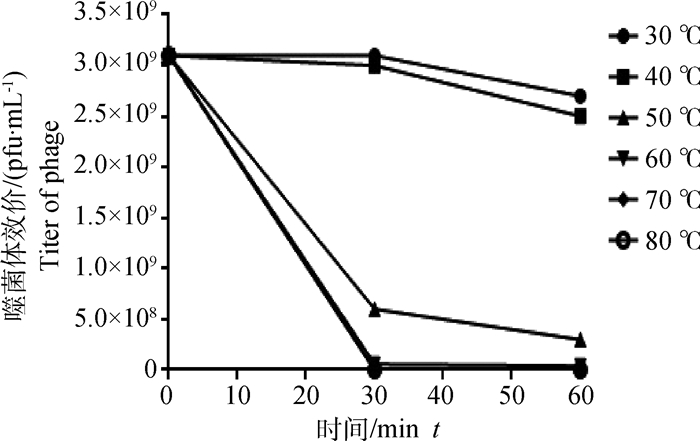
|
图 6 噬菌体RZⅢ-3的热稳定性 Figure 6 Thermal stability of phage RZⅢ-3 |
大肠杆菌噬菌体RZⅢ-3的最适pH的测定结果统计分析如图 7所示。大肠杆菌噬菌体RZⅢ-3的最适pH在5~7,同时在pH 4~10时仍能保持较高的效价。所以噬菌体RZⅢ-3能适应较宽的pH范围。
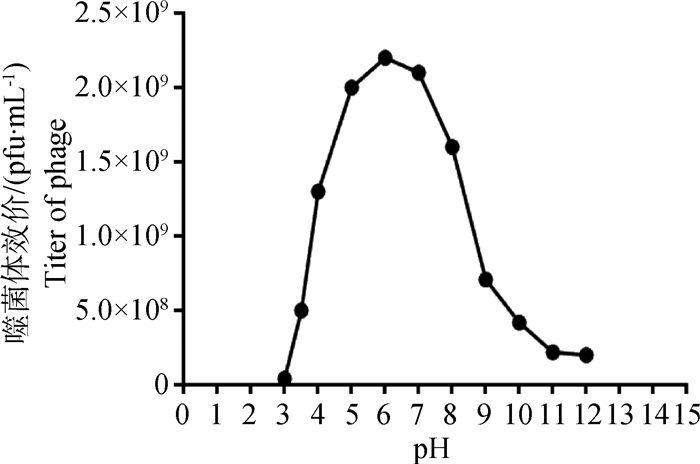
|
图 7 噬菌体RZⅢ-3的最适pH Figure 7 The optimum pH of phage RZⅢ-3 |
微量肉汤稀释法测定的大肠杆菌1019及SPF鸡粪中大肠杆菌对13种药物的MIC值。根据药敏结果统计分析,环丙沙星、多西环素、恩诺沙星、新霉素4种药可以有效地区分大肠杆菌1019与SPF鸡粪中原有的大肠杆菌。选取新霉素做后续耐药菌株的筛选。根据药敏结果大肠杆菌1019用256 μg·mL-1的新霉素麦康凯药板筛选。
筛选出来的耐药大肠杆菌提取DNA,Eric-PCR产物琼脂糖电泳条带如图 8所示:结果显示1019菌株经噬菌体作用前后无变化,可以利用药敏试验的结果对噬菌体作用后的菌株进行筛选。
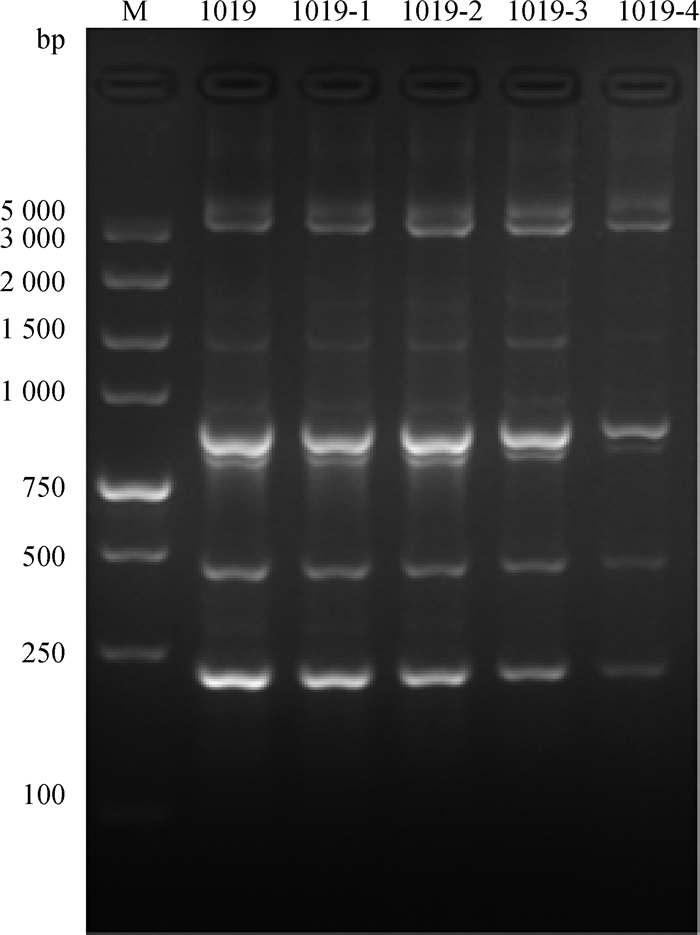
|
M. 5 000 bp DNA相对分子质量标准;1019.原大肠杆菌1019 DNA;1019-1、1019-2、1019-3、1019-4.经噬菌体RZⅢ-3作用后的大肠杆菌1019 DNA M. 5 000 bp DNA marker; 1019. Escherichia coli 1019 DNA; 1019-1, 1019-2, 1019-3, 1019-4. Escherichia coli 1019 DNA after treatment of phage RZⅢ-3 图 8 大肠杆菌Eric-PCR产物琼脂糖电泳条带 Figure 8 The E. coli Eric-PCR product agarose electrophoresis band |
攻毒后利用新霉素麦康凯平板对大肠杆菌1019分离计数,加入噬菌体后粪样中的耐药菌数量显著下降,结果见表 1。以10 h的统计结果计算,只口服大肠杆菌1019的SPF鸡每克粪样中大肠杆菌1019耐药菌含量为2.9×107 cfu·mL-1,同时口服大肠杆菌1019和噬菌体RZⅢ-3的SPF鸡每克粪样中大肠杆菌1019耐药菌含量为1.0×106 cfu·mL-1,后者比前者降低了96.5%。所以该大肠杆菌噬菌体可有效裂解致病性大肠杆菌1019,降低SPF鸡的患病风险。
|
|
表 1 每克粪样中大肠杆菌1019耐药菌含量 Table 1 The amount of Escherichia coli 1019 resistant bacteria per gram of fecal samples |
噬菌体在自然界分布广泛,据统计分析其数量可以达到1031[13]。大肠杆菌噬菌体更是广泛分布于鸡消化道、鸡场及周边环境中[14]。充分利用这些噬菌体可以在一定程度上替代抗生素的使用,降低细菌耐药性,提高养殖企业的经济利益。
作者分离到的大肠杆菌噬菌体效价可达到109 pfu·mL-1,由20面体和尾部组成,属于T4类噬菌体。这与许多研究人员从养殖场粪便中、河水中和污水中分离出的噬菌体相似[15-17]。噬菌体RZⅢ-3的最佳感染复数为0.1,感染宿主菌的潜伏期为20 min,爆发期为70 min。潜伏期和爆发期短,可以在短时间内杀死宿主菌,有效控制大肠杆菌的生长。噬菌体RZⅢ-3的裂解谱分析结果表明,RZⅢ-3可以裂解95株致病性大肠杆菌中的22株,裂解谱较宽。
噬菌体RZⅢ-3的热稳定性较高,在60 ℃保温1 h后噬菌体效价仍可达到107 pfu·mL-1以上。对pH的适应范围较宽,在pH4~10内能保持较高的裂解活性。这些特性一方面可以使其在生产过程中不需要过于严苛的生产环境,可以降低生产成本,有利于大规模的工业生产。另一方面在应用时能适应多种环境,可以在相对复杂的环境中保持一定的裂解能力,有利于扩大该噬菌体的适用范围和应用效果。
在SPF鸡肠道中的杀菌试验表明噬菌体RZⅢ-3可显著降低其对应大肠杆菌在体内的存活数量。有研究报道[18],噬菌体经胃酸作用后会失活,但是本试验表明,噬菌体RZⅢ-3经胃酸作用后仍能有效杀死宿主菌,这也是该噬菌体的优势之一。
目前抗生素耐药性越来越严重,噬菌体作为杀菌物质具有很大的优势和应用潜力。本研究中分离到的RZⅢ-3只是数量庞大的噬菌体中的一株。分离新的噬菌体并对其性质进行深入研究,可以为其成为新的抗菌剂打下基础。同时,还需要对其临床应用过程中的问题进行研究[19]。相信经过众多科研工作者的努力,噬菌体会在很大程度上弥补抗生素的缺陷,在畜禽细菌病防治中起到越来越重要的作用。
4 结论大肠杆菌噬菌体RZⅢ-3的效价为109 pfu·mL-1,属于有尾目T4噬菌体。RZⅢ-3热稳定性好,60 ℃ 1 h后效价仍可达到107 pfu·mL-1以上;最适pH在7.0左右,在pH4~10内能保持较高的裂解活性;最佳感染复数为0.1,感染宿主菌的潜伏期20 min,爆发期70 min。RZⅢ-3对大肠杆菌1019有较强的裂解能力,可使SPF鸡肠道内大肠杆菌1019的数量降低96.5%,可望用于治疗特定的大肠杆菌感染。
| [1] | GUABIRABA R, SCHOULER C. Avian colibacillosis: Still many black holes[J]. FEMS Microbiol Lett, 2015, 362(15): fnv118. DOI: 10.1093/femsle/fnv118 |
| [2] | DHAMA K, CHAKRABORTY S, BARATHIDASAN R, et al. Escherichia coli, an economically important avian pathogen, its disease manifestations, diagnosis and control, and public health significance: A review[J]. Res Opin Anim Vet Sci, 2013, 3(6): 179–194. |
| [3] | LIU Y Y, WANG Y, WALSH T R, et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: A microbiological and molecular biological study[J]. Lancet Infect Dis, 2016, 16(2): 161–168. DOI: 10.1016/S1473-3099(15)00424-7 |
| [4] | NOBREGA F L, COSTA A R, KLUSKENS L D, et al. Revisiting phage therapy: New applications for old resources[J]. Trends Microbiol, 2015, 23(4): 185–191. DOI: 10.1016/j.tim.2015.01.006 |
| [5] | D'HERELLE F. Bacteriophage as a treatment in acute medical and surgical infections[J]. Bull N Y Acad Med, 1931, 7(5): 329–348. |
| [6] | REARDON S. Phage therapy gets revitalized: The rise of antibiotic resistance rekindles interest in a century-old virus treatment[J]. Nature, 2014, 510(7503): 15–16. DOI: 10.1038/510015a |
| [7] | CHAN B K, ABEDON S T, LOC-CARRILLO C. Phage cocktails and the future of phage therapy[J]. Future Microbiol, 2013, 8(6): 769–783. DOI: 10.2217/fmb.13.47 |
| [8] | DERDA R, LOCKETT M R, TANG S K Y, et al. Filter-based assay for Escherichia coli in aqueous samples using bacteriophage-based amplification[J]. Anal Chem, 2013, 85(15): 7213–7220. DOI: 10.1021/ac400961b |
| [9] | TAZZYMAN S J, HALL A R. Lytic phages obscure the cost of antibiotic resistance in Escherichia coli[J]. ISME J, 2015, 9(4): 809–820. DOI: 10.1038/ismej.2014.176 |
| [10] | KEEN E C, ADHYA S L. Phage therapy: Current research and applications[J]. Clin Infect Dis, 2015, 61(1): 141–142. |
| [11] | JAMALLUDEEN N, JOHNSON R P, FRIENDSHIP R, et al. Isolation and characterization of nine bacteriophages that lyse O149 enterotoxigenic Escherichia coli[J]. Vet Microbiol, 2007, 124(1-2): 47–57. DOI: 10.1016/j.vetmic.2007.03.028 |
| [12] |
张倩, 于会举, 孙耀强, 等. 一株裂解性奶牛乳房炎源屎肠球菌噬菌体的分离及其生物学特性分析[J]. 畜牧兽医学报, 2017, 48(4): 706–713.
ZHANG Q, YU H J, SUN Y Q, et al. Isolation and characterization of a lytic phage infecting Enterococcus faecium of bovine mastitis[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(4): 706–713. (in Chinese) |
| [13] | HATFULL G F, HENDRIX R W. Bacteriophages and their genomes[J]. Curr Opin Virol, 2011, 1(4): 298–303. DOI: 10.1016/j.coviro.2011.06.009 |
| [14] |
李杨, 王静, 霍恺, 等. 大肠杆菌噬菌体的分离及生物学特性研究[J]. 中国畜牧兽医, 2014, 41(1): 7–10.
LI Y, WANG J, HUO K, et al. Isolation and characterization of bacteriophage of E. coli isolated from soil of chicken farm[J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(1): 7–10. (in Chinese) |
| [15] |
张培东, 孙岩, 任慧英, 等. 大肠杆菌噬菌体的分离及其生物学特性[J]. 中国兽医杂志, 2008, 44(4): 10–12.
ZHANG P D, SUN Y, REN H Y, et al. Isolation and characterization of E. coli bacteriophage[J]. Chinese Journal of Veterinary Medicine, 2008, 44(4): 10–12. (in Chinese) |
| [16] |
王冉, 韩晗, 张辉, 等. 大肠杆菌K88噬菌体的分离鉴定及其生物学特性[J]. 华北农学报, 2012, 27(4): 163–167.
WANG R, HAN H, ZHANG H, et al. Isolation and characterization of a lytic bacteriophage of enterotoxigenic Escherichia coli K88[J]. Acta Agriculturae Boreali-Sinica, 2012, 27(4): 163–167. (in Chinese) |
| [17] | BOURDIN G, SCHMITT B, GUY L M, et al. Amplification and purification of T4-like Escherichia coli phages for phage therapy: From laboratory to pilot scale[J]. Appl Environ Microbiol, 2014, 80(4): 1469–1476. DOI: 10.1128/AEM.03357-13 |
| [18] |
李灏, 谢慧君, 孔健, 等. 畜禽肠道致病菌噬菌体的生物学特性研究[J]. 微生物学通报, 2004, 31(2): 10–13.
LI H, XIE H J, KONG J, et al. Biological characterization of fowl intestinal bacteriophage[J]. Microbiology, 2004, 31(2): 10–13. (in Chinese) |
| [19] | YOUNG R, GILL J J, KONG J, et al. Phage therapy redux-What is to be done?[J]. Science, 2015, 350(6265): 1163–1164. DOI: 10.1126/science.aad6791 |



