2. 华中农业大学动物医学院农业微生物学国家重点实验室, 武汉 430070
2. The State Key Laboratory of Agricultural Microbiology, Huazhong Agricultural University, Wuhan 430070, China
猪圆环病毒2型(porcine circovirus type 2,PCV2)是一种危害养猪业较为严重的病原体,与断奶仔猪多系统衰竭综合征、猪呼吸道疾病综合征等多种疾病密切相关;隶属圆环病毒科(Circoviridae)圆环病毒属(Circovirius),直径约为17 nm,是目前已知的最小的动物病毒。PCV2感染引起机体出现持续感染和免疫抑制等症状,并易与其他病原体混合感染或诱发其他病原体的继发感染。
内质网作为蛋白质合成的主要场所,对蛋白质的翻译、修饰和折叠过程发挥重要作用,当外源或内源刺激导致内质网发生应激时,机体启动未折叠蛋白反应(unfolded protein response,UPR)以缓解内质网中积累的未折叠或错误折叠的蛋白造成的应激。其中类PKR内质网激酶(PKR-like eukaryotic initiation kinase,PERK)通路主要调控蛋白质翻译合成量。PERK具有丝/苏氨酸激酶活性,正常情况下,它以二聚体形式与内质网分子伴侣蛋白葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)结合处于未激活状态[1]。内质网应激发生后,PERK与GRP78解离后寡聚化并自身磷酸化,下游磷酸化激活真核起始因子2α(eukaryotic initiation factor 2α,eIF2α)的第51位丝氨酸,导致内质网内蛋白翻译合成量减少[2];分子伴侣蛋白P58IPK为HSP40家族成员,它在内质网应激中的转录调控受UPR中的另一通路——肌醇需酶1(inositol requiring enzyme 1,IRE1)通路激活[3],此外,因P58IPK的TPR6结构域与eIF2α具有同源性,故P58IPK还可抑制PERK激酶活性,负反馈调控PERK/eIF2α通路[4]。
已有报道PCV2感染不仅激活PERK/eIF2α通路以帮助其自身复制[5],而且还通过AMPK/ERK/TSC2/mTOR通路诱导细胞发生自噬以利自身复制增殖[6-7]。细胞自噬发生时,细胞质中的微管相关蛋白轻链3(light chain 3,LC3)被募集到自噬体膜和磷脂酰乙醇胺结合完成LC3的脂酰化(LC3-Ⅰ→LC3-Ⅱ),这一过程是自噬体形成的一个重要标志,由ATG5-ATG12复合体与ATG16L组成的泛素样蛋白系统协助完成,故LC3-Ⅱ被视为自噬体形成自噬发生的标志蛋白质。此外,LC3、ATG5及ATG12在低氧情况下受PERK/eIF2α通路调控[8]。故本试验主要通过抑制剂、RNAi和蛋白质免疫印迹研究PCV2感染激活的PERK/eIF2α通路与细胞自噬之间是否存在关联,及过表达分子伴侣蛋白P58IPK对其的影响,为进一步理解PCV2感染机制提供理论和试验依据。
1 材料与方法 1.1 病毒、载体与细胞PCV2-武汉株(PCV2-WuHan,GenBank No:FJ598044)和病毒绝对定量质粒T-PCV2由华中农业大学农业微生物国家重点实验室何启盖老师惠赠,效价为105 TCID50·mL-1。真核过表达载体pCMV-N-HA购自上海碧云天生物技术有限公司,TA克隆载体pMD19-T购自宝生物工程(大连)有限公司。猪肾上皮细胞(porcine kidney-15 cell line,PK-15)为本实验室保存,细胞生长于含10%胎牛血清的DMEM培养基中,5% CO2 37 ℃培养。
1.2 主要试剂与仪器高糖DMEM(Hyclone),DAPI(Sigma),Lipofectamine 2000(Invitrogen),SYBR Green Master Mix及ECL显色液(BioRad),快速型限制性内切酶FastDigest XbaⅠ及FastDigest EcoRⅠ(Thermo),总RNA提取试剂盒(Omega),第一链cDNA合成试剂盒(Thermo),普通琼脂糖凝胶DNA回收试剂盒及病毒基因组DNA/RNA提取试剂盒(北京天根生化科技有限公司),PERK抑制剂GSK2606414(Target Molecule)。p-eIF2α-S51抗体(ABclonal),P58IPK抗体(Genetex),LC3B及ATG12抗体(Cell Signaling Technology),PCV2抗体(VMRD),β-actin及辣根过氧化物(HPR)标记二抗(上海生工生物有限公司),荧光标记二抗(博士德)。
CFX96 Real-Time荧光定量PCR仪(BioRad),Western blot印迹转移电泳仪JY-ZY5(北京君意华鑫科技有限公司),ImageQuant LAS 4000化学发光成像分析仪(通用医疗集团生命科学部),LSM800共聚焦显微镜(卡尔蔡司)。
1.3 药物处理将1 mg GSK2606414粉末离心后,加入2.215 mL DMSO溶解,配制成浓度为1 mmol·L-1的储存液,处理前将1 mmol·L-1储存液用高糖DMEM稀释成1 μmol·L-1,并设置相同浓度的DMSO对照,同时加入待处理的PK-15细胞,处理1 h后,再以MOI≈1进行PCV2感染,设置空白对照与阴性对照,收集感染24 h后的蛋白质样本。
1.4 猪P58IPK真核过表达载体的构建根据猪P58IPK基因的mRNA序列(NM_001190184.1)设计特异性引物,引物序列如下,P58IPK-F:5′-cgGAATTCATGGTGGCCCCCGGC-3′;P58IPK-R:5′-gcTCTAGACTAATTGAAGTGGAATTTGAAGCG-3′,上下游引物分别引入EcoRⅠ和XbaⅠ酶切位点及保护性碱基。提取PK-15细胞的总RNA并反转录成cDNA,利用上述引物扩增目的片段(预期PCR产物1 534 bp),通过琼脂糖凝胶电泳及胶回收猪P58IPK基因目的条带,再连接至pMD19-T载体克隆为pMD19-T-P58IPK,酶切后获得两端分别含有EcoRⅠ和XbaⅠ酶切位点的P58IPK基因目的片段,插入同样经过EcoRⅠ和XbaⅠ酶切的pCMV-N-HA载体中,构建pCMV-HA-P58IPK融合表达质粒。
1.5 siRNA及质粒转染根据GenBank中公布的猪PERK基因mRNA序列(XM_003124925.3),由苏州吉玛设计并合成siRNA,序列见表 1。siRNA及质粒转染操作参考Lipofectamin 2000说明书,向汇合度达70%左右的6孔板中的PK-15细胞进行转染,分别设置非特异性siRNA(siNC)和PERK特异性siRNA(siPERK)三条干扰片段的混合转染,或4 μg pCMV-HA-P58IPK的转染,24 h后进行PCV2感染(MOI≈1),收集感染24 h后的RNA及蛋白质样本。
|
|
表 1 PERK特异性siRNA序列 Table 1 PERK specific siRNA sequence |
相对定量PCR:根据Omega总RNA提取试剂盒说明书进行RNA提取,测定RNA浓度,根据Thermo第一链cDNA合成试剂盒说明书将1 μg总RNA利用oligo(dT)18引物进行反转录(20 μL体系)。所得cDNA样本参考BioRad SYBR Green Master Mix推荐qPCR体系进行扩增,引物见表 2,每个样本设置3个复孔。三步法扩增反应qPCR程序:预变性95 ℃ 4 min,循环反应为变性95 ℃ 5 s,退火60 ℃ 20 s,延伸72 ℃ 20 s,并收集荧光信号,共进行40个循环,最后延伸72 ℃ 2 min。65~95 ℃升温,升温速度0.1 ℃·s-1以检测熔解曲线。目的基因的相对转录量按照2-ΔΔCt进行计算。
|
|
表 2 荧光定量PCR引物 Table 2 Real-time PCR primers |
PCV2的绝对定量PCR:反复冻融收集病毒液,根据天根病毒基因组DNA/RNA提取试剂盒说明书进行病毒DNA提取,所得DNA与101~109 copies·μL-1的T-PCV2共同进行定量PCR,PCR体系参照相对定量PCR,PCV2定量引物退火温度为56.9 ℃。通过绘制标准曲线计算PCV2拷贝数。
1.7 蛋白质免疫印迹按20 μg的蛋白质上样量进行SDS-PAGE凝胶电泳,100 V恒压转膜1 h,5%脱脂奶粉室温封闭2 h,分别加入p-eIF2α抗体(1:1 000)、LC3B抗体(1:1000)、ATG12抗体(1:1 000)、P58IPK(1:1 000)、β-actin单克隆抗体(1:3 000),4 ℃孵育过夜,洗膜后加入抗兔或抗鼠的HPR标记二抗(1:3 000),室温孵育2 h,洗膜后加入ECL显色液,利用化学发光成像分析仪成像,并用ImageJ图像分析软件分析灰度值。
1.8 免疫荧光试验将PK-15细胞接种于铺有玻片的细胞培养板中,做相应处理后,用4%多聚甲醛室温固定5 min,0.1%TrritonX-100透化10 min,并用5% BSA室温封闭1 h,加入相应一抗4 ℃孵育过夜,PBST清洗后,加入对应荧光二抗室温孵育2 h,PBST清洗后,DAPI染色10 min,封片后至激光共聚焦显微镜下观察。
1.9 数据分析应用SPSS 16.0软件进行分析,所有数据以平均数±标准差(x±s)表示,采样独立样本T检验进行显著性分析。P < 0.05为具有统计学意义,P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果 2.1 PCV2感染PK-15细胞诱导磷酸化eIF2α(p-eIF2α)及LC3-Ⅱ表达PCV2感染PK-15细胞后诱导磷酸化eIF2α(p-eIF2α)和LC3-Ⅱ的蛋白质表达(图 1),p-eIF2α的表达水平在感染后12、24、36、48 h极显著升高(P < 0.01),在36 h达到峰值。LC3-Ⅱ的表达水平在感染后12、24、36、48 h极显著升高(P < 0.01),其中以24 h表达水平最高。同时,PCV2感染诱导LC3-Ⅱ在细胞质中呈点状分布,但未与PCV2有明显共定位(图 2)。
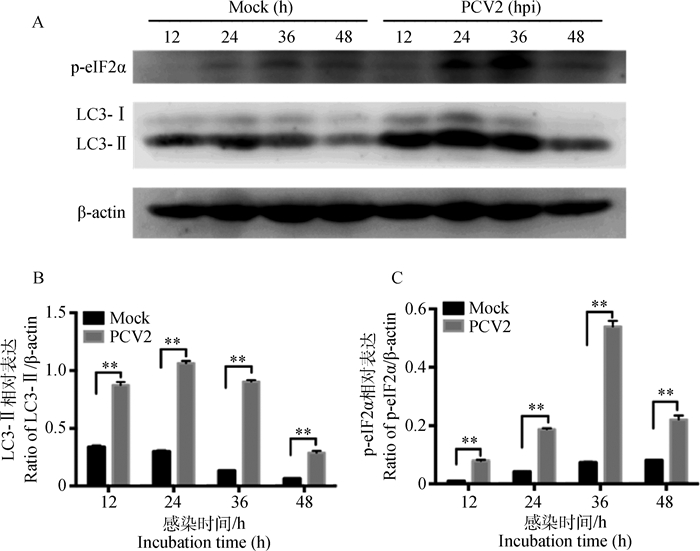
|
A.磷酸化eIF2α(p-eIF2α)及LC3-Ⅱ免疫印迹结果;B、C. LC3-Ⅱ及p-eIF2α蛋白质相对表达量分析结果;**.P < 0.01;hpi.感染后时间(h) A. Western blot results of phosphorylated eIF2α (p-eIF2α) and LC3-Ⅱ; B, C. Analysis of relative protein expression of LC3-Ⅱ and p-eIF2α; **. P < 0.01; hpi. Hours post infection 图 1 PCV2感染PK-15细胞诱导eIF2α磷酸化及LC3-Ⅱ表达 Figure 1 PCV2 infection induced eIF2α phosphorylation and LC3-Ⅱ expression in PK-15 cells |
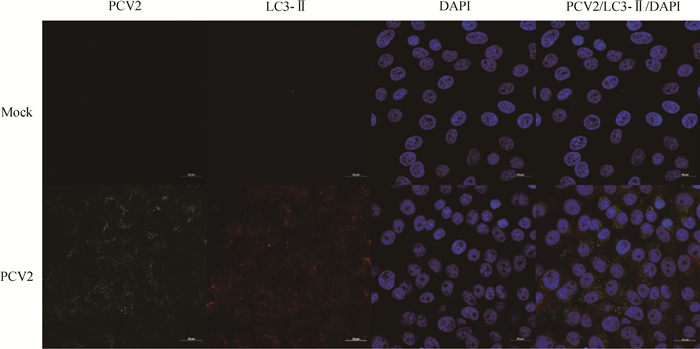
|
图 2 PCV2感染PK-15细胞诱导LC3-Ⅱ点状分布 Figure 2 PCV2 infection induced LC3-Ⅱ dots-liked expression in PK-15 cells |
PERK特异性抑制剂GSK2606414处理后可极显著抑制PCV2感染24 h后的p-eIF2α(P < 0.01)及LC3-Ⅱ表达(P < 0.01)(图 3)。
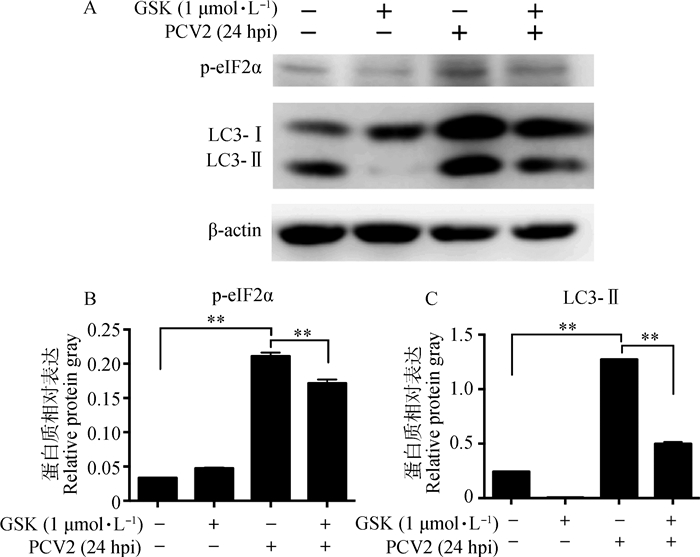
|
A.磷酸化eIF2α(p-eIF2α)和LC3-Ⅱ免疫印迹结果;B、C. p-eIF2α和LC3-Ⅱ相对β-actin表达量分析结果;**.P < 0.01;hpi.感染后时间(h) A. Western blot results of phosphorylated eIF2α (p-eIF2α) and LC3-Ⅱ; B, C. Analysis of relative protein expression of p-eIF2α and LC3-Ⅱ against β-actin; **. P < 0.01; hpi. Hours post infection 图 3 GSK2606414抑制PERK下调PCV2感染PK-15细胞诱导的p-eIF2α及LC3-Ⅱ表达 Figure 3 Inhibition of PERK by GSK2606414 downregulating p-eIF2α and LC3-Ⅱ expression in PCV2-infected PK-15 cells |
PERK特异性siRNA的干扰效率及其对PCV2诱导的ATG12转录水平的影响(图 4)。PCV2感染后,PERK mRNA水平受PERK特异性siRNA干扰极显著下调(P < 0.01),显示siRNA干扰效率可达94.41%。ATG12 mRNA水平则在PERK被干扰后极显著下降(P < 0.01)。
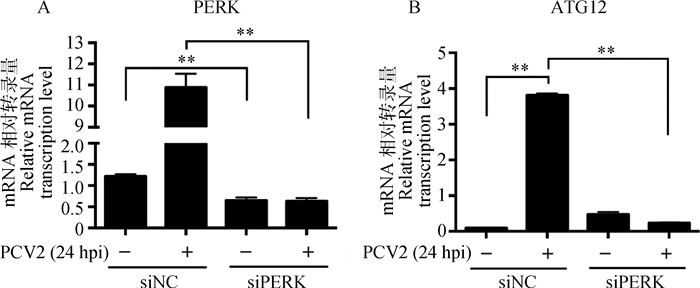
|
A. qPCR检测PERK干扰效率; B. ATG12相对转录量结果; **.P < 0.01;hpi.感染后时间(h) A. Analysis of PERK interfering efficiency; B. Relative transcription of ATG12 via qPCR; **. P < 0.01; hpi. Hours post infection 图 4 干扰PERK下调PCV2感染PK-15细胞诱导ATG12转录 Figure 4 Interference of PERK downregulated ATG12 transcription in PCV2-infected PK-15 cells |
利用siRNA干扰PERK表达对PCV2诱导的p-eIF2α、ATG5-ATG12及LC3-Ⅱ的蛋白质表达的影响(图 5)。PERK特异性siRNA干扰可极显著下调PCV2感染24 h诱导的p-eIF2α(P < 0.01),ATG5-ATG12(P < 0.01)及LC3-Ⅱ(P < 0.01)的表达。
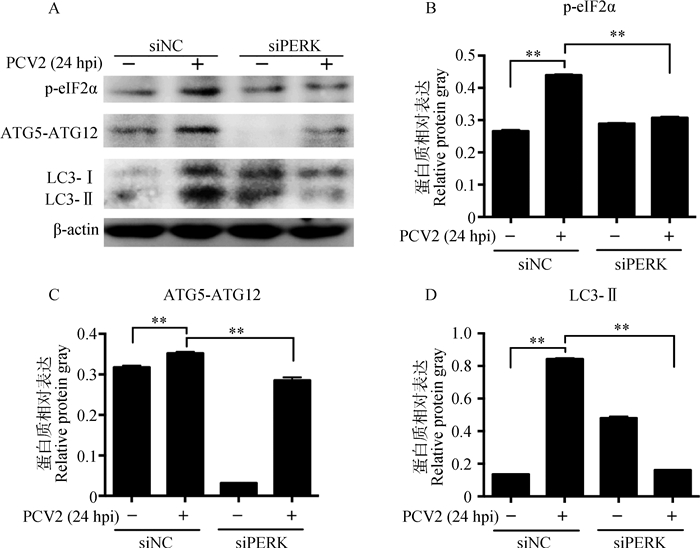
|
A. p-eIF2α、ATG5-ATG12及LC3-Ⅱ免疫印迹结果;B~D. p-eIF2α、ATG5-ATG12及LC3-Ⅱ相对β-actin表达量分析结果;**.P < 0.01;hpi.感染后时间(h) A. Western blot results of p-eIF2α, ATG5-ATG12 and LC3-Ⅱ; B-D. Analysis of relative protein expression of p-eIF2α, ATG5-ATG12 and LC3-Ⅱ against β-actin; **. P < 0.01; hpi. Hours post infection 图 5 干扰PERK下调PCV2感染PK-15细胞诱导p-eIF2α及自噬相关蛋白表达 Figure 5 Interference of PERK downregulated p-eIF2α and autophagy-related protein expression in PCV2-infected PK-15 cells |
1%琼脂糖凝胶电泳检测猪P58IPK CDS全长的扩增,可见大小约为1 534 bp的目的条带。酶切pCMV-HA-P58IPK融合表达质粒的结果与预期相符(图 6)。
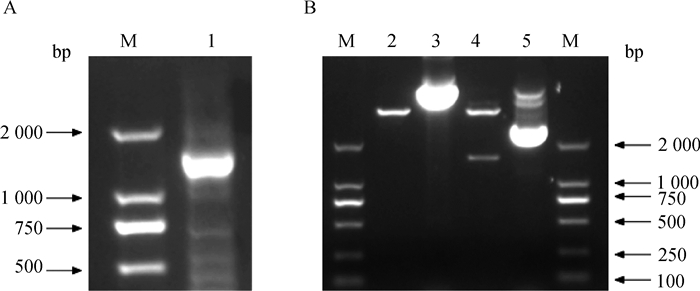
|
M. DL2000 DNA相对分子质量标准;1. P58IPK扩增片段;2. EcoRⅠ+XbaⅠ双酶切pCMV-N-HA;3. pCMV-N-HA; 4. EcoRⅠ+XbaⅠ双酶切pCMV-HA-P58IPK;5. pCMV-HA-P58IPK M. DL2000 DNA marker; 1. P58IPK gene fragment; 2. pCMV-N-HA/EcoRⅠ+XbaⅠ; 3. pCMV-N-HA; 4. pCMV-HA-P58IPK/EcoRⅠ+XbaⅠ; 5. pCMV-HA-P58IPK 图 6 猪P58IPK基因的PCR扩增(A)及pCMV-HA-P58IPK的酶切鉴定(B) Figure 6 Amplification of porcine P58IPK gene by PCR (A) and identification of pCMV-HA-P58IPK with restriction enzymes (B) |
免疫印迹结果(图 7)显示,转染pCMV-HA-P58IPK在PCV2感染前后均能极显著提高P58IPK蛋白水平表达(P < 0.01)。
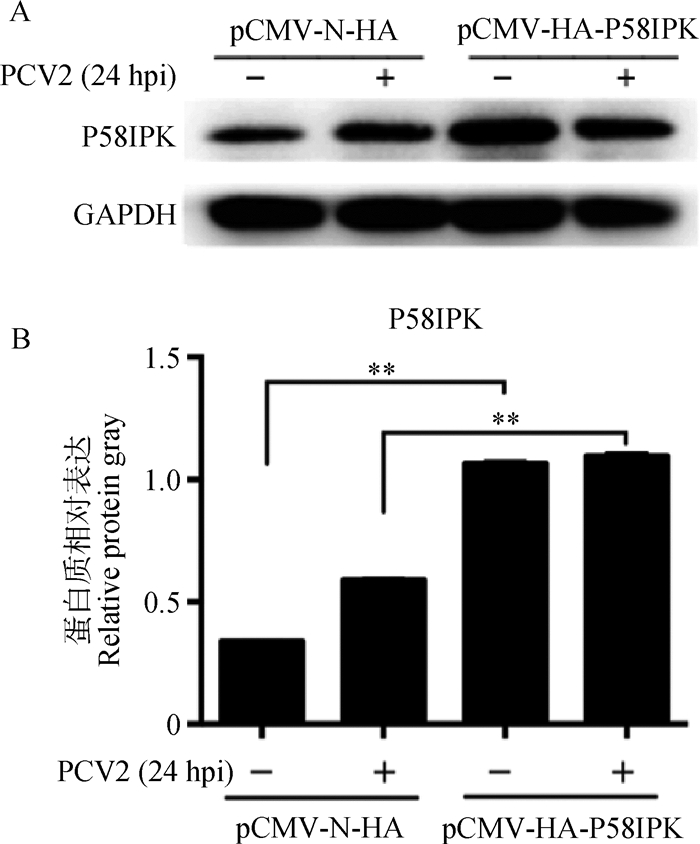
|
A. P58IPK免疫印迹结果;B. P58IPK相对GAPDH表达量分析结果;**.P < 0.01;hpi.感染后时间(h) A. Result of P58IPK western blot; B. Analysis of relative protein expression of P58IPK against GAPDH; **. P < 0.01; hpi. Hours post infection 图 7 转染pCMV-HA-P58IPK上调P58IPK蛋白表达 Figure 7 Upregulation of P58IPK protein expression by pCMV-HA-P58IPK transfection |
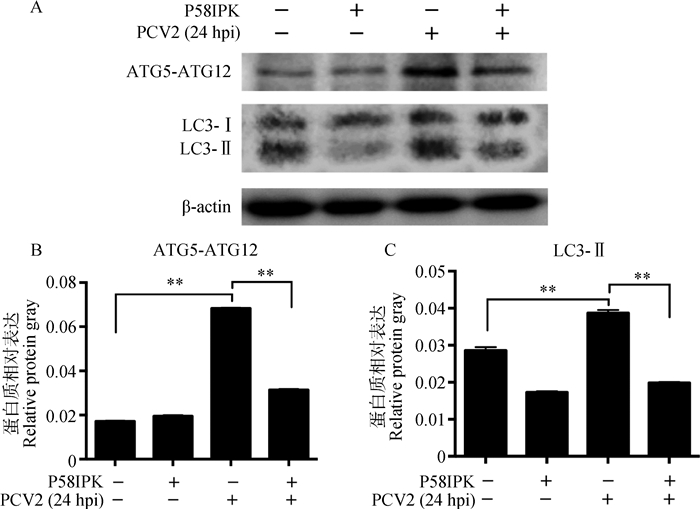
过表达P58IPK能极显著抑制PCV2感染诱导的p-eIF2α的表达(P < 0.01)(图 8)。同时,过表达P58IPK极显著下调PCV2感染诱导的ATG5-ATG12(P < 0.01)及LC3-Ⅱ(P < 0.01)的表达(图 9)。
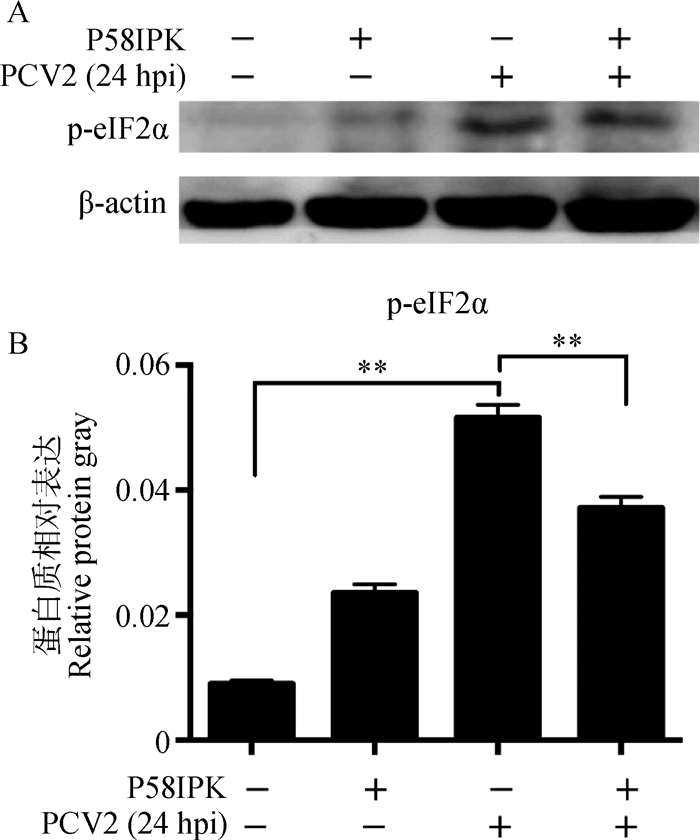
|
A. p-eIF2α免疫印迹结果;B. p-eIF2α相对β-actin表达量分析结果;**.P < 0.01;hpi.感染后时间(h) A. Result of p-eIF2α Western blot; B. Analysis of relative protein expression of p-eIF2α against β-actin; **. P < 0.01; hpi. Hours post infection 图 8 过表达P58IPK下调PCV2感染PK-15细胞诱导的p-eIF2α蛋白表达 Figure 8 Overexpression of P58IPK downregulated eIF2α phosphorylation level in PCV2-infected PK-15 cells |
|
A. ATG5-ATG12和LC3-Ⅱ的免疫印迹结果;B、C. ATG5-ATG12和LC3-Ⅱ相对β-actin表达量分析结果;**.P < 0.01;hpi.感染后时间(h) A. Western blot results of ATG5-ATG12 and LC3-Ⅱ; B, C. Analysis of relative protein expression of ATG5-ATG12 and LC3-Ⅱagainst β-actin; **. P < 0.01; hpi. Hours post infection 图 9 过表达P58IPK下调PCV2感染PK-15细胞诱导的ATG5-ATG12及LC3-Ⅱ表达 Figure 9 Overexpression of P58IPK downregulated ATG5-ATG12 and LC3-Ⅱ expression in PCV2-infected PK-15 cells |
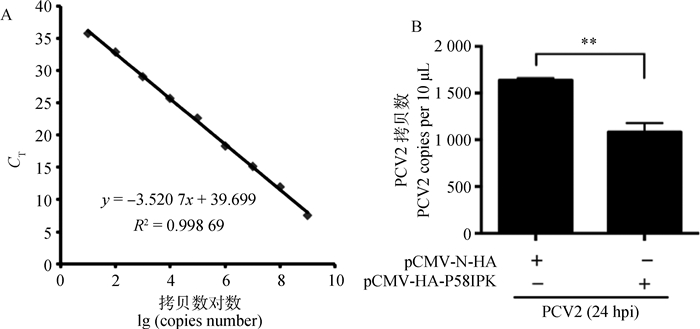
过表达P58IPK能极显著下调PCV2在PK-15细胞中的拷贝数(P < 0.01)(图 10),表明其能抑制PCV2复制。
|
A. PCV2绝对定量标准曲线;B.过表达P58IPK后PCV2拷贝数定量结果;**.P < 0.01;hpi.感染后时间(h) A. PCV2 absolute qPCR standard curve; B. qPCR result of PCV2 copies number after P58IPK overexpression; **. P < 0.01; hpi. Hours post infection 图 10 过表达P58IPK下调PCV2拷贝数 Figure 10 Overexpression of P58IPK downregulated PCV2 copies number |
病毒感染常引起内质网应激(ER stress),并诱导未折叠蛋白反应(UPR),而PERK/eIF2α通路作为控制蛋白合成的最重要的一条UPR通路,可被DNA病毒如人类单纯疱疹病毒1(human simplex virus 1,HSV1)、巨细胞病毒(cytomegalovirus,CMV)、RNA病毒如丙型肝炎病毒(hepatitis C virus,HCV)在内的多种病毒激活[9-11]。近年来,许多研究表明,PERK/eIF2α通路在许多情况下与细胞自噬有关。如多聚谷氨酸盐72(polyQ72)诱导内质网应激后,通过激活PERK/eIF2α通路诱导ATG5-ATG12-ATG16复合体依赖的LC3转换,从而诱导自噬[12]。蓝舌病毒(bluetongue virus,BTV)感染激活的PERK/eIF2α通路可介导自噬发生,并且可以帮助BTV复制[13]。在心肌细胞中应用葡萄糖剥夺模型后,NAPDH氧化酶Nox4表达上调并在内质网中诱导活性氧(reactive oxygen species,ROS)产生,ROS则抑制脯氨酰羟化酶4(prolyl hydroxylase 4,PHD4)活性,激活PERK/eIF2α通路,最终诱导自噬[14]。
PCV2可以通过诱导内质网应激使内质网内Ca2+外流至细胞质,上调细胞质Ca2+浓度以激活CaMKKβ/CaMKⅠ/WIPI1通路诱导自噬[15],CaMKKβ同样可以激活AMPK/ERK/TSC2/mTOR通路诱导自噬。本研究发现PCV2感染诱导内质网应激后,激活UPR中的PERK/eIF2α通路,经由ATG12转录及ATG5-ATG12复合体形成调控细胞自噬的水平,显示PERK通路亦在自噬体形成阶段有调控作用。此外,PERK也能通过激活LKB1/AMPK/TSC2通路以抑制mTORC1从而诱导自噬[16],表明PERK可能也在自噬起始阶段发挥作用,然而PCV2激活的PERK通路是否通过LKB1介导自噬尚未知。
内质网不仅是蛋白质合成和Ca2+储存的主要场所,还是自噬体膜的来源之一[17]。故此,不难理解为何诸多病毒可同时诱导内质网应激和细胞自噬,并且在长期的选择压力下进化出利用这两个宿主维持细胞稳态的机制以易化病毒自身的复制。如猪繁殖呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)及猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)都可以通过诱导细胞自噬以利其自身复制,并且PRRSV利用自噬体作为其复制场所[18-19]。与此类似,HCV通过UPR通路诱导自噬,并且自噬有利于HCV复制[20],而抑制UPR通路后HCV的复制和其所诱导的自噬都受到影响[21]。
然而,内质网中同样存在大量分子伴侣蛋白辅助蛋白质折叠,并且参与内质网应激的信号转导[22-23]。本研究发现过表达P58IPK能够通过抑制PERK/eIF2α通路降低PCV2诱导的细胞自噬水平,因PERK/eIF2α通路及细胞自噬都有利于PCV2的复制增殖,过表达P58IPK还能进一步抑制PCV2复制,使其拷贝数降低。
4 结论猪圆环病毒2型感染PK-15通过PERK/eIF2α通路诱导细胞自噬,过表达P58IPK通过抑制PERK通路抑制PCV2诱导的细胞自噬,从而抑制病毒复制。
| [1] | HARDING H P, ZHANG Y H, BERTOLOTTI A, et al. Perk is essential for translational regulation and cell survival during the unfolded protein response[J]. Mol Cell, 2000, 5(5): 897–904. DOI: 10.1016/S1097-2765(00)80330-5 |
| [2] | LEE A H, IWAKOSHI N N, ANDERSON K C, et al. Proteasome inhibitors disrupt the unfolded protein response in myeloma cells[J]. Proc Natl Acad Sci U S A, 2003, 100(17): 9946–9951. DOI: 10.1073/pnas.1334037100 |
| [3] | SHEN X H, ELLIS R E, LEE K, et al. Complementary signaling pathways regulate the unfolded protein response and are required for C. elegans development[J]. Cell, 2001, 107(7): 893–903. DOI: 10.1016/S0092-8674(01)00612-2 |
| [4] | MELVILLE M W, KATZE M G, TAN S L. P58IPK, a novel cochaperone containing tetratricopeptide repeats and a J-domain with oncogenic potential[J]. Cell Mol Life Sci, 2000, 57(2): 311–322. DOI: 10.1007/PL00000692 |
| [5] | ZHOU Y S, QI B Z, GU Y X, et al. Porcine circovirus 2 deploys PERK pathway and GRP78 for Its enhanced replication in PK-15 cells[J]. Viruses, 2016, 8(2): 56. DOI: 10.3390/v8020056 |
| [6] | ZHU B L, XU F, LI J, et al. Porcine circovirus type 2 explores the autophagic machinery for replication in PK-15 cells[J]. Virus Res, 2012, 163(2): 476–485. DOI: 10.1016/j.virusres.2011.11.012 |
| [7] | ZHU B L, ZHOU Y S, XU F, et al. Porcine circovirus type 2 induces autophagy via the AMPK/ERK/TSC2/mTOR signaling pathway in PK-15 cells[J]. J Virol, 2012, 86(22): 12003–12012. DOI: 10.1128/JVI.01434-12 |
| [8] | ROUSCHOP K M A, VAN DEN BEUCKEN T, DUBOIS L, et al. The unfolded protein response protects human tumor cells during hypoxia through regulation of the autophagy genes MAP1LC3B and ATG5[J]. J Clin Invest, 2010, 120(1): 127–141. DOI: 10.1172/JCI40027 |
| [9] | ORVEDAHL A, ALEXANDER D, TALLÓCZY Z, et al. HSV-1 ICP34.5 confers neurovirulence by targeting the Beclin 1 autophagy protein[J]. Cell Host Microbe, 2007, 1(1): 23–25. DOI: 10.1016/j.chom.2006.12.001 |
| [10] | TIROSH B, IWAKOSHI N N, LILLEY B N, et al. Human cytomegalovirus protein US11 provokes an unfolded protein response that may facilitate the degradation of class I Major histocompatibility complex products[J]. J Virol, 2005, 79(5): 2768–2779. DOI: 10.1128/JVI.79.5.2768-2779.2005 |
| [11] | PAVIO N, ROMANO P R, GRACZYK T M, et al. Protein synthesis and endoplasmic reticulum stress can be modulated by the hepatitis C virus envelope protein E2 through the eukaryotic initiation factor 2α kinase PERK[J]. J Virol, 2003, 77(6): 3578–3585. DOI: 10.1128/JVI.77.6.3578-3585.2003 |
| [12] | KOUROKU Y, FUJITA E, TANIDA I, et al. ER stress (PERK/eIF2α phosphorylation) mediates the polyglutamine-induced LC3 conversion, an essential step for autophagy formation[J]. Cell Death Differ, 2007, 14(2): 230–239. DOI: 10.1038/sj.cdd.4401984 |
| [13] | LV S, SUN E C, XU Q Y, et al. Endoplasmic reticulum stress-mediated autophagy contributes to bluetongue virus infection via the PERK-eIF2α pathway[J]. Biochem Biophys Res Commun, 2015, 466(3): 406–412. DOI: 10.1016/j.bbrc.2015.09.039 |
| [14] | SCIARRETTA S, ZHAI P Y, SHAO D, et al. Activation of Nox4 in the endoplasmic reticulum promotes cardiomyocyte autophagy and survival during energy stress through the PERK/eIF-2α/ATF4 pathway[J]. Circ Res, 2013, 113(11): 1253–1264. DOI: 10.1161/CIRCRESAHA.113.301787 |
| [15] | GU Y X, QI B Z, ZHOU Y S, et al. Porcine circovirus Type 2 activates CaMMKβ to initiate autophagy in PK-15 cells by increasing cytosolic calcium[J]. Viruses, 2016, 8(5): 135. DOI: 10.3390/v8050135 |
| [16] | AVIVAR-VALDERAS A, BOBROVNIKOVA-MARJON E, DIEHL J A, et al. Regulation of autophagy during ECM detachment is linked to a selective inhibition of mTORC1 by PERK[J]. Oncogene, 2012, 32(41): 4932–4940. |
| [17] | SCOTT R C, SCHULDINER O, NEUFELD T P. Role and regulation of starvation-induced autophagy in the Drosophila fat body[J]. Dev Cell, 2004, 7(2): 167–178. DOI: 10.1016/j.devcel.2004.07.009 |
| [18] | SUN M X, HUANG L, WANG R, et al. Porcine reproductive and respiratory syndrome virus induces autophagy to promote virus replication[J]. Autophagy, 2012, 8(10): 1434–1447. DOI: 10.4161/auto.21159 |
| [19] | GUO X Z, ZHANG M J, ZHANG X Q, et al. Porcine epidemic diarrhea virus induces autophagy to benefit its replication[J]. Viruses, 2017, 9(3): 53. DOI: 10.3390/v9030053 |
| [20] | SIR D, CHEN W L, CHOI J, et al. Induction of incomplete autophagic response by hepatitis C virus via the unfolded protein response[J]. Hepatology, 2008, 48(4): 1054–1061. DOI: 10.1002/hep.22464 |
| [21] | KE P Y, CHEN S S L. Autophagy:a novel guardian of HCV against innate immune response[J]. Autophagy, 2011, 7(5): 533–535. DOI: 10.4161/auto.7.5.14732 |
| [22] | BANDO Y, KATAYAMA T, KASAI K, et al. GRP94(94 kDa glucose-regulated protein) suppresses ischemic neuronal cell death against ischemia/reperfusion injury[J]. Eur J Neurosci, 2003, 18(4): 829–840. DOI: 10.1046/j.1460-9568.2003.02818.x |
| [23] | LEE A S. GRP78 induction in cancer:therapeutic and prognostic implications[J]. Cancer Res, 2007, 67(8): 3496–3499. DOI: 10.1158/0008-5472.CAN-07-0325 |



