2. 四川省畜牧总站, 成都 610041
2. Sichuan Provincial General Station for Animal Husbandry, Chengdu 610041, China
肌肉和脂肪组织占畜禽动物胴体重的70%~80%,是重要的经济性状。肌肉生长和脂肪沉积在动物体内始终处于动态平衡,因动物的种类、年龄、性别和营养状况的不同而存在差异,需要通过一系列的代谢调控过程来实现,尤其是一些关键酶的催化作用。比如ADIPOR1和ADIPOR2在脂质和能量代谢及胰岛素敏感性调节的生物学过程中发挥重要作用,其基因表达量与肥胖指数和肌内脂肪含量呈负相关[1];LPL是一种脂肪分解酶,可分解甘油三酯为甘油和脂肪酸,对脂类运输和代谢具有重要的调控作用[2];FTO已证实与人类肥胖相关,在食物摄入、能量代谢和Ⅱ型糖尿病等方面发挥重要的调控作用[3];UCP2基因的过表达能上调解偶联作用,导致基础能量代谢增强,其表达产物可通过调控脂肪酸合成酶FASN来调节脂质合成[4];MYOG基因是骨骼肌细胞发育与生长过程的关键调控因子,在骨骼肌卫星细胞向成熟肌细胞分化、融合过程中起着中心正调控的作用[5];IGF1基因可促进养分的吸收,刺激肌卫星细胞的增殖和肌肉的再生长,加速肌肉中蛋白质的合成[6];MSTN基因是骨骼肌生长和发育的负调控因子,能够抑制肌细胞的形成和分化,阻碍骨骼肌的生长和发育,其突变或缺失能促进肌细胞和肌纤维的增殖和肥大[7]。研究表明,营养调控是一种有效改善生长性能和胴体组成的方法[8-10]。J. I. Baum等[11]研究指出,高蛋白质饮食可刺激肌肉蛋白质合成来促进肌肉生长。T.B.Symons等[12]研究表明,营养调控可增加猪肌内脂肪的含量。M.Katsumata[13]对长白×杜洛克杂交猪的研究显示,低蛋白日粮会显著提高肌内脂肪含量和背膘厚。高琴等[14]研究指出,高蛋白饲粮促进肉兔骨骼肌发育可能与IGF1、MYOD和MYF5基因高表达有关,低蛋白饲粮抑制骨骼肌发育可能与IGF1基因低表达有关。杨明华等[15]研究显示,高蛋白质水平降低肝脂肪酸合成代谢基因(SREBP1c、ACC、FAS)的表达,提升脂肪酸氧化分解代谢基因(CPT1、PPARα)的表达,导致乌金猪体脂沉积减少。虽然上述研究从表型和分子水平上探讨了饲粮蛋白质水平对脂肪和肌肉的影响,但针对猪脂肪和肌肉的系统研究还比较缺乏。
荣昌猪是世界八大优良猪种之一,主产于重庆荣昌,具有耐粗饲、适应力强、肉质优良等特点,但其生长速率慢、瘦肉率低[16]。目前,日粮不同蛋白水平对荣昌猪肌肉生长和脂肪沉积的影响及其相关分子表达的研究还未见报道。因此,为了更好的开发荣昌猪种质资源,本试验以荣昌猪为对象,研究不同蛋白水平日粮对荣昌猪脂肪细胞和肌纤维发育及相关分子表达的影响,为阐明日粮蛋白质水平对荣昌猪肌肉生长和脂肪沉积影响的分子机制奠定前期理论基础,以期通过营养调控来改善荣昌猪的肌肉生长和脂肪沉积过程,从而为生产实践中提高荣昌猪的生长性能提供理论依据,并为探索适宜荣昌猪生长的蛋白营养需要和制订相应营养标准提供部分参考依据。
1 材料与方法 1.1 试验动物与日粮选取24头体重接近、健康的荣昌母猪,在育肥阶段随机分为2组,每组3个重复,每个重复4头猪,在相同条件下饲养,自由采食、饮水,试验期为180 d。按照《猪饲养标准》[17](2004)和NRC[18](1998)猪营养需要量设计低(LP)、高蛋白(HP)水平的2种试验日粮。日粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平 Table 1 Composition and nutrient levels of dietary |
试验结束后,所有猪禁食24 h,按照标准流程进行屠宰。屠宰后,立即采集背最长肌和背部皮下深层脂肪,一部分组织使用10%的甲醛进行固定,另一部分放入液氮速冻后,带回实验室于-80 ℃保存备用。
1.3 表型指标测定 1.3.1 生产性能试验开始和结束时,对试验猪供水、禁食24 h称重,统计饲料消耗总量,计算平均日增重、日采食量和料重比。
1.3.2 屠宰性能胴体重(kg):屠宰后,去除头、蹄、尾、内脏,称量左侧半片胴体重量(包括肾和板油);瘦肉率(%):肌肉重量(kg)/胴体重量(kg)×100%;脂肪率(%):脂肪重量(kg)/胴体重量(kg)×100%;眼肌面积(cm2):眼肌长度(cm)×眼肌高度(cm)×0.7;背膘厚(mm):游标卡尺测定倒数3~4肋间,背部中线皮下脂肪厚度。
1.3.3 脂肪细胞体积和肌纤维横截面面积脂肪细胞体积和肌纤维横截面面积的测定采用经典苏木精&伊红(H&E)染色法。脂肪细胞的平均直径取100个细胞的最大值和最小值的几何平均值,按如下公式计算脂肪细胞体积:π/6 Σfi Di3/Σ/fi,其中,Di为平均直径,fi为脂肪细胞数目。肌纤维横截面面积是通过随机取100根肌纤维的平均直径来进行计算。
1.4 总RNA和DNA的提取按照说明书对样品组织总RNA进行提取(TRIzol,Invitrogen)和纯化(Rneasy柱,Qiagen)。使用Bioanalyzer 2100 (Agilent Technologies)对总RNA完整性和浓度进行分析,达到要求后方能进行后续操作。遵照DNeasy血液&组织试剂盒(Qiagen)说明书对DNA进行提取。
1.5 qRT-PCR定量参照前人的报道[19]使用qRT-PCR法定量分析mRNA相对表达水平和线粒体DNA拷贝数。猪基因GAPDH和单拷贝核DNA基因GCG分别作为mRNA和线粒体DNA拷贝数定量的内参基因。基因的定量采用2-ΔΔCt法进行计算。每个二倍体核基因组mtDNA的拷贝数=2×线粒体DNA特异基因拷贝数/核基因拷贝数。所有qRT-PCR定量反应均设置3个生物学重复和阴性对照(无模板)。qRT-PCR定量分析引物序列见表 2。
|
|
表 2 qRT-PCR定量分析引物序列 Table 2 Primer sequences used for qRT-PCR |
数据统计使用软件SPSS 21.0(IBM, NY, USA)进行Student’s t检验。*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01),ns表示差异不显著(P>0.05)。数据均以“平均值±标准差”表示。
2 结果 2.1 饲粮蛋白水平对荣昌猪生产性能的影响由表 3可知,低、高蛋白组猪始重、平均日采食量和料重比差异不显著(P>0.05);高蛋白组猪末重和平均日增重显著高于低蛋白组(P < 0.05)。
|
|
表 3 不同饲粮蛋白水平对荣昌猪生产性能的影响 Table 3 Effect of protein level in diet on growth performance of Rongchang pigs |
由表 4可知,荣昌猪经低、高蛋白日粮饲喂后,后者背膘厚显著高于前者(P < 0.05);胴体重和脂肪率极显著高于前者(P < 0.01);瘦肉率和眼肌面积在两者之间无统计学差异(P>0.05)。
|
|
表 4 不同饲粮蛋白水平对荣昌猪屠宰性状的影响 Table 4 Effect of protein level in diet on carcass traits of Rongchang pigs |
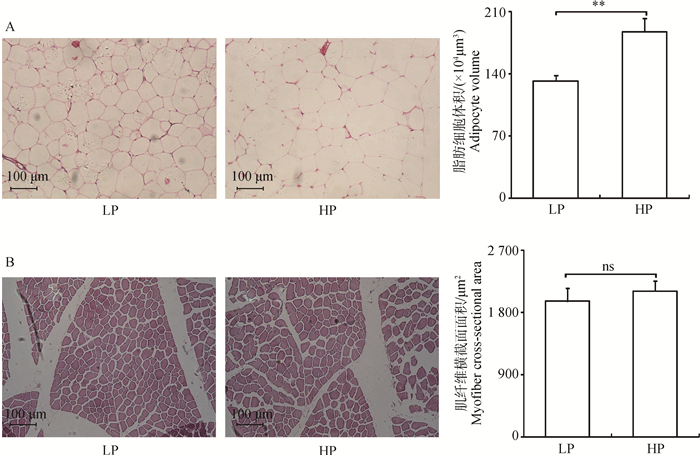
如图 1所示,对脂肪和肌肉组织的石蜡切片进行H&E染色后,可观察到细胞完整的组织学结构,细胞轮廓清晰且透光性较好,表明图像符合定量分析的要求。对切片图像进行统计分析后可知,高蛋白组的脂肪细胞体积极显著大于低蛋白组(P < 0.01),两者肌纤维横截面面积无统计学差异(P>0.05)。
|
图 1 不同饲粮蛋白水平对荣昌猪脂肪细胞(A)和肌纤维(B)的影响 Figure 1 Effect of protein level in diet on adipocyte (A) and myofiber (B) of Rongchang pigs |
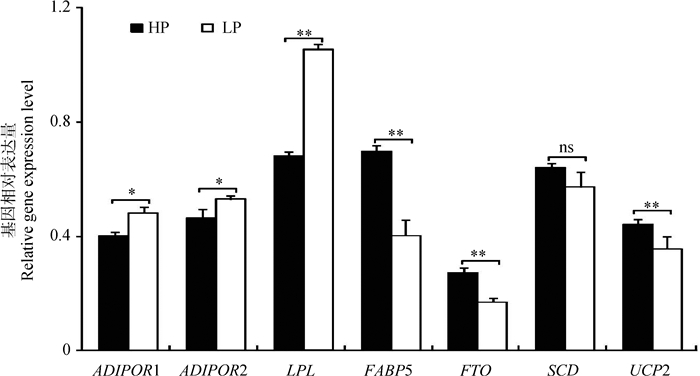
如图 2所示,与低蛋白组相比,高蛋白组促进脂质降解基因ADIPOR1和ADIPOR2的表达量显著降低(P < 0.05),基因LPL的表达量极显著降低(P < 0.01);促进脂质生成的基因FABP5、FTO和UCP2的表达量极显著升高(P < 0.01),基因SCD的表达量无统计学差异(P>0.05)。
|
图 2 不同饲粮蛋白水平对荣昌猪脂肪细胞发育基因的影响 Figure 2 Effect of protein level in diet on adipocyte development genes of Rongchang pigs |
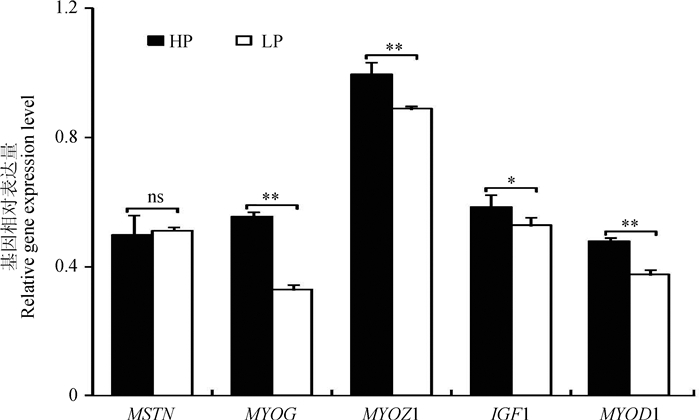
如图 3所示,与低蛋白组相比,高蛋白组抑制肌肉生长基因MSTN的表达量变化不显著(P>0.05);促进肌肉生长基因MYOG、MYOZ1和MYOD1的表达量极显著升高(P < 0.01),基因IGF1的表达量显著升高(P < 0.05)。
|
图 3 不同饲粮蛋白水平对荣昌猪肌纤维发育基因的影响 Figure 3 Effect of protein level in diet on myofiber development genes of Rongchang pigs |
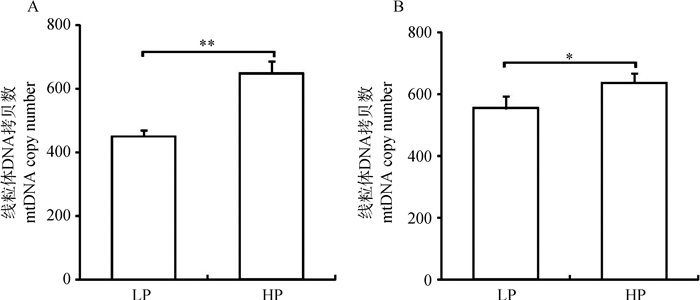
由图 4可知,与低蛋白组相比,高蛋白组脂肪细胞线粒体DNA拷贝数极显著提高(P < 0.01),肌纤维线粒体DNA拷贝数显著升高(P < 0.05)。
|
图 4 不同饲粮蛋白水平对荣昌猪脂肪细胞(A)和肌纤维(B)线粒体DNA拷贝数的影响 Figure 4 Effect of protein level in diet on adipocyte (A) and myofiber (B) mtDNA copy number of Rongchang pigs |
如表 5所示,本研究选取的脂肪细胞(LPL、FABP5、FTO和UCP2)和肌纤维(MYOG、MYOZ1、IGF1和MYOD1)发育相关基因表达水平与脂肪(脂肪率、背膘厚、脂肪细胞体积)和肌肉(瘦肉率、眼肌面积、肌纤维面积)表型均呈现显著相关性(|r|≥0.82,P < 0.05),基因ADIPOR1和ADIPOR2与脂肪细胞体积显著相关(|r|≥0.82,P < 0.05),基因SCD与背膘厚显著相关(r=0.90,P < 0.05),基因MSTN与肌肉表型则无显著相关性(P>0.05)。脂肪细胞mtDNA拷贝数与脂肪率和脂肪细胞体积显著相关(r≥0.86,P < 0.05),而肌纤维mtDNA拷贝数与肌肉表型无显著相关性(P>0.05)。总体上验证了上述分子是调控脂肪细胞和肌纤维生长发育的潜在因子,说明本研究结果准确、可靠。
|
|
表 5 分子表达水平与表型的相关性 Table 5 The correlation between molecular expression level and phenotype |
目前,猪肉的消费量日益增高,为了获得更好的市场经济效益,就需要提升猪的生长性能。猪肉的生长是一个复杂的生理学过程,受到饲养管理、营养水平、疾病、遗传等因素的影响,其中,营养调控是一种有效提高猪生产性能的方法。荣昌猪是中国优良的地方猪种之一,具有耐粗饲、抗逆性强和肉品质好等优点,但其生长性能较差。因此,本研究依据育肥猪正常所需平均蛋白水平13%,设计了低(10.5%)和高(16.5%)2种蛋白水平的饲粮,比较2组在屠宰性状、脂肪细胞和肌纤维表型、生长发育相关基因的表达和线粒体DNA拷贝数方面的差异,探索荣昌猪脂肪沉积和肌肉生长的分子机制,为荣昌猪的合理饲养和生长性能的改善提供科学依据。
3.1 高蛋白饲粮促进荣昌猪脂肪沉积蛋白质是一切生命活动的基础物质,可被消化分解成氨基酸后通过血液运送到机体各处发挥作用,其供应水平的不同则会影响生长、繁殖和产肉等性能。研究表明,当饲粮中提供的能量和必需氨基酸水平满足猪生长需要时,适当降低蛋白水平,不会影响猪的生产和屠宰性能。A. Philippou等[6]研究表明,饲粮不同蛋白水平对始重一致的淮猪末重、平均日采食量、平均日增重和屠宰性能无显著影响。J. Madrid等[20]研究显示,低蛋白平衡氨基酸饲粮对生长猪屠宰性能的影响不显著。本试验中高、低蛋白组的瘦肉率和眼肌面积无显著差异,与上述报道的结果一致。然而,高蛋白组的末重、平均日增重、胴体重、脂肪率和背膘厚显著高于低蛋白组,与M. Ruusunen等[21]的研究结果相矛盾,饲粮蛋白质减少会增加猪的整体脂肪含量,这可能是中外猪种的差异所造成,如饲料转化率、脂肪沉积能力等。中国地方猪种脂肪沉积能力较强,在消化能相同的情况下,低蛋白水平已经可以满足猪的生长需要,而过量的蛋白则引起脂肪的沉积,尤其是生长到一定阶段后,体重的增加主要以脂肪沉积为主[13]。外种猪饲喂低蛋白饲粮可能会限制肌肉生长,导致剩余能量转化为脂肪[22]。因此,对待不同品种猪应该使用不同的饲粮配方,不能一概而论,而中国地方猪品种丰富,这就需要针对不同品种猪制定相应的蛋白营养需要标准。
3.2 高蛋白饲粮引起荣昌猪脂肪细胞体积增大猪的脂肪细胞和肌纤维数目在出生前和生长发育早期就已确定,在肥育期主要通过脂肪细胞和肌纤维的增大来达到脂肪和肌肉组织的沉积[23-24],影响因素包括品种、营养水平、年龄和性别等。本研究结果显示,高、低蛋白组对肌纤维面积无显著影响,这与朱砺等[25]研究结果一致,可能是荣昌猪的瘦肉率较低,其肌纤维发育相对不充分,低蛋白水平能够满足其营养需求。然而,高蛋白组的脂肪细胞体积极显著大于低蛋白组,主要是因为过多的蛋白质摄入并转化引起甘油三酯含量的增加,使脂肪细胞体积增大[26]。此外,荣昌猪属于脂肪型猪种,脂肪沉积能力强,营养过剩可加强其脂肪沉积,本质上引起脂肪细胞体积的增大。因此,生产实践中要根据不同猪种的代谢特点来设计饲料配方,否则会造成成本的增加及浪费。
3.3 高蛋白饲粮促进荣昌猪脂肪沉积和肌肉生长基因的表达脂肪沉积和肌肉生长是合成及分解代谢两方面共同作用的结果,该过程主要由负责正向和负向调控的关键酶进行双向调节来实现,而关键酶的基因表达水平则决定了酶蛋白的多寡和活性的高低[27]。如图 2所示,高蛋白提升脂肪沉积、降低脂肪分解基因表达量,这与脂肪表型结果是一致的,与D. Cameron-Smith等[28]研究结果一致,高蛋白日粮促进人类脂质合成基因的表达。但与K. A. Lillycrop等[29]研究结果相矛盾,高蛋白饲粮使小鼠肝脂质分解基因高表达。一方面可能是机体对蛋白质的利用能力不同造成的;另一方面可能是日粮中能量和蛋白质比例不同引起的。杨凤[30]研究认为,日粮应保持适当的能量和蛋白质比例,若不当则会影响营养物质的利用效率。另外,高蛋白也可升高促进肌肉生长基因表达量(图 3),与D. Paddon-Jones等[31]研究结果类似,高蛋白饲粮可刺激蛋白合成因子及其受体的表达,进而促进骨骼肌的发育。然而,此基因表达结果并没有反映到肌肉表型上来,可能是由于蛋白水平长期过高导致机体代谢絮乱,使血浆胰岛素含量升高,引起胰岛素抵抗。但是,目前还不清楚饲料蛋白水平是如何影响上述基因表达水平的,具体的机制还需进一步深入的研究。有趣的是,饲粮蛋白水平对SCD和MSTN基因表达水平无显著影响,前者主要与荣昌猪的耐粗饲性强有关,低蛋白饲粮就可满足其能量代谢的需要,进而促进脂肪沉积;后者可能与荣昌猪肌肉主要是在早期发育,后期变化不大相关,但具体机制还不清楚。总体来说,在一定范围内,猪脂肪沉积和肌肉生长能力随饲粮蛋白质水平升高而增强,反之则影响脂肪沉积和肌肉生长。潘洪彬等[32]研究指出,高蛋白质日粮(18%)使生长中后期乌金猪肝LSP活性增加,进而影响脂肪沉积比例。R.W.Rosebrough等[33]报道,肉鸡日粮蛋白质水平为18%时,体内脂肪合成能力最强,而蛋白质水平达到30%时,脂肪合成能力最弱。可能是机体在摄入外源蛋白质时需要大量能量来水解外源性蛋白质及合成内源性蛋白质,外源性能量利用减少,内源性能量释放增多,造成脂肪动员作用加强。
3.4 高蛋白饲粮提高荣昌猪线粒体DNA拷贝数脂肪和肌肉组织是重要的能量代谢器官,而线粒体DNA拷贝数则是维持细胞能量需求的基本保证[34]。目前,研究证明线粒体DNA拷贝数受环境、遗传等因素的影响,但关于营养水平对线粒体DNA拷贝数影响的报道还比较少。本研究结果显示,高蛋白饲粮显著提高了脂肪细胞和肌纤维的线粒体DNA拷贝数。G. Al-Kafaji等[35]报道,氧化应激是影响线粒体DNA拷贝数的重要因素之一,可在受影响的细胞中扮演2种角色,一是轻度氧化应激损伤线粒体氧化呼吸链,刺激线粒体DNA分子的增加以代偿减弱的线粒体呼吸功能;二是过度氧化应激可导致线粒体功能障碍甚至细胞死亡。M. Dutta等[36]研究指出,高蛋白饲粮可增加大鼠机体的氧化应激水平。因此,在一定范围内,可通过提高饲粮中的蛋白水平影响线粒体DNA拷贝数含量来促进脂肪沉积和肌肉生长。
4 结论饲粮蛋白水平能显著影响荣昌猪肌肉和脂肪发育及相关基因的表达。与低蛋白组相比,高蛋白组显著提高胴体重、脂肪率、背膘厚、脂肪细胞体积、沉脂和肌肉生长相关基因的表达量、脂肪细胞和肌纤维线粒体DNA拷贝数(P < 0.05);显著降低脂质降解相关基因的表达量(P < 0.05)。从整体上看,高蛋白饲粮增强了荣昌猪的脂肪沉积,可能与脂质生成基因和线粒体DNA拷贝数的高表达相关。
| [1] | HAVEL P J. Update on adipocyte hormones:regulation of energy balance and carbohydrate/lipid metabolism[J]. Diabetes, 2004, 53(suppl 1): S143–S151. |
| [2] | MEAD J R, IRVINE S A, RAMJI D P. Lipoprotein lipase:structure, function, regulation, and role in disease[J]. J Mol Med, 2002, 80(12): 753–769. DOI: 10.1007/s00109-002-0384-9 |
| [3] |
林亚秋, 廖红海, 贺庆华, 等. 山羊FTO基因克隆及其表达谱[J]. 畜牧兽医学报, 2016, 47(5): 888–898.
LIN Y Q, LIAO H H, HE Q H, et al. Cloning and expression profiling of FTO gene of goat[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(5): 888–898. (in Chinese) |
| [4] | MOON J S, LEE S, PARK M A, et al. UCP2-induced fatty acid synthase promotes NLRP3 inflammasome activation during sepsis[J]. J Clin Invest, 2015, 125(2): 665–680. DOI: 10.1172/JCI78253 |
| [5] | GOUDENEGE S, PISANI D F, WDZIEKONSKI B, et al. Enhancement of myogenic and muscle repair capacities of human adipose-derived stem cells with forced expression of MyoD[J]. Mol Ther, 2009, 17(6): 1064–1072. DOI: 10.1038/mt.2009.67 |
| [6] | PHILIPPOU A, MARIDAKI M, HALAPAS A, et al. The role of the insulin-like growth factor 1(IGF-1) in skeletal muscle physiology[J]. In Vivo, 2007, 21(1): 45–54. |
| [7] | LEE C Y, HU S Y, GONG H Y, et al. Suppression of myostatin with vector-based RNA interference causes a double-muscle effect in transgenic zebrafish[J]. Biochem Biophys Res Commun, 2009, 387(4): 766–771. DOI: 10.1016/j.bbrc.2009.07.110 |
| [8] | TOUS N, LIZARDO R, VILÀ B, et al. Effect of reducing dietary protein and lysine on growth performance, carcass characteristics, intramuscular fat, and fatty acid profile of finishing barrows[J]. J Anim Sci, 2014, 92(1): 129–140. DOI: 10.2527/jas.2012-6222 |
| [9] | LAYMAN D K, EVANS E M, ERICKSON D, et al. A moderate-protein diet produces sustained weight loss and long-term changes in body composition and blood lipids in obese adults[J]. J Nutr, 2009, 139(3): 514–521. DOI: 10.3945/jn.108.099440 |
| [10] | WOLFE R R, MILLER S L. The recommended dietary allowance of protein:a misunderstood concept[J]. JAMA, 2008, 299(24): 2891–2893. DOI: 10.1001/jama.299.24.2891 |
| [11] | BAUM J I, KIM I Y, WOLFE R R. Protein consumption and the elderly:what is the optimal level of intake?[J]. Nutrients, 2016, 8(6): 359. DOI: 10.3390/nu8060359 |
| [12] | SYMONS T B, SHEFFIELD-MOORE M, WOLFE R R, et al. A moderate serving of high-quality protein maximally stimulates skeletal muscle protein synthesis in young and elderly subjects[J]. J Am Diet Assoc, 2009, 109(9): 1582–1586. DOI: 10.1016/j.jada.2009.06.369 |
| [13] | KATSUMATA M. Promotion of intramuscular fat accumulation in porcine muscle by nutritional regulation[J]. Anim Sci J, 2011, 82(1): 17–25. DOI: 10.1111/asj.2011.82.issue-1 |
| [14] |
高琴, 隋啸一, 李福昌, 等. 不同蛋白水平饲粮对肉兔骨骼肌发育及相关因子表达的影响[J]. 中国兽医学报, 2016, 36(9): 1613–1618.
GAO Q, SUI X Y, LI F C, et al. Effect of dietary protein on muscle development and relative factors of rabbit[J]. Chinese Journal of Veterinary Science, 2016, 36(9): 1613–1618. (in Chinese) |
| [15] |
杨明华, 李永能, 黄英, 等. 日粮蛋白质水平对乌金猪肝脏组织脂类代谢相关基因表达的影响[J]. 中国畜牧兽医, 2013, 40(2): 108–112.
YANG M H, LI Y N, HUANG Y, et al. Effect of dietry protein levels on the expression of hepatic lipid metabolism related genes in Wujin pigs[J]. China Animal Husbandry & Veterinary Medicine, 2013, 40(2): 108–112. (in Chinese) |
| [16] | LI M Z, WU H L, LUO Z G, et al. An atlas of DNA methylomes in porcine adipose and muscle tissues[J]. Nat Commun, 2012, 3: 850. DOI: 10.1038/ncomms1854 |
| [17] |
中华人民共和国农业部. NY/T 65-2004猪饲养标准[S]. 北京: 中国农业出版社, 2004.
Ministry of Agriculture of the People's Republic of China. NY/T65-2004 Feeding standard of swine[S]. Beijing:China Agriculture Press, 2004. (in Chinese) |
| [18] | NRC. Nutrient requirements of swine[S]. Washington, DC:National Academy Press, 1998. |
| [19] | ZHANG J, ZHOU C W, MA J D, et al. Breed, sex and anatomical location-specific gene expression profiling of the porcine skeletal muscles[J]. BMC Genet, 2013, 14: 53. |
| [20] | MADRID J, MARTíNEZ S, LÓPEZ C, et al. Effects of low protein diets on growth performance, carcass traits and ammonia emission of barrows and gilts[J]. Anim Prod Sci, 2013, 53(2): 146–153. DOI: 10.1071/AN12067 |
| [21] | RUUSUNEN M, PARTANEN K, PÖSÖ R, et al. The effect of dietary protein supply on carcass composition, size of organs, muscle properties and meat quality of pigs[J]. Livest Sci, 2007, 107(2-3): 170–181. DOI: 10.1016/j.livsci.2006.09.021 |
| [22] | DA COSTA N, MCGILLIVRAY C, BAI Q F, et al. Restriction of dietary energy and protein induces molecular changes in young porcine skeletal muscles[J]. J Nutr, 2004, 134(9): 2191–2199. |
| [23] | SCHIAFFINO S, DYAR K A, CICILIOT S, et al. Mechanisms regulating skeletal muscle growth and atrophy[J]. FEBS J, 2013, 280(17): 4294–4314. DOI: 10.1111/febs.2013.280.issue-17 |
| [24] | ZHANG J, MA J D, LONG K R, et al. Dynamic gene expression profiles during postnatal development of porcine subcutaneous adipose[J]. PeerJ, 2016, 4(2): e1768. |
| [25] |
朱砺, 李学伟, 李芳琼, 等. 肌纤维生长的影响因素分析[J]. 四川农业大学学报, 2002, 20(1): 37–39.
ZHU L, LI X W, LI F Q, et al. Factors influencing the growth of muscle fiber[J]. Journal of Sichuan Agricultural University, 2002, 20(1): 37–39. (in Chinese) |
| [26] | HAMES K C, KOUTSARI C, SANTOSA S, et al. Adipose tissue fatty acid storage factors:effects of depot, sex and fat cell size[J]. Int J Obesity, 2015, 39(6): 884–887. DOI: 10.1038/ijo.2015.10 |
| [27] |
岳颖, 刘国华, 郑爱娟, 等. 生长动物脂肪代谢关键酶基因表达调控[J]. 动物营养学报, 2012, 24(2): 232–238.
YUE Y, LIU G H, ZHENG A J, et al. Modulating the expression of genes regulating key enzymes for lipid metabolism in growing animals[J]. Journal of Animal Nutrition, 2012, 24(2): 232–238. (in Chinese) |
| [28] | CAMERON-SMITH D, BURKE L M, ANGUS D J, et al. A short-term, high-fat diet up-regulates lipid metabolism and gene expression in human skeletal muscle[J]. Am J Clin Nutr, 2003, 77(2): 313–318. |
| [29] | LILLYCROP K A, PHILLIPS E S, JACKSON A A, et al. Dietary protein restriction of pregnant rats induces and folic acid supplementation prevents epigenetic modification of hepatic gene expression in the offspring[J]. J Nutr, 2005, 135(6): 1382–1386. |
| [30] |
杨凤.
动物营养学[M]. 2版. 北京: 中国农业出版社, 2001.
YANG F. Animal nutrition[M]. 2nd ed. Beijing: China Agriculture Press, 2001. (in Chinese) |
| [31] | PADDON-JONES D, RASMUSSEN B B. Dietary protein recommendations and the prevention of sarcopenia:protein, amino acid metabolism and therapy[J]. Curr Opin Clin Nutr, 2009, 12(1): 86–90. DOI: 10.1097/MCO.0b013e32831cef8b |
| [32] |
潘洪彬, 陈强, 黄英, 等. 日粮蛋白质水平对乌金猪脂肪代谢相关酶活性的影响[J]. 中国畜牧兽医, 2012, 39(5): 90–94.
PAN H B, CHEN Q, HUANG Y, et al. Effect of dietary protein levels on activity of lipids metabolic enzymes in Wujin pigs[J]. China Animal Husbandry & Veterinary Medicine, 2012, 39(5): 90–94. (in Chinese) |
| [33] | ROSEBROUGH R W, MCMURTRY J P, VASILATOS-YOUNKEN R. Dietary fat and protein interactions in the broiler[J]. Poult Sci, 1999, 78(7): 992–998. DOI: 10.1093/ps/78.7.992 |
| [34] | TANG Y Y, SCHON E A, WILICHOWSKI E, et al. Rearrangements of human mitochondrial DNA (mtDNA):new insights into the regulation of mtDNA copy number and gene expression[J]. Mol Biol Cell, 2000, 11(4): 1471–1485. DOI: 10.1091/mbc.11.4.1471 |
| [35] | AL-KAFAJI G, GOLBAHAR J. High glucose-induced oxidative stress increases the copy number of mitochondrial DNA in human mesangial cells[J]. BioMed Res Int, 2013, 2013: 754946. |
| [36] | DUTTA M, GHOSH D, GHOSH A K, et al. High fat diet aggravates arsenic induced oxidative stress in rat heart and liver[J]. Food Chem Toxicol, 2014, 66: 262–277. DOI: 10.1016/j.fct.2014.01.050 |


