2. 江苏省农业科学院动物品种改良和繁育重点实验室, 南京 210014;
3. 南京农业大学动物科技学院, 南京 210095;
4. 江苏省农业种质资源保护与利用平台, 南京 210014
2. Key Laboratory of Animal Breeding and Reproduction, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;
3. College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;
4. The Jiangsu Provincial Platform for Conservation and Utilization of Agricultural Germplasm, Nanjing 210014, China
转录因子特殊蛋白因子1(Sp1)属于SP/Kruppel样转录因子(Sp-like and Kruppel-like transcription factors, Sp/KLFS)家族,且是该家族第1个被发现的转录因子[1]。Sp1蛋白主要包含4个部分:DNA结合区域、Sp1活化区、Btd盒及Sp盒,在Sp1C端3个串联的Cys2His2型锌指结构域能够特异性识别GC盒(-GGGGCGGGG-)与GT盒(-GGTGTGGG-),从而参与基因的转录调控[2]。因为在许多看家基因的启动子区都有Sp1结合位点,所以Sp1基因通常作为组成型转录因子调节启动子活性。同时也有研究表明,Sp1参与组织特异性基因的表达调控,转录因子Sp1启动猪ROCK1基因的表达[3];Sp1作为转录激活剂调控成纤维细胞生长因子的表达[4];Sp1转录因子启动TMEPA1基因表达并促进细胞的增殖[5]。
Sp1表达上调激活Wnt/β-Catenin信号通路促进细胞的增殖[6]。最近研究表明,Sp1还具有促凋亡的作用。在结肠癌SW480-细胞中,Sp1可通过调控人端粒酶反转录酶基因调节端粒酶的活性而使细胞凋亡[7]。在肝癌的研究中发现,Sp1通过上调NF-DR5κB的转录活性而诱导肝癌细胞凋亡[8]。有些抗凋亡基因(Bcl-2、Bcl-x、Survivin)和促凋亡基因(Bax、Trail、Fas、Caspase-8和Caspase-3)的启动子区均发现存在Sp1转录因子结合位点[9]。尽管Sp1具有抑制增殖、促进凋亡作用,但Sp1对颗粒细胞调控还未见报道。本试验以湖羊卵巢组织为研究对象,扩增Sp1基因编码区全序列,分析其序列特征,构建真核表达载体转染人颗粒细胞系KGN-细胞,研究湖羊Sp1基因在KGN-细胞中的功能,为进一步解析Sp1基因在湖羊卵泡发育中的作用提供一定的依据。
1 材料与方法 1.1 试验动物试验湖羊来自江苏省泰州市西来源有限公司,母羊屠宰后收集心、肝、脾、肺、肾、子宫和卵巢组织于液氮中保存备用。采用试剂盒(百迈克,中国)提取RNA,并使用Prime Script TM-RT RTM Mix完成cDNA第一链的合成(TaKaRa,日本)。
1.2 引物的合成和扩增根据绵羊Sp1基因序列(序列号:XM_012174189.2),采用Primer Premier 5.0软件设计3对特异性引物P1、P2和P3,用于湖羊Sp1编码区的扩增、表达载体构建及湖羊组织表达模式的鉴定。引物由上海捷瑞生物技术有限公司合成,引物序列的相关信息见表 1。
|
|
表 1 Sp1基因扩增引物 Table 1 Primer used for amplification of the Sp1 gene |
以湖羊卵巢组织为模板,扩增湖羊Sp1基因编码区序列。PCR反应体系为25 μL,含模板DNA 60 ng、1.5 TM2X High-Fidelity Master Mix 5 μL、上下游引物各1 μL,添加灭菌双蒸水至25 μL。PCR扩增程序:98 ℃预变性2 min;98 ℃变性10 s,53 ℃退火10 s,72 ℃延伸10 s,35个循环;72 ℃延伸5 min。
1.3 序列分析与系统发育树的构建用DNAMAN6.0软件进行序列翻译并与其它动物的核苷酸和氨基酸序列进行比对。在NCBI的ORF Finder(http://www.ncbi.nlm.nih.gov/projects/gorf/)中进行开放阅读框的预测,利用DNAStar软件对从GenBank中挑选6个不同动物的Sp1所编码的氨基酸序列进行多序列比对分析(表 2),用MEGA5.1软件包中的邻接法NJ构建系统发育树。
|
|
表 2 不同哺乳动物Sp1氨基酸序列信息 Table 2 The amino acid sequences information of Sp1 in different mammals |
反应程序:95 ℃ 15 min; 94 ℃ 15 s,56 ℃ 30 s,70 ℃ 30 s (40个循环); 95 ℃ 15 min,55 ℃ 30 s,95 ℃ 30 s。每次试验每个样品做3个重复,整个试验重复3次。
1.5 Sp1基因表达载体的构建用限制性内切酶Kpn Ⅰ和Xho Ⅰ将质粒pcDNA3.1充分酶切胶回收后,与用同样酶切后胶回收的Sp1基因16 ℃连接过夜,转化后得到表达载体pcDNA3.1-Sp1,用PCR方法鉴定重组质粒pcDNA3.1-Sp1。
1.6 细胞培养和瞬时转染KGN-细胞培养在含有10%胎牛血清(FBS,Atlanta Biologicals)和1% Roswell Park Memorial Institute Media(RPMI,Sigma)青霉素-链霉素-谷氨酰胺(Mediatech)的Dulbec-co′s改良的Eagle培养基(DMEM,Sigma),37 ℃ 5% CO2的培养箱中。细胞转染前将细胞平铺于24孔板,待细胞完全贴壁并生长至75%~80%融合时,参照Lipofectmine 3000使用说明书,将质粒和对照组分别转染细胞中。24 h后收集细胞样,进行后续试验。
1.7 KGN-细胞增殖和凋亡试验将KGN-细胞平铺于96孔板,每孔3×103个细胞, 铺板后分别将Sp1过表达载体和pc-DNA3.1空载转染到KGN-细胞中,利用试剂盒测定CCK-8(南京建成生物公司,中国)值和Caspase-3(南京建成生物公司,中国)的含量,具体操作方法参考南京建成生物公司试剂盒操作流程。
1.8 流式细胞术测定KGN-细胞凋亡率使用Annexin 155V-FITC /碘化丙啶凋亡试剂盒(KeyGEN,Nanjing,China)检测KGN-细胞凋亡。将KGN以每孔(3~8)×106个细胞的密度接种到6孔板中。处理后,KGN-细胞用0.25%胰酶消化,用PBS洗涤2次(2 000 r·min-1离心5 min)收(1~5)×105,在室温下将KGN-细胞悬浮于500 mL含有碘化丙啶/膜联蛋白V-FITC159的结合缓冲液中,加入5 μL Annexin155V-FITC混匀后,加入5 μL Propidum Iodide碘化丙啶避光反应5~15 min后,上机检测。
1.9 数据分析采用SPSS17.0软件One-Way分析(Anova)或t检验进行统计学处理,数据以“平均值±标准差(Mean±SD)”表示,P < 0.05和P < 0.01为差异有统计学意义。
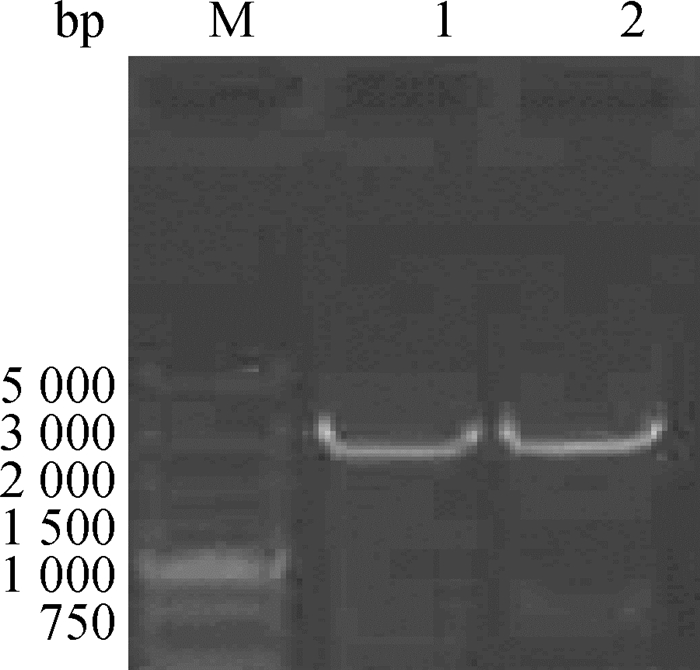
2 结果 2.1 湖羊Sp1基因CDS区扩增以湖羊卵巢组织cDNA为模板,以P1为引物(表 1)进行PCR扩增,扩增产物经电泳检测,得到1条特异性条带(图 1)。测序发现扩增产物大小与预测结果相一致,与引物源序列的一致性为99.07%,说明扩增产物为湖羊Sp1基因CDS区。
|
M. DNA相对分子质量标准;1、2. PCR扩增片段 M. DNA marker; 1, 2. Amplified fragments of PCR 图 1 湖羊Sp1基因CDS编码区PCR扩增产物电泳图谱 Figure 1 Agarose gel photograph of CDS region of Sp1 gene in Hu sheep |
通过克隆测序获得2 340 bp湖羊Sp1基因CDS区序列,碱基组成分析发现湖羊Sp1基因CDS区序列中A、T、G、C碱基含量分别为26.37%、19.83%、25.51%和28.29%,其中A+T含量46.20%,G+C含量53.80%。同源性分析发现,湖羊Sp1基因核苷酸序列与人、牛、猪、小鼠和鸡的同源性分别为94.28%、97.73%、94.29%、89.06%和70.10%,氨基酸序列与人、牛、猪、小鼠和鸡的一致性为95.75%、97.40%、95.79%、91.79%和75.28%,表明转录因子Sp1在哺乳动物中高度保守(图 2)。

|
*.氨基酸一致 *.Amino acids are consistent 图 2 湖羊Sp1基因氨基酸序列同源性比对结果 Figure 2 The results of comparison of amino acid sequence homology of Sp1 gene in Hu sheep |
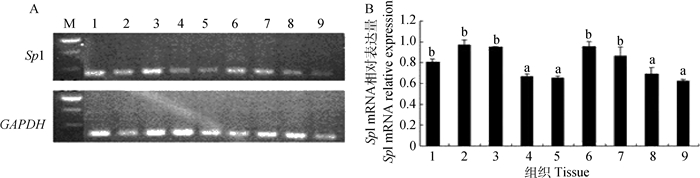
用RT-PCR,以GAPDH为内参基因,鉴定湖羊Sp1基因表达(图 3)。Sp1基因在湖羊心、肝、脾、肺、肾、肌肉、子宫、卵巢和卵泡中均有表达,并且Sp1基因在卵泡、卵巢、子宫、肺、脾的表达量显著高于肌肉、肾、肝和心(P < 0.05)。
|
A.定性分析;B.定量分析。1.卵泡;2.卵巢;3.子宫;4.肌肉;5.肾;6.肺;7.脾;8.肝;9.心;M.DNA相对分子质量标准。不同字母表示差异显著 A. The results of phenotypic analysis of expression; B. The results of quantitative analysis of expression. 1.Follicle; 2.Ovary; 3.Uterus; 4.Muscle; 5.Kidney; 6.Lung; 7.Spleen; 8.Liver; 9.Heart. M. DNA marker. The different letters indicate significant differences 图 3 湖羊Sp1基因组织表达谱 Figure 3 The results of expression profile of Sp1 gene in Hu sheep |
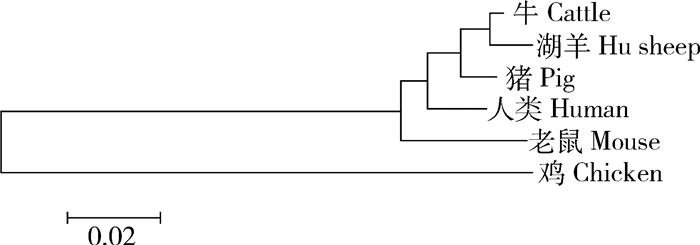
以家禽为外类群,采用MEGA 5.1软件中的NJ法构建了哺乳动物Sp1蛋白的系统发育树(图 4),结果发现聚类结果与经典分类学结果基本一致。湖羊与4个哺乳动物聚在一起,而外类群家禽自成一类;在哺乳动物中,鼠科自成一类,3个家畜品种和1个灵长类物种聚在一起;在家畜品种中,湖羊、牛和猪聚为一类(BP=100%)。
|
图 4 Sp1基因编码区的蛋白序列NJ系统发育树 Figure 4 The protein sequence NJ phylogenetic tree of Sp1 gene coding region |
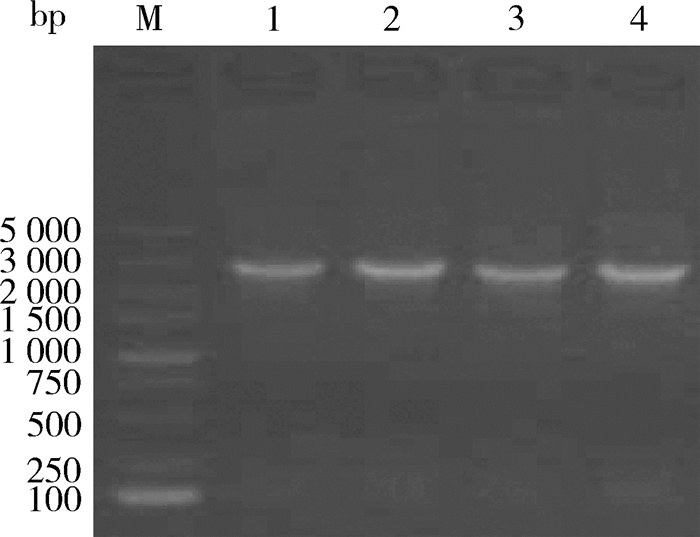
以湖羊卵巢组织cDNA为模板,利用引物P1(表 1)扩增湖羊Sp1基因CDS区。扩增产物用Kpn Ⅰ和Xho Ⅰ进行双酶切,克隆到过表达载体pc-DNA3.1中,并转化到DH5α感受态细胞中。对提取质粒进行PCR鉴定,结果显示目的片段已连接到载体中(图 5)。质粒测序结果表明插入片段序列正确,说明湖羊Sp1基因过表达载体构建成功,命名为pcDNA3.1-Sp1(P-Sp1)。
|
M. DNA相对分子质量标准;1~4.质粒编号 M. DNA marker; 1-4.Plasmid numbers 图 5 重组质粒pcDNA3.1-Sp1的鉴定 Figure 5 Identification of recombinant plasmid pcDNA3.1-Sp1 |
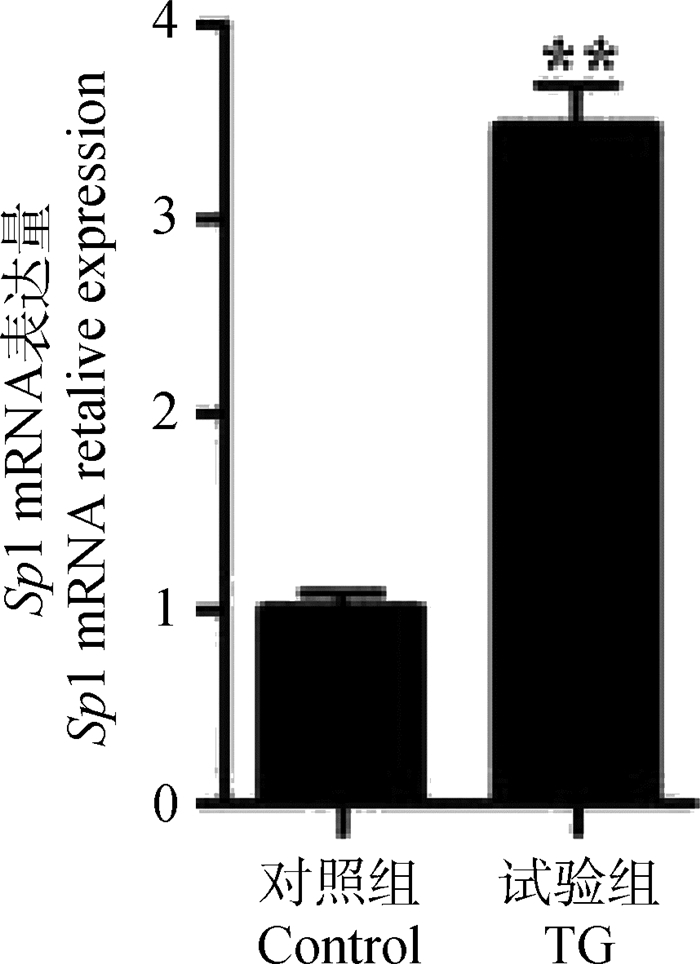
将pcDNA3.1-Sp1载体瞬时转染KGN-细胞后,收集试验组和对照组细胞,进行RNA提取和第一链合成,以P2(表 1)为引物,对试验组和对照组Sp1结果进行定量分析,结果显示试验组和对照组相比,Sp1的表达水平呈现显著的差异,表明构建的表达载体在KGN-细胞中成功表达Sp1 (图 6)。
|
**.P < 0.01。下同 **.P < 0.01.The same as below 图 6 转染pcDNA3.1-Sp1后KGN-细胞中Sp1表达量 Figure 6 The expression of Sp1 gene in KGN-cells after transfection with pcDNA3.1-Sp1 |
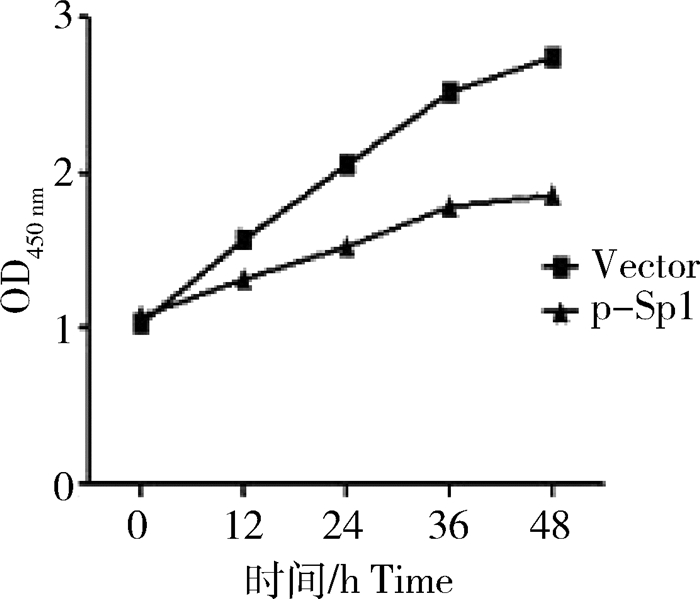
为了检测Sp1对KGN-细胞增殖的影响,采用CCK-8试剂盒检测方法,检测Sp1过表达载体和pc-DNA3.1空载体转染KGN-细胞0、12、24、36、48 h后450 nm处吸光度值。结果发现处理组细胞的增殖显著低于对照组(P < 0.05) (图 7),说明Sp1抑制颗粒细胞的增殖。
|
图 7 转染pcDNA3.1-Sp1后KGN-细胞增殖结果 Figure 7 The results of proliferation of KGN-cells after transfection with pcDNA3.1-Sp1 |
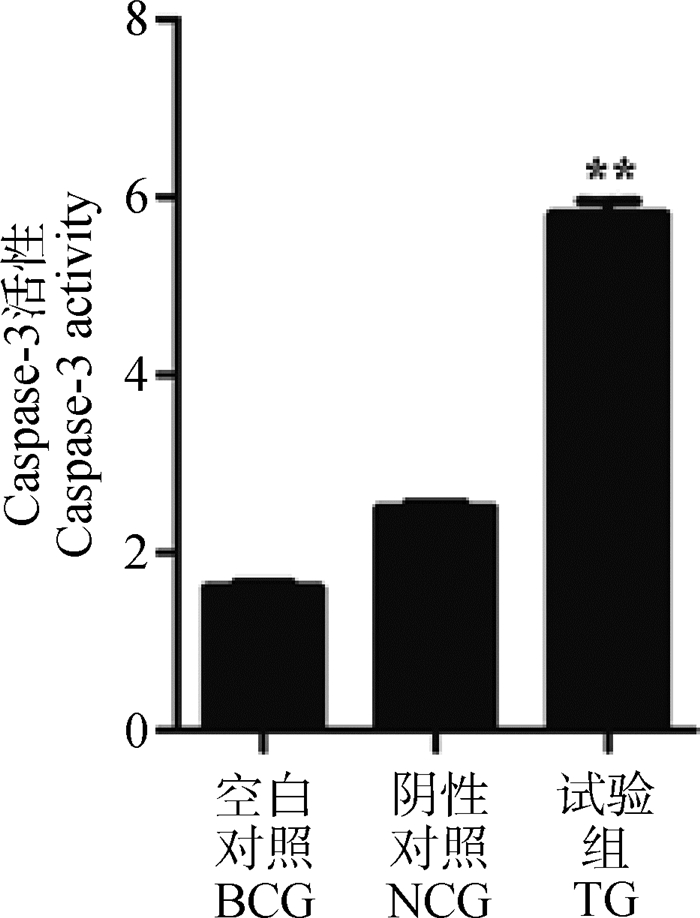
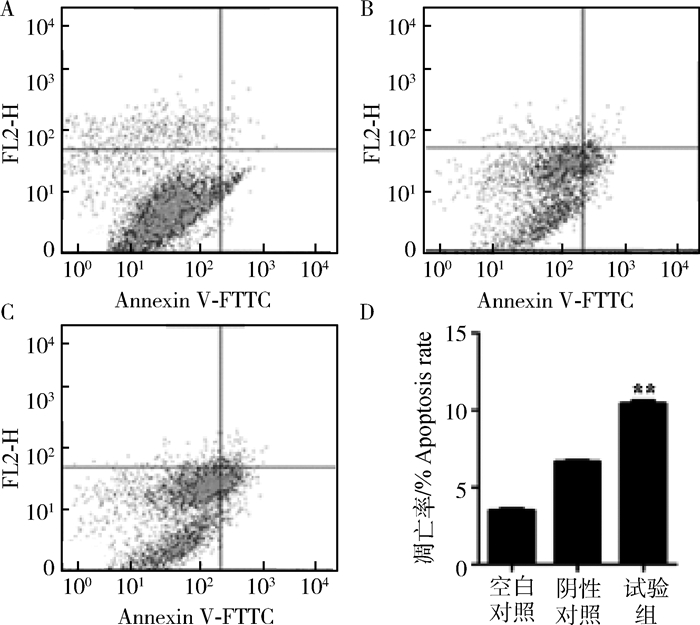
将Sp1表达载体转染KGN-细胞后检测Caspase-3蛋白的含量,结果表明,过表达Sp1后,试验组与对照组相比,Caspase-3活性极显著升高(P < 0.01)(图 8)。流式细胞术检测显示,3组细胞均有细胞凋亡的现象(图 9),未经转染质粒的空白对照组,转染空载体pc-DNA3.1的阴性对照组和转染pc-DNA3.1-Sp1组(试验组)的凋亡率,分别为(3.41±0.64)%、(6.06±0.43)%和(11.19±1.23)%。试验组极显著高于空白对照组和阴性对照组(P < 0.01)。
|
图 8 转染pcDNA3.1-Sp1后Caspase-3活性 Figure 8 The activities of Caspase-3 after transfection with pcDNA3.1-Sp1 |
|
A.空白对照组;B.阴性对照组;C.pcDNA3.1-Sp1转染组(试验组);D.3组凋亡率的数值统计 A.Blank control group (BCG); B.Negative control group (NCG); C.pcDNA3.1-Sp1 transfection group (TG); D.The numerical statistics of the 3 groups of apoptotic rates 图 9 转染Sp1过表达载体后KGN-细胞凋亡率 Figure 9 The apoptosis rate of KGN-cells after transfected with Sp1 overexpression vector |
Sp1转录因子在哺乳动物组织中广泛表达,一般与长21~22 bp、富含GC结合,作为基因的转录激活剂,在细胞分化、动物生长和繁殖等方面发挥着重要的作用[10-11]。本文以江苏特色绵羊品种-湖羊卵巢组织为研究对象,扩增湖羊转录因子Sp1基因,结果发现湖羊Sp1基因编码区全长2 340 bp,编码779个氨基酸残基。以Sp1氨基酸序列构建的系统进化树发现,湖羊与牛的亲缘关系最近[12],与家禽的亲缘关系最远,与传统的拓扑结构一致。同源比对发现Sp1基因在哺乳动物中高度保守。
相关的研究发现Sp1在调控细胞凋亡方面的作用相当复杂,既能促进细胞增殖,也能促进细胞凋亡。Sp1激活长链非编码AGAP2-AS1从而促进胃癌细胞的增殖[13];Sp1和NF-B 激活IL-1α的表达从而促进T-ALL-细胞的增殖[14];S. Shelake等发现Sp1与survivin蛋白共同作用抑制尤文肉瘤细胞的增殖[15];EMMPRIN、Sp1和microRNA-27a介介导8-o-β-吡喃葡萄糖苷诱导的骨肉瘤细胞凋亡[16]。p53[17]、bcl2[18]、c-myc[19]、Fas/Fasl[20]、WTl[21]、ICE[22]基因与颗粒细胞的凋亡密切相关的基因启动子区存在Sp1结合位点。并且Sp1在肿瘤初期大量积累,参与调控肿瘤发展的各个阶段[23]。为了研究湖羊Sp1基因在KGN-细胞凋亡和增殖中的作用,本研究构建了湖羊Sp1真核表达载体并转染KGN-细胞。目前检测细胞凋亡的方法有很多,比如TUNEL法检测细胞形态[24]、Caspase-3试剂盒检测Caspase-3活性[25]、DNA片段化检测法[26]等。半胱氨酸天冬氨酸蛋白酶3(Caspase-3)参与细胞的凋亡,是细胞凋亡过程中主要的终末剪切酶[27]。Caspase-3在细胞凋亡中有着不可替代的作用,是促凋亡蛋白[28]。活化的Caspase-3能裂解DNA修复相关分子、凋亡抑制蛋白、细胞外基质蛋白及骨架蛋白等,促使细胞凋亡[29]。本研究选择Caspase-3活性检测和磷脂酰丝氨酸外翻分析结合流式细胞检测方法测定湖羊Sp1过表达后对KGN-细胞凋亡的影响。结果发现Sp1过表达的试验组Caspase-3的活性显著高于对照组,流式细胞术检测结果也表明,Sp1过表达后促进了细胞的凋亡;进一步的细胞增殖试验检测结果显示,与阴性对照组相比,转染组的细胞增殖明显受到抑制。综上表明,湖羊Sp1可诱导KGN-细胞的凋亡。有研究表明,颗粒细胞凋亡可导致卵泡闭锁,在闭锁卵泡超微结构的研究中发现,细胞凋亡形态的变化包括包浆空泡、染色质浓集,细胞形成凋亡小体等,而这些细胞形态的变化首先在颗粒细胞中发生[30],因此颗粒细胞增殖或者凋亡对于卵泡发育或者闭锁具有重要的意义。
4 结论本试验克隆得到湖羊Sp1基因编码区全长2 340 bp,编码779个氨基酸残基。成功构建Sp1过表达载体。Sp1基因广泛表达于湖羊的各个组织中,在卵巢组织中表达水平最高。湖羊和牛的亲缘关系最近。湖羊Sp1基因可抑制人卵巢颗粒细胞(KGN)增殖、诱导其凋亡。本研究结果为进一步解析Sp1基因在湖羊卵泡发育、闭锁中的作用提供了一定的依据。
| [1] | PHILIPSEN S, SUSKE G. A tale of three fingers:the family of mammalian Sp/XKLF transcription factors[J]. Nucleic Acids Res, 1999, 27(15): 2991–3000. DOI: 10.1093/nar/27.15.2991 |
| [2] | MILDE-LANGOSCH K. The Fos family of transcription factors and their role in tumourigenesis[J]. Eur J Cancer, 2005, 41(16): 2449–2461. DOI: 10.1016/j.ejca.2005.08.008 |
| [3] | ZHANG R R, FENG X T, ZHAN M S, et al. Transcription factor Sp1 promotes the expression of porcine ROCK1 gene[J]. Int J Mol Sci, 2016, 17(1): 112. DOI: 10.3390/ijms17010112 |
| [4] | CHEN S Q, LI H T, ZHANG J, et al. Identification of Sp1 as a transcription activator to regulate fibroblast growth factor 21 gene expression[J]. BioMed Res Int, 2017, 2017: 8402035. |
| [5] | LI Y Y, GUO A L, FENG Y J, et al. Sp1 transcription factor promotes TMEPAI gene expression and contributes to cell proliferation[J]. Cell Prolif, 2016, 49(6): 710–719. DOI: 10.1111/cpr.2016.49.issue-6 |
| [6] | KWON Y J, BAEK H S, YE D G, et al. CYP1B1 enhances cell proliferation and metastasis through induction of EMT and activation of Wnt/β-catenin signaling via Sp1 upregulation[J]. PLoS One, 2016, 11(3): e0151598. DOI: 10.1371/journal.pone.0151598 |
| [7] | ZHAO L G, ZHU Y, NIU W T, et al. Silencing Sp1 suppresses telomerase activity and promotes apoptosis of SW480 cells line in colorectal carcinoma[J]. Chin-German J Clin Oncol, 2011, 10(4): 220–224. DOI: 10.1007/s10330-011-0762-2 |
| [8] |
方珏敏, 王理伟. 转录因子specificity protein 1——胰腺癌治疗的新靶点[J]. 肿瘤, 2011, 31(8): 772–774.
FANG J M, WANG L W. Transcription factor specificity protein 1:a new biomarker for pancreatic cancer therapy[J]. Tumor, 2011, 31(8): 772–774. (in Chinese) |
| [9] | BLACK A R, BLACK J D, AZIZKHAN-CLIFFORD J. Sp1 and krüppel-like factor family of transcription factors in cell growth regulation and cancer[J]. J Cell Physiol, 2001, 188(2): 143–160. DOI: 10.1002/jcp.v188:2 |
| [10] | XIA X L, YAN C, WU W J, et al. Characterization of the porcine peptidylarginine deiminase type VI gene (PADI6) promoter:Sp1 regulates basal transcription of the porcine PADI6[J]. Gene, 2016, 575(2): 551–558. DOI: 10.1016/j.gene.2015.09.042 |
| [11] | NALVARTE I, TOHONEN V, LINDEBERG M, et al. Estrogen receptor β controls MMP-19 expression in mouse ovaries during ovulation[J]. Reproduction, 2016, 151(3): 253–259. DOI: 10.1530/REP-15-0522 |
| [12] |
李隐侠, 乔永, 张俊, 等. 湖羊肌肉UCP3基因序列特征分析及其在肌肉中的表达[J]. 江苏农业学报, 2015, 31(5): 1078–1083.
LI Y X, QIAO Y, ZHANG J, et al. Characterization of UCP3 gene sequence and its expression in Hu lamb muscles[J]. Journal of Jiangsu Agricultural Sciences, 2015, 31(5): 1078–1083. (in Chinese) |
| [13] | QI F Z, LIU X H, WU H, et al. Long noncoding AGAP2-AS1 is activated by Sp1 and promotes cell proliferation and invasion in gastric cancer[J]. J Hematol Oncol, 2017, 10: 48. DOI: 10.1186/s13045-017-0420-4 |
| [14] | ZHANG Y S, YU X, LIN D D, et al. Propiece IL-1α facilitates the growth of acute T-lymphocytic leukemia cells through the activation of NF-κB and SP1[J]. Oncotarget, 2017, 8(9): 15677–15688. |
| [15] | SHELAKE S, SANKPAL U T, BOWMAN W P, et al. Targeting specificity protein 1 transcription factor and survivin using tolfenamic acid for inhibiting Ewing sarcoma cell growth[J]. Invest New Drugs, 2017, 35(2): 158–165. DOI: 10.1007/s10637-016-0417-9 |
| [16] | WANG Z H, YANG H L. EMMPRIN, Sp1 and microRNA-27a mediate physcion 8-O-β-glucopyranoside-induced apoptosis in osteosarcoma cells[J]. Am J Cancer Res, 2016, 6(6): 1331–1344. |
| [17] | HAN Y, SU C Y, YU D P, et al. Cholecystokinin attenuates radiation-induced lung cancer cell apoptosis by modulating p53 gene transcription[J]. Am J Transl Res, 2017, 9(2): 638–646. |
| [18] | JIA X Z, OUYANG H J, ABDALLA B A, et al. miR-16 controls myoblast proliferation and apoptosis through directly suppressing Bcl2 and FOXO1 activities[J]. Biochim Biophys Acta, 2017, 1860(6): 674–684. DOI: 10.1016/j.bbagrm.2017.02.010 |
| [19] | CUI F M, HOU J, HUANG C C, et al. C-Myc regulates radiation-induced G2/M cell cycle arrest and cell death in human cervical cancer cells[J]. J Obstet Gynaecol Res, 2017, 43(4): 729–735. DOI: 10.1111/jog.2017.43.issue-4 |
| [20] | WANG Y, MU Y, ZHOU X R, et al. SIRT2-mediated FOXO3a deacetylation drives its nuclear translocation triggering FasL-induced cell apoptosis during renal ischemia reperfusion[J]. Apoptosis, 2017, 22(4): 519–530. DOI: 10.1007/s10495-016-1341-3 |
| [21] | MAZZEI L, GARCíA M, CALVO J P, et al. Changes in renal WT-1 expression preceding hypertension development[J]. BMC Nephrol, 2016, 17: 34. DOI: 10.1186/s12882-016-0250-6 |
| [22] | NICHOLSON D W, ALI A, THORNBERRY N A, et al. Identification and inhibition of the ICE/CED-3 protease necessary for mammalian apoptosis[J]. Nature, 1995, 376(6535): 37–43. DOI: 10.1038/376037a0 |
| [23] | KONG L M, LIAO C G, FEI F, et al. Transcription factor Sp1 regulates expression of cancer-associated molecule CD147 in human lung cancer[J]. Cancer Sci, 2010, 101(6): 1463–1470. DOI: 10.1111/cas.2010.101.issue-6 |
| [24] | LI J Y, GAO H, TIAN Z, et al. Effects of chronic heat stress on granulosa cell apoptosis and follicular atresia in mouse ovary[J]. J Anim Sci Biotechnol, 2016, 7: 57. DOI: 10.1186/s40104-016-0116-6 |
| [25] | RAK A, DRWAL E, WRÓBEL A, et al. Resistin is a survival factor for porcine ovarian follicular cells[J]. Reproduction, 2015, 150(4): 343–355. DOI: 10.1530/REP-15-0255 |
| [26] |
谭晓华, 姜泊, 张亚历, 等. 凋亡细胞核DNA片段检测方法进展[J]. 第一军医大学学报, 1999, 19(4): 371–373.
TAN X H, JIANG B, ZHANG Y L, et al. Progress of DNA fragment detection in apoptotic nuclei[J]. Journal of First Military Medical University, 1999, 19(4): 371–373. (in Chinese) |
| [27] | XUE D, LI Y N, JIANG Z J, et al. A ROS-dependent and Caspase-3-mediated apoptosis in sheep bronchial epithelial cells in response to Mycoplasma Ovipneumoniae infections[J]. Vet Immunol Immunopthol, 2017, 187: 55–63. DOI: 10.1016/j.vetimm.2017.04.004 |
| [28] | LI X P, LUO R, JIANG R J, et al. The role of the Hsp90/Akt pathway in myocardial calpain-induced caspase-3 activation and apoptosis during sepsis[J]. BMC Cardiovasc Disord, 2013, 13: 8. DOI: 10.1186/1471-2261-13-8 |
| [29] | WU X J, STAHI T, HU Y, et al. The production of reactive oxygen species and the mitochondrial membrane potential are modulated during onion oil-induced cell cycle arrest and apoptosis in A549 cells[J]. J Nutr, 2006, 136(3): 608–613. |
| [30] | YUAN S Z, WEN J Y, CHENG J, et al. Age-associated up-regulation of EGR1 promotes granulosa cell apoptosis during follicle atresia in mice through the NF-κB pathway[J]. Cell Cycle, 2016, 15(21): 2895–2905. DOI: 10.1080/15384101.2016.1208873 |



