脂肪细胞主要分布在动物的皮下和内脏周围,在机体内扮演着重要的作用,如维持体型结构、储存能量、维持体温和受到机械撞击时的缓冲作用。然而太多的脂肪也会造成机体能量代谢不平衡,增加代谢性疾病(如二型糖尿病、高脂血症和脂肪肝)的风险。现有的研究认为,前体脂肪细胞是由间充质干细胞定向分化而来,进而向成熟的脂肪细胞分化。相对人和其他动物,家兔无论是肌间脂肪还是皮下脂肪的沉积都相对较少。因此,正确理解家兔前体脂肪细胞的沉积和分化,可为改善兔肉品质提供有价值的信息。
前体脂肪细胞分化发生在动物的各个生理阶段,受到许多基因和信号通路的调控。目前已发现的信号通路主要有:刺猬蛋白信号通路(Hedgehog,Hh)、丝裂原活化的蛋白激酶信号通路(Mitogen Activated Protein Kinase,MAPK)、WNT (Wingless-Type MMTV integration site family members)信号通路等[1],而分化的开始与进展取决于一氧化氮[2]和胰岛素[3]等各种因子的刺激。不仅如此,脂肪细胞分化还涉及到许多特异转录因子的调控。C/EBPa和PPARγ是前体脂肪细胞分化的关键转录因子[4],几乎所有前体脂肪细胞特异的基因在脂肪细胞终末分化时都受到这2个转录因子的调控,同时这2个转录因子也可作为脂肪细胞分化的标志基因。
MicroRNA(miRNA)是一类长度为19~22 nt的非编码小RNA,主要通过靶向mRNA的UTR区发挥作用,不完全靶向可抑制该mRNA发挥作用,完全靶向则会降解该mRNA[5]。研究表明,miRNA参与前体脂肪细胞的增殖和分化,例如miRNA-21可以通过靶向TGF-β信号通路中TGFBR2基因抑制人脂肪组织中间充质干细胞向成熟脂肪细胞的定向分化[6];miR-27b可以直接靶向PPARγ抑制3T3-L1和MSC细胞成脂分化[7-8];miR-155可以通过靶向CREB促进3T3-L1细胞的成脂分化[9]。越来越多的研究证实,miR-130b在多种生命活动中发挥重要的作用。研究发现,miR-130b可促进癌细胞的增殖和侵袭[10-12]。另外,miR-130b特异性下调可以影响肺腺上皮细胞IGF-1的分泌,并预防肺腺上皮纤维化[13]。近年来也有文献报道miRNA-130b可调控脂肪分化,如胞外囊泡携带的miR-130b可以进入脂肪细胞,靶向转录因子PPARγ,抑制猪原代前体脂肪细胞的脂肪沉积[14]。但miR-130b在家兔前体脂肪细胞分化中的作用,还不清楚。因此,本试验通过对家兔前体脂肪细胞的原代培养和构建成脂分化细胞模型,过表达和抑制表达miR-130b并诱导分化前体脂肪细胞,初步探究miR-130b在家兔前体脂肪细胞分化过程中的作用机制。
1 材料与方法 1.1 动物组织采集本试验在四川农业大学动物科技学院实验动物护理和使用委员会的批准下进行。本试验采用四川农业大学雅安校区农场饲养的新生新西兰兔作为试验兔。处死3只初生仔兔后,迅速采集心、肝、脾、肺、肾、腿肌、肾周脂肪各1 g左右,快速放入液氮中保存。
1.2 RNA的抽提与反转录采用Trizol法提取各组织和细胞总RNA。总RNA的纯度用OD260 nm/OD280 nm和OD260 nm/OD230 nm比值判定,其完整性通过1.5%琼脂糖凝胶电泳评估。参照反转录试剂盒(TaKaRa,Mir-XTM miRNA First-Strand Synthesis Kit货号:1604342A和TaKaRa, PrimeScriptTM RT reagent Kit with gDNA Eraer货号AK4002)进行miRNA和mRNA的反转录,得到各自的cDNA,保存于-20 ℃冰箱。
1.3 miRNA和mRNA定量检测组织样本和细胞的miRNA-130b和mRNA的表达量用U6和GAPDH作为内参进行实时荧光定量PCR(RT-qPCR)检测,miRNA定量体系(10 μL体系):5 μL SYBR green Ⅱ,0.5 μL上游引物、0.5 μL下游引物,3 μL的去RNA灭菌水,1 μL cDNA。定量程序:95 ℃预变性30 s;38个循环:95 ℃ 5 s,61 ℃ 20 s;熔解曲线:95 ℃ 10 s,65 ℃ 5 s,95 ℃ 30 s。mRNA的定量体系(10 μL体系):5 μL SYBR green Ⅰ,0.4 μL上游引物、0.4 μL下游引物,3.2 μL的去RNA灭菌水,1 μL cDNA。定量程序:95 ℃预变性10 s;38个循环:95 ℃ 5 s,61 ℃(按引物最适退火温度调节)20 s;熔解曲线:95 ℃ 1 min,55 ℃ 30 s,95 ℃ 15 s。所有的PCR产物通过熔解曲线分析。本试验所用引物均由成都擎科生物有限公司合成(表 1)。
|
|
表 1 引物序列 Table 1 Primer sequence |
在无菌条件下采集少量初生新西兰兔的肾周脂肪组织,剪碎后,用0.1% Ⅰ型胶原酶消化60 min,完全培养基(DMEM/F12+10%胎牛血清+2%青链霉素混合液)终止消化,再用100和40 nm的细胞筛过滤,1 000 r·min-1离心5 min,弃上清,加入新的完全培养基,吹打混匀,接种于T25细胞培养瓶,置于细胞培养箱(5% CO2,37 ℃),48 h更换培养基。
1.5 转染、诱导分化及染色当24孔板细胞密度达到80%时,用Lipofactamine 3000(lip3000; Invitrogen, Carlsbad, CA, USA)转染miR-130b-mimic和miR-130b-inhibitor。转染终浓度:mimic和mimic NC为50 nmol·L-1;miR-130b-inhibitor和miR-130b-inhibitor NC为100 nmol·L-1。转染6 h后换诱导分化培养基(1.7 μmol·L-1胰岛素,1 μmol·L-1地塞米松,0.5 mmol·L-1 IBMX,鸡尾酒法)诱导分化48 h后替换维持分化培养基(1.7 μmol·L-1胰岛素),维持48 h替换完全培养基。用10%的中性甲醛固定6孔板细胞30 min后,油红O染色30 min,在100倍(100×)和200倍(200×)显微镜下鉴定脂肪滴的含量并拍照。
1.6 靶基因预测参考miRBase数据库对miR-130b进行同源性分析,并用Targetscan对miR-130b进行靶基因预测。
1.7 数据分析本试验过程均采用3个生物学重复和3个技术重复。RT-qPCR检测的mRNA的表达量计算以GAPDH作为内参,miRNA的表达量计算以U6 snRNA作为内参。所有结果采用2-△△CT计算,以“平均值±标准误”表示,并用SAS 8.0检测显著性,用GraphPad Prism 7进行结果作图。
2 结果 2.1 miR-130b参与家兔前体脂肪细胞分化为了探明miR-130b在家兔各个组织中的表达谱,试验通过RT-qRCR检测了miR-130b在初生兔各组织中的表达情况。以心肌作为对照,miR-130b的表达量在肾和肝中极显著高于心肌(图 1A,P<0.01);miR-130b的表达量在腿肌中显著低于心肌(图 1A,P<0.05);在脾、肺、脂肪组织较心肌中miR-130b的表达量差异不显著。结果显示,miR-130b在家兔体内各个组织中差异表达,广泛参与家兔生命活动的调节。
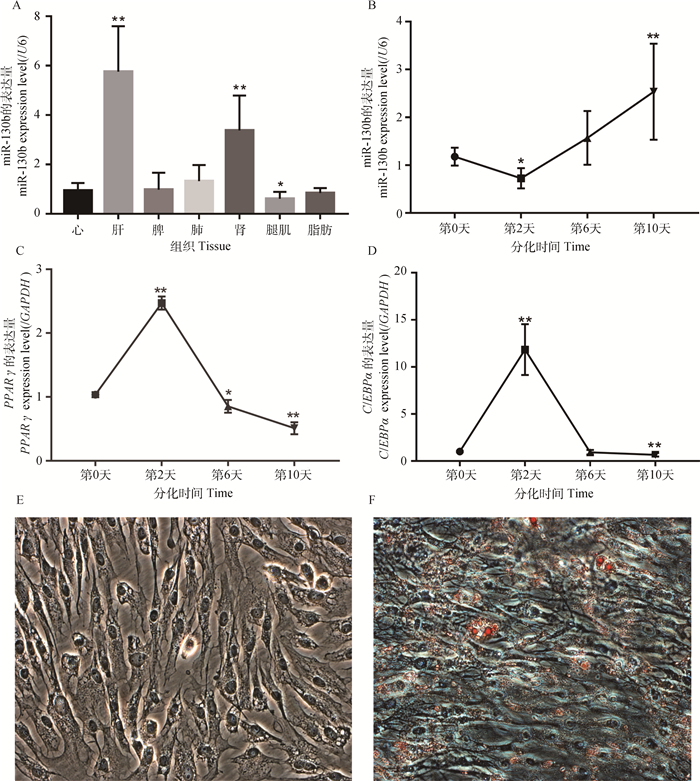
|
A. miR-130b在心、肝、脾、肺、肾、腿肌、脂肪的表达;B. miR-130b在脂肪细胞分化过程中的表达;C. PPARγ在脂肪细胞分化过程中的表达;D. C/EBPα在脂肪细胞分化过程中的表达;E.诱导分化第0天,脂肪细胞油红O染色(100×);F.诱导分化第8天,脂肪细胞油红O染色(100×)。*. P ≤0.05;**. P<0.01,下同 A. The expression of miR-130b in heart, liver, spleen, lung, kidney, leg muscle and adipose; B. Expression of miR-130b during adipocyte differentiation; C. Expression of PPARγ during adipocyte differentiation; D. Expression of C/EBPα during adipocyte differentiation; E, F. Oil Red O staining adipogenic differentiation at day 0 and 8(100×). *. P ≤0.05; **. P < 0.01, the same as below 图 1 miR-130b在家兔心、肝、脾、肺、肾、腿肌、脂肪中的表达量及前体脂肪细胞的分化 Figure 1 The expression of miR-130b in heart, liver, spleen, lung, kidney, leg muscle, fat in rabbit and the differentiation of preadipocyte |
用油红O染色法鉴定前体脂肪细胞是否分化,结果显示,分化第0天,细胞中并未出现橘红色脂滴(图 1E),诱导分化第8天时,脂肪细胞中出现大量的橘红色脂滴(图 1F)。为了进一步验证前体脂肪细胞是否分化,笔者通过qPCR检测PPARγ和C/EBPα的表达量,发现PPARγ在分化第2天较第0天极显著升高(P<0.01),而第6天显著低于第0天(P<0.05),第10天极显著低于第0天(图 1C,P<0.01),C/EBPα在分化第2天较第0天极显著升高(P<0.01),而第6天低于第0天,但差异不显著,第10极显著低于第0天(图 1D,P<0.01)。miR-130b在分化第2天时较第一天显著降低(P<0.05),分化第10天极显著高于第0天(图 1B,P<0.01)。结果显示,鸡尾酒法成功诱导家兔前体脂肪细胞分化,且miR-130b可能参与前体脂肪细胞的分化。
2.2 miR-130b靶基因的预测通过对miR-130b进行同源性分析发现,miR-130b在小鼠、人、大鼠、鸭嘴兽等哺乳动物中高度保守,而在鲑鱼中3′端有2个碱基的缺失。靶基因预测发现,miR-130b的种子序列可以完全靶向PPARγ的UTR区,推测PPARγ可作为其潜在的靶向调控基因(图 2)。

|
图 2 同源性分析及miR-130b潜在靶基因的预测 Figure 2 Homology analysis and the prediction of the potential target gene for miR-130b |
为了进一步探明miR-130b对家兔前体脂肪细胞的作用机制,通过构建合成mimic(miRNA类似物),并利用lip3000作为载体转染入细胞内。转染6 h后,相对于NC组,mimic组miRNA-130b表达量升高2 500倍左右,极显著高于NC组(图 3A,P<0.01)。在分化第2天时,mimic组PPARγ和C/EBPα的表达量极显著低于NC组(图 3B、3C,P<0.01)。油红O染色发现,分化第8天mimic组(图 3H、3K)橘红色脂肪滴明显少于NC对照组(图 3G、3J)。结果表明,过表达miR-130b可以抑制家兔前体脂肪细胞分化。
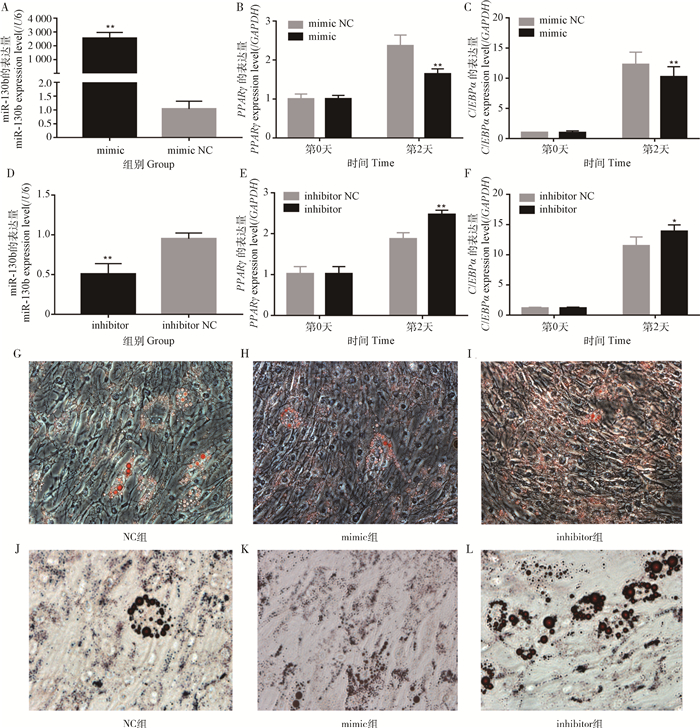
|
A. mimic和mimic NC组miR-130b表达量;B、C. mimic和mimic NC组PPARγ和C/EBPα的表达量;D. inhibitor和inhibitor NC组miR-130b表达量;E、F. inhibitor和inhibitor NC组PPARγ和C/EBPα的表达量;G、H、I分别为前体脂肪细胞诱导分化第8天NC组、mimic组和inhibitor组油红O染色(100×);J、K、L分别为前体脂肪细胞诱导分化第8天NC组、mimic组和inhibitor组油红O染色(200×) A. The expression of miR-130b in mimic and mimic NC groups; B, C. The expression of PPARγ and C/EBPα in mimic and mimic NC groups; D. The expression of miR-130b in inhibitor and inhibitor NC groups; E, F. The expression of PPARγ and C/EBPα in inhibitor and inhibitor NC groups; G, H, I. Oil Red O staining adipogenic differentiation at Days 8 in NC group, mimic group, inhibitor group (100×); J, K, L. Oil Red O staining adipogenic differentiation at Days 8 in NC group, mimic group, inhibitor group (200×) 图 3 过表达和抑制表达miR-130b对家兔前体脂肪细胞分化的影响 Figure 3 The effects of overexpression and inhibition of miR-130b on preadipocytes differentiation in rabbit |
向前体脂肪细胞转染miRNA-130b inhibitor 6 h后发现,inhibitor组miR-130b的表达量极显著低于inhibitor NC组(图 3D,P<0.01);诱导分化第2天时inhibitor组PPARγ的表达量极显著高于inhibitor NC组(图 3E,P<0.01),C/EBPα的表达量显著高于inhibitor NC组(图 3F,P<0.05);油红O染色发现,分化第8天inhibitor组(图 3I、3L)橘红色脂肪滴明显多于NC对照组(图 3G、3J)。mimic NC组与inhibitor NC组诱导分化后,油红O染色水平上高度一致,所以试验结果中,油红O染色图只用mimic NC作为对照组,即NC组。结果表明,抑制miR-130b的表达可以促进家兔前体脂肪细胞分化。
3 讨论成脂分化是一个复杂的且与基因表达密切相关的过程,目前,有大量成脂分化相关基因被发现,例如PPARγ和C/EBPα,它们的结构和功能都比较清楚。PPARγ可以参与调节细胞分化、脂糖代谢和胰岛素信号等,且PPARγ在脂肪组织中特异表达,通常在分化前期被诱导生成,对于脂肪分化起关键的作用[15]。C/EBPα并不在脂肪组织中特异性表达,但其表达量在前体脂肪细胞分化过程中显著升高,并且能启动其他脂肪细胞特异性基因的转录,如Ap2,葡萄糖转运子4(Glucose Transporter 4, GLUT4)、瘦素(Leptin)等[16]基因,促进前体脂肪细胞进入终末分化。本试验选择PPARγ和C/EBPα作为家兔前体脂肪细胞分化的标志基因,检测脂肪细胞是否分化。前人研究发现,在诱导人间充质干细胞成脂分化时,随着细胞分化,PPARγ和C/EBPα表达量逐渐升高,且第10天仍然显著高于第0天[17]。在诱导猪前体脂肪细胞成脂分化第8天,PPARγ和C/EBPα表达量仍然极显著高于第0天[18]。而在家兔前体脂肪细胞诱导分化过程中,PPARγ和C/EBPα均在第2天升高,但在第6天时显著低于第0天,第10天时也极显著低于第0天,但油红O染色显示,家兔前体脂肪细胞分化第8天时分化程度高且大量脂滴聚集。这与其他研究有不同之处,可能是由于物种不同而产生的差异,具体机制仍需进一步研究。
本研究发现,mimic NC组与inhibitor NC组诱导分化时,无论是在基因表达水平,还是油红O染色水平上都高度一致,所以试验结果中,油红O染色图只用mimic NC作为对照组。目前对于家兔前体脂肪细胞分化的研究屈指可数,但关于3T3细胞分化的研究甚多。相较于3T3细胞[18-20],家兔前体脂肪细胞分化第8天时,橘红色大脂滴合成较少,且小脂滴较多。笔者认为,这种差异可能是由于物种差异、前体脂肪细胞分化程度不同以及合成脂滴的能力不同造成的,具体原因,有待进一步研究。
本研究发现,miR-130b在家兔体内各个组织均有表达,说明miR-130b广泛参与到动物体内的生命活动,且在前体脂肪细胞分化的过程中存在差异表达。由此,笔者推测miR-130b可能参与调控脂肪细胞分化。为了进一步探究miR-130b在前体脂肪细胞分化过程中的作用机制,笔者通过在线生物信息学软件预测PPARγ可以作为miR-130b的潜在靶基因。而前人对于miR-130b的研究主要集中在肿瘤疾病相关领域,比如,miR-130b可以通过靶向肿瘤蛋白53诱导核蛋白1的表达,促进CD133(+)肝肿瘤起始细胞的生长和更新[21];miR-130b是预后标志物,可以通过靶向STAT3抑制胰腺癌细胞的增殖和侵袭能力;miR-130b可以通过抑制PTEN的表达和Akt磷酸化在食管癌细胞中的致癌作用,从而抑制癌症的发生[22];miR-130b也参与调控增殖和分化,研究发现,miR-130b可以靶向FMR1基因调节胚胎神经前体细胞的增殖和分化[23];有研究发现,miR-130b参与调控脂肪细胞的脂质代谢,miR-130b可以靶向PPARγ辅助因子-1α抑制山羊乳腺上皮细胞的脂肪代谢[24];E.K.Lee等[25]发现,miR-130b强烈的影响脂肪细胞的分化,过表达miR-130b可以抑制脂肪细胞的分化,抑制表达miR-130b可以促进脂肪细胞的分化,进一步研究发现,miR-130b是通过靶向降解PPARγ抑制人前体脂肪细胞和3T3细胞的分化,本试验研究结果与其一致。过表达miR-130b后,PPARγ和C/EBPα的表达量显著低于NC组,而抑制miR-130b后,PPARγ和C/EBPα的表达量显著高于NC组,油红O染色结果与之一致,说明在家兔前体脂肪细胞分化的过程中,miR-130b起负调控作用,进一步证实miR-130b可通过靶向PPARγ抑制家兔前体脂肪细胞的分化。
4 结论本试验结果表明,miR-130b在各个组织中均有表达,且在肾和肝组织中表达量最高,肌肉组织中表达量最低;miR-130b在家兔前体脂肪细胞分化的过程中差异表达;miR-130b过表达和抑制表达试验发现,miR-130b可以通过靶向PPARγ抑制家兔前体脂肪细胞的分化。本研究结果可以为研究家兔脂肪的沉积及脂肪细胞分化的分子机制提供基础信息。
| [1] | MURUGANANDAN S, ROMAN A A, SINAL C J. Adipocyte differentiation of bone marrow-derived mesenchymal stem cells:cross talk with the osteoblastogenic program[J]. Cell Mol Life Sci, 2009, 66(2): 236–253. DOI: 10.1007/s00018-008-8429-z |
| [2] | YAN H, AZIZ E, SHILLABEER G, et al. Nitric oxide promotes differentiation of rat white preadipocytes in culture[J]. J Lipid Res, 2003, 43(12): 2123–2129. |
| [3] | GABEN-COGNEVILLE A M, ARON Y, IDRISS G, et al. Differentiation under the control of insulin of rat preadipocytes in primary culture. Isolation of homogeneous cellular fractions by gradient centrifugation[J]. BBA-Mol Cell Res, 1983, 762(3): 437–444. |
| [4] | ROSEN E D, MACDOUGALD O A. Adipocyte differentiation from the inside out[J]. Nat Rev Mol Cell Biol, 2006, 7(12): 885. DOI: 10.1038/nrm2066 |
| [5] | GREGORY R I, CHENDRIMADA T P, COOCH N, et al. Human RISC couples microRNA biogenesis and posttranscriptional gene silencing[J]. Cell, 2005, 123(4): 631–640. DOI: 10.1016/j.cell.2005.10.022 |
| [6] | KIM Y J, HWANG S J, YONG C B, et al. MiR-21 regulates adipogenic differentiation through the modulation of TGF-β signaling in mesenchymal stem cells derived from human adipose tissue[J]. Stem Cells, 2009, 27(12): 3093–3102. |
| [7] | KIM S Y, KIM A Y, LEE H W, et al. miR-27a is a negative regulator of adipocyte differentiation via suppressing PPARgamma expression[J]. Biochem Bioph Res Co, 2010, 392(3): 323–328. DOI: 10.1016/j.bbrc.2010.01.012 |
| [8] | LIN Q, GAO Z, ALARCON R M, et al. A role of miR-27 in the regulation of adipogenesis[J]. Febs J, 2009, 276(8): 2348. DOI: 10.1111/ejb.2009.276.issue-8 |
| [9] | LIU S, YANG Y, WU J. TNFα-induced up-regulation of miR-155 inhibits adipogenesis by down-regulating early adipogenic transcription factors[J]. Biochem Bioph Res Co, 2011, 414(3): 618–624. DOI: 10.1016/j.bbrc.2011.09.131 |
| [10] | LAI K W, KOH K X, LOH M, et al. MicroRNA-130b regulates the tumour suppressor RUNX3 in gastric cancer[J]. Eur J Cancer, 2010, 46(8): 1456–1463. DOI: 10.1016/j.ejca.2010.01.036 |
| [11] | COLANGELO T, FUCCI A, VOTINO C, et al. MicroRNA-130b promotes tumor development and is associated with poor prognosis in colorectal cancer[J]. Neoplasia, 2013, 15(9): 1086–1099. DOI: 10.1593/neo.13998 |
| [12] | LI B L, LU C, LU W, et al. miR-130b is an EMT-related microRNA that targets DICER1 for aggression in endometrial cancer[J]. Med Oncol, 2013, 30(1): 484. DOI: 10.1007/s12032-013-0484-0 |
| [13] | LI S, GENG J, XU X, et al. miR-130b-3p modulates epithelial-mesenchymal crosstalk in lung fibrosis by targeting IGF-1[J]. PLoS One, 2016, 11(3): e0150418. DOI: 10.1371/journal.pone.0150418 |
| [14] | PAN S, YANG X, JIA Y, et al. Microvesicle-shuttled miR-130b reduces fat deposition in recipient primary cultured porcine adipocytes by inhibiting PPARγ expression[J]. J Cell Physiol, 2014, 229(5): 631–639. DOI: 10.1002/jcp.v229.5 |
| [15] | FAJAS L, FRUCHART J C, AUWERX J. Transcriptional control of adipogenesis[J]. Curr Opin Cell Biol, 1998, 10(2): 165. DOI: 10.1016/S0955-0674(98)80138-5 |
| [16] | YEH W C, CAO Z, CLASSON M, et al. Cascade regulation of terminal adipocyte differentiation by three members of the C/EBP family of leucine zipper proteins[J]. Gene Dev, 1995, 9(2): 168. DOI: 10.1101/gad.9.2.168 |
| [17] | SHI C, MIN Z, TONG M, et al. miR-148a is associated with obesity and modulates adipocyte differentiation of mesenchymal stem cells through Wnt signaling[J]. Sci Rep-UK, 2015, 5: 9930. DOI: 10.1038/srep09930 |
| [18] | JI H L, SONG C C, LI Y F, et al. miR-125a inhibits porcine preadipocytes differentiation by targeting ERRα[J]. Mol Cell Biochem, 2014, 395(1): 155–165. |
| [19] | GUO Y, CHEN Y, ZHANG Y, et al. Up-regulated miR-145 expression inhibits porcine preadipocytes differentiation by targeting IRS1[J]. Int J Biol Sci, 2012, 8(10): 1408–1417. DOI: 10.7150/ijbs.4597 |
| [20] | LIU S Y, ZHANG Y Y, GAO Y, et al. MiR-378 plays an important role in the differentiation of bovine preadipocytes[J]. Cell Physiol Biochem, 2015, 36(4): 1552–1562. DOI: 10.1159/000430318 |
| [21] | MA S, TANG K H, CHAN Y P, et al. miR-130b promotes CD133(+) liver tumor-initiating cell growth and self-renewal via tumor protein 53-induced nuclear protein 1[J]. Cell Stem Cell, 2010, 7(6): 694–707. DOI: 10.1016/j.stem.2010.11.010 |
| [22] | YU T, CAO R, LI S, et al. MiR-130b plays an oncogenic role by repressing PTEN expression in esophageal squamous cell carcinoma cells[J]. BMC Cancer, 2015, 15(1): 1–9. DOI: 10.1186/1471-2407-15-1 |
| [23] | GONG X, ZHANG K, WANG Y, et al. MicroRNA-130b targets Fmr1 and regulates embryonic neural progenitor cell proliferation and differentiation[J]. Biochem Bioph Res Co, 2013, 439(4): 493. DOI: 10.1016/j.bbrc.2013.08.096 |
| [24] | CHEN Z, LUO J, MA L, et al. MiR130b-regulation of PPARγ coactivator-1α suppresses fat metabolism in goat mammary epithelial cells[J]. PLoS One, 2015, 10(11): e0142809. DOI: 10.1371/journal.pone.0142809 |
| [25] | LEE E K, LEE M J, ABDELMOHSEN K, et al. miR-130 suppresses adipogenesis by inhibiting peroxisome proliferator-activated receptor gamma expression[J]. Mol Cell Biol, 2011, 31(4): 626. DOI: 10.1128/MCB.00894-10 |



