2. 山西农业大学生命科学学院, 太谷 030801;
3. 山西医科大学基础医学院, 太原 030001
2. College of Life Science, Shanxi Agricultural University, Taigu 030801, China;
3. School of Basic Medical Sciences, Shanxi Medical University, Taiyuan 030001, China
动物的肤色是由表皮角质细胞中黑色素的种类和数量决定的,黑色素的生成是一个复杂的过程,在黑色素细胞中,黑素体是产生黑色素特有的细胞器,在黑色素生成过程中会产生具有细胞毒性的多巴醌,因此黑色素必须在黑素体中生成,黑色素有真黑素和褐黑素2种类型,随黑素体到达表皮角化细胞的黑色素种类、数量和比例决定了动物的肤色和毛色。黑色素的生成受多个基因的调控,但酪氨酸酶(TYR)及其相关蛋白是黑色素生成的重要调控因子,TYR是黑色素生成的限速酶,酪氨酸相关蛋白酶1(TYRP1)和酪氨酸相关蛋白酶2(TYRP2)主要参与调控真黑素的生成,小眼畸形相关转录因子(MITF)也是黑色素形成的关键因子, 该因子通过结合TYR、TYRP1和TYRP2共有的启动子保守元件——即含有CATGTG保守序列的M-box盒子而调控TYR、TYRP1和TYRP2的表达,进而调控黑色素的生成[1]。
MicroRNAs (miRNAs)是一类小的非编码RNA,一般由20个左右的核苷酸组成,它们通过部分碱基(一般7~8个碱基)之间碱基互补的方式结合到靶基因的3′非翻译区,miRNAs一旦与靶基因结合就会导致mRNA的降解或抑制靶基因蛋白的翻译,因此miRNAs对靶基因的调控是转录后调控,并且大多数是负调控[2-3],最近也发现,有些miRNA是正调控,如miR-66对sGC基因的调控就是正调控[4],但其调控机制目前还不清楚。
近年来已经发现有多种miRNA参与调控皮肤黑色素的形成,如miR-434通过抑制TYR的表达从而使皮肤变白[5];miR-25、miR-218、miR-137通过调控MITF的表达使黑色素的生成减少[6-8],miR-145、miR-193、miR-324通过调控靶基因减少皮肤黑色素的沉积等[9-11]。有文献报道,miR-186与许多种癌症的形成有关,并称它为一种“癌症抑制因子”,H.J.Qiu等[12-13]研究发现,miR-186在黑色素瘤组织和黑色素瘤细胞中表达异常,且miR-186过表达影响黑色素瘤细胞的增殖、迁移,因此推断,miR-186可能与正常黑色素细胞的功能有关,与正常黑色素细胞的迁移、增殖有关,也可能与毛色的形成有关。
综上,miRNAs通过调控与黑色素生成相关的各种因子来调节黑色素的生成,而且研究表明,很多因素如一些炎症介质和细胞因子SCF、ET-1、神经生长因子等不仅能促进体外黑色素细胞的增殖,并且对黑色素细胞的运动及TYR的活性都有显著的影响[14-15],但关于miRNAs对细胞增殖、迁移的影响大都集中在癌症、肿瘤细胞的研究中[16-17],本研究通过TargetScan、miRBase等数据库预测miR-186的靶基因,并通过在体外培养的正常绵羊黑色素细胞中转染miR-186表达载体来探究其对正常黑色素细胞增殖和迁移的影响。
1 材料与方法 1.1 材料 1.1.1 miRNAs载体的构建及引物合成miRNAs的真核表达载体为pcDNA6.2-GW/EmGFPmiR (Invitrogen),该表达载体上连有绿色荧光报告蛋白(Green fluorescent protein,GFP),可根据有无绿色荧光判断转染效果,miR-186-5p真核表达载体、阴性对照真核表达载体、抑制miR-186的真核表达载体均由Invitrogen公司构建,绵羊黑色素细胞系由本实验室分离鉴定培养,相关引物(表 1)由北京六合华大科技股份有限公司合成。
|
|
表 1 引物序列 Table 1 The primer sequences |
Trizol试剂(Invitrogen,美国),壮观霉素、反转录PCR试剂盒(TaKaRa, 大连),黑素细胞培养基(ScienCell,美国),质粒中提试剂盒(QIAGEN,美国),SYBR Prime Script TMRT PCR KIT (TaKaRa,大连),高速低温冷冻离心机(Sigma,德国),超净工作台(SW-CJ-CO,苏州),7500 Fast Real time PCR System(Life technologies,美国),核酸蛋白测定仪(Thermo,美国)。
1.2 试验方法 1.2.1 皮肤样品的采集本试验随机选择3只头颈部有黑色斑点的成年苏尼特羊为试验对象,按照山西农业大学试验动物管理办法,进行麻醉取材。黑色和白色被毛部位分别取1 cm2皮肤组织各3块,皮肤离体后迅速置于液氮中备用。
1.2.2 黑色素细胞的复苏绵羊黑色素细胞系由本实验室保存。从液氮中取出细胞,迅速放入37 ℃预热的水浴中溶解复苏,离心收集细胞后,新鲜培养基重悬细胞,最后将细胞均匀的接种于6孔细胞培养板中,37 ℃,5% CO2条件下在细胞培养箱中培养。24 h后更换新鲜培养基,细胞密度长到80%左右时进行传代或转染。
1.2.3 黑色素细胞的转染传代后,黑色素细胞密度达到80%左右时进行转染。为了提高转染效率,制备不含双抗的转染用培养基,经预试验验证6孔板每孔3 μg质粒转染效果最佳。在1个1.5 mL的离心管中加入250 μL的转染用培养基和3 μg的含有miRNAs的质粒DNA,二者混匀孵育5 min备用,在另1个1.5 mL的离心管中加入250 μL的转染用培养基和6 μL的DNA转染试剂混匀,然后将2个离心管中的溶液混合并孵育20 min。期间除去细胞中的培养基,每孔中添加1 mL的转染用培养基,最后将含有DNA转染试剂与DNA复合物的混合物均匀接种于培养孔中,置于CO2细胞培养箱中培养,24 h后用完全培养基终止转染,继续培养48 h后收集细胞备用。做划痕试验的细胞转染后,用10 μL枪头在培养孔中轻轻划出痕迹,最后将培养板置于细胞培养箱中培养,每隔24 h观察划痕处细胞生长情况,并拍照记录。
本试验设计了试验组(miR组,转染miR-186-5p真核表达载体)、阴性对照组(NC组,转染NC真核表达载体)、抑制组(inhibitor组,转染抑制miR-186-5p的真核表达载体),每组设9个重复,其中3孔细胞用于黑色素含量测定, 3孔细胞用于提取总RNA,另外3孔细胞用于划痕试验。
1.2.4 细胞黑色素含量测定转染48 h后去除培养基,PBS冲洗细胞3次并进行细胞计数,80 ℃金属浴中0.2 mol·L-1NaOH裂解细胞,裂解液加入酶标板,每个样品3个重复,使用酶标仪记录波长475 nm时的吸光值,根据细胞计数值与475 nm时的吸光值计算各组黑色素的相对含量(μg·10-6个细胞)
1.2.5 Real-time RT-PCR检测取出液氮中保存的皮肤组织,在液氮中研磨,根据Trizol法提取皮肤总RNA,然后用反转录试剂对总RNA进行反转录,获得不同绵羊毛色皮肤cDNA。体外培养的绵羊黑色素细胞转染48 h后,方法同上制备cDNA。
根据已有关于miR-186-5p在皮肤各种疾病中作用的报道,推测其与毛色可能存在一定的关系,在miRBase数据库中查找相关序列,并根据已知序列设计绵羊miR-186和U6的RT-PCR扩增引物,引物序列见表 1。按照荧光定量试剂使用说明进行RT-PCR试验,cDNA样品浓度统一后作为RT-PCR的模板,每个样品重复3次。反应体系10 μL:SYBR Premix 5 μL,上下游引物各0.2 μL,cDNA模板1 μL、RNase Free H2O 3.6 μL。反应条件:95 ℃预变性10 min;95 ℃变性10 s;60 ℃退火30 s;72 ℃延伸10 s;40个循环。
1.3 数据分析miR-186-5p的mRNA表达水平、各试验组黑色素含量等指标都采用SPSS软件进行差异显著性分析,结果以“均值±标准差(Means±SD)”表示,其中miR-186-5p的相对表达量采用2-ΔΔCT方法计算,以U6为内参基因。
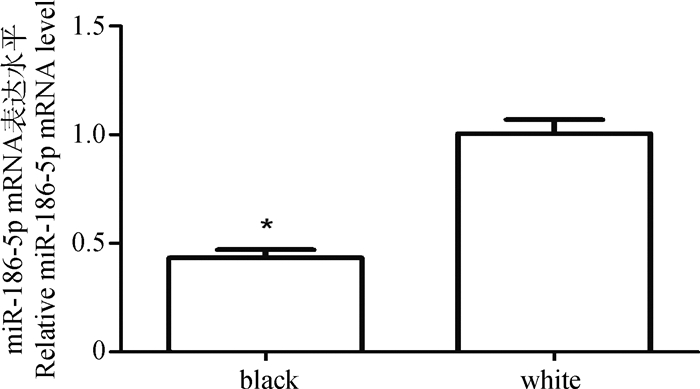
2 结果 2.1 不同绵羊毛色皮肤中miR-186-5p mRNA表达水平的差异RT-PCR结果表明,绵羊白色和黑色被毛皮肤中均有miR-186-5p表达,但白色皮肤中miR-186-5p mRNA表达高于黑色皮肤且差异显著(P<0.05)(图 1),是黑色皮肤的2.56倍,说明miR-186-5p与皮肤毛色有关。
|
*. P<0.05. The same as below 图 1 不同毛色绵羊皮肤中miR-186-5p mRNA表达水平 Figure 1 Expression analysis of miR-186-5p in white and black sheep skins |
miRNAs靶基因预测软件分析结果表明,MITF是miR-186-5p的靶基因之一,并且与miR-186-5p的结合位点在MITF 3′UTR的970~977 bp区域(图 2),由图 2可知,各种动物MITF 3′UTR序列相对保守,且与miR-186-5p结合的序列大都是AUUCUUUA,而miR-186-5p的结合序列是UAAGAAAC。

|
图 2 miR-186-5p与MITF 3′UTR的结合位点 Figure 2 The binding site of miR-186-5p to MITF 3′UTR |
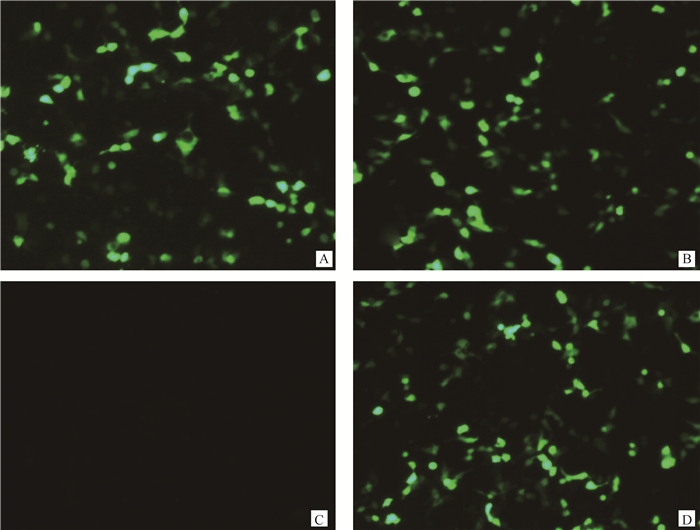
转染48 h后,在倒置显微镜下观察转染绵羊黑色素细胞中绿色荧光表达情况,由图 3可见所有转染了真核表达载体的细胞都有均一的绿色荧光,而没有转染的正常绵羊黑色素细胞没有绿色荧光,说明转染良好,各表达载体都成功转入目的细胞。
|
A. miR组;B. NC组;C.正常绵羊黑色素细胞;D. inhibitor组 A. miR-186-5p-sheep melanocytes; B. miR-186-NC-sheep melanocytes; C. Normal sheep melanocytes; D. miR-186-inhibitor-sheep melanocytes 图 3 黑色素细胞的转染效率(100×) Figure 3 The efficiency of transfecting in melanocytes (100×) |
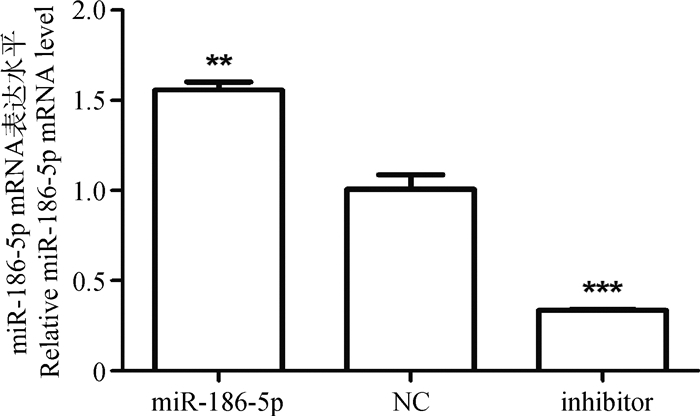
转染后,各组转染细胞中miR-186-5p mRNA的表达差异结果如图 4所示,miR组miR-186-5p的表达量明显上升,是NC组的1.56倍,且差异极显著(P<0.01),而inhibitor组miR-186-5p的表达量明显降低,与NC组相比下降了3.03倍,且差异极显著(P<0.001),说明各组细胞转染成功,且绵羊黑色素细胞中转染miR-186-5p表达载体能促进miR-186-5p的表达,而其抑制载体也能抑制其表达,说明各个载体构建成功。
|
**. P<0.01; ***. P<0.001 图 4 各转染组中miR-186-5p mRNA表达水平检测 Figure 4 Expression analysis of miR-186-5p in different transfected groups |
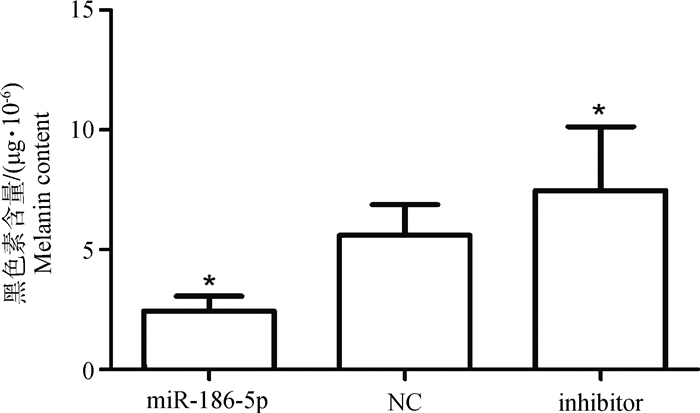
黑色素含量测定结果显示,miR组的黑色素含量明显降低,与NC组相比下降了2.33倍,且差异显著(P<0.05),而inhibitor组的黑色素含量则明显升高,与NC组相比提高了1.34倍,差异显著(P<0.05)(图 5)。由此可见,黑色素细胞中转染miR-186-5p能下调黑色素的生成,而抑制miR-186-5p表达的细胞中黑色素的生成增加,由此说明miR-186-5p能抑制黑色素的生成。
|
图 5 各转染组的黑色素含量 Figure 5 Melanin content in different transfected groups |
黑色素细胞转染后轻轻划出痕迹,如图 6每张细胞片中没有细胞的区域是划出的痕迹,0、24、36、48 h观察划痕处细胞的生长情况并拍照,由图 6可看出,转染24 h后各组细胞划痕处细胞生长情况差不多,划痕处细胞增殖不明显,只有inhibitor组在划痕处看到有少数细胞的生长,各组细胞划痕处细胞生长及其差异主要出现在转染36 h后,由图 6可看出,转染36 h后miR组划痕处细胞最少,inhibitor组划痕处细胞最多,NC组划痕处细胞密度介于二者之间。转染48 h后划痕处细胞基本长满,但inhibitor组划痕处细胞密度最大,基本看不到划痕,而miR组和NC组划痕处细胞密度相对较小,划痕痕迹依稀可见,但NC组划痕处细胞密度又较miR组大。总之inhibitor组划痕处细胞长得最快,其次是NC组,最后才是miR组,由此可见,miR-186-5p抑制了绵羊黑色素细胞的增殖和迁移,而抑制miR-186-5p表达则会促进黑色素细胞的增殖和迁移。

|
A. miR组;B. NC组;C. inhibitor组。1~4.分别为转染后0、24、36、48 h A. miR-186-5p-sheep melanocytes; B. miR-186-NC-sheep melanocyts; C. miR-186-inhibitor-sheep melanocyts. 1-4. Post transfection 0, 24, 36, 48 h 图 6 划痕试验检测各转染组黑色素细胞的增殖和迁移能力(40×) Figure 6 Capacity of migration and proliferation in different transfected groups by wound-healing assay (40×) |
miRNAs是一类含有18~25个核苷酸的内源性非编码RNA,通过部分碱基互补的方式结合到靶基因mRNA的3′-UTR并对该基因进行转录后调控[3],大量研究表明,miRNAs参与细胞的生长、分化和凋亡,并在动物的生长发育和疾病的发展过程中起调控作用,而且大多数miRNAs对靶基因是负调控。
近年来对miRNAs的研究主要集中在各种肿瘤(如肺癌、乳腺癌、颅脑肿瘤、肝癌、胃癌、胶质瘤及淋巴瘤等)的形成方面[18-21],miRNAs对正常细胞的调控研究比较少,已有的关于miR-186-5p的报道也大都集中在肿瘤、癌症等的研究中,而且其对靶基因的调控也大都是负调控,如C.H.Cao等[16]报道miR-186通过抑制靶基因Twist1的表达抑制胃癌细胞的侵染、增殖和迁移,X.Hua等[17]报道miR-186通过抑制GOLPH3基因抑制前列腺癌细胞的增殖,K. Yao等[22]报道miR-186通过抑制NSBP1的表达抑制膀胱癌细胞的增殖和侵袭,本研究发现,绵羊毛色越深的皮肤中miR-186-5p表达越低,而通常肤色和毛色的颜色越深黑色素含量越高,由此可见,在绵羊体内miR-186-5p对黑色素生成的调控与对癌细胞的调控都是负调控,本研究还发现,在体外培养的正常绵羊黑色素细胞中过表达miR-186-5p,其黑色素含量明显降低,说明在体外培养的正常黑色素细胞中miR-186-5p对黑色素的生成也同样是负调控。
miRNAs在细胞增殖、分化、凋亡及维持胚胎干细胞的潜能等多种生理过程中都发挥重要作用[23-24],并已证实在肿瘤形成过程中miRNAs可作为癌基因或抑癌基因来调节细胞的增殖和凋亡[25-27]。F. Chen等[28]研究发现,miR-186抑制结肠癌细胞的增殖、迁移和侵袭能力,J. C. Cai等[29]发现,miR-186通过抑制细胞周期抑制肺癌细胞的增殖迁移,W. He等[30]发现,miR-186抑制食管鳞状细胞癌细胞的增殖、侵袭和细胞凋亡,Z.Y.Liu等[31]发现,在多发性骨髓瘤(MM)细胞系和骨髓瘤患者的组织细胞中miR-186表达下调,而且在体外培养的骨髓瘤细胞中过表达miR-186会显著抑制体细胞的生长,并使细胞周期停滞在G0/G1期。本研究划痕试验发现,miR-186-5p抑制了绵羊黑色素细胞的增殖和迁移,同对肿瘤细胞的增殖、迁移影响一致,miR-186-5p对绵羊黑色素细胞增殖、迁移的抑制可能是通过抑制细胞周期实现的。
另外,笔者通过miRBase、TargetScan等生物信息学网站分析,预测MITF是miR-186-5p可能的靶基因之一,miR-186-5p可能通过直接与MITF的3′UTR区结合而调控MITF的翻译。而MITF主要在色素细胞中表达,是黑色素形成的关键因子,MITF突变会导致一系列的表型变化,如眼的色素缺失、减退等,此外MITF还与细胞周期、分化、衰老、凋亡、增殖和迁移等有关,在黑色素瘤细胞中过表达MITF能促进黑色素瘤细胞增殖[32-33],黎钊等[34]研究发现,正常人黑色素细胞能显著表达MITF,而白癜风患者皮肤的MITF表达显著减少,我们推断,miR-186-5p对绵羊黑色素细胞中黑色素生成及对黑色素细胞增殖、迁移的抑制作用也可能是通过下调MITF的表达实现的,miR-186-5p对黑色素细胞的作用机制尚需进一步的研究。
4 结论在绵羊不同毛色皮肤中miR-186-5p的表达存在差异,而且在浅色皮肤中高表达,在正常绵羊黑色素细胞中过表达miR-186-5p能抑制黑色素的产生,抑制黑色素细胞的增殖和迁移。
| [1] | PARK H Y, KOSMADAKI M, YAAR M, et al. Cellular mechanisms regulating human melanogenesis[J]. Cell Mol Life Sci, 2009, 66(9): 1493–1506. DOI: 10.1007/s00018-009-8703-8 |
| [2] | LUCAS K, RAIKHEL A S. Insect microRNAs:Biogenesis, expression profiling and biological functions[J]. Insect Biochem Mol Biol, 2013, 43(1): 24–38. DOI: 10.1016/j.ibmb.2012.10.009 |
| [3] | WINTER J, JUNG S, KELLER S, et al. Many roads to maturity:microRNA biogenesis pathways and their regulation[J]. Nat Cell Biol, 2009, 11(3): 228–234. DOI: 10.1038/ncb0309-228 |
| [4] | YANG S S, FAN R W, SHI Z, et al. Identification of a novel microRNA important for melanogenesis in alpaca (Vicugna pacos)[J]. J Anim Sci, 2015, 93(4): 1622–1631. DOI: 10.2527/jas.2014-8404 |
| [5] | WU D T, CHEN J S, CHANG D C, et al. Mir-434-5p mediates skin whitening and lightening[J]. Clin Cosmet Investig Dermatol, 2008, 1: 19–35. |
| [6] | ZHU Z W, HE J P, JIA X, et al. MicroRNA-25 functions in regulation of pigmentation by targeting the transcription factor MITF in Alpaca (Lama pacos) skin melanocytes[J]. Domest Anim Endocrinol, 2010, 38(3): 200–209. DOI: 10.1016/j.domaniend.2009.10.004 |
| [7] | GUO J, ZHANG J F, WANG W M, et al. MicroRNA-218 inhibits melanogenesis by directly suppressing microphthalmia-associated transcription factor expression[J]. RNA Biol, 2014, 11(6): 732–741. DOI: 10.4161/rna.28865 |
| [8] | DONG C S, WANG H D, XUE L L, et al. Coat color determination by miR-137 mediated down-regulation of microphthalmia-associated transcription factor in a mouse model[J]. RNA, 2012, 18(9): 1679–1686. DOI: 10.1261/rna.033977.112 |
| [9] | DYNOODT P, MESTDAGH P, VAN PEER G, et al. Identification of miR-145 as a key regulator of the pigmentary process[J]. J Invest Dermatol, 2013, 133(1): 201–209. DOI: 10.1038/jid.2012.266 |
| [10] |
张亚玲, 许冬梅, 杜斌, 等. 过表达miR-193b对黑色素细胞中MITF和TYR表达的影响[J]. 畜牧兽医学报, 2016, 47(5): 938–943.
ZHANG Y L, XU D M, DU B, et al. The influences of over-expressing miR-193b on MITF and TYR in melanocytes[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(5): 938–943. (in Chinese) |
| [11] |
曾庆宝, 范瑞文, 张秋月, 等. miR-324-3p通过调控MC1R基因影响黑色素的形成[J]. 畜牧兽医学报, 2016, 47(7): 1381–1388.
ZENG Q B, FAN R W, ZHANG Q Y, et al. The effect of miR-324-3p on melanin synthesis via MC1R gene[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(7): 1381–1388. (in Chinese) |
| [12] | BROZOVIC A. The relationship between platinum drug resistance and epithelial-mesenchymal transition[J]. Arch Toxicol, 2017, 91(2): 605–619. DOI: 10.1007/s00204-016-1912-7 |
| [13] | QIU H J, YUAN S R, LU X H. miR-186 suppressed CYLD expression and promoted cell proliferation in human melanoma[J]. Oncol Lett, 2016, 12(4): 2301–2306. |
| [14] | SFONDRINI L, MORELLI D, BODINI A, et al. High level antibody response to retrovirus-associated but not to melanocyte lineage-specific antigens in mice protected against B16 melanoma[J]. Int J Cancer, 1999, 83(1): 107–112. DOI: 10.1002/(ISSN)1097-0215 |
| [15] | HORIKAWA T, NORRIS D A, YOHN J J, et al. Melanocyte mitogens induce both melanocyte chemokinesis and chemotaxis[J]. J Invest Dermatol, 1995, 104(2): 256–259. DOI: 10.1111/1523-1747.ep12612795 |
| [16] | CAO C H, SUN D G, ZHANG L, et al. miR-186 affects the proliferation, invasion and migration of human gastric cancer by inhibition of Twist1[J]. Oncotarget, 2016, 7(48): 79956–79963. |
| [17] | HUA X, XIAO Y, PAN W H, et al. miR-186 inhibits cell proliferation of prostate cancer by targeting GOLPH3[J]. Am J Cancer Res, 2016, 6(8): 1650–1660. |
| [18] | GALLARDO E, NAVARRO A, VIÑOLAS N, et al. miR-34a as a prognostic marker of relapse in surgically resected non-small-cell lung cancer[J]. Carcinogenesis, 2009, 30(11): 1903–1909. DOI: 10.1093/carcin/bgp219 |
| [19] | HEYN H, ENGELMANN M, SCHREEK S, et al. MicroRNA miR-335 is crucial for the BRCA1 regulatory cascade in breast cancer development[J]. Int J Cancer, 2011, 129(12): 2797–2806. DOI: 10.1002/ijc.25962 |
| [20] | NAVARRO A, DIAZ T, MARTINEZ A, et al. Regulation of JAK2 by miR-135a:Prognostic impact in classic Hodgkin lymphoma[J]. Blood, 2009, 114(14): 2945–2951. DOI: 10.1182/blood-2009-02-204842 |
| [21] | LANDGRAF P, RUSU M, SHERIDAN R, et al. A mammalian microRNA expression Atlas based on small RNA library sequencing[J]. Cell, 2007, 129(7): 1401–1414. DOI: 10.1016/j.cell.2007.04.040 |
| [22] | YAO K, HE L Y, GAN Y, et al. miR-186 suppresses the growth and metastasis of bladder cancer by targeting NSBP1[J]. Diagn Pathol, 2015, 10: 146. DOI: 10.1186/s13000-015-0372-3 |
| [23] | GANGARAJU V K, LIN H F. MicroRNAs:Key regulators of stem cells[J]. Nat Rev Mol Cell Biol, 2009, 10(2): 116–125. DOI: 10.1038/nrm2621 |
| [24] | MANIKANDAN J, AARTHI J J, KUMAR S D, et al. Oncomirs:The potential role of non-coding microRNAs in understanding cancer[J]. Bioinformation, 2008, 2(8): 330–334. DOI: 10.6026/bioinformation |
| [25] | IORIO M V, CROCE C M. microRNAs in cancer:Small molecules with a huge impact[J]. J Clin Oncol, 2009, 27(34): 5848–5856. DOI: 10.1200/JCO.2009.24.0317 |
| [26] | MELO S A, ESTELLER M. Dysregulation of microRNAs in cancer:Playing with fire[J]. FEBS Lett, 2011, 585(13): 2087–2099. DOI: 10.1016/j.febslet.2010.08.009 |
| [27] | ORTHOLAN C, PUISSEGUR M P, ILIE M, et al. MicroRNAs and lung cancer:New oncogenes and tumor suppressors, new prognostic factors and potential therapeutic targets[J]. Curr Med Chem, 2009, 16(9): 1047–1061. DOI: 10.2174/092986709787581833 |
| [28] | CHEN F, ZHOU C, LU Y X, et al. Expression of hsa-miR-186 and its role in human colon carcinoma cells[J]. J South Med Univ, 2013, 33(5): 654–660. |
| [29] | CAI J C, WU J H, ZHANG H Z, et al. miR-186 downregulation correlates with poor survival in lung adenocarcinoma, where it interferes with cell-cycle regulation[J]. Cancer Res, 2013, 73(2): 756–766. DOI: 10.1158/0008-5472.CAN-12-2651 |
| [30] | HE W, FENG J F, ZHANG Y, et al. microRNA-186 inhibits cell proliferation and induces apoptosis in human esophageal squamous cell carcinoma by targeting SKP2[J]. Lab Invest, 2016, 96(3): 317–324. DOI: 10.1038/labinvest.2015.134 |
| [31] | LIU Z Y, ZHANG G Q, YU W Z, et al. miR-186 inhibits cell proliferation in multiple myeloma by repressing Jagged1[J]. Biochem Biophys Res Commun, 2016, 469(3): 692–697. DOI: 10.1016/j.bbrc.2015.11.136 |
| [32] | CARREIRA S, GOODALL J, DENAT L, et al. Mitf regulation of Dia1 controls melanoma proliferation and invasiveness[J]. Genes Dev, 2006, 20(24): 3426–3439. DOI: 10.1101/gad.406406 |
| [33] |
刘铮铮. Waardenburg综合征Ⅱ型一家系的临床分析和MITF基因的突变检测[D]. 长沙: 中南大学, 2007.
LIU Z Z. Clinical analysis of a Waardenburg syndrome type 2 family and mutation detection for MITF gene[D]. Changsha:Central South University, 2007. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10533-2007172393.htm |
| [34] |
黎钊, 王平, 洪为松, 等. 正常人黑素细胞MITF对酪氨酸酶相关蛋白的转录调控研究[J]. 医学研究杂志, 2013, 42(3): 58–62.
LI Z, WANG P, HONG W S, et al. Effect of MITF transcriptional control on family of tyrosinase-related proteins in normal human melanocytes[J]. Journal of Medical Research, 2013, 42(3): 58–62. (in Chinese) |



