2. 山西省左云县畜牧兽医服务中心, 左云 037100
2. Zuoyun Animal Husbandry and Veterinary Service Center, Zuoyun 037100, China
绵羊是重要的肉用家畜,作为检测肉品质的重要指标,胴体脂肪含量是人们关注的热点。降低绵羊胴体脂肪含量是肉羊遗传改良的重要育种目标。为此,研究脂肪分解相关基因的遗传基础就显得尤为必要。解偶联蛋白(Uncoupling protein,UCP2)是UCPs家族成员之一,通过辅助因子介导线粒体质子漏机制,所消耗底物的能量以热能形式散发出来。当机体开始以脂肪组织为主要能源物质时,血糖降低导致胰高血糖素、促肾上腺糖皮质激素和促甲状腺激素分泌增加,血液中的脂肪酸和酮体含量升高,使脂肪酶活化[1]。再继续利用脂肪作为供能底物,会产生大量的H+,刺激UCP2表达升高,质子漏增加,进而增加能量消耗和产热。绵羊UCP2在白色脂肪组织和棕色脂肪组织中都有表达,且在深层脂肪组织的表达高于浅层脂肪组织[2];对牛的热生成基因调节通路的研究发现,UCP2的过表达会降低胴体背膘厚度[3]。这些研究充分说明,UCP2在促进脂肪组织分解代谢和机体非颤抖产热方面发挥重要功能。
MicroRNA(miRNA)通过调节功能基因对绵羊肉质的影响也成为近年来的研究热点。自P.Z.Xu等[4]发现了第一个调控脂肪代谢的miR-14之后,越来越多的脂肪代谢相关miRNAs被研究和关注。例如,增加miR-103和miR-107的表达量可以阻碍糖代谢,降低胰岛素敏感性,从而导致血糖升高,抑制脂肪的生成[5]。miR-1、miR-206和miR-133在褐色和白色脂肪组织中差异表达,说明在脂肪细胞储能、耗能以及分化方面有着不同的分工[6]。敲除小鼠miR-200b/a和miR-429的试验证明,miR-200b/a和miR-429可促进脂肪分解,加快能量消耗[7]。这些研究表明,miRNAs在调节脂肪代谢中具有重要作用。然而,关于UCP2表达的miRNA调节机制研究并不多见。
目前,大量报道集中在对小鼠、人、猪等miRNA的研究上,对绵羊miRNA的研究并不多见。本研究旨在了解可以与绵羊UCP2基因特异性结合的miRNAs及其作用机制。利用生物信息学软件预测与UCP2特异性结合的miRNAs,验证二者的靶标关系后,用RT-qPCR和Western blotting技术研究miRNAs对UCP2基因表达的调节机制。为进一步解析绵羊脂肪代谢的miRNA调控网络提供依据。
1 材料与方法 1.1 试验材料 1.1.1 用于细胞培养的组织及采样方法采集约4月龄绵羊的尾部脂肪组织用于前体脂肪细胞的培养。采样程序:屠宰后迅速去除尾部皮毛,用无菌的剪刀、镊子剪下0.5 cm×0.5 cm的尾部脂肪组织块。用含有1%双抗(青霉素和链霉素)的无菌PBS溶液冲洗2~3遍后,将组织块浸泡于15 mL含有双抗的PBS溶液的离心管中。然后,将离心管置于冰盒保存,1 h内送回实验室。
1.1.2 主要材料与试剂miRNA mimics、miRNA NC(Negative control)和引物均由上海生工有限公司合成;胶回收试剂盒、pUC-T质粒、PAGE制胶试剂盒购自北京康为世纪有限公司;Trizol购自Sigma公司;质粒小提试剂盒购自Omega公司;LB固体培养基、液体培养基购自北京索莱宝公司;哺乳动物全蛋白提取试剂盒、BCA试剂盒购自江苏凯基生物公司;限制性内切酶XhoⅠ和XbaⅠ、反转录试剂盒、荧光定量试剂盒购自TaKaRa公司;LipofectamineTM2000(lipo2000)转染试剂购自Invitrogen公司;用于Western blotting的抗体购自Abcam公司。
1.2 试验方法 1.2.1 靶标关系预测利用生物信息学预测软件miRanda(http://www.microrna.org/)、DIANA-microT(http://diana.imis.athena-innovation.gr/DianaTools/)、miRDB(http://www.mirdb.org)预测可以与UCP2特异结合的miRNAs,选择miRSVR score(miR support vector regression score)≥0.7的miRNAs,便于进一步筛选并提高成功率。经过初步分析,选定miR-132-3p与UCP2作为研究对象。
1.2.2 引物设计及目的片段扩增根据GenBank中公布的绵羊UCP2 3′-UTR的序列设计引物,扩增序列需包含预测的miR-132-3p与UCP2的结合位点。根据GenBank中绵羊的UCP2序列设计其CDS的引物。根据miRBase公布的miR-132-3p成熟序列设计miR-132-3p的引物。内参引物采用核糖体大亚基蛋白L13(Ribosomal protein L13, RPL13)和U6引物序列。所用引物序列见表 1。
|
|
表 1 PCR引物序列 Table 1 Primer sequences for PCR |
利用绵羊UCP2 3′-UTR引物以及绵羊总cDNA进行PCR反应。PCR扩增总反应体系15.8 μL,包括:2×Taq Master mix 7.6 μL,UCP2 3′-UTR上、下游引物各0.6 μL,ddH2O 6 μL,cDNA 1 μL。PCR程序:95 ℃预变性5 min;95 ℃变性30 s,62 ℃退火30 s,72 ℃延伸30 s,33个循环;72 ℃ 5 min使产物延伸完整。扩增结束后进行琼脂糖凝胶电泳。
1.2.3 UCP2 3′-UTR克隆载体的构建对上述琼脂糖凝胶电泳结果,使用胶回收纯化试剂盒,对目的片段进行割胶、回收、纯化目的DNA。取纯化DNA 4 μL,pUC-T质粒1 μL,2×Solution Buffer 5 μL,在PCR仪中16 ℃过夜连接。转化50 μL的Trans5α感受态细胞,加入200 μL LB液体培养基(加氨苄)摇菌,离心后弃100 μL上清,其余混匀。将氨苄、蓝白斑筛选的X-gal和IPTG均匀涂于LB固体培养基上,待吸收完全后,将上述混匀菌液均匀涂板,37 ℃恒温培养箱倒置过夜。然后进行蓝白斑筛选,挑取白色单菌落放入装有7~8 mL LB液体培养基的离心管中,摇菌6 h,后保菌及测序。测序结果与GenBank登录的序列一致,且包含miR-132-3p种子区结合位点。
1.2.4 UCP2 3′-UTR双荧光素酶载体的构建对含有Pmir-GLO质粒的菌液及测序正确的带有目的片段的pUC-T克隆载体菌液进行摇菌,用质粒小提试剂盒进行质粒DNA提取。测定质粒DNA浓度后,分别加入Xba I 1 μL,Xho I 1 μL,10×Quick Cut Buffer 5 μL,DNA片段1 μg,进行双酶切。酶切完全后,分别进行琼脂糖凝胶电泳。用胶回收试剂盒回收纯化酶切后的Pmir-GLO质粒与目的片段,测定浓度。取目的片段5 μL,Pmir-GLO质粒3 μL,T4连接酶1 μL,T4 Buffer 1 μL,在PCR仪16 ℃过夜连接。转化50 μL的Trans5α感受态细胞,加入200 μL LB液体培养基(加1‰氨苄)摇菌,离心后弃100 μL上清,其余混匀。将氨苄均匀涂于LB固体培养基上,待吸收完全后,将上述混匀菌液均匀涂板,37 ℃恒温培养箱倒置过夜。挑取单菌落放入装有7~8 mL LB液体培养基的离心管中,摇菌6 h。进行菌液PCR和Xba I/Xho I双酶切鉴定。验证重组质粒含有目的片段后保菌,并送公司测序。
1.2.5 细胞培养及共转染将含有10%胎牛血清、1%双抗的DMEM/High glucose作为生长培养基,置于37 ℃,5% CO2培养箱中培养HEK-293T细胞。待细胞长满后传代接种到12孔板继续培养。待细胞达到80%~90%融合度时,采用Lipo2000转染试剂进行转染。将转染试验分3组进行,分别转染阴性对照NC(NC组)、过表达miR-132-3p mimics(Mimics组)和重组Pmir-GLO(Blank组)。各组转染试剂量见表 2。
|
|
表 2 用于共转染的NC、blank和mimics分组体系试剂量 Table 2 Reagent volumes in NC, blank and mimics groups for cotransfection |
共转染72 h后收取细胞。参照双荧光素酶报告系统检测试剂盒说明书进行细胞荧光活性检测。
1.2.6 细胞培养及单转染将含有15%胎牛血清、1%双抗的DMEM/F12生长培养基置于37 ℃,5% CO2的培养箱中培养绵羊前体脂肪细胞。待细胞长满后传代接种到6孔板继续培养。待细胞达到40%~60%融合度时,采用Lipo2000转染试剂进行转染。转染分2组:过表达组加入6 μL Lipo2000,11 μL mimics;阴性对照组加入6 μL Lipo2000,11 μL NC。待转染36 h后,用Trizol提取总RNA。48 h后,用哺乳动物全蛋白提取试剂盒裂解细胞, 提取总蛋白。
1.2.7 miR-132-3p和目的基因的实时荧光定量分析对转染后提取的总RNA进行浓度测定。用反转录试剂盒分别进行两步法反转录。RPL13为内参,利用SYBR法测定UCP2基因的mRNA表达量。对总RNA进行一步法反转录,以U6 snRNA为内参,用SYBR法测定miR-132-3p的表达量。
1.2.8 转染后目的蛋白的Western blotting分析用BCA试剂盒及酶标仪测定总蛋白浓度。以4:1比例加入5×Lane Loading Buffer加热变性,进行聚丙烯酰胺凝胶电泳。然后将目的蛋白转至NC膜,封闭后进行一抗(鼠源)、二抗(羊抗鼠)孵育。ECL法显影,用Image J进行灰度值分析。
1.2.9 UCP2在脂肪细胞分化过程中的表达用完全培养基(89% DMEM/F12,10%胎牛血清,1%双抗)培养绵羊前体脂肪细胞2~3 d(Day 0)。待细胞融合度达80%~90%以后,更换为分化培养基(89% DMEM/F12,10%胎牛血清,1%双抗,250 μmol·L-1 IBMX,500 μmol·L-1 DEX,8 μmol·L-1胰岛素),1 d后改用维持培养基(89% DMEM/F12,10%胎牛血清,1%双抗,8 μmol·L-1胰岛素)继续培养(Day 1)。分化培养基培养细胞2 d后,用维持培养基继续培养(Day 2)。后续不同分化天数的细胞处理方法同上,直到第6天。然后,提取不同分化时间细胞的RNA进行反转录。采用实时荧光定量PCR检测UCP2和miR-132-3p的表达量。
1.3 数据处理与分析试验数据采用SPSS 19.0对共转染组以Mimics、NC、Blank处理组为变量进行方差分析,以Mimics、NC组为变量对单转染组中UCP2基因表达量进行独立样本t检验,使用GraphPad Prism6.0制作直方图。使用Bioinformatics & Evolutionary Genomics在线软件制作韦恩图。
2 结果 2.1 miR-132-3p与UCP2间靶标关系的预测利用生物信息学软件miRanda、DIANA-microT、miRDB预测与UCP2存在靶标关系的miRNAs,分别得到了22、61和37个miRNAs,如图 1所示,得到含有2个microRNAs的交集,分别是miR-132-3p与miR-212-3p。基于miR-132-3p序列用3个在线软件预测,如图 2所示分别得到691个、815个、306个靶基因,得到包含101个基因的交集,并对得到的101个基因根据其主要功能进行分类,包括多个与癌症发生相关的基因,例如抑癌基因原钙粘蛋白10(Procadherin-10, PCDH10)、信号素6A(Semaphorin 6A,Sema6A)、威廉姆斯瘤基因1(Wilms tumour gene1, WT1)等,在细胞增殖和分化起重要作用的生长分化因子5(Growth Differentiate Factor5,GDF5)和F-box21蛋白(F-box protein 21,Fbxo21)等基因以及与脂肪分解相关的UCP2等。可见,miR-132-3p与UCP2理论上具有靶标关系。
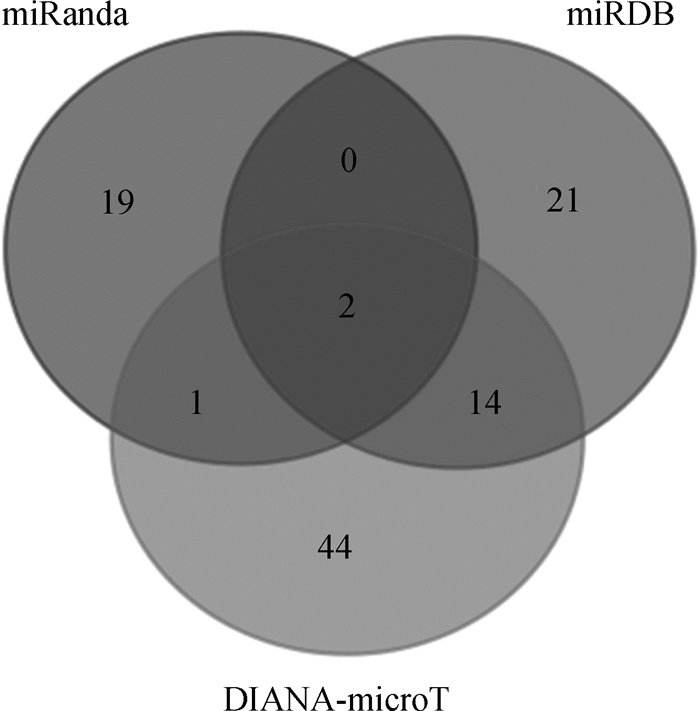
|
图 1 miRanda、miRDB和DIANA-microT软件预测的与UCP2 3′-UTR结合的miRNAs的数量 Figure 1 The amount of miRNAs binding to UCP2 3′-UTR predicted by miRanda, miRDB and DIANA-microT |
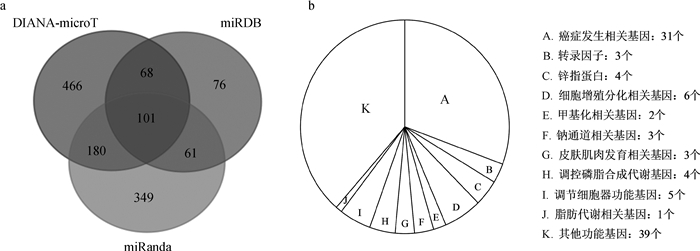
|
a.根据miR-132-3p的序列,用miRanda、miRDB和DIANA-microT软件预测得到靶基因数量,基于靶基因数量制作的韦恩图;b. miR-132-3p调控的靶基因的主要功能及分类 a. According to the sequence of miR-132-3p, target genes number were predicted by miRanda, miRDB and DIANA-microT, and a venn diagram was produced based on the number of target genes; b. Main function and classification of each target gene regulated by miR-132-3p 图 2 miRanda、miRDB和DIANA-microT软件预测的由miR-132-3p调控的靶基因数量和主要功能 Figure 2 The amount and main functions of target genes targeted by miR-132-3p predicted by miRanda, miRDB, DIANA-microT |
以含目的片段的Pmir-GLO重组质粒菌液为模板,用目的片段引物进行PCR扩增,结果见图 3。可见,在1泳道检测到的片段与预期目的片段(132 bp)大小相近。Xba I/Xho I双酶切后,在2泳道检测到和1泳道长度相同的片段。3泳道为正常Pmir-GLO质粒电泳条带。送公司测序后,证实重组质粒有试验所需的目的片段。
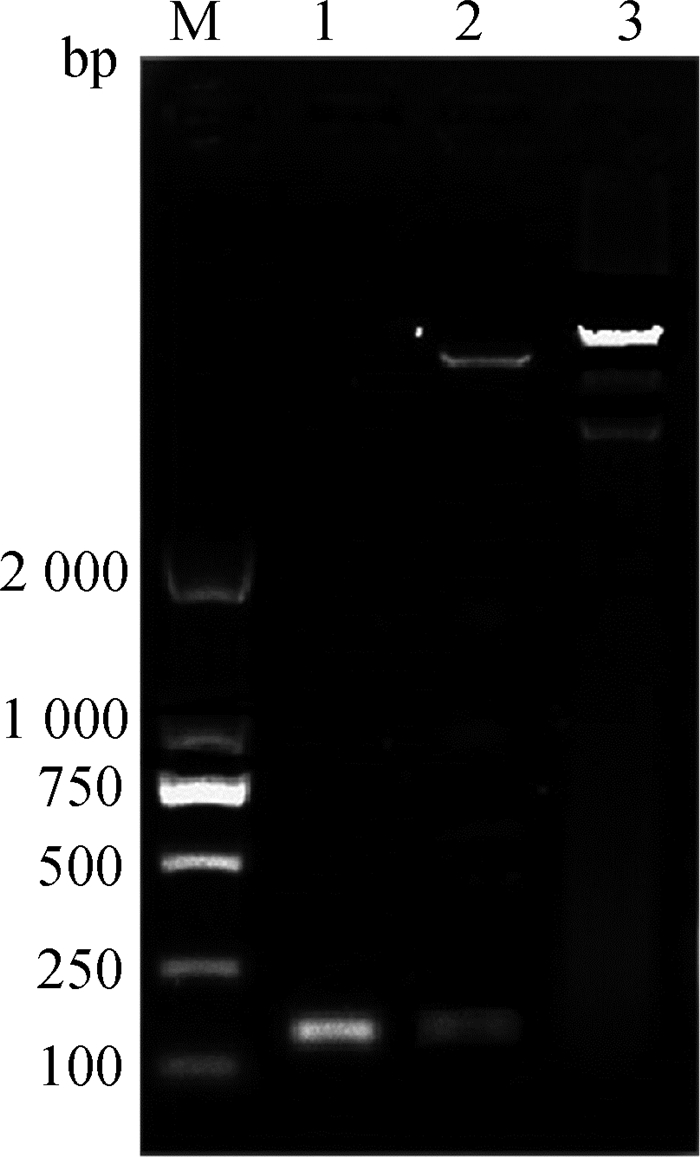
|
M. DNA相对分子质量标准;1.重组双荧光质粒菌液PCR鉴定;2.重组双荧光质粒的双酶切鉴定;3.正常双荧光质粒电泳 M. DL2000 marker; 1. Identified recombinant dual-fluorescence plasmid by bacterial-liquid PCR; 2. Identified recombinant dual-fluorescence plasmid by double digest protocol; 3. Electrophoresis of dual-fluorescence plasmid 图 3 菌液PCR和双酶切鉴定重组双荧光质粒 Figure 3 Identified recombinant dual-fluorescence plasmid by bacterial-liquid PCR and double digestion |
双荧光素酶活性检测结果表明,与阴性对照NC(4.71±0.04)相比,miR-132-3p的mimics显著降低了UCP2 3′-UTR连接的Pmir-GLO载体的荧光活性(2.39±0.03)(P<0.05)。与空白对照Blank(5.85±0.01)相比,miR-132-3p的mimics也显著降低了该载体的荧光活性(P<0.05)。阴性对照NC与空白对照Blank对比,荧光活性无显著差异(图 4)。由此说明,miR-132-3p与UCP2 3′-UTR有结合位点,存在靶标关系。
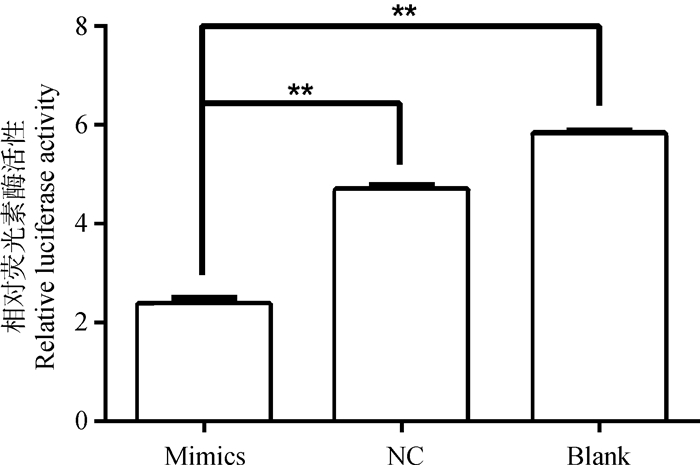
|
NC.阴性对照组;Mimics.过表达组;Blank.空白对照组。**.P<0.05,图 5同 NC. Negative control; Mimics. Overexpressing miR-132-3p; Blank. blank. **.P < 0.05, the same as figure 5] 图 4 UCP2 3′-UTR重组双荧光质粒的相对荧光活性 Figure 4 The relative luciferase activity of UCP2 3′-UTR recombinant dual-fluorescence plasmid |
|
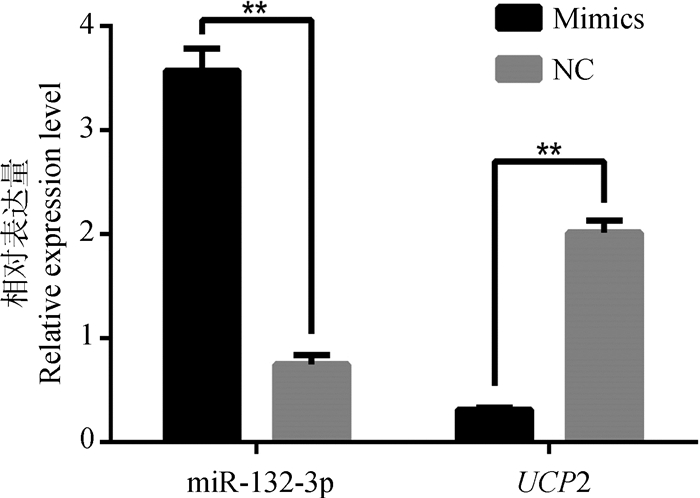
NC.阴性对照组;Mimics.过表达miR-132-3p。图 6同 NC. Negative control; Mimics. Overexpressing miR-132-3p. The same as figure 6 图 5 miR-132-3p和UCP2在过表达miR-132-3p前后的表达变化 Figure 5 The expression changes of miR-132-3p and UCP2 before and after overexpressing miR-132-3p |
|
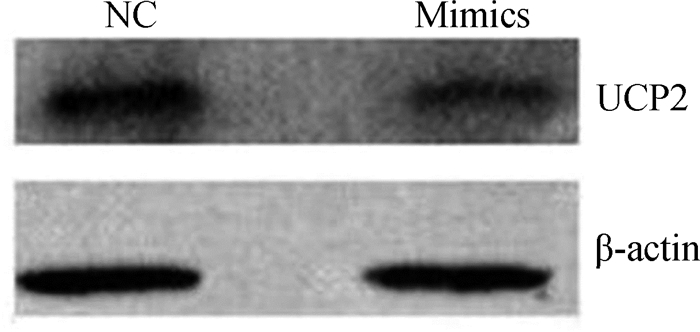
β-actin.内参 β-actin. Reference 图 6 过表达miR-132-3p前后UCP2蛋白的表达 Figure 6 Expressions of UCP2 protein before and after overexpressing miR-132-3p |
图 5给出的是过表达组和阴性对照组的miR-132-3p和UCP2的表达量。组内比较表明,无论是对照组还是过表达组,miR-132-3p表达量高时,UCP2表达量低;反之,UCP2表达量则高。组间比较表明,过表达组miR-132-3p的表达量(3.57±0.13)显著高于阴性对照组(0.75±0.08)(P<0.05),表明过表达miR-132-3p是成功的;而过表达组UCP2的表达量(0.36±0.03)显著低于阴性对照组(2.02±0.09)(P<0.05),表明过表达miR-132-3p后,绵羊前体脂肪细胞中UCP2的表达量显著降低。这些结果充分说明miR-132-3p负调控UCP2的表达。
单转染处理后的绵羊前体脂肪细胞中UCP2蛋白的Western blotting检测结果见图 6。可见,过表达组UCP2的相对表达量(Mimics)明显低于阴性对照组(NC)。由此说明,miR-132-3p对UCP2蛋白也表现负调控作用。
2.5 前体脂肪细胞分化过程中UCP2和miR-132-3p的表达图 7给出的是绵羊前体脂肪细胞分化过程(0~6 d)中,每隔1 d检测到的UCP2和miR-132-3p的表达量。可见,在分化前期(0~2 d),miR-132-3p的表达量未出现显著差异,UCP2的表达量也未出现显著差异。分化中期(3~5 d),miR-132-3p在4 d时的表达量相对于1~3 d的表达量显著升高(P<0.05),而UCP2在5 d时的表达量与1~4 d相比显著降低(P<0.05),并表现出相反的发展趋势。当分化至第6天时,UCP2和miR-132-3p的表达量与分化中期各自表达量相比未出现显著差异。结果说明,在分化中期miR-132-3p和UCP2存在负调控关系;在分化前期和中期,UCP2的表达量随着前体脂肪细胞的分化呈现逐渐降低的趋势。
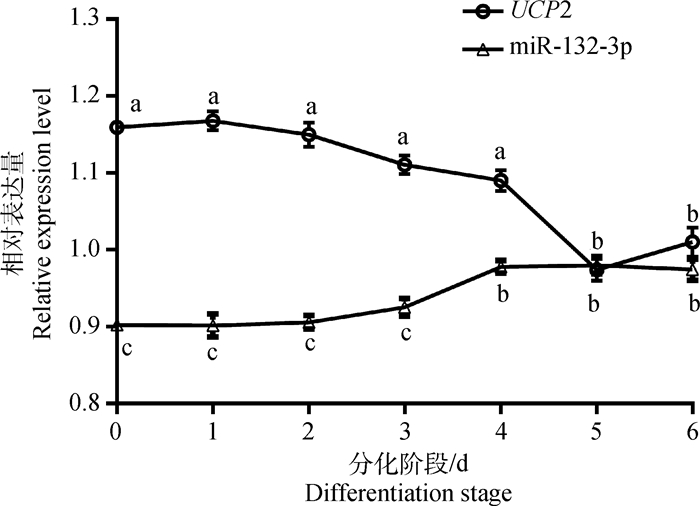
|
不同小写字母表示差异显著(P<0.05) Different lowercase letters indicate significant difference (P < 0.05) 图 7 UCP2和miR-132-3p在绵羊脂肪细胞分化过程中的表达量变化 Figure 7 The expression of UCP2 and miR-132-3p during the differentiation process of ovine adipocytes |
生物信息学软件预测得到miR-132和miR-212可以特异性结合UCP2基因。由于miR-132和miR-212来源于同一染色体且具有相同的种子序列,被称作miR-132/212基因簇[8]。对人类has-miR-132/212进行生物信息学分析发现,miR-132-3p在人类脂肪组织中有微量表达,且预测miR-132-3p的靶基因时,结果并未得到UCP2基因[9]。本研究采用理论预测与试验验证相结合的方式,阐明了绵羊miR-132-3p与UCP2基因的靶标关系。与前人的研究有所不同,可能是由于物种间差异引起的。另有研究发现,miR-132和miR-212虽然有相同的种子序列,但共同的靶基因却很少[10]。所以本研究选择miR-132-3p作为对象,miR-212是否可以调控UCP2 mRNA的表达有待后续研究。
UCP2基因是参与脂肪分解的重要成员之一。本课题组已有研究证明UCP2在绵羊脂肪组织中的时空特异性,阐明了UCP2基因在调节机体能量平衡和脂肪组织代谢方面的重要作用[11]。其他研究也说明UCP2具有相似的功能,西门塔尔牛生长相关性状会受到UCP2单核苷酸多态性的影响[12];在敲除UCP2基因的小鼠体内,过多的葡萄糖被转化为脂肪,且脂肪的代谢速率降低[1],对该小鼠进行葡萄糖刺激胰岛β细胞的试验中发现,胰岛β细胞中ATP合成增多,葡萄糖利用率升高,脂肪生成速率加快[13-14]。在本试验中,不但研究了UCP2在绵羊前体脂肪细胞中的作用,与前人研究结果高度一致,而且发现了一个负向调控UCP2表达的miRNA,与大多数基因一样,UCP2受到多个miRNAs的调控,例如:miR-15a可以直接下调UCP2基因的表达,也同样可以使小鼠体内胰岛素生成量增加,提高葡萄糖利用率,进而沉积更多的脂肪[15];miR-214可以通过下调UCP2的表达来控制肝癌的发生[16];miR-133a并不下调UCP2 mRNA的表达量,而是减少UCP2蛋白的表达量,这也符合miRNA的调节方式[17]。而在本研究中,我们发现了一个新的且可以直接靶标UCP2并下调其表达的miR-132-3p,其可以在一定程度上加快绵羊前体脂肪细胞分化与脂肪沉积的速度。本研究有助于更进一步了解UCP2基因在绵羊脂肪中的作用,完善UCP2的miRNA调控网络。
MiR-132-3p对脂肪细胞的影响主要体现在加速脂肪生成和减少脂肪分解两个方面。有研究报道,前体脂肪细胞分化程度对胰岛素有剂量依赖性,增加胰岛素剂量可以加快前体脂肪细胞分化,使之产生更多脂滴[18-19]。胰岛素与miR-132-3p的关系近期也有报道,例如,miR-132-3p的靶基因中有可以阻碍胰岛β细胞功能的基因,说明miR-132-3p可以改善胰岛β细胞的功能[20-22];miR-132-3p已经被证实在自发Ⅱ型糖尿病大鼠(Goto-kakizaki rat, GK)中的表达量显著高于对照组[23];miR-132-3p的过表达则会导致胰岛素分泌显著增加[24]。所以推测,miR-132-3p可以通过促进胰岛素的分泌加快前体脂肪细胞的分化,促进脂肪沉积。另一方面,由于miR-132-3p对UCP2基因的抑制作用,我们推测,GK大鼠中miR-132-3p的过量表达会直接抑制UCP2的表达,造成脂肪分解速率下降,最终导致脂肪沉积加快。
UCP2基因具有抑制细胞分化的功能。在对细胞分化过程中生化机制的研究发现,UCP2的表达量降低,使得细胞有足够时间完成由分解葡萄糖向线粒体氧化磷酸化的转化[25]。另一方面,因为UCP2有可以保护机体免受过氧化损伤的作用,UCP2基因表达量降低会造成细胞内过氧化物的积累,这种积累对于细胞的分化也具有一定的诱导作用[26]。在小鼠骨骼肌细胞分化过程中,分化信号刺激骨骼肌组织中肌调节因子的表达后会诱导miR-133a的表达,通过与UCP2的靶标关系,下调UCP2的表达,解除UCP2施加的分化抑制[15],加快骨骼肌细胞的分化。本研究中,在绵羊前体脂肪细胞分化的前期和中期,UCP2基因的表达量逐渐下降,解除了UCP2对绵羊前体脂肪细胞的分化抑制,对绵羊前体脂肪细胞的分化有促进作用。
本研究预测得到miR-132-3p的靶基因及其结合位点,通过双荧光素酶报告系统、转染、RT-qPCR及Western blotting等证明miR-132-3p可与UCP 2 3′-UTR靶向结合,并下调UCP2基因的表达。同时UCP2蛋白量也明显降低,促进了绵羊前体脂肪细胞分化。
4 结论经理论预测和试验证实,绵羊miR-132-3p靶向UCP2 3′-UTR,并下调UCP2基因的表达,抑制UCP 2蛋白的合成,促进绵羊前体脂肪细胞的分化。
| [1] | SAMEC S, SEYDOUX J, RUSSELL A, et al. Skeletal muscle heterogeneity in fasting-induced upregulation of genes encoding UCP2, UCP3, PPARγ and key enzymes of lipid oxidation[J]. Pflügers Arch, 2002, 445(1): 80–86. DOI: 10.1007/s00424-002-0879-9 |
| [2] |
刘建华. 绵羊UCP2和UCP3基因的克隆、表达及其遗传变异研究[D]. 太谷: 山西农业大学, 2013.
LIU J H. Study on the cloning, expression and genetic variation of ovine UCP2 and UCP3 genes[D]. Taigu:Shanxi Agricultural University, 2013. (in Chinese) http: //cdmd. cnki. com. cn/Article/CDMD-10113-1016056724. htm |
| [3] | RYU J, KIM Y, KIM C, et al. Association of bovine carcass phenotypes with genes in an adaptive thermogenesis pathway[J]. Mol Biol Rep, 2012, 39(2): 1441–1445. DOI: 10.1007/s11033-011-0880-5 |
| [4] | XU P Z, VERNOOY S Y, GUO M, et al. The Drosophila microRNA Mir-14 suppresses cell death and is required for normal fat metabolism[J]. Curr Biol, 2003, 13(9): 790–795. DOI: 10.1016/S0960-9822(03)00250-1 |
| [5] | TRAJKOVSKI M, HAUSSER J, SOUTSCHEK J, et al. microRNAs 103 and 107 regulate insulin sensitivity[J]. Nature, 2011, 474(7353): 649–653. DOI: 10.1038/nature10112 |
| [6] | WALDEN T B, TIMMONS J A, KELLER P, et al. Distinct expression of muscle-specific microRNAs (myomirs) in brown adipocytes[J]. J Cell Physiol, 2009, 218(2): 444–449. DOI: 10.1002/jcp.v218:2 |
| [7] | TAO C, REN H Y, XU P, et al. Adipocyte miR-200b/a/429 ablation in mice leads to high-fat-diet-induced obesity[J]. Oncotarget, 2016, 7(42): 67796–67807. DOI: 10.18632/oncotarget.v7i42 |
| [8] | VO N, KLEIN M E, VARLAMOVA O, et al. A cAMP-response element binding protein-induced microRNA regulates neuronal morphogenesis[J]. Proc Natl Acad Sci U S A, 2005, 102(45): 16426–16431. DOI: 10.1073/pnas.0508448102 |
| [9] | XIA L, LI D J, LIN C W, et al. Comparative study of joint bioinformatics analysis of underlying potential of 'neurimmiR', miR-212-3p/miR-132-3p, being involved in epilepsy and its emerging role in human cancer[J]. Oncotarget, 2017, 8(25): 40668–40682. |
| [10] | WANET A, TACHENY A, ARNOULD T, et al. miR-212/132 expression and functions:within and beyond the neuronal compartment[J]. Nucleic Acids Res, 2012, 40(11): 4742–4753. DOI: 10.1093/nar/gks151 |
| [11] |
刘建华, 乔利英, 郭云雁, 等. 绵羊UCP2基因的克隆及其在脂肪组织中的季节性差异表达[J]. 畜牧兽医学报, 2015, 46(7): 1114–1121.
LIU J H, QIAO L Y, GUO Y Y, et al. Cloning of ovine UCP2 gene and its seasonally differential expression in adipose tissues[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(7): 1114–1121. (in Chinese) |
| [12] |
陈翠, 张立敏, 陈晓杰, 等. UCP2基因遗传多态性与西门塔尔牛生长相关性状的遗传效应分析[J]. 畜牧兽医学报, 2012, 43(5): 708–716.
CHEN C, ZHANG L M, CHEN X J, et al. Associations of UCP2 gene polymorphisms with growth traits in Simmental[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(5): 708–716. (in Chinese) |
| [13] | ZHANG C Y, BAFFY G, PERRET P, et al. Uncoupling protein-2 negatively regulates insulin secretion and is a major link between obesity, β cell dysfunction, and type 2 diabetes[J]. Cell, 2001, 105(6): 745–755. DOI: 10.1016/S0092-8674(01)00378-6 |
| [14] | BORDONE L, MOTTA M C, PICARD F, et al. Correction:sirt1 regulates insulin secretion by repressing UCP2 in pancreatic β cells[J]. PLoS Biol, 2015, 13(12): e1002346. DOI: 10.1371/journal.pbio.1002346 |
| [15] | SUN L L, JIANG B G, LI W T, et al. microRNA-15a positively regulates insulin synthesis by inhibiting uncoupling protein-2 expression[J]. Diabetes Res Clin Pract, 2011, 91(1): 94–100. DOI: 10.1016/j.diabres.2010.11.006 |
| [16] | YU G S, WANG J L, XU K S, et al. Dynamic regulation of uncoupling protein 2 expression by microRNA-214 in hepatocellular carcinoma[J]. Biosci Rep, 2016, 36(3): e00335. DOI: 10.1042/BSR20160062 |
| [17] | CHEN X, WANG K H, CHEN J N, et al. In vitro evidence suggests that miR-133a-mediated regulation of uncoupling protein 2(UCP2) is an indispensable step in myogenic differentiation[J]. J Biol Chem, 2009, 284(8): 5362–5369. DOI: 10.1074/jbc.M807523200 |
| [18] |
卢建雄, 杨具田, 臧荣鑫, 等. 胰岛素对原代培养大鼠前体脂肪细胞增殖分化的影响[J]. 中国兽医科学, 2006, 36(11): 915–919.
LU J X, YANG J T, ZANG R X, et al. Effects of insulin on proliferation and differentiation of rat primary-cultured preadipocytes[J]. Veterinary Science in China, 2006, 36(11): 915–919. (in Chinese) |
| [19] | MUNIYAPPA R, MONTAGNANI M, KON KOH K, et al. Cardiovascular actions of insulin[J]. Endocr Rev, 2007, 28(5): 463–491. DOI: 10.1210/er.2007-0006 |
| [20] | NESCA V, GUAY C, JACOVETTI C, et al. Identification of particular groups of microRNAs that positively or negatively impact on beta cell function in obese models of type 2 diabetes[J]. Diabetologia, 2013, 56(10): 2203–2212. DOI: 10.1007/s00125-013-2993-y |
| [21] | LIU Y, TANABE K, BARONNIER D, et al. Conditional ablation of Gsk-3β in islet beta cells results in expanded mass and resistance to fat feeding-induced diabetes in mice[J]. Diabetologia, 2010, 53(12): 2600–2610. DOI: 10.1007/s00125-010-1882-x |
| [22] | LIU Z, TANABE K, BERNAL-MIZRACHI E, et al. Mice with beta cell overexpression of glycogen synthase kinase-3β have reduced beta cell mass and proliferation[J]. Diabetologia, 2008, 51(4): 623–631. DOI: 10.1007/s00125-007-0914-7 |
| [23] | ESGUERRA J L S, BOLMESON C, CILIO C M, et al. Differential glucose-regulation of microRNAs in pancreatic islets of non-obese type 2 diabetes model Goto-Kakizaki rat[J]. PLoS One, 2011, 6(4): e18613. DOI: 10.1371/journal.pone.0018613 |
| [24] | MOLLET I G, MALM H A, WENDT A, et al. Integrator of stress responses calmodulin binding transcription Activator 1(Camta1) regulates miR-212/miR-132 expression and insulin secretion[J]. J Biol Chem, 2016, 291(35): 18440–18452. DOI: 10.1074/jbc.M116.716860 |
| [25] | ZHANG J, KHVOROSTOV I, HONG J S, et al. UCP2 regulates energy metabolism and differentiation potential of human pluripotent stem cells[J]. EMBO J, 2011, 30(24): 4860–4873. DOI: 10.1038/emboj.2011.401 |
| [26] | XIAO Y, LI X, CUI Y Q, et al. Hydrogen peroxide inhibits proliferation and endothelial differentiation of bone marrow stem cells partially via reactive oxygen species generation[J]. Life Sci, 2014, 112(1-2): 33–40. DOI: 10.1016/j.lfs.2014.07.016 |



