2. 中国农业科学院北京畜牧兽医研究所, 北京 100193
2. Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China
血常规是反映机体免疫力状况的基本参考指标[1-2]。挖掘妊娠母猪免疫力性状的有效分子标记,并将之用于分子选育,对提高妊娠母猪的抗病力、增加健仔数、提高母猪利用年限等都具有重要意义。在猪上,通常可以测定包括白细胞及其分类指标、红细胞及其分类指标和血小板指标等19项血常规指标反映检测猪的健康状况[3-5]。血液中的主要组织相容性复合体(Major histocompatibility complex, MHC)也称白细胞抗原[6],编码猪白细胞抗原(Swine leucocyte antigen, SLA)的基因位于7号染色体着丝粒两侧[7],其遗传多样性丰富,与疾病抗性具有显著关联性[8-9]。其中,SLA-DOB基因参与SLA Ⅱ类抗原的递呈,在免疫应答反应中,SLA Ⅱ类分子特异性结合CD4细胞黏附分子,并由CD4分子传递抗原信号,激活T细胞[10-12]。
与猪血常规性状相关的QTLs主要定位于2、7和8号染色体上,其中KIT基因是潜在的候选基因[13-16]。2014年本课题组刘会杰等[17]对大白、长白猪CD4基因启动子多态性及表达差异进行了研究,发现CD4基因多态位点在品种间存在显著差异。迄今有关SLA-DOB与CD4基因对妊娠母猪血常规性状的遗传效应未见报道。
为获得与妊娠母猪免疫力性状显著关联的分子标记,本研究首先检测并分析了妊娠长白母猪的19项血常规免疫指标及其相关性,进而以SLA-DOB及CD4基因为候选基因,分析2个基因的遗传变异及其与妊娠母猪各项血常规免疫指标的关联性,为揭示妊娠母猪免疫力性状的分子基础及分子抗病育种提供重要信息。
1 材料与方法 1.1 试验材料试验猪为天津市宁河原种猪场3个圈舍的纯种长白妊娠母猪群,共计358头,胎次为2~4胎。在母猪妊娠期第30~80天,分3批采集前腔静脉血,EDTA抗凝,用于血常规指标测定以及DNA提取。
1.2 血常规测定取2 mL抗凝血,采用动物全自动血细胞分析仪(XFA6030,南京普朗生物医学有限公司)检测试验用猪的血常规指标。血常规指标包括3类性状19项指标:(1)7项白细胞相关性状,包括:白细胞总数(WBC)、淋巴细胞数(LY)、淋巴细胞百分比(LY%)、中性细胞及单核细胞数(NE.MO)、中性细胞及单核细胞百分比(NE.MO%)、嗜酸细胞数(EOS)、嗜酸细胞百分比(EOSP);(2)8项红细胞相关性状:红细胞总数(RBC)、血红蛋白(HGB)、红细胞平均体积(MCV)、红细胞压积(HCT)、平均血红蛋白含量(MCH)、平均血红蛋白浓度(MCHC)、红细胞分布宽度SD(RDW_SD)、红细胞分布宽度CV(RDW_CV);(3)4项血小板相关性状:血小板总数(PLT)、血小板平均体积(MPV)、血小板压积(PCT)、血小板分布宽度(PDW)。
1.3 基因组DNA提取、混池测序及基因分型利用天根基因组提取试剂盒,从血样中提取基因组DNA。分别针对猪CD4、SLA-DOB基因上下游2 kb和外显子区段,利用Oligo 6.0软件设计扩增引物,引物序列如表 1所示。试验所用的PCR反应体系的总体积为25 μL:PreMIX 12.5 μL,ddH2O 9.5 μL,正向引物1 μL,反向引物1 μL,模板DNA 1 μL。PCR反应条件:95 ℃ 8 min;95 ℃ 30 s, 最适退火温度30 s, 72 ℃ 30 s,35个循环;72 ℃ 10 min。随机选择43头长白妊娠母猪,将其基因组DNA样本等量混池,进行PCR扩增,扩增产物进行Sanger法双向测序或克隆测序,检测遗传变异位点。利用MassArray SNP分型方法,对358头长白妊娠母猪进行遗传变异位点的基因分型。
|
|
表 1 引物序列 Table 1 Primer sequence |
采用Haploview4.2软件进行遗传变异位点间连锁不平衡(Linkage disequilibrium, LD)估计和单倍型推断。LD程度一般用D’或R2来表示,数值越大表示LD程度越强。D’=1时表示完全连锁。基于Haploview软件的Confidence intervals算法得到单倍型块,进而采用单倍型滑窗法进行单倍型的推断。一般单倍型频率大于0.05为主要的单倍型,小于0.05的单倍型进行合并。以单个基因为研究对象,将推断的主要单倍型与血常规性状进行后续的关联分析。
1.5 单标记及单倍型与血常规性状的关联分析利用SAS 9.1的MIXED过程[18],对长白妊娠母猪的血常规免疫性状与基因型或单倍型进行关联分析:
y=μ+z+b+p+g+a+e,其中,y为表型观察值;μ为群体均值;z为场区效应;b为批次效应;p为胎次效应;a为个体随机加性遗传效应,a~N(0, Aδa2),A为加性亲缘关系矩阵,δa2为加性遗传方差;g为基因型效应或单倍型组合效应;e为随机残差。
1.6 各突变位点的加性效应和显性效应分析本研究采用SAS9.1进行各SNP加性和显性效应的显著性检验。每个SNP的加性效应、显性效应可通过如下公式[19]计算:
加性效应:a=(AA-BB)/2,
显性效应:d=AB-(AA+BB)/2,
其中,AA、AB和BB为对应基因型血常规性状的最小二乘均值。
2 结果 2.1 妊娠母猪血常规性状的描述性统计及概率分布对测定到的358头妊娠长白母猪的19项血常规指标进行描述性统计分析,结果如表 2所示。
|
|
表 2 长白妊娠母猪19项血常规性状的描述性统计量 Table 2 Descriptive statistics of 19 routine blood traits of pregnant Landrace sows |
对所有测试妊娠母猪的上述19项血常规指标进行概率分布图绘制,其中11项血常规指标近似服从正态分布(图 1),包括白细胞总数(WBC)、中性及单核细胞数(NE.MO)、血红蛋白(HGB)、平均血红蛋白含量(MCH)、平均血红蛋白浓度(MCHC)、红细胞平均体积(MCV)、红细胞压积(HCT)、红细胞分布宽度SD(RDW_SD)、红细胞分布宽度CV(RDW_CV)、血小板平均体积(MPV)、血小板压积(PCT)等,将这些血常规指标用于后续的关联分析。
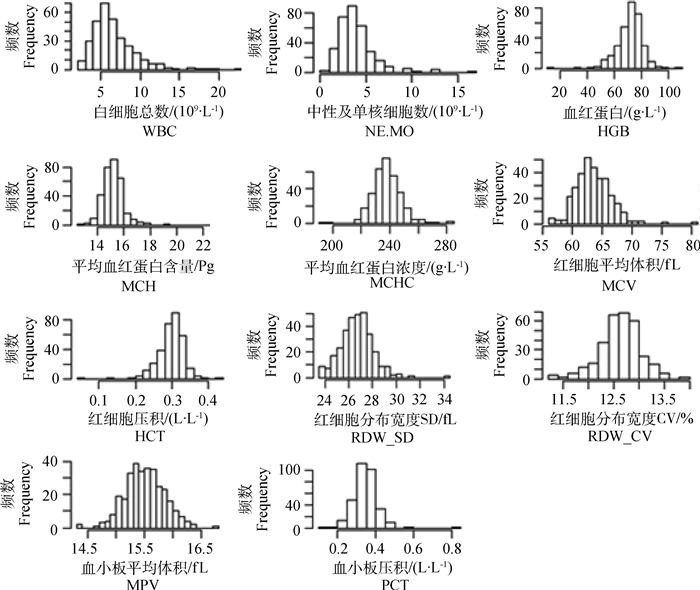
|
图 1 近似正态分布的11项血常规指标的概率分布图 Figure 1 Probability distribution profiles of 11 routine blood indexes appeared to be normal distribution |
对试验用妊娠母猪的血常规性状进行相关分析,表 3为性状间相关系数及显著性。可以看出,11项近似分布的血常规指标间表现不同程度相关性。其中,白细胞总数(WBC)与中性及单核细胞数(NE.MO)、血红蛋白(HGB)与红细胞压积(HCT)和血红蛋白与红细胞分布宽度CV(RDW_CV)、平均血红蛋白含量(MCH)与红细胞平均体积(MCV)和平均血红蛋白含量与红细胞分布宽度SD(RDW_SD)、红细胞平均体积(MCV)与红细胞分布宽度SD(RDW_SD)、红细胞压积(HCT)与红细胞分布宽度CV(RDW_CV)等血常规性状间相关极显著(P<0.01),且相关系数达0.60以上。
|
|
表 3 血常规指标间的相关系数 Table 3 The correlation coefficients among the routine blood indexes |
通过混池PCR扩增产物测序(扩增图略),在2个基因上下游2 kb和外显子区段共检测到11个遗传变异位点,其中6个为新发现的变异。SLA-DOB基因共检测到5个遗传变异位点,编码区、启动子区、基因下游79 bp处各包含1个,内含子区包含2个;CD4基因检测出6个遗传变异位点,4个位于外显子区(SNP6、Ins9、SNP10、SNP11),2个位于内含子区(表 4)。SNP12(表 4)位于CD4基因第7外显子区,为本课题组前期研究发现[20]。
|
|
表 4 猪SLA-DOB、CD4基因遗传突变注释信息 Table 4 Annotation information of the genetic mutations in porcine SLA-DOB and CD4 |
图 2为2个基因的遗传变异位点测序图。其中Ins9为GTCA四碱基插入突变(图 2,Ins9),用PCR产物直接测序方法显示为套峰,克隆测序可以获得确切的序列信息,其余均为单碱基突变(SNP12为本课题组前期发现,直接用于后续SNPs分型)。
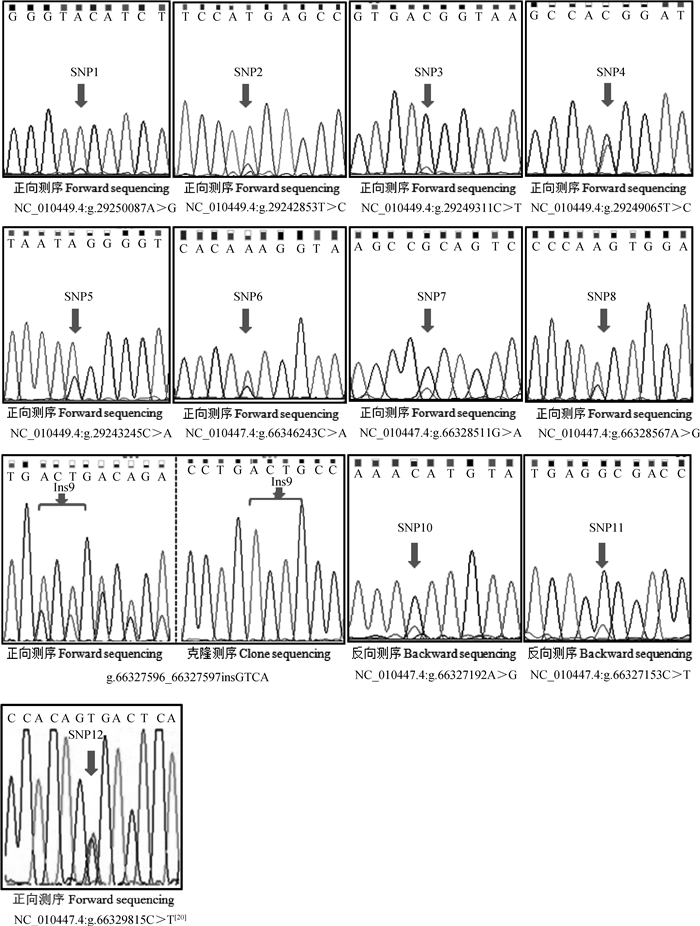
|
图 2 长白妊娠母猪SLA-DOB及CD4基因遗传变异位点测序图 Figure 2 Sequencing maps of mutations of pregnant Landrace sows SLA-DOB and CD4 genes |
长白妊娠母猪SLA-DOB、CD4两个基因12个遗传变异位点的等位基因频率和基因型频率如表 5所示。选择8个位于调控区及外显子区的遗传突变与妊娠母猪的血常规性状进行关联分析,包括位于SLA-DOB基因调控区、外显子区的3个遗传突变:SNP1(启动子区)、SNP2(基因下游)以及SNP3(外显子区);位于CD4基因外显子区的5个遗传突变:SNP6、Ins9、SNP10、SNP11、SNP12。
|
|
表 5 长白妊娠母猪SLA-DOB及CD4基因变异位点的基因型频率和等位基因频率 Table 5 The frequency of genotype and allele of mutations in SLA-DOB and CD4 genes in pregnant Landrace sows |
通过对SLA-DOB基因3个SNPs与11项呈近似正态分布的血常规指标进行关联分析发现,共有5项血常规指标与这3个SNPs显著关联(表 6)。其中,SNP1显著影响红细胞压积(HCT)和红细胞分布宽度SD(RDW_SD)(P<0.05),对血小板平均体积(MPV)影响极显著(P<0.01),其中AA型个体均显著高于GA型个体;SNP2极显著影响MPV(P<0.01),且TT型个体极显著高于CT型个体;SNP3显著影响平均血红蛋白含量(MCH)和平均血红蛋白浓度(MCHC)(P<0.05),其CT型个体显著高于CC型个体。由于SLA-DOB基因的SNP1和SNP2均与血小板平均体积关联极显著(P<0.01),提示SLA-DOB基因的遗传突变与血小板的免疫学功能密切相关。
|
|
表 6 长白妊娠母猪SLA-DOB基因SNPs与血常规指标的关联分析(最小二乘均值±标准误) Table 6 Associations of SNPs of pregnant Landrace sows SLA-DOB gene with routine blood indexes (LSM±SE) |
通过对CD4基因的5个遗传突变与妊娠母猪11项血常规指标的关联分析发现,SNP6和SNP12未发现显著的遗传效应,Ins9、SNP10及SNP11三个遗传突变有显著遗传效应(表 7)。其中,Ins9与红细胞平均体积(MCV)关联显著(P<0.05),与血小板平均体积(MPV)关联极显著(P<0.01),且EE(代表GTCA/GTCA纯合插入型)个体的MCV显著高于DD(代表DEL/DEL纯合未插入型)个体(P<0.05),而EE个体及DE(代表DEL/GTCA杂合型)个体的MPV均极显著低于DD型个体(P<0.01)。SNP10与平均血红蛋白浓度(MCHC)、红细胞分布宽度SD(RDW_SD)均关联显著(P<0.05),而与MCV、平均血红蛋白含量(MCH)及MPV均关联极显著(P<0.01),其AG型个体的效应均较高。SNP11与RDW_SD关联显著(P<0.05),与MCV、MCH及MPV均关联极显著(P<0.01),除MPV是TT型个体极显著高于GG型和TG型个体外(P<0.01),其余3项指标均是TC型个体显著高于TT型个体(P<0.05)。
|
|
表 7 长白妊娠母猪CD4基因突变与血常规指标关联分析(最小二乘均值±标准误) Table 7 Associations of mutations of pregnant Landrace sows CD4 gene with routine blood indexes(LSM±SE) |
对有显著遗传效应的CD4基因的3个突变与血常规指标进行加性和显性效应分析(表 8)。结果发现,Ins9突变对MPV的显性效应极显著(P<0.01);SNP10对RDW_SD的显性效应极显著(P<0.01),对MPV的加性效应极显著(P<0.01)。以上结果表明,CD4基因与长白妊娠母猪的血常规免疫力性状关联显著,其中Ins9和SNP10可作为妊娠母猪免疫力改良的重要候选分子标记。
|
|
表 8 长白妊娠母猪CD4基因突变对血常规指标的加性及显性效应(最小二乘均值±标准误) Table 8 Additive and dominant effects of mutations of CD4 on routine blood indexes in pregnant Landrace sows (LSM±SE) |
|
|
表 9 长白妊娠母猪CD4的4个变异位点形成的单倍型组合与血常规性状关联分析(LSM±SE) Table 9 Haplotype combination associations of the 4 mutations in Landrace pregnant sow CD4 with routine blood indexes(LSM±SE) |
针对上述2个基因的8个突变,利用HaploView4.2软件分别对SLA-DOB、CD4的突变进行单倍型推断分析。对SLA-DOB基因的单倍型分析发现,该基因的3个SNPs没有形成单倍型块,说明3个突变间不存在紧密连锁。
对CD4基因的5个突变进行单倍型分析,结果发现其中4个突变(SNP11、Ins9、SNP12和SNP6)完全连锁,并形成一个单倍型块(图 3)。该单倍型块由3种单倍型组成,H1(CDTA)、H2(TETA)、H3(CECC)(其中D代表GTCA未插入,E代表GTCA插入),频率分别为0.442、0.303和0.253。
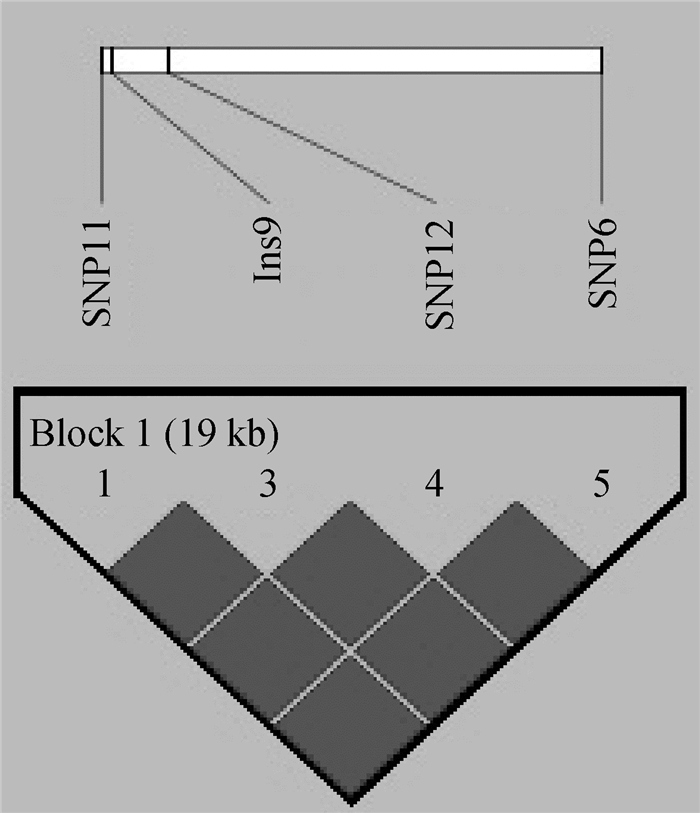
|
突变的交叉值表示LD程度D’;黑色方形未有数值标注的表示2个突变完全连锁(D’=1) The values within boxes are pair wise mutation correlation (D'); Black boxes without numbers indicate complete LD (D'=1) 图 3 CD4基因连锁不平衡估计 Figure 3 The estimation of linkage disequilibrium among SNPs in CD4 gene |
针对长白妊娠母猪CD4基因的3种主要单倍型,对其与11项血常规性状进行关联分析。结果发现,3种单倍型组成的6种单倍型组合极显著影响MCV和MPV 2项血常规性状(P<0.01),并显著影响MCH性状(P<0.05)。
3 讨论妊娠母猪的免疫力状况与其抗病力、繁殖力和生产力水平密切相关。本研究在检测358头长白妊娠母猪血常规性状基础上,进行了SLA-DOB和CD4基因遗传突变检测及其与11项血常规性状的关联分析。结果共检测到11个遗传突变,其中6个为新发现的遗传突变,这6个突变均与妊娠母猪血常规性状显著关联(P<0.05),表明这些新的遗传突变可为妊娠母猪免疫力性状的研究和改良提供重要基础数据。
人和其他哺乳动物妊娠早期的免疫功能相对较低[21-23],妊娠母猪也存在同样的现象,其淋巴细胞转化率显著低于未妊娠母猪[24]。血常规检测是基本的免疫测定指标,红细胞、白细胞、血小板等数量的增加或减少以及形态的改变可以辅助判断妊娠母猪机体的免疫力状态[3-5]。本研究发现,长白妊娠母猪19项血常规性状多数性状间存在高度相关(表 3),表明妊娠母猪血常规性状间存在较强变化规律,是利用分子标记辅助选择来提高妊娠母猪免疫力的重要表型指标。
红细胞是血液中重要的固有免疫细胞,具有识别、黏附、杀伤抗原、清除循环免疫复合物等能力[25-27],红细胞的天然免疫功能可调控指导白细胞固有免疫反应与获得性免疫反应[28-29]。本研究发现,所检测的SLA-DOB基因的3个SNPs(SNP1、SNP2和SNP3)显著影响长白妊娠母猪红细胞体积、平均血红蛋白含量、平均血红蛋白浓度以及红细胞分布宽度等红细胞性状;CD4基因的5个突变中,有3个突变(Ins9、SNP10、SNP11)也显著影响这4项红细胞性状。由于红细胞内含有许多与免疫有关的物质,如CRl、CR3、CD58、CD59、DAF、SOD酶等,红细胞体积及分布宽度等指标受SLA-DOB及CD4基因的遗传突变显著影响,提示它们可作为妊娠母猪红细胞类免疫力性状的重要候选分子标记。
血小板与止血功能有关[3-4],血小板颗粒亦含许多促炎性反应和抗炎性反应细胞因子及趋化因子,参与炎症反应[30]。通常炎症因子的增加会激活NF-κB炎症信号通路,CD4、MHCⅡ分子也对NF-κB信号通路起一定的调控作用,该通路在免疫反应中发挥重要作用。本研究发现,SLA-DOB的SNP1、SNP2和CD4的Ins9、SNP10、SNP11均与平均血小板体积(MPV)存在极显著相关。这提示SLA-DOB、CD4的遗传突变可能通过影响血小板进而调控NF-κB信号通路,进而影响妊娠母猪的免疫力。
白细胞是免疫系统的重要组成部分,包括自然杀伤细胞、吞噬细胞、树突状细胞等天然免疫细胞及淋巴细胞等适应性免疫细胞[21, 31]。但本研究中,2个基因的8个遗传突变均未显著影响白细胞相关指标,建议针对2个基因中其他未检测的遗传突变进行研究。
单倍型分析可提供更高的统计效力。基于检测的遗传变异位点,推断出相应的单倍型,可更准确的分析与免疫指标的关联性,筛选出有意义的单倍型标记。本研究发现,CD4基因的Ins9、SNP6、SNP11、SNP12完全连锁,构成的单倍型组合显著影响MCV、MPV及MCH等红细胞相关指标。结果提示,CD4基因与红细胞指标显著关联的单倍型可作为有效的分子辅助标记应用于妊娠母猪免疫力的提高。
4 结论综上,本研究对长白妊娠母猪CD4、SLA-DOB基因与血常规指标进行了单标记和单倍型关联分析,获得了显著影响红细胞及血小板指标的SNPs及Insertion突变,验证了CD4、SLA-DOB基因作为长白妊娠母猪免疫抗性分子标记的可能性。
| [1] | PÉREZ-DE-HEREDIA F, GÓMEZ-MARTÍNEZ S, DÍAZ L E, et al. Influence of sex, age, pubertal maturation and body mass index on circulating white blood cell counts in healthy European adolescents-the HELENA study[J]. Eur J Pediatr, 2015, 174(8): 999–1014. DOI: 10.1007/s00431-015-2497-5 |
| [2] |
宋欣, 曹随忠, 张龙超, 等. 猪红细胞生成素受体基因突变与血常规性状关联分析[J]. 畜牧兽医学报, 2012, 43(11): 1697–1702.
SONG X, CAO S Z, ZHANG L C, et al. Association of SNPs in erythropoietin receptor gene with blood parameters[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(11): 1697–1702. (in Chinese) |
| [3] | LI J L, ZARBOCK A, HIDALGO A. Platelets as autonomous drones for hemostatic and immune surveillance[J]. J Exp Med, 2017. DOI: 10.1084/jem.20170879 |
| [4] | VIEIRA-DE-ABREU A, CAMPBELL R A, WEYRICH A S, et al. Platelets:versatile effector cells in hemostasis, inflammation, and the immune continuum[J]. Semin Immunopathol, 2012, 34(1): 5–31. DOI: 10.1007/s00281-011-0286-4 |
| [5] | GROβJOHANN B, EICHLER P, GREINACHER A, et al. Ceftriaxone causes drug-induced immune thrombocytopenia and hemolytic anemia:characterization of targets on platelets and red blood cells[J]. Transfusion, 2004, 44(7): 1033–1040. DOI: 10.1111/trf.2004.44.issue-7 |
| [6] |
陈芳芳, 潘玲, 耿照玉, 等. MHC分子多态性的起源、演变与抗病机理[J]. 畜牧兽医学报, 2010, 41(9): 1061–1067.
CHEN F F, PAN L, GENG Z Y, et al. Origin, evolvement and resistance mechanism of polymorphism of MHC molecules[J]. Acta Veterinaria et Zootechnica Sinica, 2010, 41(9): 1061–1067. (in Chinese) |
| [7] |
胜利, 安利峰. MHC及其免疫学意义[J]. 西北民族学院学报:自然科学版, 2000, 21(2): 54–58.
SHENG L, AN L F. Major histocompathbility complex (MHC) and their immunological significance[J]. Journal of Northwest Minorities University:Natural Science Edition, 2000, 21(2): 54–58. (in Chinese) |
| [8] | SMITH T P, ROHRER G A, ALEXANDER L J, et al. Directed integration of the physical and genetic linkage maps of swine chromosome 7 reveals that the SLA spans the centromere[J]. Genome Res, 1995, 5(3): 259–271. DOI: 10.1101/gr.5.3.259 |
| [9] | BASKIN L C, POMP D. Rapid communication:mapping of the porcineColipase gene to chromosome 7 using linkage analysis[J]. J Anim Sci, 1998, 76(4): 1241–1242. DOI: 10.2527/1998.7641241x |
| [10] |
郑世军.
动物分子免疫学[M]. 北京: 中国农业出版社, 2015.
ZHENG S J. Veterinary molecular immunology[M]. Beijing: China Agriculture Press, 2015. (in Chinese) |
| [11] |
周光炎.
免疫学原理[M]. 3版. 北京: 科学出版社, 2013.
ZHOU G Y. Principles of immunology[M]. 3rd ed. Beijing: Science Press, 2013. (in Chinese) |
| [12] | HE Y, CHU Q, MA P, et al. Association of bovine CD4 and STAT5b single nucleotide polymorphisms with somatic cell scores and milk production traits in Chinese Holsteins[J]. J Dairy Res, 2011, 78(2): 242–249. DOI: 10.1017/S0022029911000148 |
| [13] |
巩元芳, 卢昕, 王志鹏, 等. 猪2、7和8号染色体上影响血常规指标的数量性状基因座(QTL)检测[J]. 生物化学与生物物理进展, 2008, 35(11): 1291–1297.
GONG Y F, LU X, WANG Z P, et al. Detection of quantitative trait loci affecting haematological traits on swine chromosomes 2, 7 and 8[J]. Progress in Biochemistry and Biophysics, 2008, 35(11): 1291–1297. DOI: 10.3321/j.issn:1000-3282.2008.11.011 (in Chinese) |
| [14] | ZOU Z Z, REN J, YAN X M, et al. Quantitative trait loci for porcine baseline erythroid traits at three growth ages in a White Duroc×Erhualian F2, resource population[J]. Mamm Genome, 2008, 19(9): 640–646. DOI: 10.1007/s00335-008-9142-9 |
| [15] | YANG S, REN J, YAN X, et al. Quantitative trait loci for porcine white blood cells and platelet-related traits in a White Duroc×Erhualian F2 resource population[J]. Anim Genet, 2009, 40(3): 273–278. DOI: 10.1111/age.2009.40.issue-3 |
| [16] | ZHANG Z Y, HONG Y, GAO J, et al. Genome-wide association study reveals constant and specific loci for hematological traits at three time stages in a White Duroc×Erhualian F2 resource population[J]. PLoS One, 2013, 8(5): e63665. DOI: 10.1371/journal.pone.0063665 |
| [17] |
刘会杰, 王晓铄, 王志军, 等. 大白、长白猪CD4基因启动子多态性及表达差异研究[J]. 中国畜牧杂志, 2014, 50(1): 10–14.
LIU H J, WANG X S, WANG Z J, et al. Study on genetic polymorphism in the promoter of CD4 gene and its expression in Yarkshire and Landrace[J]. Chinese Journal of Animal Science, 2014, 50(1): 10–14. (in Chinese) |
| [18] | USMAN T, WANG Y C, LIU C, et al. Novel SNPs in IL-17F and IL-17A genes associated with somatic cell count in Chinese Holstein and Inner-Mongolia Sanhe cattle[J]. J Anim Sci Biotechnol, 2017, 8: 5. DOI: 10.1186/s40104-016-0137-1 |
| [19] | FALCONER D S, MACKAY T F C, FRANKHAM R. Introduction to quantitative genetics[M]. 4th ed.Essex, UK: Pearson Education Limited, 1996: 280. |
| [20] |
许金根. 猪T淋巴细胞亚群的候选基因分析及表达谱研究[D]. 北京: 中国农业大学, 2013.
XU J G.Analysis of candidate genes and study of expression profile for porcine T lymphocyte subpopulations[D].Beijing:China Agricultural University, 2013.(in Chinese) |
| [21] | GUPTA S K. Reproductive immunology[M]. Netherlands: Springer, 1999: 4. |
| [22] |
林飞卿, 章谷生.
细胞免疫学研究进展[M]. 北京: 人民卫生出版社, 1980.
LIN F Q, ZHANG G S. Progress in cellular immunology[M]. Beijing: People's Medical Publishing House, 1980. (in Chinese) |
| [23] |
刘宝全. 兽医免疫学的进展(二)[J]. 现代化农业, 1988(6): 19–20.
LIU B Q. Progress in veterinary immunology (Ⅱ)[J]. Modernizing Agriculture, 1988(6): 19–20. (in Chinese) |
| [24] |
张孝全, 张跃明, 贾珉, 等. 成年母猪的淋巴细胞转化试验[J]. 中国兽医科技, 1982(9): 21–23, 68.
ZHANG X Q, ZHANG Y M, JIA M, et al. Lymphocyte transformation test of adult sows[J]. Chinese Veterinary Science, 1982(9): 21–23, 68. (in Chinese) |
| [25] |
郭峰. 红细胞天然免疫与获得性免疫[J]. 自然杂志, 2004, 26(4): 194–199.
GUO F. Red cell innate immunity and acquired immunity[J]. Chinese Journal of Nature, 2004, 26(4): 194–199. (in Chinese) |
| [26] |
郭峰. 红细胞免疫的研究和意义[J]. 自然杂志, 2002, 24(5): 268–273.
GUO F. Red cell immunology research and significance[J]. Chinese Journal of Nature, 2002, 24(5): 268–273. (in Chinese) |
| [27] | SIEGEL I, LIU T L, GLEICHER N. The red-cell immune system[J]. Lancet, 1981, 318(8246): 556–559. DOI: 10.1016/S0140-6736(81)90941-7 |
| [28] |
郭峰, 张乐之, 蔡志扬, 等. 红细胞调控白细胞免疫功能新的自然实验研究体系[J]. 解放军医学杂志, 2006, 31(2): 92–94.
GUO F, ZHANG L Z, CAI Z Y, et al. A study of modulation of white blood cell immune function by erythrocyte with a new system of immunological experimental system[J]. Medical Journal of Chinese People's Liberation Army, 2006, 31(2): 92–94. (in Chinese) |
| [29] | CHEN Z, TANG H, QAYYUM R, et al. Genome-wide association analysis of red blood cell traits in African Americans:the COGENT Network[J]. Hum Mol Genet, 2013, 22(12): 2529–2538. DOI: 10.1093/hmg/ddt087 |
| [30] |
高淑芳, 李培成. 血小板免疫介质分泌及与免疫病理关系研究进展[J]. 国际检验医学杂志, 2012, 33(5): 560–562.
GAO S F, LI P C. Platelet immune media secretion and the research progress of its relationship with immune pathological[J]. International Journal of Laboratory Medicine, 2012, 33(5): 560–562. (in Chinese) |
| [31] | TAJUDDIN S M, SCHICK U M, EICHER J D, et al. Large-scale exome-wide association analysis identifies loci for white blood cell traits and pleiotropy with immune-mediated diseases[J]. Am J Hum Genet, 2016, 99(1): 22–39. DOI: 10.1016/j.ajhg.2016.05.003 |



