2. 扬州大学教育部农业与农产品安全国际合作联合实验室, 扬州 225009
2. Joint International Research Laboratory of Agriculture & Agri-Product Safety, Yangzhou University, Yangzhou 225009, China
F18大肠杆菌(E. coli F18)属于产肠毒素大肠杆菌(Enterotoxigenic Escherichia coli, ETEC),是造成当今断奶仔猪腹泻高发病率和死亡率的主要病原菌之一[1-2]。F18大肠杆菌通过表面的宿主特异性肠吸附菌毛(黏附素)特异性吸附于小肠上皮细胞表面的刷状缘受体,定居并大量繁殖,随后产生肠毒素(Enterotoxin)和内毒素(Lipopolysaccharide, LPS)进入细胞内,使细胞壁损伤,刺激肠上皮细胞分泌大量液体进入肠腔并发挥病理效应,从而导致仔猪腹泻、脱水甚至死亡[3-5]。小肠上皮细胞是猪抵抗肠道致病菌的第一道防线,是与革兰氏阴性菌及其释放的脂多糖(LPS)直接作用的细胞,它的病变将会导致仔猪的腹泻和水肿等症状的出现。研究发现,大肠杆菌F18受体的最小抗原决定簇为ABH血型抗原中的1型H抗原,该抗原主要由FUT2酶催化[6-7]并在球系列鞘糖脂生物合成通路中合成[8]。
本课题组前期研究发现,鞘糖脂生物合成-球系列通路可能对断奶仔猪F18大肠杆菌抗性具有重要的调控作用[9],并初步确定鞘糖脂生物合成-球系列通路中α-(1, 2)岩藻糖转移酶基因(FUT1、FUT2基因)对F18大肠杆菌病抗性具有关键的调控作用[10]。FUT1、FUT2基因在染色体上呈串联形式排列[11],两者共同调控α-(1, 2)岩藻糖转移酶的功能活性,催化ABH血型抗原中1型H抗原的形成,从而影响F18大肠杆菌受体的形成及F18大肠杆菌的黏附[12]。研究发现,FUT1基因可以影响E. coli F18受体蛋白的表达,该基因存在2个突变位点M307和M857位点,且M307位点的遗传变异可作为猪抗E. coli F18育种的遗传标记,并已实现了多个国外品种的抗病育种[13-14]。然而本课题组及其他学者发现,在20多个中国地方猪品种中FUT1基因M307和M857位点均呈现极端偏态分布[15-18];在国外猪品种中抗E. coli F18育种得以应用的FUT1遗传标记可能不适合中国地方猪品种,需要寻求新的适合中国地方猪品种的重要候选基因及其有效遗传标记;基于FUT2的生物学功能和前期研究结果,开展FUT2基因的功能及其与E. coli F18抗性关系的研究无疑具有重要的科学意义和应用前景。本课题组前期在mRNA水平上的研究进一步表明,FUT2基因在E. coli F18抗性组猪十二指肠和空肠的表达量极显著低于敏感组,且FUT2基因的表达与FUT1基因呈极显著正相关,两者都参与E. coli F18的抗性调控[19]。迄今为止,关于猪FUT2基因的研究大多集中在探讨基因多态和表达与仔猪抗大肠杆菌病的关系,还需要在细胞水平上开展功能研究及验证工作。
RNAi技术是目前发展起来的基因阻断技术之一,是现今生物学研究的一种重要手段。它能够在细胞水平上研究基因在信号通路和动物个体中的功能,从而改善动物的遗传性状,提高经济价值,甚至能提高动物的抗病力,防治疾病[20-22]。本试验利用大肠杆菌刺激和脂多糖(Lipopolysaccharides,LPS)诱导处理猪肠上皮细胞系(IPEC-J2),检测处理前后FUT2基因mRNA水平相对表达量,分析大肠杆菌感染和LPS诱导条件下FUT2基因的表达变化规律,同时设计并构建靶向猪FUT2基因的shRNA干扰序列及阴性对照,进行慢病毒包装,转染猪小肠上皮细胞系,利用Real-time PCR方法检测干扰效率,选择效率最高的慢病毒进行后续功能验证,获得FUT2基因稳定沉默的肠上皮细胞后,分析FUT2基因沉默对其所在细胞球系列鞘糖脂生物合成通路其他关键基因(FUT1、ST3GAL1(β-半乳糖苷a-2, 3-唾液酸转移酶1)、HEXA(β-N-乙酰半乳糖胺酶A)、HEXB(β-N-乙酰半乳糖胺酶B)、B3GALNT1(β-1, 3-N-乙酰基半乳糖基转移酶1)、NAGA(N-乙酰基半乳糖苷酶A))表达以及对小肠上皮细胞E. coli F18黏附能力的影响,在细胞水平上探讨FUT2的功能,以期为研究FUT2基因及其所在通路在猪肠上皮细胞受到E. coli F18侵染时的调控作用及其分子机制提供基础,同时为今后提升仔猪抗大肠杆菌侵染能力的分子选育提供理论依据。
1 材料与方法 1.1 试验材料猪小肠上皮细胞系IPEC-J2由美国宾夕法尼亚大学惠赠;人胚肾上皮细胞293T购自中国科学院细胞库;大肠杆菌F18ab、F18ac由扬州大学朱国强教授馈赠。DMEM/F12(1:1)培养基、DMEM培养基、胎牛血清、Opti-MEM、Trypsin-EDTA Solution及Polybrene均购自Gibco BRL(Life Technologies, Grand island, NY, USA);LPS购自Sigma公司(Sigma-aldrich, St. Louis, MO, USA);Trizol购自Invitrogen公司(美国);反转录试剂盒、SYBR定量试剂盒购自Vazyme公司(中国,南京);穿梭质粒pGLV3/H1/GFP+Puro和包装质粒pGag/Pol、pRev、pVSV-G由上海吉玛构建制备;RNAi-Mate转染试剂、T4 DNA连接酶、质粒中提试剂盒均购自Invitrogen公司(美国)。
1.2 引物设计与合成根据GenBank数据库提供的猪FUT2基因序列(U70881.2)设计4个针对FUT2基因的短发夹RNA(short hairpin RNA,shRNA)干扰序列(表 1);并设计球系列鞘糖脂生物合成通路7个关键基因序列的实时荧光定量PCR引物。所有荧光定量引物片段大小均在100 bp左右,且都跨外显子设计,以避免基因组DNA污染;使用GAPDH基因作为内参基因,规范所有其他组织产物的循环阈值(CT)。同时根据大肠杆菌菌毛蛋白基因PILIN设计荧光定量引物,并设计猪β-actin基因的荧光定量引物,用细胞基因β-actin作为内参对细菌菌毛基因PILIN进行均一化。所有引物均由上海生工生物工程有限公司合成。引物的详细信息如表 2所示。
|
|
表 1 shRNA寡聚单链DNA序列 Table 1 The oligomeric single stranded DNA sequence of shRNAs |
|
|
表 2 Real-time PCR引物信息 Table 2 The information of Real-time PCR primer |
将大肠杆菌F18ab、F18ac分别接种于LB培养液,200 r·min-1摇菌12 h,3 000 r·min-1离心10 min,收集菌体,用PBS缓冲液重悬洗涤并离心,重复3次。最后用细胞培养液将细菌稀释至1.0×109 CFU·mL-1,按每孔1 mL的量加入细胞培养孔,每组有3个平行样,4 h后收集细胞。
将LPS用细胞培养液稀释至0.1 μg·mL-1,按每孔1 mL的量加入细胞培养孔进行诱导,阴性对照组只加用于配置诱导液的细胞培养液,每组有3个平行样。分别在诱导后的4、8、12 h收集细胞。
1.4 荧光定量检测大肠杆菌F18ab、F18ac菌体感染和LPS诱导IPEC-J2细胞后的基因表达变化利用Trizol法提取所收集细胞的总RNA,通过1.2%琼脂糖凝胶电泳和核酸/蛋白浓度测定仪NanoDrop ND-1000检测RNA的纯度和浓度,-70 ℃保存备用。以每个个体的RNA作为模板按照反转录试剂盒操作程序进行cDNA合成:每10 μL的反应体系中含5× qRT SuperMix Ⅱ 2 μL,总RNA不超过500 ng,RNase-free ddH2O补足至10 μL。反应条件:25 ℃ 10 min, 50 ℃ 30 min,85 ℃ 5 min,4 ℃保存。
荧光定量PCR反应体系20 μL:cDNA(100~500 ng)2 μL,上下游引物(10 μmol·L-1)各0.4 μL,50× ROX Reference Dye Ⅱ 0.4 μL,2× AceQTM qPCR SYBR Green Master Mix 10 μL,ddH2O 6.8 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 34 s,40个循环;扩增结束后分析熔解曲线,程序:95 ℃ 15 s,60 ℃ 1 min;95 ℃ 15 s,60 ℃ 15 s。应用熔解曲线检测其是否具有(85±0.8)℃ Tm扩增的特异性,每个样本进行3次实时PCR检测,取平均值。
1.5 Western blotting检测以大肠杆菌感染前后的细胞为样本,使用NE-PER试剂盒提取细胞总蛋白,并通过BCA试剂盒检测蛋白含量,使蛋白质水平标准化。SDS-PAGE(10% SDS-聚丙烯酰胺凝胶电泳):取10 μL蛋白质上样,160 V跑胶70 min。Western blotting(蛋白印迹):蛋白质转移到PVDF(聚丙烯二氟乙烯)膜上,与相关抗体进行免疫印迹,FUT2抗体(1:500)作为一抗,兔原抗体(1:3 000)IgG作为二抗,β-actin抗体作为参照。
1.6 干扰载体构建将合成的5对oligo序列分别通过退火处理成双链,克隆入pGLV3/H1/GFP+Puro载体。退火程序:正反单链(100 μmol·L-1)各5 μL,退火缓冲液(10×)2 μL,双蒸水8 μL,置于95 ℃加热5 min,然后室温自然冷却20 min,形成双链。连接程序:连接缓冲液(5×)4 μL,双链DNA(10 nmol·L-1) 4 μL,pGLV3(100 ng·μL-1)2 μL,T4 DNA连接酶(1 U·μL-1)1 μL,双蒸水9 μL,室温连接处理30 min。连接产物分别转化感受态细胞DH5α,在含氨苄青霉素的固体培养基上培养16 h,挑取多个单克隆提取质粒并进行测序验证。经测序验证序列连接正确后,抽提高纯度质粒备用。
1.7 慢病毒载体包装及滴度测定293T细胞在37 ℃,5% CO2的培养箱中培养至覆盖率达到80%,按照RNAi-Mate转染说明书将慢病毒重组载体与包装质粒共转染293T细胞,72 h后收集培养液4 000 r·min-1离心4 min,取上清,去除细胞和碎片,并用0.45 μm的滤器过滤;将病毒原液在20 000 r·min-1下超速离心2 h,去除上清,重悬于Opti-MEM培养液中。
用含5 μg·mL-1 Polybrene、10% FBS的DMEM培养液,按10倍梯度稀释病毒液,每梯度各取100 μL加入培养有293T细胞的96孔板,每梯度3个重复孔。37 ℃,5% CO2的培养箱中培养24 h后,吸弃稀释病毒液,加10% FBS的DMEM培养液,继续培养48 h。在荧光显微镜下观察各孔中荧光细胞数量,病毒滴度为各孔中表达荧光的细胞平均数除以每孔中含有的慢病毒液体积。
1.8 病毒液侵染猪IPEC-J2细胞及干扰效率验证取滴度为1×108 TU·mL-1的pGLV3-FUT2-shRNA及阴性对照病毒液10 μL,加入指数生长期IPEC-J2细胞的12孔板中,同时设置不转染的正常细胞组。48 h后观察荧光情况,使用10 μg·mL-1嘌呤霉素进行药物筛选,每24 h换1次含灭嘌呤霉素的新鲜培养液,荧光显微镜下观察阳性细胞情况,直至正常细胞全部死亡停止加药。收集细胞总RNA,检测FUT2基因相对表达情况,并计算干扰效率。
1.9 定量检测FUT2基因沉默对IPEC-J2细胞中球系列鞘糖脂生物合成通路相关基因表达的影响选择干扰效率最高的慢病毒载体侵染后的细胞继续培养,加嘌呤霉素维持,获得FUT2基因沉默的IPEC-J2细胞系,分别将FUT2干扰组、阴性对照组及空白对照组处理的细胞以5.0×105个·孔-1密度接种至12孔板培养。收集细胞提取总RNA,通过实时荧光定量PCR检测FUT2基因沉默对IPEC-J2细胞中球系列鞘糖脂生物合成通路关键基因表达的影响(FUT1、FUT2、ST3GAL1、HEXA、HEXB、B3GALNT1、NAGA),比较分析干扰FUT2基因表达对通路中其他基因表达水平的影响,以分析FUT2基因在球系列鞘糖脂生物合成通路中的作用。
1.10 FUT2基因沉默对大肠杆菌黏附能力的影响上述3组细胞按5.0×105个·孔-1的密度分别接种到12孔板,培养至细胞铺满整个孔室。大肠杆菌F18ab和F18ac分别接种至LB培养液,37 ℃摇床200 r·min-1培养12 h,4 000 r·min-1离心5 min收集菌体,PBS缓冲液重悬洗涤并离心,重复3次。用细胞培养液将细菌稀释至1.0×109 CFU·mL-1,向培养板中分别加入1.0 mL细菌悬液,各3个重复,37 ℃ 5% CO2培养箱孵育1 h。弃去培养孔中细菌液,PBS洗涤3次,
一板用超纯水配制的0.5% Triton X-100溶液处理20 min,再用移液器收集细菌悬液并按10倍浓度进行梯度稀释,涂布于LB平板,37 ℃培养过夜,统计平板上菌落个数。一板立即向其中加入DNA提取试剂盒裂解液,严格按照试剂盒说明提取细胞和细菌DNA。以抽提细菌和细胞混合DNA为模板,每个样本3个重复孔,以相对定量模式进行定量检测。
1.11 数据处理与分析采用2-ΔΔCt法[23]处理相对定量的结果,用内参基因对表达水平进行均一化。使用下列公式:ΔΔCt=(待测组目的基因平均Ct值-待测组内参基因平均Ct值)-(对照组目的基因平均Ct值-对照组内参基因平均Ct值)。利用SPSS 16.0软件的一般线性模型(General Linear Model, GLM)对细胞感染细菌前后、LPS不同处理时间、RNAi基因前后的细胞基因表达差异情况及干扰前后的细胞黏附情况进行比较分析。
2 结果 2.1 FUT2基因在大肠杆菌感染猪小肠上皮细胞后的mRNA表达水平变化大肠杆菌F18ab和F18ac菌体分别感染IPEC-J2细胞后,细胞FUT2基因的表达量呈极显著上升(P<0.01),且大肠杆菌F18ab感染IPEC-J2细胞后的FUT2基因表达水平高于F18ac感染后的细胞。
2.2 LPS诱导IPEC-J2后不同时间FUT2基因表达量的差异以空白对照组FUT2基因的表达量为1,对LPS不同诱导阶段IPEC-J2细胞中FUT2基因的荧光定量结果进行统计,发现在0.1 μg·mL-1的LPS诱导后,随诱导时间的延长FUT2基因表达呈阶梯状增长,如图 2所示。在LPS诱导4、8和12 h后,FUT2基因表达量均极显著高于空白对照(P<0.01),但3个不同时间点之间FUT2基因表达量差异不显著(P>0.05)。
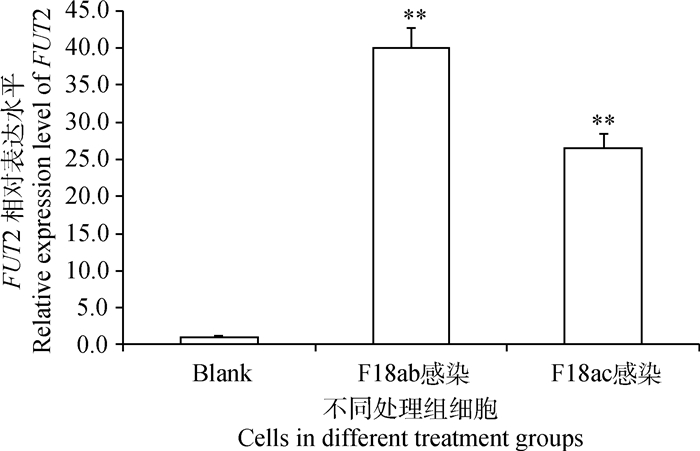
|
Blank.空白处理组细胞;**.表示差异极显著(P<0.01)。下表同 Blank stands for the cells without any treatment; **. Means extremely significant difference between the treatments (P<0.01). The same as below 图 1 FUT2基因在大肠杆菌菌体感染细胞后的mRNA相对表达水平 Figure 1 The mRNA expression level of FUT2 gene in cells infected by Escherichia coli |
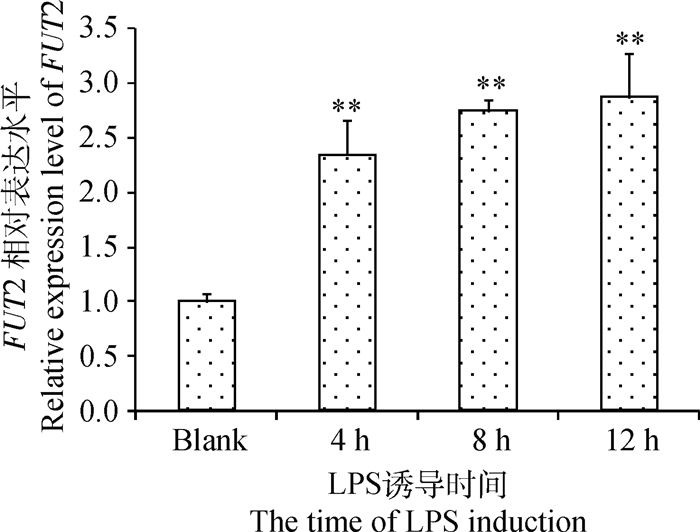
|
图 2 0.1 μg·mL-1 LPS诱导IPEC-J2后FUT2基因的表达量 Figure 2 The expression of FUT2 in IPEC-J2 induced by 0.1 μg·mL-1 LPS |
从图 3可以看出,大肠杆菌F18ab和F18ac感染IPEC-J2后FUT2蛋白表达水平高于对照组。这与mRNA相对定量的结果一致。
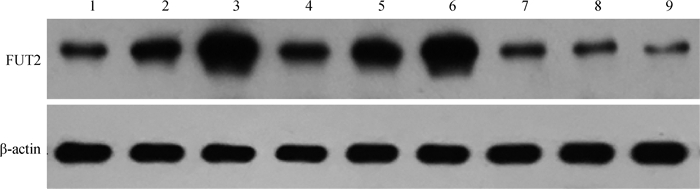
|
1~3. F18ab感染组;4~6. F18ac感染组;7~9.对照组 1-3. F18ab infection group; 4-6. F18ac infection group; 7-9. The control group 图 3 FUT2蛋白在大肠杆菌F18ab和F18ac菌体感染IPEC-J2细胞前后的差异表达 Figure 3 Differential expression of FUT2 protein before and after E. coli F18ab and F18ac infection |
通过对所挑取阳性克隆进行测序验证,最终获得连接正确的4个干扰和1个阴性对照慢病毒重组质粒载体,分别命名为pGLV3-FUT2-1、pGLV3-FUT2-2、pGLV3-FUT2-3、pGLV3-FUT2-4和pGLV3-FUT2-NC。包装成功后收集病毒液进行病毒滴度检测和计算:4个干扰载体滴度均为3×108 TU·mL-1,阴性对照为2×108 TU·mL-1,该滴度水平达到了细胞感染的要求。用Opti-MEM培养液将慢病毒液稀释至1×108 TU·mL-1,并分装保存于-80 ℃。
2.5 慢病毒载体干扰效率验证由图 4可知,慢病毒侵染IPEC-J2细胞后,细胞能表达绿色荧光蛋白;药物筛选72 h后均能持续稳定表达绿色荧光蛋白,表明慢病毒载体已成功转染细胞并稳定表达。提取总RNA进行实时荧光定量检测FUT2基因转录水平表达情况,由图 5可知,pGLV3-FUT2-2处理的IPEC-J2细胞中猪FUT2基因相对表达水平为0.13,干扰效率为87%,即pGLV3-FUT2-2干扰效率最高,可用于后续试验。

|
RNAi表示FUT2基因干扰,NC表示阴性对照。左列是荧光显微镜下观察到的细胞,右列是普通光镜下与左侧相同视野的对照 RNAi represent FUT2 gene interference, and NC represent negative control. The left are cells observed by the fluorescence microscope, and the right are the control of the same view in left observed by ordinary light microscope 图 4 pGLV3-FUT2-shRNA病毒颗粒侵染IPEC-J2细胞荧光效果(40×) Figure 4 Fluorescence effect of pGLV3-FUT2-shRNA virus particles infecting IPEC-J2 cells(40×) |
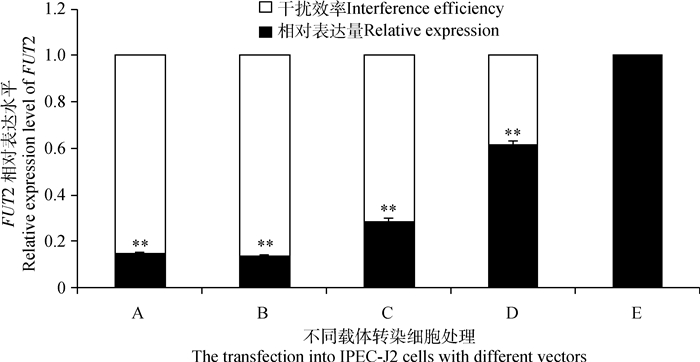
|
A~E.依次为pGLV3-FUT2-1、pGLV3-FUT2-2、pGLV3-FUT2-3、pGLV3-FUT2-4和pGLV3-FUT2-NC转染IPEC-J2细胞处理 A-E. Transfection into IPEC-J2 cells with pGLV3-FUT2-1, pGLV3-FUT2-2, pGLV3-FUT2-3, pGLV3-FUT2-4 and pGLV3-FUT2-NC, respectively 图 5 实时荧光定量检测FUT2基因mRNA表达水平及干扰效率分析 Figure 5 The mRNA expression of FUT2 and analysis of interference efficiency |
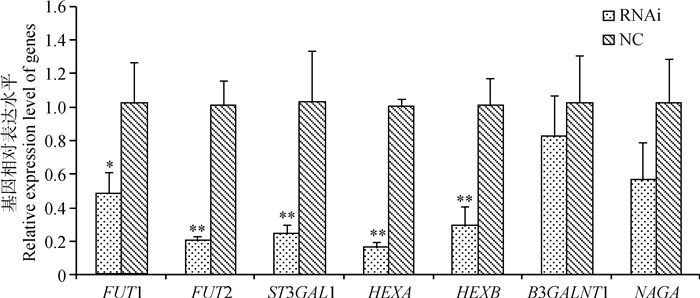
由图 6可知,FUT2基因沉默造成ST3GAL1、HEXA和HEXB基因表达水平极显著下调(P<0.01),FUT1基因表达水平显著下调(P<0.05),而B3GALNT1和NAGA基因表达水平未发生显著变化。
|
RNAi表示FUT2基因干扰,NC表示阴性对照。*表示差异显著(P<0.05)。下同 RNAi represents FUT2 gene interference, and NC represents negative control. * means significant difference between the treatments(P<0.05). The same as below 图 6 FUT2基因沉默后IPEC-J2细胞中各基因的表达 Figure 6 Expression of genes in IPEC-J2 cells after FUT2 gene silencing |
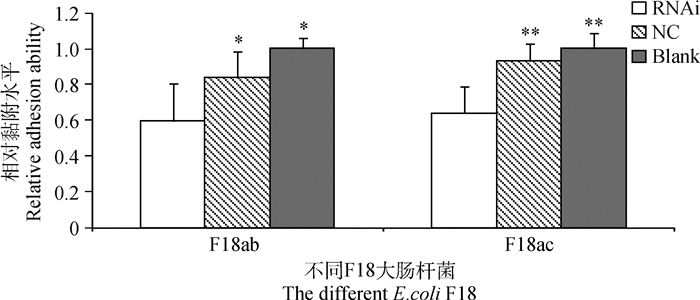
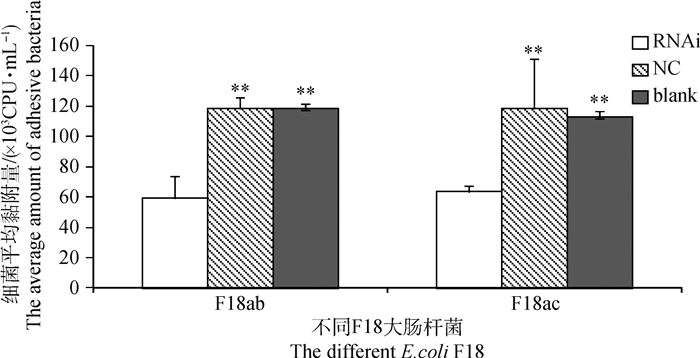
由图 7和图 8可以看出,细菌黏附的荧光定量结果和菌落定量结果均显示,FUT2基因沉默后大肠杆菌F18ab和F18ac对IPEC-J2细胞的黏附能力均显著下降。
|
Blank表示空白对照 Blank represents blank control 图 7 FUT2基因沉默的IPEC-J2细胞对大肠杆菌的黏附水平的荧光定量结果 Figure 7 The fluorescence quantitative results about the adhesion of IPEC-J2 cells to Escherichia coli after silencing FUT2 gene |
|
图 8 FUT2基因沉默的IPEC-J2细胞对大肠杆菌黏附水平的菌落定量结果 Figure 8 The colonies quantitative results about the adhesion of IPEC-J2 cells to Escherichia coli after silencing FUT2 gene |
鞘糖脂在免疫应答、细胞发育分化、细胞识别过程中都发挥重要的作用[24],它能和糖肌醇磷脂锚定蛋白(GPI锚定蛋白)在反式高尔基体上形成聚集物,然后靶向定位于极化的上皮细胞顶端域。这种分布特性使得上皮细胞在不利环境中能免受侵害,另外可作为肠道共生菌群黏附结合的位点[25-26]。因此球系列鞘糖脂生物合成通路在E. coli F18受体形成的过程中发挥着重要的作用。目前研究表明,球系列鞘糖脂生物合成通路中的FUT2基因与肠道菌群以及病毒性腹泻的易感性存在着重要的联系,了解病毒感染的整体框架,有助于提高机体对病毒性腹泻的抵抗力[27]。FUT2基因的遗传多态性与克罗恩病等炎症性肠道疾病的易感性有着密切的关系,它能影响肠黏蛋白的功能状态,从而影响疾病的易感性[28]。另有研究表明,FUT2基因的遗传多态能够影响肠黏膜和其分泌物的岩藻糖基化水平,导致肠道菌群的生态失调,从而引起炎症反应的发生。同时肠内微生物和细菌黏附也影响FUT2基因的表达[29-30]。FUT2基因催化形成的1型H抗原(组织血型抗原)主要分布在分泌液及大量外胚层或中胚层起源的组织中,导致了FUT2基因在肠道组织中的高表达[31]。同时基于FUT2基因参与E. coli F18受体的形成,因此本试验选用小肠上皮细胞作为试验对象,开展一系列细胞水平的研究。本课题组研究表明,FUT2基因在E. coli F18抗性组仔猪十二指肠和空肠的表达量极显著低于敏感组,且FUT2基因的表达与FUT1基因呈极显著正相关,两者都参与E. coli F18的抗性调控[19]。本试验结果表明,在F18大肠杆菌菌体刺激和LPS诱导后,IPEC-J2细胞FUT2基因的表达均表现出明显的上升。LPS是大肠杆菌黏附肠上皮细胞所释放的内毒素,其诱导细胞后FUT2基因的极显著上调与大肠杆菌感染所引起的基因变化一致,说明FUT2基因的低水平表达有利于机体抵抗大肠杆菌的感染。而这一结果与之前课题组在mRNAs水平上的试验结果完全一致,进一步说明了FUT2基因的低水平表达有助于提高仔猪对大肠杆菌病的抵抗力,其在E. coli F18的抗性调控中发挥着重要的作用。
国外研究表明,FUT2基因敲除后岩藻糖基化结构减少,多糖结构Lewis-a增加,从而导致岩藻糖基化黏蛋白的缺失,破坏幽门螺杆菌表达血型抗原结合黏附素对胃黏膜的黏合,进而防治幽门螺杆菌感染[32]。为了在细胞水平上对FUT2基因进行更深入的功能验证,进一步构建4个靶向FUT2基因的shRNA慢病毒干扰载体,检测干扰前后对细胞球系列鞘糖脂生物合成通路关键基因表达和E.coli F18黏附能力的影响。本研究结果表明,FUT2基因干扰后其所在的鞘糖脂生物合成-球系列通路中FUT1、ST3GAL1、HEXA和HEXB基因表达水平显著或极显著下调,而B3GALNT1和NAGA基因表达水平虽有所下调,但未发生显著变化,同时其干扰后对大肠杆菌的黏附能力显著降低。这说明FUT2基因与球系列鞘糖脂生物合成通路中FUT1、ST3GAL1、HEXA和HEXB等基因存在着协同互作作用,FUT2基因的下调也将导致FUT1、ST3GAL1等基因的下调。B3GALNT1酶和NAGA酶主要促进H抗原前体物质的合成,且NAGA酶可以水解O-型糖链上的复合物;HEXA酶和HEXB酶对H抗原前体的合成具有反向催化作用,两者主要参与己糖胺酶的合成;ST3GAL1酶主要作用于H抗原前体合成唾液酸,再链接于酸化的糖配体末端形成不同的受体[17]。结合以上功能分析推测,FUT2基因的下调一方面影响α-(1, 2)岩藻糖转移酶的功能活性,减少ABH血型抗原中的1型H抗原和F18大肠杆菌受体的形成,降低对F18大肠杆菌的黏附,从而参与E. coli F18的抗性调控。另一方面,FUT2基因的下调也将导致FUT1、ST3GAL1等基因的下调,抑制了H抗原前体物质的合成,从而抑制H抗原和唾液酸的合成,导致F18大肠杆菌受体的形成受到了阻碍。此外,FUT2基因的低水平表达降低了肠黏膜和其分泌物的岩藻糖基化水平,提高了肠黏蛋白的功能状态,促进肠道菌群的生态平衡,使宿主增强了对细菌侵染的抵抗力。
基于本试验研究结果,下一步将继续运用RNA干扰技术构建共抑制或过量表达一种而抑制另一基因表达的双向表达载体,转染小肠上皮细胞,测定对小肠上皮细胞F18大肠杆菌黏附状态的影响,从而较准确地确定基因之间的协同或颉颃作用。同时设计FUT2基因敲除载体,获得FUT2基因敲除猪,在个体水平上研究FUT2基因在抵抗E. coli F18感染过程中发挥的作用。这有助于解决中国地方品种大肠杆菌病抗性育种的问题,为今后制定抗大肠杆菌病遗传选育策略提供一定的理论依据。
4 结论本研究结果表明,FUT2基因低表达可能不利于仔猪大肠杆菌受体的形成,以增强猪小肠上皮细胞抵抗E.coli F18感染的能力,本试验结果同时为球系列鞘糖脂生物合成通路在仔猪抗大肠杆菌感染过程中的作用机制研究提供一定的理论基础和依据。
| [1] | BOLDIN B. Persistence and spread of gastro-intestinal infections:The case of enterotoxigenic Escherichia coli in piglets[J]. Bull Math Biol, 2008, 70(7): 2077–2101. DOI: 10.1007/s11538-008-9348-8 |
| [2] | NGUYEN U V, CODDENS A, MELKEBEEK V, et al. High susceptibility prevalence for F4+ and F18+ Escherichia coli in Flemish pigs[J]. Vet Microbiol, 2017, 202: 52–57. DOI: 10.1016/j.vetmic.2016.01.014 |
| [3] | IMBERECHTS H, WILD P, CHARLIER G, et al. Characterization of F18 fimbrial genes fedE and fedF involved in adhesion and length of enterotoxemic Escherichia coli strain 107/86[J]. Microb Pathog, 1996, 21(3): 183–192. DOI: 10.1006/mpat.1996.0053 |
| [4] | IMBERECHTS H, DE GREVE H, SCHLICKER C, et al. Characterization of F107 fimbriae of Escherichia coli 107/86, which causes edema disease in pigs, and nucleotide sequence of the F107 major fimbrial subunit gene, fedA[J]. Infect Immun, 1992, 60(5): 1963–1971. |
| [5] |
蒋磊, 周明旭, 夏芃芃, 等. 产肠毒素大肠杆菌感染的分子致病机制[J]. 中国兽医学报, 2014, 34(9): 1551–1560.
JIANG L, ZHOU M X, XIA P P, et al. Molecular pathogenic mechanisms of enterotoxigenic Escherichia coli infection[J]. Chinese Journal of Veterinary Science, 2014, 34(9): 1551–1560. (in Chinese) |
| [6] | MOONENS K, BOUCKAERT J, CODDENS A, et al. Structural insight in HISTO-blood group binding by the F18 fimbrial adhesin FedF[J]. Mol Microbiol, 2012, 86(1): 82–95. DOI: 10.1111/mmi.2012.86.issue-1 |
| [7] | LONARDI E, MOONENS K, BUTS L, et al. Structural sampling of glycan interaction profiles reveals mucosal receptors for fimbrial adhesins of enterotoxigenic Escherichia coli[J]. Biology (Basel), 2013, 2(3): 894–917. |
| [8] | HAKOMORI S. Traveling for the glycosphingolipid path[J]. Glycoconj J, 2000, 17(7-9): 627–647. |
| [9] | BAO W B, YE L, PAN Z Y, et al. Microarray analysis of differential gene expression in sensitive and resistant pig to Escherichia coli F18[J]. Anim Genet, 2012, 43(5): 525–534. DOI: 10.1111/age.2012.43.issue-5 |
| [10] |
叶兰. 断奶仔猪大肠杆菌F18菌株抗性候选基因的筛选与功能分析[D]. 扬州: 扬州大学, 2013.
YE L. Screening and function analysis of candidate genes related to E. coli F18 resistance in weanling pigs[D]. Yangzhou:Yangzhou University, 2013. (in Chinese) http: //cdmd. cnki. com. cn/Article/CDMD-11117-1014115345. htm |
| [11] | ABRANTES J, POSADA D, GUILLON P, et al. Widespread gene conversion of alpha-2-fucosyltransferase genes in mammals[J]. J Mol Evol, 2009, 69(1): 22–31. DOI: 10.1007/s00239-009-9239-0 |
| [12] | CODDENS A, DISWALL M, ÅNGSTRÖM J, et al. Recognition of blood group ABH type 1 determinants by the FedF adhesin of F18-fimbriated Escherichia coli[J]. J Biol Chem, 2009, 284(15): 9713–9726. DOI: 10.1074/jbc.M807866200 |
| [13] | VOGELI P, MEIJERINK E, FRIES R, et al. A molecular test for the detection of E. coli F18 receptors:a breakthrough in the struggle against edema disease and post-weaning diarrhea in swine[J]. Schweiz Arch Tierheilkd, 1997, 139(11): 479–484. |
| [14] | MEIJERINK E, FRIES R, VÖGELI P, et al. Two α(1, 2) fucosyltransferase genes on porcine chromosome 6q11 are closely linked to the blood group inhibitor (S) and Escherichia coli F18 receptor (ECF18R) loci[J]. Mamm Genome, 1997, 8(10): 736–741. DOI: 10.1007/s003359900556 |
| [15] |
施启顺, 黄生强, 柳小春, 等. 不同猪种E. coli F18受体基因的多态性[J]. 遗传学报, 2003, 30(3): 221–224.
SHI Q S, HUANG S Q, LIU X C, et al. Polymorphism of E. coli F18 receptor gene in different pig breeds[J]. Acta Genetica Sinica, 2003, 30(3): 221–224. (in Chinese) |
| [16] |
晏学明, 任军, 郭源梅, 等. 猪a1-岩藻糖转移酶基因(FUT1)在26个中外猪种中的遗传变异研究[J]. 遗传学报, 2003, 30(9): 830–834.
YAN X M, REN J, GUO Y M, et al. Research on the genetic variations of a1-fucosytransferase(FUT1) gene in 26 pig breeds[J]. Acta Genetica Sinica, 2003, 30(9): 830–834. (in Chinese) |
| [17] | BAO W B, WU S L, MUSA H H, et al. Genetic variation at the alpha-1-fucosyltransferase (FUT1) gene in Asian wild boar and Chinese and Western commercial pig breeds[J]. J Anim Breed Genet, 2008, 125(6): 427–430. DOI: 10.1111/jbg.2008.125.issue-6 |
| [18] |
吴圣龙, 包文斌, 鞠慧萍, 等. 猪a1-岩藻糖转移酶基因(FUT1)M857位点遗传变异分析[J]. 遗传, 2007, 29(9): 1071–1076.
WU S L, BAO W B, JU H P, et al. Analysis of genetic variations at M857 locus of the a1-fucosy-transferase (FUT1) ORF in pigs[J]. Hereditas (Beijing), 2007, 29(9): 1071–1076. (in Chinese) |
| [19] | DONG W H, DAI C H, SUN L, et al. Expression of key glycosphingolipid biosynthesis-globo series pathway genes in Escherichia coli F18-resistant and Escherichia coli F18-sensitive piglets[J]. Anim Genet, 2016, 47(4): 428–435. DOI: 10.1111/age.12428 |
| [20] |
赵宇航, 梁浩, 刘明秋, 等. 基因敲除技术在大型家畜中的应用[J]. 畜牧兽医学报, 2014, 45(1): 1–8.
ZHAO Y H, LIANG H, LIU M Q, et al. The application of gene knockout technologies in big domestic animals[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(1): 1–8. (in Chinese) |
| [21] |
杜琛, 李金泉, 陈秀娟. 白绒山羊PPARγ基因RNA干扰慢病毒载体的构建及对肌内脂肪细胞增殖分化的影响[J]. 畜牧兽医学报, 2016, 47(4): 671–678.
DU C, LI J Q, CHEN X J. Construction of lentiviral RNAi Vector of PPARγ gene in cashmere goat and its effect on proliferation and differentiation of intramuscular adipocytes[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(4): 671–678. (in Chinese) |
| [22] |
郑敏, 罗乐, 熊朝丽, 等. 靶向鸭肠炎病毒NP基因RNAi对DEV增殖的影响[J]. 畜牧兽医学报, 2017, 48(1): 132–139.
ZHENG M, LUO L, XIONG Z L, et al. Effection of targeting DEV-NP gene on DEV proliferation by RNA interference[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(1): 132–139. (in Chinese) |
| [23] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the method[J]. Methods, 2001, 25(4): 402–408. DOI: 10.1006/meth.2001.1262 |
| [24] |
王艳萍, 王征, 朱健, 等. 鞘糖脂研究进展[J]. 生命科学, 2011, 23(6): 583–591.
WANG Y P, WANG Z, ZHU J, et al. Progress in study of glycosphingolipids[J]. Chinese Bulletin of Life Sciences, 2011, 23(6): 583–591. (in Chinese) |
| [25] | ICHIKAWA S, HIRABAYASHI Y. Glucosylceramide synthase and glycosphingolipid synthesis[J]. Trends Cell Biol, 1998, 8(5): 198–202. DOI: 10.1016/S0962-8924(98)01249-5 |
| [26] | UEMURA A, WATARAI S, IWASAKI T, et al. Induction of immune responses against glycosphingolipid antigens:Comparison of antibody responses in mice immunized with antigen associated with liposomes prepared from various phospholipids[J]. J Vet Med Sci, 2005, 67(12): 1197–1201. DOI: 10.1292/jvms.67.1197 |
| [27] | RODRÍGUEZ-DÍAZ J, GARCÍA-MANTRANA I, VILA-VICENT S, et al. Relevance of secretor status genotype and microbiota composition in susceptibility to rotavirus and norovirus infections in humans[J]. Sci Rep, 2017, 7: 45559. DOI: 10.1038/srep45559 |
| [28] | MCGOVERN D P B, JONES M R, TAYLOR K D, et al. Fucosyltransferase 2(FUT2) non-secretor status is associated with Crohn's disease[J]. Hum Mol Genet, 2010, 19(17): 3468–3476. DOI: 10.1093/hmg/ddq248 |
| [29] | NANTHAKUMAR N N, MENG D, NEWBURG D S. Glucocorticoids and microbiota regulate ontogeny of intestinal fucosyltransferase 2 requisite for gut homeostasis[J]. Glycobiology, 2013, 23(10): 1131–1141. DOI: 10.1093/glycob/cwt050 |
| [30] | RAYES A, MORROW A L, PAYTON L R, et al. A genetic modifier of the gut microbiome influences the risk of graft-versus-host disease and bacteremia after hematopoietic stem cell transplantation[J]. Biol Blood Marrow Transplant, 2016, 22(3): 418–422. DOI: 10.1016/j.bbmt.2015.11.017 |
| [31] |
夏日炜, 钦伟云, 甘丽娜, 等. 不同日龄苏太仔猪FUT2基因的组织表达谱和表达差异分析[J]. 中国畜牧杂志, 2016, 52(9): 1–4.
XIA R W, QIAN W Y, GAN L N, et al. Tissue expression profile and differential expression of FUT2 gene in Sutai piglets at different ages[J]. Chinese Journal of Animal Science, 2016, 52(9): 1–4. (in Chinese) |
| [32] | MAGALHES A, ROSSEZ Y, ROBBE-MASSELOT C, et al. Muc5ac gastric mucin glycosylation is shaped by FUT2 activity and functionally impacts Helicobacter pylori binding[J]. Sci Rep, 2016, 6: 25575. DOI: 10.1038/srep25575 |



