富营养化水体中蓝藻水华频繁发生,由此产生的严重生态危害已成为备受关注的重大水环境问题。水华的发生使水体感官性状恶化、自净能力降低,并破坏自然人文景观,其中产毒蓝藻产生释放的藻毒素,对生态环境造成危害并危及人类健康[1-3]。
蓝藻毒素是产毒蓝藻产生的次级代谢产物,毒素种类繁多,其中肝毒素(hepatotoxins)和神经毒素(neurotoxins)对人类危害最为严重[4]。微囊藻毒素(microcystin,MCs)是普遍存在于富营养化水体中的肝毒素,也是目前研究最为广泛的毒素,主要由微囊藻属(Microcystis)、浮丝藻属(Planktothrix)和颤藻属(Oscillatoria)等藻类产生[5];鱼腥藻毒素(anatoxin,AnTX)是鱼腥藻属(Anabaena)和束丝藻属(Aphanizomenon)等藻类产生的神经毒素;麻痹性贝类毒素(paralytic shellfish toxins,PSTs)是具有神经毒性的小分子生物碱,主要由亚历山大藻属(Alexandrium)、束丝藻属和鱼腥藻属等藻类产生[6]。
蓝藻毒素类型多样,分离困难,微量多变,监测分析难度大,目前缺乏对蓝藻水华及蓝藻毒素危害的有效控制手段。常用的蓝藻毒素检测方法对样品和检测条件要求高,往往只能检测水体中已产生并积累到一定浓度的毒素,无法对毒素产生、毒素种类和产毒藻种进行预判。随着分子生物学技术的发展,对藻毒素合成酶基因的研究发现微囊藻毒素、鱼腥藻毒素和麻痹性贝类毒素的生物合成分别受mcy(microcystin synthesis gene)基因簇、ana(anatoxin synthesis gene)基因簇和sxt(saxitoxin synthesis gene)基因簇的调控[7-9],这为针对性地开展产毒蓝藻监测和研究提供了重要手段,通过相关毒素酶合成基因检测产毒藻类的方法目前已成功应用于蓝藻水华监测和研究中[10]。VALÉRIO等[11]采用多重PCR和高效液相色谱法对124株环境样品进行检测,结果表明多重PCR检测结果灵敏性为92.3%,特异性高达100%。TILLETT等[12]针对微囊藻毒素合成酶基因mcyA设计特异性引物,运用PCR技术检测实验室培养的37株微囊藻的产毒能力,结果表明有18株PCR结果呈阳性。LEGRAND等[13]采用巢式PCR方法扩增环境样品中鱼腥藻毒素基因anaC,结果表明该方法扩增效果显著,并发现anaC基因广泛分布在淡水湖泊中。BALLOT等[14]采用sxtA基因对德国东北部湖泊中分离到的14株产麻痹性贝类毒素的束丝藻进行PCR检测,结果表明14株束丝藻样本均呈阳性。分子生物学方法简单快捷,灵敏度高,成本较低,能够在蓝藻毒素释放之前对其进行定性检测,可提升对环境水体中毒素的预警预测预防能力,具有广阔应用前景。
云南滇池是云南高原地区面积最大的淡水湖泊,是我国富营养化最严重的湖泊之一[15],2017年滇池外海水质由Ⅴ类降为劣Ⅴ类[16],蓝藻水华频繁发生。基于常规PCR技术采用产毒蓝藻特有的3种藻毒素合成酶基因mcyE、anaC和sxtA,检测2017年3月—2018年2月云南滇池海埂水域产毒蓝藻种类,并通过测序得到的序列构建进化树分析产毒蓝藻多样性。研究富营养化湖泊产毒蓝藻和藻毒素基因多样性,能为科学评价富营养化湖泊产毒蓝藻及其藻毒素生态环境危害提供理论依据,有助于建立有毒藻华预警方法,对降低藻华危害效应具有重要意义。
1 材料与方法 1.1 样品采集和处理于2017年3月—2018年2月每月中旬在滇池外海海埂水域3个采样点(24°57′46″ N、102°39′58″ E,24°57′41″ N、102°39′26″ E,24°57′43″ N、102°39′08″ E)分别采集0.5 m深处表层和2 m深处底层水样,同时测定样点水温、pH值和透明度。采集水样后立即带回实验室,将表层和底层水样混合后经0.45和0.22 μm孔径纤维滤膜过滤收集藻细胞,滤膜于-40 ℃条件下保存。
1.2 藻细胞基因组DNA提取及PCR扩增采用E.Z.N.A.®Water DNA Kit试剂盒(OMEGA)提取样品藻类总DNA,并分别采用产毒蓝藻特有的微囊藻毒素合成酶基因mcyE[17]、鱼腥藻毒素合成酶基因anaC[18]和麻痹性贝类毒素合成酶基因sxtA[14]对DNA进行PCR检测,引物序列见表 1,扩增引物由昆明硕擎生物科技有限公司合成。PCR反应体系为Premix Taq (2×) (TaKaRa) 10.0 μL,正、反向引物各1 μL (10 μmol·L-1),模板DNA 3.0 μL和ddH2O 5.0 μL,总体积20 μL。反应条件为94 ℃预变性5 min,94 ℃变性30 s,退火30 s(表 1),72 ℃延伸90 s,35个循环,72 ℃延伸7 min。
|
|
表 1 使用的引物序列 Table 1 Primers used in the study |
将扩增后的目的片段使用胶回收试剂盒(TIANGEN)进行纯化,纯化后采用pEASY ®-T1 Cloning Kit (TransGen Biotech)连接与转化产物,在培养过夜的LB平板上随机挑取单克隆菌落(每个样品20个)振荡培养,对菌液阳性重组子菌落进行鉴定,阳性菌液由昆明硕擎生物科技有限公司进行测序。
1.4 系统进化分析将测序得到的序列经NCBI BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对后,结合GenBank数据库中mcyE、anaC和sxtA基因参考序列,采用ClustalX 1.83软件将所有序列进行匹配排列,采用MEGA 6.0软件中NJ法分别构建系统进化树,bootstrap value设为1 000。
2 结果与分析 2.1 滇池海埂水域藻毒素基因PCR扩增及克隆测序从滇池海埂水域样品中提取蓝藻DNA进行普通PCR扩增。如图 1所示,藻毒素合成基因mcyE、anaC和sxtA分别于812、861和683 bp处有明显亮带,这表明由滇池海埂水域水样成功扩增出mcyE、anaC和sxtA基因,共获得184条mcyE基因有效序列、142条anaC基因有效序列和195条sxtA基因有效序列。
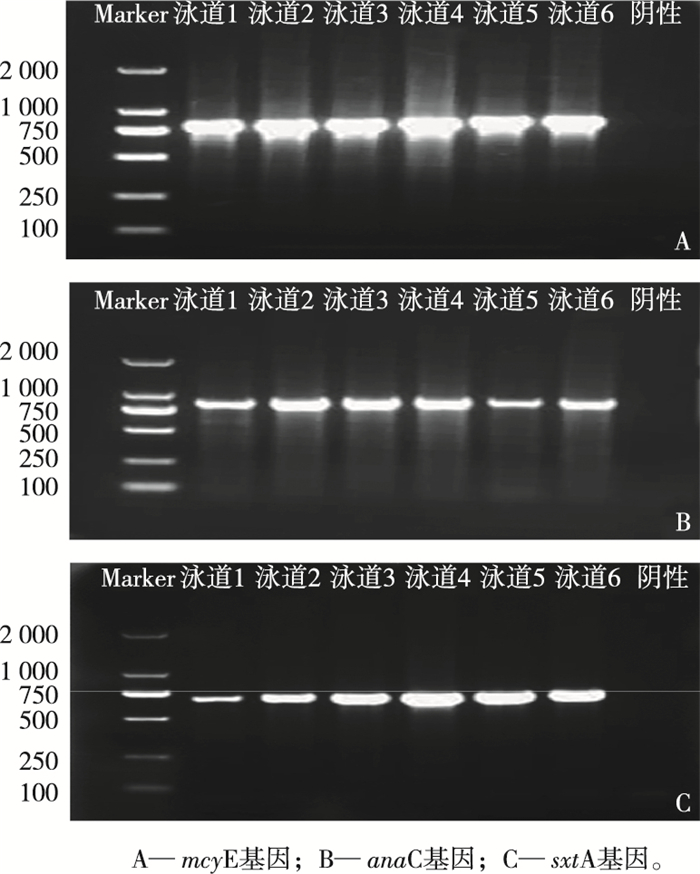
|
图 1 藻毒素基因琼脂糖凝胶电泳图 Fig. 1 Agarose gel electrophoresis of Algae toxin gene |
研究区获得的184条mcyE基因有效序列中,春(3—5月)、夏(6—8月)、秋(9—11月)、冬(12月—次年2月)样品序列分别为55、50、40和39条,在持续1 a的不同季节均被检出。将这184条微囊藻毒素mcyE基因样本序列与代表性mcyE基因参考序列在核苷酸水平上构建系统进化树。如图 2所示,所有序列在进化树上可划分为3个进化簇(Cluster Ⅰ~Ⅲ)。Cluster Ⅰ中包括微囊藻属中铜绿微囊藻和绿色微囊藻mcyE基因参考序列(序列号为AB032549、AF183408、JQ290085和EU151892)以及笔者研究获得的184条mcyE基因序列,表明滇池海埂水域微囊藻毒素可能主要由微囊藻属藻类产生。Cluster Ⅱ包括席藻属(Phormidium)(序列号为JQ771645和JQ771644)和浮丝藻属(序列号为EU151891、AJ441056和AM990462)mcyE基因参考序列。Cluster Ⅲ则包括鱼腥藻属(序列号为AJ536156和EU151887)、费氏藻属(Fischerella)(序列号为JQ771640、KX891213、KJ364645)、软管藻属(Hapalosiphon)(序列号为EU151886)、念珠藻属(Nostoc)(序列号为KC699835)和节球藻属(Nodularia)(序列号为AY382540~AY382542)mcyE基因参考序列。Cluster Ⅱ~Ⅲ均不含笔者研究样本序列。由此推断,滇池海埂水域mcyE基因遗传多样性较为单一,主要由微囊藻属产毒蓝藻产生,且全年不同季节均存在。
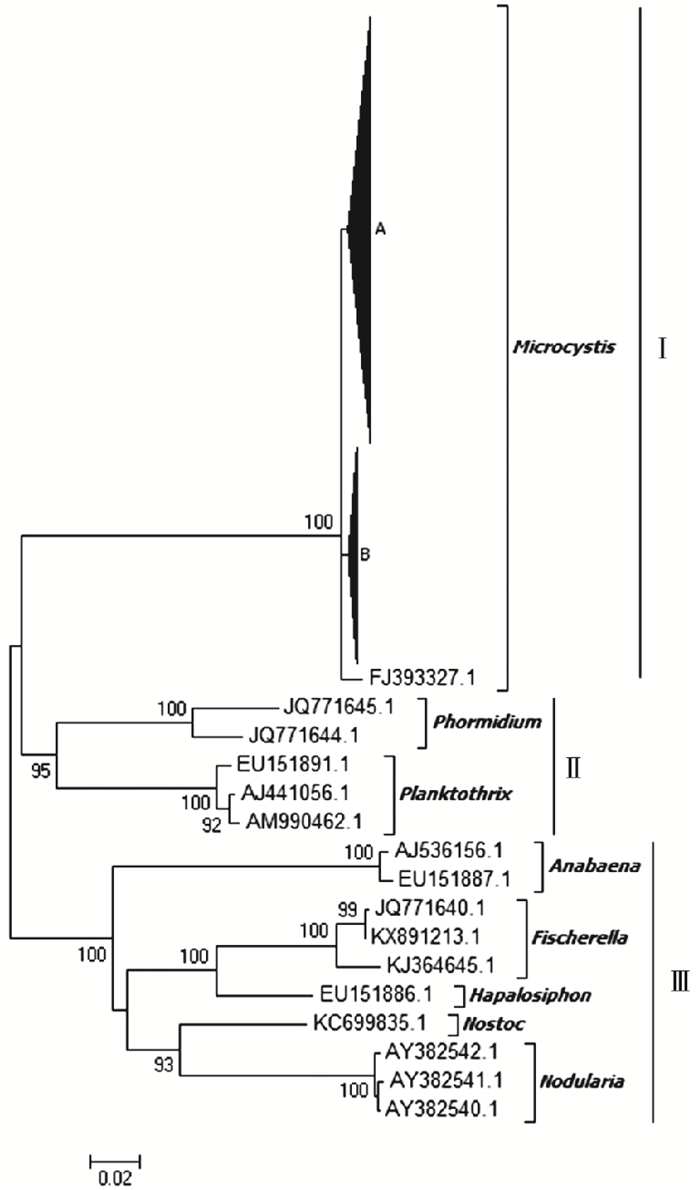
|
A包含微囊藻参考序列和该研究120条mcyE序列,B包含微囊藻参考序列和该研究64条mcyE序列。 图 2 滇池海埂水域产毒蓝藻mcyE基因系统进化树 Fig. 2 The phylogenetic tree of mcyE gene in toxic cyanobacteria in Haigeng, Dianchi |
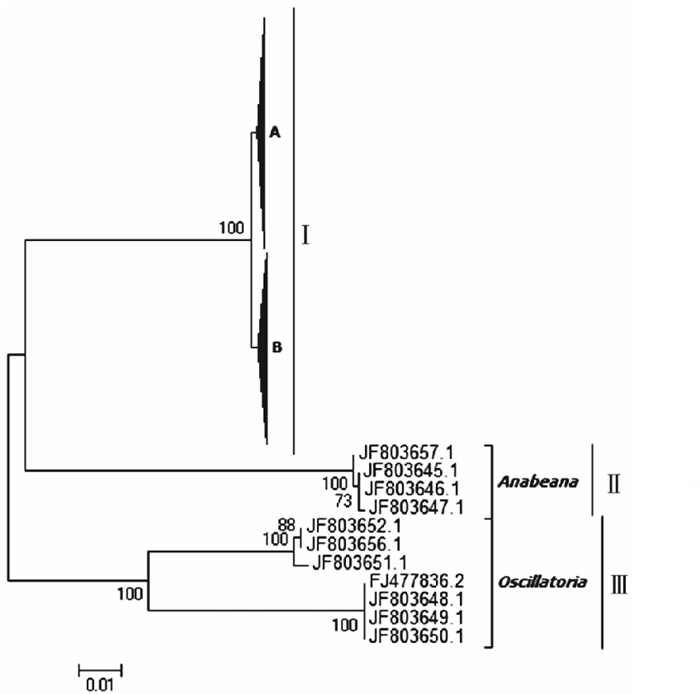
|
A包含束丝藻参考序列和该研究78条anaC序列,B包含束丝藻和矛丝藻参考序列以及该研究64条anaC序列。 图 3 滇池海埂水域产毒蓝藻anaC基因系统进化树 Fig. 3 The phylogenetic tree of anaC gene in toxic cyanobacteria in Haigeng, Dianchi |
研究区获得的142条鱼腥藻毒素anaC基因有效序列,其中春、夏、冬季样品序列分别为53、44和45条,而秋季样品未检出。将这142条anaC基因序列与代表性anaC基因参考序列在核苷酸水平上构建系统进化树。如图 3所示,所有序列在进化树上可划分为3个进化簇(Cluster Ⅰ~Ⅲ)。Cluster Ⅰ的克隆来自束丝藻属anaC基因的参考序列和笔者研究获得的全部142条anaC基因序列,形成两个进化亚簇,其中笔者研究获得的一部分anaC基因序列与未经培养的anaC基因参考序列形成一个进化亚簇A(序列号为KR813863、KR813865、KR813868和KR813869),且未经培养的蓝藻序列与束丝藻属anaC基因序列高度同源;另一部分anaC基因序列与束丝藻属和矛丝藻属的anaC基因参考序列位于另一个进化亚簇B(序列号为JF803655和KM245023~KM245025),矛丝藻属是部分束丝藻归类的新藻属,其根源应属于束丝藻[19]。Cluster Ⅱ包括鱼腥藻属anaC基因序列的参考序列(序列号为JF803645~JF803647和JF803657)。Cluster Ⅲ包括颤藻属anaC基因序列的参考序列(序列号为JF803648、FJ477836、JF803651、JF803652和JF803656)。Cluster Ⅱ~Ⅲ均不含笔者研究样本序列。这表明研究区anaC基因主要由束丝藻属蓝藻产生,且除秋季外其他季节均存在。
2.2.3 麻痹性贝类毒素sxtA基因系统进化分析研究区获得的195条麻痹性贝类毒素sxtA基因有效序列中春、夏、秋、冬季样品序列分别为57、39、53和46条,全年不同季节均有检出。将这195条sxtA基因序列与代表性sxtA基因参考序列在核苷酸水平上构建系统进化树。如图 4所示,所有序列在进化树上可划分为4个进化簇(Cluster Ⅰ~Ⅳ)。Cluster Ⅰ包括笔者研究获得的195条麻痹性贝类毒素sxtA基因序列和束丝藻属sxtA基因参考序列(序列号为EU603710、EU629175和LT549446~LT549449),且同源性为99%。Cluster Ⅱ包括鱼腥藻属sxtA基因序列的参考序列(序列号为DQ787201、EU629176和EU629177)。Cluster Ⅲ包括拟柱胞藻属sxtA基因序列的参考序列(序列号为DQ787200和EU629178)。Cluster Ⅳ包括鞘丝藻属sxtA基因序列的参考序列(序列号为EU603711)。Cluster Ⅱ~Ⅳ均不含笔者研究样本序列。由此推断,研究区sxtA基因主要由束丝藻属蓝藻产生,且全年均存在。
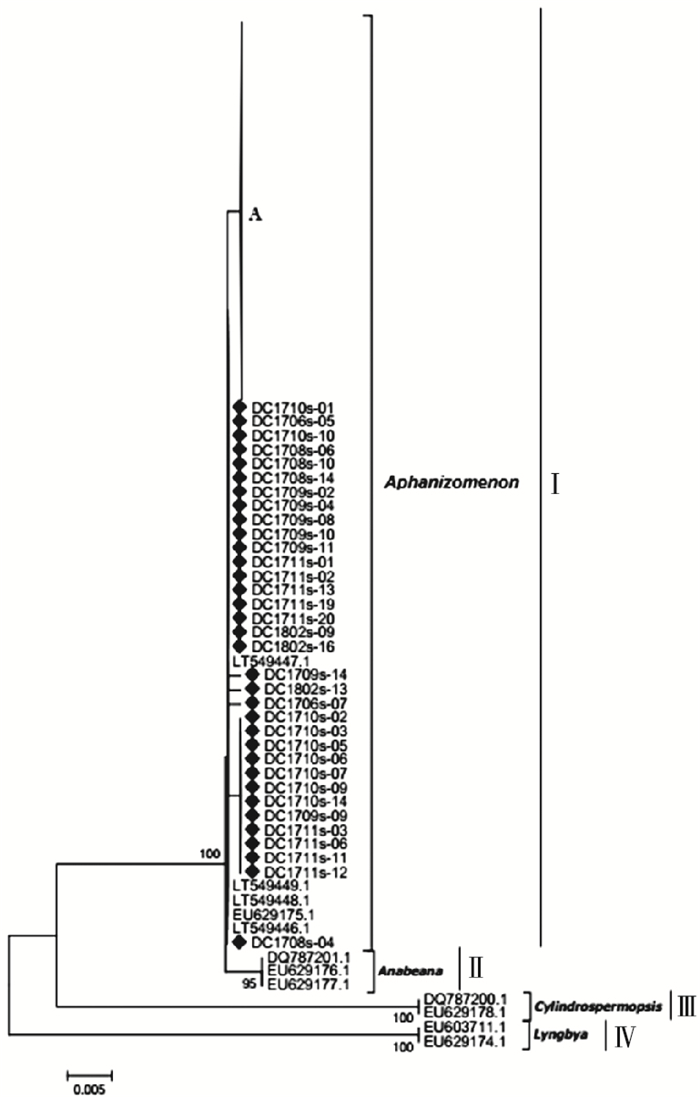
|
A包含该研究161条sxtA序列。 图 4 滇池海埂水域产毒蓝藻sxtA基因系统进化树 Fig. 4 The phylogenetic tree of sxtA gene in toxic cyanobacteria in Haigeng, Dianchi |
以微囊藻毒素合成酶基因mcyE、鱼腥藻毒素合成酶基因anaC和麻痹性贝类毒素合成酶基因sxtA为靶标基因,采用PCR技术检测云南滇池海埂水域产毒蓝藻种类。结果表明,2017年3月—2018年2月滇池海埂水域均检测到mcyE基因。系统进化分析结果显示,获得的mcyE基因序列与微囊藻属中铜绿微囊藻和绿色微囊藻的序列同源性为99%,滇池海埂水域微囊藻毒素主要由微囊藻属水华蓝藻产生。鲍忠祥[20]采用高效液相色谱法(HPLC)检测微囊藻毒素并结合显微计数获得的优势种群发现,滇池中存在微囊藻毒素,并且其主要由微囊藻属产生,笔者研究结果与之一致。滇池海埂水域光照、水温、呈弱碱性的水体pH等环境因子都适合微囊藻生长。滇池蓝藻水华以微囊藻水华为主,微囊藻已成为滇池蓝藻水华的优势种群[21],这可能导致mcyE基因多样性较为单一,遗传差异性不明显。
鱼腥藻毒素和麻痹性贝类毒素都属于神经毒素,对动物及人类危害很大。目前对藻毒素的研究以微囊藻毒素为主,有关其他类型藻毒素研究较少。加强其他毒素的研究,建立较完善的藻毒素研究体系势在必行。笔者研究中滇池海埂水域产麻痹性贝类毒素的有毒束丝藻和产鱼腥藻毒素的有毒束丝藻均被检出。研究区sxtA基因序列于2017年3月—2018年2月不同季节水样中均被检出,而anaC基因序列于2017年秋季(9—11月)没有被检出,其他时间均被检出,这可能与水体中藻毒素降解、生物吸收和环境因子等因素有关[22-24],具体原因有待进一步研究。刘永梅等[25]通过小白鼠生物检测发现滇池束丝藻水华可能产生麻痹性贝类毒素。笔者研究获得的anaC和sxtA基因均属于束丝藻属,与参考序列同源性较高,遗传差异性也不明显,这表明这些anaC和sxtA基因可能由束丝藻属藻类产生。万能等[21]研究表明,滇池蓝藻水华的优势种群存在明显的微囊藻—束丝藻季节性交替。研究区域anaC和sxtA基因多样性较单一,这可能与束丝藻是滇池蓝藻水华的优势种群有关。
4 结论蓝藻毒素在湖泊中广泛存在,迫切需要建立准确、快速、有效地预测水华尤其是有毒蓝藻水华的方法,这需要检测富营养化湖泊中产毒蓝藻种类,分析藻毒素类型。滇池蓝藻水华频繁暴发,由此产生的蓝藻毒素问题也不容小觑。笔者通过3种藻毒素合成酶基因检测2017年3月—2018年2月滇池海埂水域蓝藻产毒基因种类,发现研究区微囊藻毒素mcyE基因、鱼腥藻毒素anaC基因和麻痹性贝类毒素sxtA基因均有检出,且mcyE、anaC和sxtA基因多样性均较为单一,遗传差异性不明显。笔者研究组采用16S rRNA和18S rRNA测序方法分别研究滇池海埂水域不同季节原核浮游生物和真核浮游生物,分析其蓝藻群落结构,发现春、夏、秋和冬季研究区微囊藻属占据优势,束丝藻属等其他藻属也均有存在,为后续研究产毒蓝藻分子检测提供参考,也为产毒蓝藻预警机制提供技术支持。湖泊不同区域环境条件不同,富营养化程度不同,蓝藻优势种群也不同,导致不同区域产毒蓝藻种类可能存在差异,有必要进一步扩大研究范围,以期更加全面深入了解滇池产毒蓝藻多样性。仅采用有毒蓝藻产毒基因的分子生物学检测方法难以有效反映水体藻毒素水平,在实际应用中可结合高效液相色谱法(HPLC)和酶联免疫吸附试验(ELISA)等具体毒素分析方法共同使用。
| [1] |
MACÁRIO I P E, CASTRO B B, NUNES I M S, et al. Stepwise Strategy for Monitoring Toxic Cyanobacterial Blooms in Lentic Water Bodies[J]. Environmental Monitoring and Assessment, 2017, 189(12): 620. (  0) 0) |
| [2] |
TRINCHET I, CADEL-SIX S, DJEDIAT C, et al. Toxicity of Harmful Cyanobacterial Blooms to Bream and Roach[J]. Toxicon, 2013, 71: 121-127. (  0) 0) |
| [3] |
LIN H, LIU W Y, ZENG H, et al. Determination of Environmental Exposure to Microcystin and Aflatoxin as a Risk for Renal Function Based on 5493 Rural People in Southwest China[J]. Environmental Science & Technology, 2016, 50(10): 5346-5356. (  0) 0) |
| [4] |
FUNARI E, TESTAI E. Human Health Risk Assessment Related to Cyanotoxins Exposure[J]. Critical Reviews in Toxicology, 2008, 38(2): 97-125. (  0) 0) |
| [5] |
KURMAYER R, CHRISTIANSEN G. The Genetic Basis of Toxin Production in Cyanobacteria[J]. Freshwater Reviews, 2009, 2(1): 31-50. (  0) 0) |
| [6] |
兰文升, 张锐, 贺秀媛, 等.麻痹性贝类毒素研究进展[C]// 2013中国环境科学学会学术年会论文集(第八卷).昆明: 2013中国环境科学学会学术年会, 2013: 6989-6996.
(  0) 0) |
| [7] |
TILLETT D, DITTMANN E, ERHARD M, et al. Structural Organization of Microcystin Biosynthesis in Microcystis aeruginosa PCC7806:An Integrated Peptide-Polyketide Synthetase System[J]. Chemistry & Biology, 2000, 7(10): 753-764. (  0) 0) |
| [8] |
MÉJEAN A, MANN S, MALDINEY T, et al. Evidence that Biosynthesis of the Neurotoxic Alkaloids Anatoxin-a and Homoanatoxin-a in the Cyanobacterium Oscillatoria PCC6506 Occurs on a Modular Polyketide Synthase Initiated by L-proline[J]. Journal of the American Chemical Society, 2009, 131(22): 7512-7513. (  0) 0) |
| [9] |
KELLMANN R, MIHALI T K, JEON Y J, et al. Biosynthetic Intermediate Analysis and Functional Homology Reveal a Saxitoxin Gene Cluster in Cyanobacteria[J]. Applied and Environmental Microbiology, 2008, 74(13): 4044-4053. (  0) 0) |
| [10] |
AL-TEBRINEH J, PEARSON L A, YASAR S A, et al. A Multiplex qPCR Targeting Hepato- and Neurotoxigenic Cyanobacteria of Global Significance[J]. Harmful Algae, 2012, 15: 19-25. (  0) 0) |
| [11] |
VALÉRIO E, CHAMBEL L, PAULINO S, et al. Multiplex PCR for Detection of Microcystins-Producing Cyanobacteria From Freshwater Samples[J]. Environmental Toxicology, 2009, 25(3): 251-260. (  0) 0) |
| [12] |
TILLETT D, PARKER D L, NEILAN B A. Detection of Toxigenicity by a Probe for the Microcystin Synthetase A Gene (mcyA) of the Cyanobacterial Genus Microcystis:Comparison of Toxicities With 16S rRNA and Phycocyanin Operon (Phycocyanin Intergenic Spacer) Phylogenies[J]. Applied and Environmental Microbiology, 2001, 67(6): 2810-2818. (  0) 0) |
| [13] |
LEGRAND B, LESOBRE J, COLOMBET J, et al. Molecular Tools to Detect Anatoxin-a Genes in Aquatic Ecosystems:Toward a New Nested PCR-Based Method[J]. Harmful Algae, 2016, 58: 16-22. (  0) 0) |
| [14] |
BALLOT A, FASTNER J, WIEDNER C. Paralytic Shellfish Poisoning Toxin-Producing Cyanobacterium Aphanizomenon gracile in Northeast Germany[J]. Applied and Environmental Microbiology, 2010, 76(4): 1173-1180. DOI:10.1128/AEM.02285-09 (  0) 0) |
| [15] |
方红云. 浅析滇池蓝藻暴发原因[J]. 环境科学导刊, 2010, 29(S1): 74-75. [ FANG Hong-yun. Brief Talk on Reasons of Blue Algae Bloom in Dianchi Lake[J]. Environmental Science Survey, 2010, 29(S1): 74-75.] (  0) 0) |
| [16] |
郑丙辉, 彭嘉玉, 胡小贞, 等. 2017年滇池外海水质异常下降原因及对策[J]. 环境工程技术学报, 2018, 8(5): 465-472. [ ZHENG Bing-hui, PENG Jia-yu, HU Xiao-zhen, et al. The Cause for Abnormal Water Quality Deterioration of Waihai of Dianchi Lake in 2017 and the Countermeasures[J]. Journal of Environmental Engineering Technology, 2018, 8(5): 465-472.] (  0) 0) |
| [17] |
RANTALA A, FEWER D P, HISBERGUES M, et al. Phylogenetic Evidence for the Early Evolution of Microcystin Synthesis[J]. Proceedings of the National Academy of Sciences, 2004, 101(2): 568-573. (  0) 0) |
| [18] |
RANTALA-YLINEN A, KÄNÄ S, WANG H, et al. Anatoxin-a Synthetase Gene Cluster of the Cyanobacterium Anabaena sp.Strain 37 and Molecular Methods to Detect Potential Producers[J]. Applied and Environmental Microbiology, 2011, 77(20): 7271-7278. (  0) 0) |
| [19] |
吴忠兴, 虞功亮, 施军琼, 等. 我国淡水水华蓝藻-束丝藻属新记录种[J]. 水生生物学报, 2009, 33(6): 1140-1144. [ WU Zhong-xing, YU Gong-liang, SHI Jun-qiong, et al. The Two Newly Recorded Species of Bloom-Forming Cyanobacterial Genus Aphanizomenon Morr.ex Born.et Flah.(C)yanophyta From China[J]. Acta Hydrobiologica Sinica, 2009, 33(6): 1140-1144.] (  0) 0) |
| [20] |
鲍忠祥.滇池浮游植物和微囊藻毒素的时空分布及细菌去除毒素研究[D].昆明: 云南大学, 2012. [BAO Zhong-xiang.The Temporal and Spatial Variation of Aquatic Phytoplankton and Microcystin in Dianchi Lake and the Removal of Microcystin With Bacteria[D].Kunming: Yunnan University, 2012.]
(  0) 0) |
| [21] |
万能, 宋立荣, 王若南, 等. 滇池藻类生物量时空分布及其影响因子[J]. 水生生物学报, 2008, 32(2): 184-188. [ WAN Neng, SONG Li-rong, WANG Ruo-nan, et al. The Spatio-Temporal Distribution of Algal Biomass in Dianchi Lake and Its Impact Factors[J]. Acta Hydrobiologica Sinica, 2008, 32(2): 184-188. DOI:10.3321/j.issn:1000-3207.2008.02.007] (  0) 0) |
| [22] |
张维昊, 方涛, 徐小清. 滇池水华蓝藻中藻毒素光降解的研究[J]. 中国环境科学, 2001, 21(1): 1-3. [ ZHANG Wei-hao, FANG Tao, XU Xiao-qing. Study on Photodegradation of Cyanobacterial Toxin in Blooms of Dianchi Lake[J]. China Environmental Science, 2001, 21(1): 1-3. DOI:10.3321/j.issn:1000-6923.2001.01.001] (  0) 0) |
| [23] |
潘晓洁, 常锋毅, 沈银武, 等. 滇池水体中微囊藻毒素含量变化与环境因子的相关性研究[J]. 湖泊科学, 2006, 18(6): 572-578. [ PAN Xiao-jie, CHANG Feng-yi, SHEN Yin-wu, et al. The Correlation Between the Variation of Microcystin Content and Environment Factors in Dianchi Lake[J]. Journal of Lake Sciences, 2006, 18(6): 572-578. DOI:10.3321/j.issn:1003-5427.2006.06.003] (  0) 0) |
| [24] |
TSUJI K, SETSUDA S, WATANUKI T, et al. Microcystin Levels During 1992-1995 for Lakes Sagami and Tsukui-Japan[J]. Natural Toxins, 1996, 4(4): 189-194. (  0) 0) |
| [25] |
刘永梅, 刘永定, 李敦海, 等. 滇池束丝藻水华毒性生物检测[J]. 水生生物学报, 2004, 28(2): 216-218. [ LIU Yong-mei, LIU Yong-ding, LI Dun-hai, et al. Bioassay for the Toxicity of Aphanizomenon Flos-Aquae Bloom From Lake Dianchi[J]. Acta Hydrobiologica Sinica, 2004, 28(2): 216-218. DOI:10.3321/j.issn:1000-3207.2004.02.021] (  0) 0) |




