2. 安徽师范大学环境科学与工程学院, 安徽 芜湖 241003
2. College of Environmental Science and Engineering, Anhui Normal University, Wuhu 241003, China
生物质炭是有机物料在缺氧条件下, 经高温裂解产生的固体残渣, 具有丰富的孔隙结构、巨大的比表面积和丰富的表面官能团等特征, 这使得生物质炭在改善土壤质量、阻止污染物质迁移、治理环境污染和实现生态修复等方面具有广泛的应用前景[1]。土壤微生物是土壤生态环境的重要组成部分, 其丰度、多样性和活性对于维持土壤生态系统平衡、促使养分转化和污染物迁移等方面起着重要作用[2]。生物质炭作为一种新型的土壤改良剂, 被施用到土壤后, 可以直接或间接影响土壤微生物群落结构和功能[2]。MAESTRINI等[3]和KUZYAKOV等[4]采用13C或14C标记生物质炭的研究发现, 4或15 g·kg-1生物质炭成分可进入土壤微生物。同时, 生物质炭可通过自身携带养分和影响土壤物理化学性质和养分有效性等途径影响微生物量、活性和群落结构[2]。盖霞普等[5]通过短期室内培养试验发现生物质炭通过影响土壤pH、有机碳和全氮含量, 进而影响土壤微生物量和群落结构, 而这些影响在不同土壤类型间存在差异。李明等[6]研究发现秸秆生物质炭的添加可提高微生物活性, 增加磷脂脂肪酸(PLFAs)总量, 且高温裂解生物质炭比低温裂解生物质炭更能促进微生物量增加; 但也有研究表明生物质炭添加降低了土壤PLFAs量, 对土壤微生物群落结构也没有显著影响[7], 低温裂解生物质炭更有利于提高微生物活性[8]。赵兰凤等[9]研究发现施用生物质炭有利于提高土壤微生物的物种丰富度, 促进微生物种类的均匀分布。ZHU等[10]研究了添加生物质炭已2 a的玉米地土壤微生物, 发现低温(400 ℃)裂解生物质炭添加对土壤微生物丰富度指数和优势度指数没有显著影响, 仅增加10~20 cm土壤层微生物的均匀度指数。因此, 生物质炭添加对土壤微生物量、活性和群落结构的影响研究结果存在差异, 而这些差异与生物质炭裂解温度、生物质炭原材料、土壤类型、土壤养分含量以及微生物种类等有关[2, 5-13]。土壤水分是土壤的重要组成部分, 且水分条件深刻影响着土壤微生物群落结构和活性[14], 可能会改变生物质炭添加对土壤微生物群落结构影响的方式或程度, 但当前尚缺乏相关方面的研究。
以生物质炭为添加剂, 以具有干湿交替或长期淹水的独特水文条件的湿地土壤[15]为研究对象, 采用PLFAs表征方法研究不同水分条件下生物质炭添加对土壤微生物群落结构的影响, 以期丰富生物质炭对土壤微生物群落结构影响的认识。
1 材料与方法 1.1 供试土壤性质供试土壤于2014年4月采自巢湖十五里河河口湿地(31°43′56.89″ N, 117°21′29.66″ E)表层(0~10 cm)。该地属于亚热带季风气候区, 年均气温为16.1 ℃, 年降水量为947.0~1 596.5 mm。土样采集后, 自然风干, 挑去肉眼可见的细根, 过0.85 mm孔径筛, 部分土样过0.15 mm孔径筛, 以备室内模拟实验。供试土壤的基本理化性质:pH值为4.55, w(有机质)为58.7 g·kg-1, w(全磷)为1.64 g·kg-1, w(速效磷)为101.6 mg·kg-1, w(碱解氮)为77 mg·kg-1, C/N比值为10.3。
1.2 生物质炭制备和室内土壤培养实验以风干芦苇为原料, 将其置于密闭不锈钢饭盒内, 用马弗炉隔氧加热4 h[7], 制备温度分别为350和600 ℃。将生物质炭研磨, 用过筛方法筛选粒径为0.60~2.00 mm的生物质炭。生物质炭基本理化性质见表 1。
|
|
表 1 生物质炭基本性质 Table 1 Basic properties of biochar |
室内模拟土柱为内壁直径7 cm、高度15 cm的PVC圆柱管。每个土柱内装入7 g生物质炭和168 g过0.85 mm孔径筛的土壤(生物质炭量为土壤质量的4%)的均匀混合物, 形成约10 cm高的土柱。试验共设置3个生物质炭处理(CK、350B和600B)和3个水分处理(75、J和Y)。CK表示不添加生物质炭的土壤处理, 350B和600B分别表示添加制备温度分别为350和600 ℃生物质炭的土壤处理, 75表示75%田间持水量, J表示干湿交替, Y表示淹水。同时, 用拉伸薄膜覆盖封闭以防止淹水和75%田间持水量处理的土壤水分蒸发, 干湿交替为敞开式培养, 先保持薄薄水层, 直到干到接近原始质量, 采用称重法确定后期培养加水量。添加水为超纯水, 以避免水体不净带来污染。培养温度和光照条件与室内一致。试验共设置9个处理, 每个处理设3次重复, 培养时间始于2014年9月, 共培养2 a, 分别在添加生物质炭培养240和720 d后进行破坏性取样, 土样自然风干。培养后土壤基本化学性质见表 2。将自然风干的土样进行预培养, 经75%田间持水量培养后风干的土样, 重新添加超纯水后调节至75%田间持水量; 经干湿交替和淹水培养后的风干土样, 均加超纯水调至淹水状态, 最后在25 ℃条件下恒温培养7 d, 促使土壤微生物复苏。然后将预培养后的土样进行冷冻干燥, 以备土壤PLFAs测定分析。
|
|
表 2 添加生物质炭的土壤基本化学性质及其多因素方差分析 Table 2 Chemical properties of biochar amended soils and multiple factor variance analysis |
土壤速效磷、铵态氮和碱解氮含量的测定参考《土壤农业化学分析方法》[16]。土壤pH按V(水):m(土)=5:2测定, 生物质炭pH按V(水):m(炭)=25:1测定。硝态氮含量测定采用紫外分光光度法[17]。
土壤PLFAs量的测定和鉴定:采取修正的Bligh和Dyer方法提取PLFAs[18]。具体步骤:取3 g冻干土置于50 mL三角瓶中, 用V(磷酸缓冲液):V(氯仿):V(甲醇缓冲液)为3.2:4:8的混合液振荡提取脂类, 通过固相抽提柱层析得到PLFAs, 然后经碱性甲基化得到磷脂脂肪酸甲脂。PLFAs定量内标为十九烷酸(上海安谱实验科技有限公司); PLFAs鉴定标准样品编号为1208, 碳链长度为C10-C24(美国MIDI公司); PLFAs送至中国科学院南京土壤研究所, 在气相色谱仪(美国Agilent 7890A)上采用MIDI微生物鉴定仪(MIDI, Newark, Delaware, USA)进行检测, 同时结合SherlockMIS 6.2系统(Sherlock Microbial Identification System)鉴定分析PLFAs。微生物PLFAs数据库为该系统软件自带的PLFAD1。筛选得到47种标记物, PLFAs经鉴定分为6类[6]:真菌(18:2 w6c, 18:1 w9c, 23:0)、丛枝菌根(AM)真菌(16:1 w5c)、放线菌(16:0 10-methyl, 17:1 w7c 10-methyl, 17:0 10-methyl, 18:1 w7c 10-methyl, 18:0 10-methyl, 20:0 10-methyl)、革兰阴性细菌G-(15:1 w6c, 16:1 w7c, 17:1 w8c, 18:1 w7c, 19:1 w8c, 20:1 w9c, 20:1 w8c, 21:1 w6c, 21:1 w5c, 21:1 w3c, 22:1 w9c, 17:0 cyclo w7c, 19:0 cyclo w9c, 19:0 cyclo w7c)、革兰阳性细菌G+(15:1 iso w6c, 17:1 iso w9c, 13:0 iso, 12:0 anteiso, 13:0 anteiso, 14:0 iso, 15:0 iso, 16:0 iso, 17:0 iso, 22:0 iso, 15:0 anteiso, 17:0 anteiso, 17:1 anteiso w7c)和一般细菌(12:0, 13:0, 14:0, 15:0, 16:0, 17:0, 18:0, 20:0, 22:0, 24:0)。
1.4 数据处理采用Excel 2003软件对试验数据进行初步处理和制图, 并计算Shannon-Wiener丰富度指数(H)、Pielou均匀度指数(J)和Simpson优势度指数(D)[19]。采用SPASS 20软件对数据进行多因素方差分析和相关性分析。采用CANOCO 5软件进行冗余分析(RDA), 先对数据进行除趋势对应分析(DCA), 由于排序轴梯度长度(LGA) < 3, 故选择RDA方法对微生物群落结构多样性与土壤养分的关系进行分析; RDA方法中蒙特卡罗置换检验显著性水平设置为α=0.05, 置换数(number of permutations)为499。
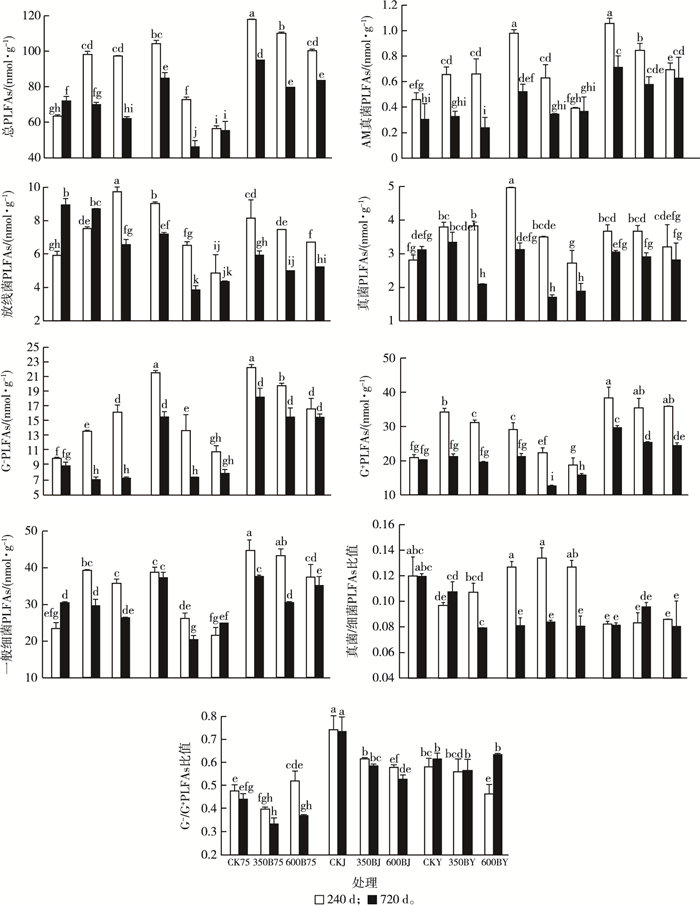
2 结果与分析 2.1 生物质炭添加对土壤微生物PLFAs的影响多因素方差分析结果表明培养时间、水分条件和生物质炭添加对大多数土壤微生物PLFAs量具有极显著的主效应和交互效应(表 3)。在75%田间持水量条件下, 培养240 d后生物质炭添加显著提高土壤PLFAs表征的土壤微生物量, PLFAs总量和各类群PLFAs量比对照土壤平均增加49.01%(图 1)。在75%田间持水量条件下培养720 d, 添加生物质炭的土壤PLFAs总量、AM真菌、放线菌、G-和一般细菌的PLFAs量与对照相比, 分别平均下降8.32%、25.72%、14.62%、19.77%和8.20%(图 1); 干湿交替条件下培养240和720 d生物质炭添加处理土壤微生物PLFAs量平均下降38.85%, 淹水条件下土壤微生物PLFAs量平均下降12.83%(图 1)。就3种水分处理而言, 干湿交替条件下, 添加生物质炭的土壤PLFAs量下降幅度最大。3种水分条件下培养240 d后, 总体上添加裂解温度为350 ℃生物质炭的土壤PLFAs总量和各类群PLFAs量高于添加裂解温度为600 ℃生物质炭的土壤, 但培养720 d后生物质炭裂解温度对土壤PLFAs量影响的差异未达显著水平或差异较小(图 1)。不同于对照土壤, 添加生物质炭培养240和720 d后, 土壤PLFAs总量、一般细菌、真菌、放线菌和G+的PLFAs量表现为干湿交替低于其他两种水分处理, AM真菌和G-的PLFAs量表现为干湿交替仅小于淹水, 与75%田间持水量间无显著差异性; 总体上, 土壤PLFAs总量、AM真菌、G+、G-的PLFAs量均以淹水处理为最高, 而其他类群PLFAs量在淹水条件下与干湿交替和75%田间持水量条件下无显著差异。除75%田间持水量处理外, 培养240 d生物质炭添加处理土壤微生物PLFAs总量和AM真菌、真菌、G+、G-及一般细菌PLFAs量均大于培养720 d生物质炭添加处理。土壤真菌/细菌和G-/G+比值范围分别为0.079~0.134和0.33~0.74, 生物质炭添加显著降低了干湿交替条件下土壤G-/G+比值, 干湿交替条件显著降低土壤真菌/细菌PLFAs比值, 其他处理下土壤生物质炭制备温度、培养时间及土壤水分条件对土壤G-/G+和真菌/细菌的PLFAs比值均无显著影响或无明显规律性(图 1)。
|
|
表 3 添加生物质炭的土壤微生物PLFAs多因素方差分析(P值) Table 3 Multiple factor variance analysis of microbial PLFAs in soils amended with biochar under different water conditions |
|
同一分图中所有直方柱上方英文小写字母不同表示各处理间某指标差异显著(P < 0.05)。 图 1 不同水分条件下添加生物质炭的土壤培养后微生物磷脂脂肪酸(PLFAs)含量 Fig. 1 Concentrations of microbial PLFAs in soils amended with and without biochar under different water conditions |
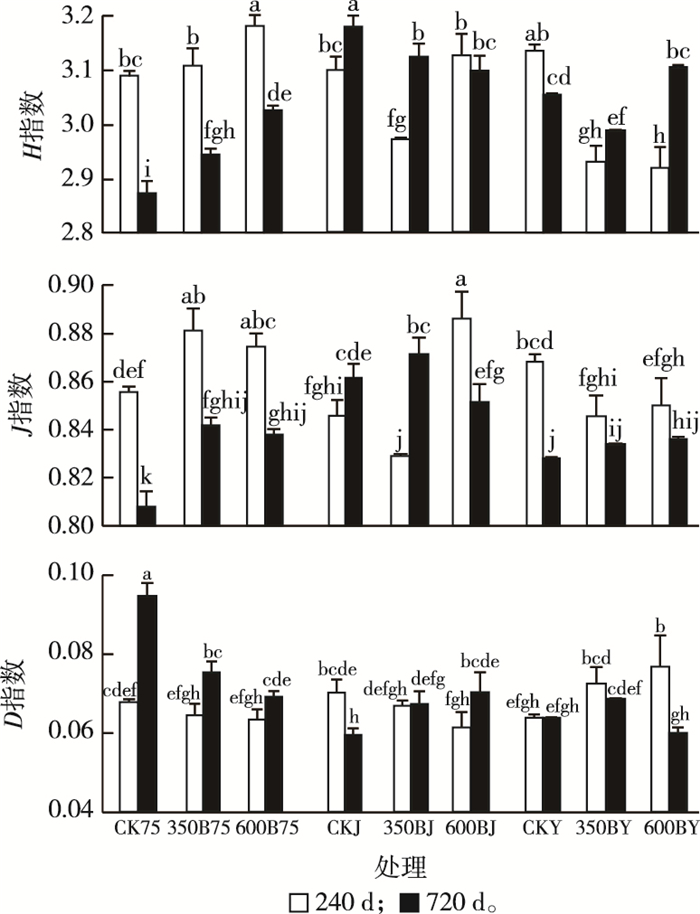
多因素方差分析表明除了少部分Simpson优势度指数(D)外, 培养时间、水分条件和生物质炭添加对土壤微生物Shannon-Wiener丰富度指数(H)、Pielou均匀度指数(J)和D指数具有极显著的主效应和交互效应(表 4)。在75%田间持水量条件下, 添加生物质炭可增加土壤H和J值, 但降低D值; 淹水条件下, 仅培养240 d生物质炭添加就可降低H和J指数, 但增加D指数(图 2)。在干湿交替条件下, 生物质炭添加和培养时间对土壤微生物多样性指数的影响没有明显规律性。生物质炭制备温度和土壤水分条件对土壤微生物多样性指数的影响也没有明显规律性。
|
|
表 4 添加生物质炭的土壤微生物PLFAs多样性指数的多因素方差分析(P值) Table 4 Multiple factor variance analysis of microbial PLFAs diversity indexes in soils amended with biochar(P值) |
|
同一分图中所有直方柱上方英文小写字母不同表示各处理间某指标差异显著(P < 0.05)。 图 2 不同生物质炭处理土壤微生物PLFAs多样性指数 Fig. 2 Diversity indexes of microbial communities in soils amended with and without biochar |
各类群PLFAs与土壤基本性质的偏相关性分析结果(表 5)表明, 土壤总PLFAs,真菌、细菌、放线菌和G-的PLFAs值均与土壤pH值呈显著正相关, 其中, 真菌PLFAs值与pH呈极显著正相关。总PLFAs,细菌和G+的PLFA值均与速效磷含量呈显著负相关, 而G-/G+ PLFA比值和H指数均与土壤速效磷含量呈显著正相关。而真菌、放线菌PLFAs, 真菌/细菌PLFAs比值均与土壤NO3--N含量呈显著负相关, 而J指数与土壤NO3--N含量呈显著正相关。土壤碱解氮含量与总PLFAs和其他类群微生物PLFAs呈正相关, 但仅与放线菌PLFAs值和D指数呈显著正相关。土壤NH4+-N含量与总PLFAs和其他类群微生物PLFAs呈正相关, 但仅与放线菌PLFAs值、D指数呈显著正相关, 而与H和J指数呈显著负相关。
|
|
表 5 土壤微生物PLFAs量与土壤基本性质之间的偏相关性分析 Table 5 Partial correlation analysis between soil PLFAs and soil basic properties |
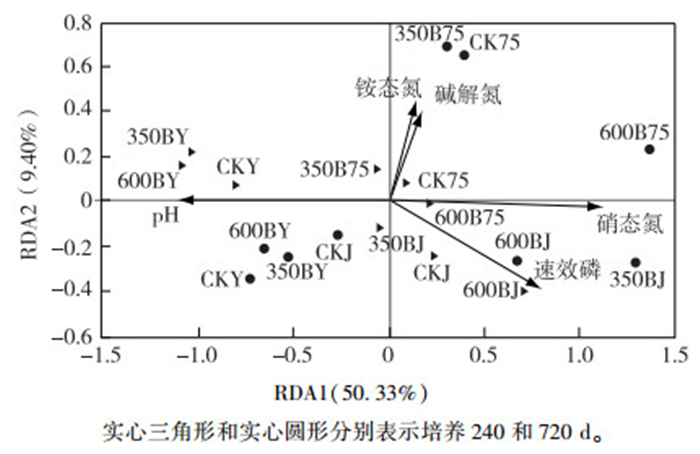
应用RDA方法对土壤微生物群落结构与土壤基本性质指标的关系进行分析, 结果见图 3。图 3中箭头表示土壤基本性质指标, 实心圆形和三角形表示不同处理土壤微生物群落结构。箭头投影到某个微生物群落与中心连线上的点距离中心越长, 表示该土壤性质指标对微生物群落结构影响越大。箭头连线与排序轴夹角表示某一土壤性质与排序轴相关性大小, 夹角越小表示相关性越高。圆圈之间、三角形之间和圆圈与三角形之间的距离越短, 表示微生物群落结构越相似。RDA分析结果显示, 两个排序轴解释量达59.73%, 其中, 第1排序轴(横轴)共解释50.33%的土壤养分信息, 第2排序轴(纵轴)共解释9.40%的土壤养分信息。从排序图可以看出, pH、硝态氮含量和速效磷含量3个土壤养分因子的箭头较长, 说明它们对微生物群落结构的解释量较大, 且与第1排序轴的夹角较小, 说明它们是第1排序轴的主要影响因子, 也是影响微生物群落结构的主要因素。这与相关性分析结果(表 5)一致。生物质炭添加可通过改变土壤pH影响土壤微生物群落结构[2], 土壤硝态氮含量和铵态氮含量强烈影响土壤微生物群落结构, 而过多的硝态氮可抑制微生物生长, 降低土壤微生物量[20]。由图 3可知, 相同水分条件和相同培养时间条件下的土壤处理相对比较集中, 表明具有较为相似的微生物群落结构, 以相同水分条件下表现尤其明显。这也说明土壤水分条件和培养时间是左右生物质炭添加对微生物群落结构影响的重要因子。
|
图 3 土壤微生物群落结构与土壤化学性质的冗余分析 Fig. 3 Redundancy analysis (RDA) of soil microbial community structure and soil chemical properties |
生物质炭对土壤微生物生物量和群落结构的影响较为复杂, 生物质炭可通过提供微生物生长所需的碳源、氮源等营养物质, 改变土壤pH值、通气性和持水性等理化性质, 自身携带或吸附土壤多环芳烃等抑制微生物生长的有毒物质, 以及为微生物提供生存栖息地等途径来影响土壤微生物[3-4, 6, 21]。笔者研究发现, 除75%田间持水量条件下培养240 d, 生物质炭添加显著提高土壤PLFAs量外, 75%田间持水量条件下培养720 d以及干湿交替和淹水条件下培养240和720 d, 生物质炭添加均降低土壤PLFAs总量和各类群微生物PLFAs量。这可能是由于生物质炭虽然可提供少量养分[2, 12], 但生物质炭可吸附固持土壤有效养分, 降低土壤养分生物有效性[7, 21], 进而导致生物质炭添加后土壤微生物生物量降低。添加生物质炭的土壤碱解氮含量和NH4+-N含量大都低于对照土壤, 而添加生物质炭的部分土壤速效磷含量也低于对照或无显著差异(表 2), 且相关性分析结果也显示土壤碱解氮含量和NH4+-N含量与各类群土壤微生物PLFAs量呈正相关关系(表 5)。土壤硝态氮过多可抑制土壤微生物生长, 降低土壤微生物生物量[20], 笔者研究中土壤大多数类群微生物PLFAs量与硝态氮含量间存在显著负相关关系(表 5), 因此, 生物质炭添加使得土壤硝态氮含量上升可能也是导致土壤微生物PLFAs量降低的原因之一。生物质炭还可通过影响土壤pH进而影响土壤微生物生长[2, 6]。笔者研究中土壤pH与土壤大多数类群微生物PLFAs量呈显著正相关关系(表 5), 而生物质炭添加促进了土壤pH降低(表 2), 导致土壤多数类群微生物PLFAs量降低。同时, 由于生物质炭自身携带乙醛、松萜和多环芳烃等具有毒性的有机化合物, 可抑制微生物的生长[22], 进而促使生物质炭添加后土壤微生物PLFAs量降低。而75%田间持水量条件下培养240 d, 生物质炭添加显著提高土壤PLFAs量, 可能是因为相对于淹水和干湿交替条件, 75%田间持水量条件下土壤微生物活性更高, 可促进生物质炭自身携带毒性有机物分解且毒性降低更快, 使得土壤微生物生长恢复更快, 进而使土壤微生物PLFAs量有所提高。
有研究[8]表明与低温裂解生物质炭相比, 高温裂解生物质炭更有利于促进微生物生长, 进而更有利于增加土壤PLFAs量[6], 也有研究发现低温裂解生物质炭更有利于提高微生物活性。笔者研究发现75%田间持水量条件下培养720 d, 以及干湿交替和淹水条件下培养240 d, 添加低温裂解生物质炭土壤PLFAs含量高于添加高温裂解生物质炭土壤, 这可能归因于低温裂解生物质炭比高温裂解生物质炭含有更多低相对分子质量、易降解的有机化合物[8], 为土壤微生物提供更多的碳源和养分[2, 12], 因此, 添加低温裂解生物质炭更有利于土壤微生物生长。
生物质炭添加对土壤微生物影响状况还受生物质炭添加时间长短的影响[7, 23]。笔者研究发现, 培养时间对添加生物质炭的土壤微生物影响显著, 培养240 d时添加生物质炭的土壤微生物PLFAs总量和各类群微生物PLFAs量高于培养720 d时, 表明培养时间越长, 添加生物质炭就越不利于微生物生长。AMELOOT等[23]也发现, 添加生物质炭(30 t·hm-2)的土壤培养2 a后, 土壤真菌、放线菌、G+和G-的PLFAs量均小于培养7个月时土壤上述微生物PLFAs量。这主要是因为生物质炭含有的已被微生物分解矿化的有机物随着培养时间延长而降低, 使得微生物生长所需的底物减少, 从而抑制微生物活性和生物量, 促使土壤微生物PLFAs量下降。同时, 随着添加到土壤的生物质炭逐渐老化, 生物质炭对土壤养分吸附和固定能力增强, 可进一步抑制土壤微生物生长。
土壤水分条件一方面通过影响土壤有效养分来影响土壤微生物群落结构或活性, 另一方面直接影响对水分条件敏感的土壤微生物[15]。笔者研究中RDA分析结果也表明, 相同水分条件下土壤微生物群落结构较为相似(图 3)。牛佳等[24]研究发现淹水条件下微生物PLFAs总量和各菌群PLFAs含量显著高于无淹水土壤, 这归因于淹水条件下土壤有机碳含量和全氮含量显著高于无淹水土壤。笔者研究发现, 总体上干湿交替条件下, 添加生物质炭的土壤PLFAs量较低, 淹水条件下PLFAs量较高。这可能是由于干湿交替条件下土壤环境变化强烈, 导致土壤微生物大量死亡[14], 而淹水条件下土壤环境稳定, 对微生物影响小, 所以干湿交替条件下土壤微生物PLFAs量较低, 淹水条件下PLFAs量较高。在干湿交替条件下添加生物质炭的土壤碱解氮、铵态氮和pH下降相对于其他2种水分条件更加显著(表 2), 因此, 生物质炭添加加剧干湿交替条件下土壤养分有效性的降低, 进而促使土壤各类群微生物PLFAs量降低。
生物质炭添加影响着土壤各类群微生物, 进而影响土壤微生物群落结构。笔者研究生物质炭对土壤G-/G+和真菌/细菌PLFAs比值的影响没有规律性, 但生物质炭对土壤多样性指数的影响受土壤水分条件所左右, 表现为75%田间持水量条件下, 生物质炭添加显著增加土壤微生物丰富度指数和均匀度指数, 降低优势度指数; 淹水条件下培养240 d时生物质炭添加降低土壤微生物丰富度指数和均匀度指数, 增加了优势度指数; 干湿交替条件下生物质炭添加对土壤微生物群落多样性指数的影响没有明显规律性。由于75%田间持水量条件下水分和氧气较充足, 生物质炭添加增加了土壤微生物生境多样化[21], 促使土壤微生物多样性增加; 而淹水条件属于厌氧且较为均质环境, 生物质炭添加促进某些微生物种群生长, 但抑制了其他类群微生物的生长[9]。微生物多样性指数是表征微生物群落结构的重要指标, 多样性指数越高, 土壤微生物生态系统就越复杂, 微生物生态功能就越稳定[9]。这说明75%田间持水量条件下, 生物质炭添加使得土壤微生物更加丰富和多样, 微生物生态系统更加复杂和稳定。RDA分析结果表明, 相同水分条件下土壤微生物群落结构更为相似(图 3), 表明生物质炭添加对土壤微生物群落结构影响深受水分条件所左右。
4 结论(1) 在75%田间持水量条件下, 生物质炭添加促进培养初期(240 d)土壤各类群微生物生长, 提高土壤各类群微生物PLFAs量, 但生物质炭添加降低培养后期(720 d)土壤各类群微生物PLFAs量; 在干湿交替和淹水条件下, 生物质炭添加降低整个培养期土壤各类群微生物PLFAs量, 其中干湿交替条件下土壤各类群微生物PLFAs量下降最为显著; 培养时间越长, 生物质炭添加促使土壤微生物PLFAs量降低越明显。这表明生物质炭添加对土壤微生物生长影响深受土壤水分条件和培养时间左右。
(2) 75%田间持水量条件下, 生物质炭添加提高了土壤微生物群落丰富度和均匀度, 降低了土壤微生物优势度; 淹水条件下培养240 d, 生物质炭添加降低了土壤微生物群落丰富度和均匀度, 提高了土壤微生物优势度; 干湿交替条件下, 生物质炭添加对微生物群落结构影响没有显著规律性,相同水分条件下土壤微生物群落结构更为相似,说明水分条件左右生物质炭添加对土壤微生物群落结构的影响。
(3) 土壤水分条件和培养时间通过影响生物质炭的自身老化和有毒有机化合物降解, 以及通过左右生物质炭添加对土壤有效养分(硝态氮、速效磷)含量和pH的影响, 进而左右生物质炭添加对土壤微生物类群丰度和群落结构影响的方式和程度。
| [1] |
LEHMANN J. Bio-Energy in the Black[J]. The Ecological Society of America, 2007, 5(7): 381-387. (  0) 0) |
| [2] |
饶霜, 卢阳, 黄飞, 等. 生物质炭对土壤微生物的影响研究进展[J]. 生态与农村环境学报, 2016, 32(1): 53-59. [ RAO Shuang, LU YANG, HUANG Fei, et al. A Review of Researches on Effects of Biochars on Soil Microorganisms[J]. Journal of Ecology and Rural Environment, 2016, 32(1): 53-59.] (  0) 0) |
| [3] |
MAESTRINI B, HERRMANN A M, NANNIPIERI P, et al. Ryegrass-Derived Pyrogenic Organic Matter Changes Organic Carbon and Nitrogen Mineralization in a Temperate Forest Soil[J]. Soil Biology and Biochemistry, 2014, 69: 291-301. DOI:10.1016/j.soilbio.2013.11.013 (  0) 0) |
| [4] |
KUZYAKOV Y, SUBBOTINA I, CHEN H Q, et al. Black Carbon Decomposition and Incorporation Into Soil Microbial Biomass Estimated by 14C Labeling[J]. Soil Biology and Biochemistry, 2009, 41(2): 210-219. DOI:10.1016/j.soilbio.2008.10.016 (  0) 0) |
| [5] |
盖霞普, 翟丽梅, 王洪媛, 等. 生物质炭对土壤微生物量及其群落结构的影响[J]. 沈阳农业大学学报, 2017, 48(4): 399-410. [ GE Xia-pu, ZHAI Li-mei, WANG Hong-yuan, et al. Impacts of Biochar on Soil Microbial Biomass and Community Structure[J]. Journal of Shenyang Agricultural University, 2017, 48(4): 399-410.] (  0) 0) |
| [6] |
李明, 李忠佩, 刘明, 等. 不同秸秆生物炭对红壤性水稻土养分及微生物群落结构的影响[J]. 中国农业科学, 2015, 48(7): 1361-1369. [ LI Ming, LI Zhong-pei, LIU Ming, et al. Effects of Different Straw Biochar on Nutrient and Microbial Community Structure of a Red Paddy Soil[J]. Scientia Agricultura Sinica, 2015, 48(7): 1361-1369.] (  0) 0) |
| [7] |
盖霞普, 刘宏斌, 翟丽梅, 等. 生物炭对中性水稻土养分和微生物群落结构影响的时间尺度变化研究[J]. 农业环境科学学报, 2016, 35(4): 719-728. [ GE Xia-pu, LIU Hong-bin, ZHAI Li-mei, et al. Temporal Fluctuations of Impacts Corn-Stover Biochar on Nutrients and Microbial Community Structure in a Neutral Paddy Soil[J]. Journal of Agro-Environment Science, 2016, 35(4): 719-728.] (  0) 0) |
| [8] |
KOLB S E, FERMANICH K J, DORNBUSH M E. Effect of Charcoal Quantity on Microbial Biomass and Activity in Temperate Soils[J]. Soil Science Society of America Journal, 2009, 73(4): 1173-1181. DOI:10.2136/sssaj2008.0232 (  0) 0) |
| [9] |
赵兰凤, 张新明, 程根, 等. 生物炭对菜园土壤微生物功能多样性的影响[J]. 生态学报, 2017, 37(14): 4754-4762. [ ZHAO Lan-feng, ZHANG Xin-ming, CHENG Gen, et al. Effects of Biochar on Microbial Functional Diversity of Vegetable Garden Soil[J]. Acta Ecologica Sinica, 2017, 37(14): 4754-4762.] (  0) 0) |
| [10] |
ZHU L X, XIAO Q, SHEN Y F, et al. Microbial Functional Diversity Responses to 2 Years Since Biochar Application in Silt-Loam Soils on the Loess Plateau[J]. Ecotoxicology and Environmental Safety, 2017, 144: 578-584. DOI:10.1016/j.ecoenv.2017.06.075 (  0) 0) |
| [11] |
YU J L, DEEM L M, CROW S E, et al. Biochar Application Influences Microbial Assemblage Complexity and Composition Due to Soil and Bioenergy Crop Type Interactions[J]. Soil Biology and Biochemistry, 2018, 117: 97-107. DOI:10.1016/j.soilbio.2017.11.017 (  0) 0) |
| [12] |
ZHANG L Y, JING Y M, XIANG Y Z, et al. Responses of Soil Microbial Community Structure Changes and Activities to Biochar Addition:A Met-Analysis[J]. Science of the Total Environment, 2018, 643: 926-935. DOI:10.1016/j.scitotenv.2018.06.231 (  0) 0) |
| [13] |
NIELSEN S, MINCHIN T, KIMBER S, et al. Comparative Analysis of the Microbial Communities in Agricultural Soil Amended With Enhanced Biochars or Traditional Fertilisers[J]. Agriculture, Ecosystems & Environment, 2014, 191: 73-82. (  0) 0) |
| [14] |
SUN D S, BI Q F, LI K J, et al. Effect of Soil Drying Intensity During an Experimental Drying-Rewetting Event on Nutrient Transformation and Microbial Community Composition[J]. Pedosphere, 2018, 28(4): 644-655. DOI:10.1016/S1002-0160(17)60450-8 (  0) 0) |
| [15] |
MITSCH W J, GOSSELIN J G. Wetlands[M]. New York, USA: Wiley, 2000: 89-125.
(  0) 0) |
| [16] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000: 151-181.
(  0) 0) |
| [17] |
宋歌, 孙波, 教剑英. 测定土壤硝态氮的紫外分光光度法与其他方法的比较[J]. 土壤学报, 2007, 44(2): 288-293. [ SONG Ge, SUN Bo, JIAO Jian-ying. Comparison Between Ultraviolet Spectrophotometry and Other Methods in Determination of Soil Nitrate-N[J]. Acta Pedologica Sinica, 2007, 44(2): 288-293. DOI:10.3321/j.issn:0564-3929.2007.02.014] (  0) 0) |
| [18] |
BLIGH E G, DYER W J. A Rapid Method of Total Lipid Extraction and Purification[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917. DOI:10.1139/o59-099 (  0) 0) |
| [19] |
刘雨芳. EXCEL在群落生物多样性参数计算中的应用[J]. 湘潭师范学院学报(自然科学版), 2003, 25(2): 80-82. [ LIU Yu-fang. On Application of Calculating Parameters on Biodiversity in Communities With EXCEL[J]. Journal of Xiangtan Normal University(Natural Science Edition), 2003, 25(2): 80-82.] (  0) 0) |
| [20] |
刘彩霞, 焦如珍, 董玉红, 等. 应用PLFA方法分析氮沉降对土壤微生物群落结构的影响[J]. 林业科学, 2015, 51(6): 155-162. [ LIU Cai-xia, JIAO Ru-zhen, DONG Yu-hong, et al. Effect of Nitrogen Deposition on Soil Microbial Community Structure Determined With the PLFA Method[J]. Scientia Silvae Sinicae, 2015, 51(6): 155-162.] (  0) 0) |
| [21] |
QUILLIAM R S, GLANVILLE H C, WADE S C, et al. Life in the 'Charosphere':Does Biochar in Agricultural Soil Provide a Significant Habitat for Microorganisms?[J]. Soil Biology and Biochemistry, 2013, 65: 287-293. DOI:10.1016/j.soilbio.2013.06.004 (  0) 0) |
| [22] |
NGUYEN T T N, XU C Y, TAHMASBIAN I, et al. Effects of Biochar on Soil Available Inorganic Nitrogen:A Review and Meta-Analysis[J]. Geoderma, 2017, 288: 79-96. DOI:10.1016/j.geoderma.2016.11.004 (  0) 0) |
| [23] |
AMELOOT N, SLEUTEL S, CASE S D C, et al. C Mineralization and Microbial Activity in Four Biochar Field Experiments Several Years After Incorporation[J]. Soil Biology and Biochemistry, 2014, 78: 195-203. DOI:10.1016/j.soilbio.2014.08.004 (  0) 0) |
| [24] |
牛佳, 周小奇, 蒋娜, 等. 若尔盖高寒湿地干湿土壤条件下微生物群落结构特征[J]. 生态学报, 2011, 31(2): 474-482. [ NIU Jia, ZHOU Xiao-qi, JIANG Na, et al. Characteristics of Soil Microbial Communities Under Dry and Wet Condition in Zoige Alpine Wetland[J]. Acta Ecologica Sinica, 2011, 31(2): 474-482.] (  0) 0) |




