2. 永清环保股份有限公司上海分公司, 上海 200051
2. Branch of Shanghai, Yonker Environmental Protection Co., Ltd., Shanghai 200051, China
重金属是广泛存在于土壤中的一种污染物, 它通过生物放大对人体健康和生态环境造成严重危害[1]。不同于有机污染物, 重金属一旦释放到土壤环境中, 很难通过化学或生物降解方法从土壤中去除[2]。稳定化修复技术因具有高效、经济等优点, 已成为我国现阶段重金属污染土壤修复的主要技术之一[3-4], 该方法通过改变土壤中重金属的赋存形态降低其生物有效性[5]。然而, 目前仅通过浸出实验反映重金属由固相转移到液相的程度来评估稳定化修复效果是不严谨的, 浸出浓度无法用于评估稳定化修复是否降低了重金属对土壤生物的危害。生物有效性能够准确反映土壤生物对重金属的利用程度, 因此, 近年来污染土壤中重金属的生物有效性评估越来越多地被应用到稳定化修复效果评估中[6-7]。
土壤中蚯蚓数量巨大, 因其易于在实验室条件下培养和具有耐受较高浓度重金属等特点, 常用于指示土壤污染状况和评估重金属污染土壤的修复效果[8]。笔者归纳了稳定化处理后土壤中重金属对蚯蚓的生物有效性评估方法及特点, 并讨论了影响生物有效性评估的相关因素。
1 生物有效性概念土壤中重金属的生物有效性能够用于衡量重金属的迁移性及其对土壤环境造成的影响, 能够更准确地表示生物对重金属的利用程度。ISO 17402[9]中给出了生物有效性的定义:生物有效性指土壤中化学物质被人体或生态受体吸收或代谢的程度, 或可与生物系统相互作用的程度。
土壤中重金属以物理或化学方式与土壤中特定组分结合, 导致土壤中一部分重金属封存, 不能与受体相互作用。土壤中未被封存的重金属组分被称为环境有效组分[10]。蚯蚓在土壤中移动, 只能通过摄食、皮肤接触等过程与土壤的一部分组分保持接触或进行相互作用。将能够与蚯蚓进行相互作用的环境有效重金属组分称为环境生物有效组分[10]。进入蚯蚓体内的重金属通过蚯蚓的新陈代谢、转化和排泄等作用, 在蚯蚓体内累积或被排出体外。毒理学生物有效性指蚯蚓摄取和吸收的重金属到达毒性作用位点并与其相互作用的部分[10], 这个过程依赖于包括转化、代谢和解毒在内的一系列复杂程序。LANNO等[10]将生物有效性分为环境有效性、环境生物有效性和毒理学生物有效性(图 1)。
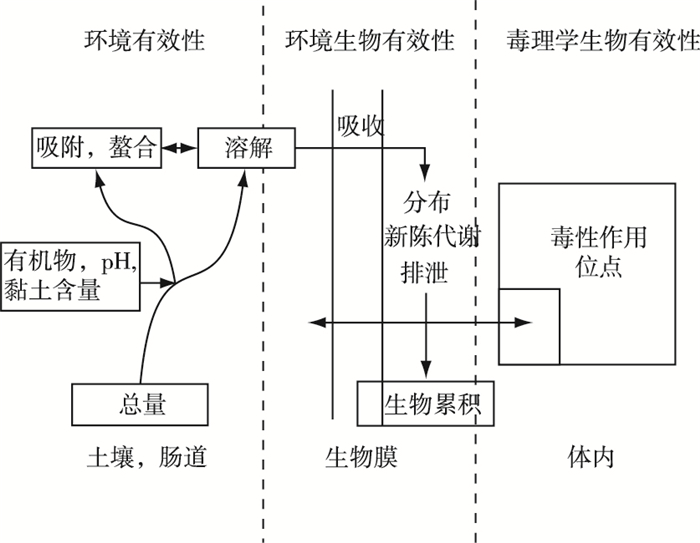
|
图 1 生物有效性的图解模型[10] Fig. 1 Schematic model of bioavailability |
重金属的生物有效性评估主要采用化学或生物学方法, 化学方法主要反映了土壤中重金属的环境有效组分, 生物学方法则主要反映了环境生物有效组分或毒理学生物有效性[11]。
2.1 化学方法重金属以不同形态存在于土壤中, 重金属形态与其生物有效性密切相关[12]。土壤中不稳定的重金属组分能与土壤固相分离, 转移到土壤液相中, 可通过化学手段从土壤中提取并测量, 代表了土壤中能被蚯蚓吸收和摄取的重金属组分, 即为环境有效组分。化学方法因具有易操作、实验周期短等优点, 常用于评估稳定化处理后土壤中重金属生物有效态含量。按照提取过程的不同, 可将化学提取法分为单次提取法、连续提取法和梯度扩散薄膜技术(diffusion gradient in thin films technique, DGT)等。
2.1.1 单次提取法单次提取法指使用一种试剂或多种试剂的组合, 一次性提取土壤中特定组分的重金属。不同提取剂的提取机制具有不同的特点, 按照提取剂性质可分为中性盐溶液、酸提取剂和有机络合提取剂(表 1)。
|
|
表 1 单次提取法提取剂的提取机制及其适用范围 Table 1 Extracting reagent extraction mechanism and its application scope |
(1) 中性盐溶液提取剂
使用中性盐溶液能够有效地提取溶解在土壤孔隙水中的重金属, 人们普遍认为该组分的重金属极易被蚯蚓摄取和吸收, 可代表土壤中重金属对蚯蚓的生物有效性。常用的中性盐溶液包括0.001~0.1 mol·L-1 CaCl2和1.0 mol·L-1 MgCl2等。HOUBA等[13]推荐使用0.1 mol·L-1 CaCl2来评估重金属生物有效性。LEE等[14]使用0.01 mol·L-1 CaCl2提取土壤中Cu, 发现蚯蚓体内Cu累积量与CaCl2提取量的决定系数R2为0.860 4, 说明使用CaCl2溶液作为提取剂能够表征土壤中Cu对蚯蚓的生物有效性。中性盐提取剂适用于移动性和迁移性较强的重金属, 如Cd、Ni、Zn等[15]。
(2) 酸提取剂
酸提取剂主要包括醋酸和HCl等稀酸溶液, 提取剂中H+通过与土壤中重金属阳离子发生离子交换反应提取土壤中重金属。RAHMAN等[16]以1 mol·L-1 HCl作为提取剂评估As污染土壤的生物有效性, 提取液中As含量与蚯蚓体内As生物累积因子的相关性R2为0.933。酸提取剂不适用于碳酸盐含量高的土壤, 主要是因为H+会与土壤中CO32-反应而降低土壤中重金属的提取效率[15]。
(3) 有机络合提取剂
有机络合提取剂又称螯合剂, 主要包括乙二胺四乙酸(EDTA)、二乙基三胺五乙酸(DTPA)等。提取剂通过与重金属产生螯合作用从而将其从土壤中提取, 能够提取与土壤基质结合较紧密的重金属组分, 主要适用于Cu和Pb等迁移性弱的重金属。LEE等[14]使用DTPA提取剂评估Cu的生物有效性, 蚯蚓体内Cu含量与提取剂DTPA所提取的重金属含量之间的回归方程R2为0.898 1。WANG等[17]采集南京某废弃铜矿附近农田土壤及土壤中蚯蚓, 正蚓科(Lumbricidae)、链胃蚓科(Moniligastridae)和钜蚓科(Megascolecidae)3种蚯蚓体内Cu含量与使用DTPA提取的Cu含量之间的R2分别为0.814、0.914和0.919, 使用DTPA提取剂可有效预测土壤中生物有效态重金属组分。DAVIES等[8]使用Ca5(PO4)3OH对土壤进行稳定化处理后, 分析以DTPA作为提取剂提取的Pb含量和蚯蚓对Pb的累积。DTPA提取的Pb含量与蚯蚓体内Pb含量的R2在稳定化处理前后分别为0.66和0.99。DTPA提取法能够很好地反映稳定化处理前后土壤中蚯蚓对Pb的累积情况, 可用于稳定化处理效果的评估。
2.1.2 连续提取法连续提取法指使用不同提取剂的组合, 分多个步骤, 提取土壤中不同形态重金属。通过连续提取法可分析土壤中重金属的分布情况, 其中, 使用最多的是Tessier提取法[18]和BCR提取法[19]。许多研究者将连续提取法获得的不同重金属形态与蚯蚓体内重金属含量进行相关性分析, 确定土壤中重金属存在形态与生物有效性的关系[20-21]。
NANNONI等[20]利用改进的BCR提取法研究不同形态重金属在土壤中的分布, 结果表明蚯蚓体内Cd含量与Cd可溶态和可提取态组分的相关系数分别为0.683和0.606;蚯蚓体内Cu含量与Cu氧化态组分的相关系数为0.839。LIU等[22]用水溶性硫脲-甲醛树脂对土壤中重金属Cr进行稳定化处理, 并用Tessier连续提取法分析土壤中不同形态Cr的分布。结果显示, 经稳定化处理后, 土壤中Cr由离子交换态转化为铁锰氧化态。稳定化之前, Cr离子交换态和铁锰氧化态含量分别占总量的52.81%和5.27%;稳定化之后, Cr离子交换态和铁锰氧化态含量分别占总量的4.33%和38.39%。离子交换态代表土壤中较活跃的重金属形态, 能反映重金属生物有效性, 离子交换态含量的减少标志着生物有效性降低。
2.1.3 DGTDGT装置由过滤膜、扩散膜和吸附膜以及固定这3层膜的塑料外套组成, 其中, 过滤膜主要作用是避免待测环境中颗粒物进入DGT装置; 溶液态离子通过扩散膜自由扩散; 可选择不同的吸附材料作为吸附膜以达到良好的吸附效果[23]。
DGT通过模拟蚯蚓对重金属的吸收过程来评估重金属对蚯蚓的生物有效性, 反映了土壤中重金属从固相到液相的补充能力和动力学过程, 以及土壤溶液中重金属的实际有效浓度[24], 强调了重金属在土壤颗粒与间隙水之间的动态转移过程。与生物体摄取一样, DGT会降低装置附近孔隙水中重金属浓度, 同时导致重金属从土壤固相解吸到孔隙水中[25]。BADE等[25]使用DGT模拟蚯蚓摄取重金属, 预测金属冶炼厂土壤中重金属生物有效性, 根据PEIJNENBURG等[26]描述的单室模型确定蚯蚓和DGT树脂中重金属浓度随时间的动态变化, 结果显示DGT吸收量与蚯蚓体内Cu含量之间具有很好的相关性(R2=0.610~0.895)。
刘智敏等[27]使用DGT预测黑土中有效态Cd含量, 研究发现DGT获得的有效态Cd含量与蚯蚓体内Cd含量具有显著相关性(P < 0.01), 证明DGT技术可用于表征土壤中赤子爱胜蚓对Cd的吸收。GU等[24]使用DGT测定土壤中Cd对蚯蚓的生物有效性, DGT对3种供试土壤中Cd的吸收量与蚯蚓体内Cd累积量的R2分别为0.91、0.99和0.99, DGT是预测Cd对蚯蚓生物有效性的可靠工具。
各个化学提取法仅提供了土壤中生物所暴露的不同重金属组分含量, 未考虑生物行为和暴露时间等因素, 通过化学方法评估有效组分是经验性结论[16]。研究者多通过化学方法获取土壤中重金属有效态含量, 与暴露于土壤的蚯蚓生物累积量进行相关性分析。当两者具有相关性时, 则认为该方法获取的有效态含量可以代表土壤中蚯蚓的生物有效性[17, 27]。
2.2 生物学方法蚯蚓与土壤的相互作用是一个复杂过程, 仅仅采用化学分析方法评价重金属对蚯蚓的生物有效性是不准确的。另外, 在对污染土壤进行稳定化修复后, 不仅要考虑土壤中重金属的生物有效性, 还要关注外源引入的稳定剂对土壤生物的影响;然而, 使用化学提取法不能反映重金属稳定剂的风险。以蚯蚓作为受体能更准确地反映污染土壤中重金属对蚯蚓的生物有效性和稳定剂对土壤生物可能造成的影响, 因此生物学方法常用于重金属稳定化修复后的生物有效性评估。
2.2.1 生物累积污染土壤中蚯蚓体内累积的重金属含量可反映重金属的环境生物有效组分。蚯蚓对土壤中重金属累积的方式主要有2种:(1)随着暴露时间的延长, 重金属累积量不断增加, 蚯蚓最终死亡; (2)在一段时间内, 重金属累积量随暴露时间延长而增加, 随后, 蚯蚓对重金属的摄取量与排出量处于动态平衡中, 重金属累积量达到稳定状态[28]。
生物累积因子为蚯蚓体内重金属累积量达到稳定时蚯蚓体内重金属含量与土壤中重金属总含量的比值; 吸收速率常数为暴露一段时间后蚯蚓体内重金属含量与土壤中重金属总含量、暴露时间乘积的比值。PEARSON等[28]研究了污染土壤中蚯蚓体内Pb、Zn和Cd含量随暴露时间的变化, 其中, Pb和Zn累积量分别在暴露24和6 h后达到稳定, 而Cd含量却一直增加。因此, 使用生物累积因子表征土壤中Pb和Zn对蚯蚓的生物有效性, 使用吸收速率常数表示Cd对蚯蚓的生物有效性。
SESHADRI等[29]通过测量Cd、Pb和Zn在蚯蚓体内的累积, 分析不同磷化合物对重金属的稳定化效果。将重金属对蚯蚓的生物有效性表示为蚯蚓摄取的重金属总量占土壤中重金属总量的百分比:生物有效性=(蚯蚓体内重金属含量×蚯蚓生物量)/(土壤中重金属含量×土壤质量)×100%。
2.2.2 生物反应蚯蚓暴露于重金属污染土壤中, 摄取的重金属到达并累积在毒性作用位点, 引起蚯蚓的生物反应, 如体重减轻、繁殖率降低、死亡等。蚯蚓的生物反应能准确反映重金属到达毒性作用位点后对蚯蚓的损害, 即毒理学生物有效性。
土壤中重金属生物有效性的改变会引起蚯蚓生物反应的变化, 蚯蚓的生物反应可应用于稳定化修复前后重金属的生物有效性评估。GONZÁLEZ等[6]通过测量安德爱胜蚓(Eisenia andrei)存活率和体重损失率表征重金属对蚯蚓的生物有效性, 评估稳定剂对污染土壤中Cd、Pb和Zn的稳定化效果。结果发现有机稳定剂反而会导致重金属生物有效性升高, 蚯蚓存活率由100%降低为30%, 体重损失率由7.6%升高至19.4%。DAVIES等[8]研究了使用Ca5(PO4)3OH对Pb污染土壤进行稳定化处理后Pb的蚯蚓生物有效性变化。在未处理土壤中, 蚯蚓28 d半数致死浓度w(LC50)=(4 379±356) mg·kg-1, 28 d体重损失半效应浓度w(EC50)=(1 408±198) mg·kg-1, 产茧率半效应浓度w(EC50)=(971±633) mg·kg-1; 稳定化处理后分别变为(5 203±401)、(3 334±731)和(1 814±613) mg·kg-1。
生物学方法需要使用蚯蚓进行暴露实验, 实验周期较长, 在实际工程中应用较少。笔者认为应结合生物和化学方法进行综合性评估。在实验室条件下进行蚯蚓暴露实验, 并与化学方法结合, 通过相关性分析验证化学方法的可行性, 在实际工程中使用已验证的化学方法对重金属生物有效性进行评估。
3 影响生物有效性的因素重金属的生物有效性与其存在形态密切相关, 土壤物理化学性质(如pH、有机质含量等)的不同会导致重金属存在形态的变化, 从而影响其生物有效性。稳定化过程会造成土壤物理化学性质的改变, 因此需要考虑由土壤性质变化引起的生物有效性的改变。
3.1 pH土壤pH可控制重金属在土壤基质中的溶解和沉淀, 改变其溶解度和迁移性。pH升高, 土壤中更易形成有机质, 增大有机质-金属络合物形成的几率; 同时, 在碱性条件下, 铁锰氧化物多带负电荷, 对重金属元素的吸附作用增强, 其迁移性变弱, 生物有效性降低[30]。pH降低, 大多数重金属元素溶解性会增强, 致使土壤液相中重金属元素含量增加, 更易被生物吸收利用。BRADHAM等[31]使用21种Pb总含量(2 000 mg·kg-1)相同但具有不同理化性质(pH为3.8~7.8)的土壤, 通过测定蚯蚓致死率、体内Pb含量等指标验证土壤理化性质对Pb生物有效性的影响。在相同含量Pb污染土壤中, 蚯蚓致死率为0~100%, 蚯蚓体内w(Pb)为28.7~782 mg·kg-1, 说明Pb的生物有效性因土壤理化性质的变化而改变。分析结果表明, pH是影响蚯蚓致死率和体内Pb含量的最主要土壤性质, pH与致死率和蚯蚓体内Pb含量之间具有明显负相关关系(线性相关系数r分别为-0.695和-0.506)。MING等[32]测定酸性(pH为5.99)和碱性(pH为8.44)土壤中Pb含量对蚯蚓致死率的影响, 在酸性土壤中Pb的半数致死浓度w(LC50)为4 000 mg·kg-1, 远远低于碱性土壤〔w(LC50)=6 000 mg·kg-1〕, 该结果表明pH降低导致Pb对蚯蚓的生物有效性升高。
3.2 有机物有机物含量是影响土壤中多种重金属行为的重要因素[33-34]。土壤中大多数有机质不溶于土壤液相部分, 带负电荷的有机质能够吸附重金属阳离子, 对重金属阳离子具有很强的结合和固定作用[1], 降低了土壤中重金属的生物有效性。但一些小分子有机物能与重金属离子结合形成可溶复合物, 使其不被土壤固体表面吸附, 增强重金属的移动性和生物有效性。NANNONI等[35]使用主成分分析法分析土壤理化性质对蚯蚓体内重金属含量的影响, 结果显示土壤样品中有机碳含量影响蚯蚓对Cd、Cu、Pb、Sb和Zn的摄取和累积。土壤中有机物(如腐殖质)能够通过离子交换和络合作用吸附重金属, 蚯蚓在摄取有机物的过程中, 重金属亦随之进入蚯蚓肠胃系统, 蚯蚓对有机物的摄取可能是吸收重金属的一个重要途径。DELGADILLO等[36]使用52种具有不同污染程度和物理化学性质的土壤进行蚯蚓回避试验, 分析土壤理化性质对蚯蚓回避反应的影响, 线性回归分析结果表明土壤有机质对蚯蚓的回避反应具有很大影响。
3.3 土壤专性吸附能力重金属生物有效性与重金属在土壤中的分配和形态密切相关, 土壤胶体对重金属的吸附, 特别是专性吸附能力是影响重金属分配和形态形成的重要因素, 土壤专性吸附的主要载体是有机质和铁铝锰氧化物。JANSSEN等[37]选择20种污染土壤, 研究土壤性质对蚯蚓摄取Pb的影响, Pb生物累积因子和土壤性质的回归方程显示铁氧化物是影响生物累积的主要因素。
3.4 其他土壤性质土壤中黏粒比表面积大, 带有负电荷, 对重金属离子具有强吸附能力[1], 可通过吸附作用影响重金属生物有效性。此外, 碳酸钙含量、含铁氧化物等也对土壤中重金属生物有效性产生影响。
4 展望对重金属污染土壤稳定化修复效果进行生物有效性评价, 有助于实现重金属污染场地的风险控制, 也有助于规范污染场地的修复市场。目前, 生物有效性评估方法复杂多样, 由于缺乏标准的评估流程, 不同数据之间可比性差, 影响了生物有效性评估方法在稳定化后评估过程中的应用。建议尽快建立具有较强普适性的标准化评估方法体系和衡量标准, 为生物有效性评估的应用提供理论基础。
| [1] |
周国华. 土壤重金属生物有效性研究进展[J]. 物探与化探, 2014, 38(6): 1097-1106. [ ZHOU Guo-hua. Recent Progress in the Study of Heavy Metal Bioavailability in Soil[J]. Geophysical and Geochemical Exploration, 2014, 38(6): 1097-1106.] (  0) 0) |
| [2] |
MAHAR A, WANG P, LI R H, et al. Immobilization of Lead and Cadmium in Contaminated Soil Using Amendments:A Review[J]. Pedosphere, 2015, 25(4): 555-568. DOI:10.1016/S1002-0160(15)30036-9 (  0) 0) |
| [3] |
李培中, 吕晓健, 王海见, 等. 某电镀厂六价铬污染土壤还原稳定化试剂筛选与过程监测[J]. 环境科学, 2017, 38(1): 368-373. [ LI Pei-zhong, LÜ Xiao-jian, WANG Hai-jian, et al. Screening of the Reduction/Stabilization Reagent for Cr(Ⅵ) Contaminated Soil in a Planting Site and Reaction Process Monitoring[J]. Environmental Science, 2017, 38(1): 368-373.] (  0) 0) |
| [4] |
WANG Y S, DAI J G, WANG L, et al. Influence of Lead on Stabilization/Solidification by Ordinary Portland Cement and Magnesium Phosphate Cement[J]. Chemosphere, 2018, 190: 90-96. DOI:10.1016/j.chemosphere.2017.09.114 (  0) 0) |
| [5] |
LEE S H, LEE J S, JEONG CHOI Y, et al. In Situ Stabilization of Cadmium-, Lead-, and Zinc-Contaminated Soil Using Various Amendments[J]. Chemosphere, 2009, 77(8): 1069-1075. DOI:10.1016/j.chemosphere.2009.08.056 (  0) 0) |
| [6] |
GONZÁLEZ V, DÍEZ-ORTIZ M, SIMÍN M, et al. Assessing the Impact of Organic and Inorganic Amendments on the Toxicity and Bioavailability of a Metal-Contaminated Soil to the Earthworm Eisenia andrei[J]. Environmental Science and Pollution Research, 2013, 20(11): 8162-8171. DOI:10.1007/s11356-013-1773-z (  0) 0) |
| [7] |
MAŇÁKOVÁ B, KUTA J, SVOBODOVÁ M, et al. Effects of Combined Composting and Vermicomposting of Waste Sludge on Arsenic Fate and Bioavailability[J]. Journal of Hazardous Materials, 2014, 280: 544-551. DOI:10.1016/j.jhazmat.2014.08.024 (  0) 0) |
| [8] |
DAVIES N A, HODSON M E, BLACK S. Changes in Toxicity and Bioavailability of Lead in Contaminated Soils to the Earthworm Eisenia fetida(Savigny 1826) After Bone Meal Amendments to the Soil[J]. Environmental Toxicology and Chemistry, 2002, 21(12): 2685-2691. DOI:10.1002/etc.5620211222 (  0) 0) |
| [9] |
BS EN ISO 17402: 2011, Soil Quality-Requirements and Guidance for the Selection and Application of Methods for the Assessment of Bioavailability of Contaminants in Soil and Soil Materials[S].
(  0) 0) |
| [10] |
LANNO R, WELLS J, CONDER J, et al. The Bioavailability of Chemicals in Soil for Earthworms[J]. Ecotoxicology and Environmental Safety, 2004, 57(1): 39-47. DOI:10.1016/j.ecoenv.2003.08.014 (  0) 0) |
| [11] |
BEAUMELLE L, VILE D, LAMY I, et al. A Structural Equation Model of Soil Metal Bioavailability to Earthworms:Confronting Causal Theory and Observations Using a Laboratory Exposure to Field-Contaminated Soils[J]. Science of the Total Environment, 2016, 569/570: 961-972. DOI:10.1016/j.scitotenv.2016.06.023 (  0) 0) |
| [12] |
XIANG H F, TANG H, YING Q H. Transformation and Distribution of Forms of Zinc in Acid, Neutral and Calcareous Soils of China[J]. Geoderma, 1995, 66(1/2): 121-135. (  0) 0) |
| [13] |
HOUBA V J G, LEXMOND T M, NOVOZAMSKY I, et al. State of the Art and Future Developments in Soil Analysis for Bioavailability Assessment[J]. Science of the Total Environment, 1996, 178(1/2/3): 21-28. (  0) 0) |
| [14] |
LEE S H, KIM E Y, HYUN S, et al. Metal Availability in Heavy Metal-Contaminated Open Burning and Open Detonation Soil:Assessment Using Soil Enzymes, Earthworms, and Chemical Extractions[J]. Journal of Hazardous Materials, 2009, 170(1): 382-388. DOI:10.1016/j.jhazmat.2009.04.088 (  0) 0) |
| [15] |
KIM R Y, YOON J K, KIM T S, et al. Bioavailability of Heavy Metals in Soils:Definitions and Practical Implementation:A Critical Review[J]. Environmental Geochemistry and Health, 2015, 37(6): 1041-1061. DOI:10.1007/s10653-015-9695-y (  0) 0) |
| [16] |
RAHMAN M S, REICHELT-BRUSHET A J, CLARK M W, et al. Arsenic Bio-Accessibility and Bioaccumulation in Aged Pesticide Contaminated Soils:A Multiline Investigation to Understand Environmental Risk[J]. Science of the Total Environment, 2017, 581/582: 782-793. DOI:10.1016/j.scitotenv.2017.01.009 (  0) 0) |
| [17] |
WANG Q Y, ZHOU D M, CANG L, et al. Indication of Soil Heavy Metal Pollution With Earthworms and Soil Microbial Biomass Carbon in the Vicinity of an Abandoned Copper Mine in Eastern Nanjing, China[J]. European Journal of Soil Biology, 2009, 45(3): 229-234. DOI:10.1016/j.ejsobi.2008.12.002 (  0) 0) |
| [18] |
TESSIER A, CAMPBELL P G C, BISSON M. Sequential Extraction Procedure for the Speciation of Particulate Trace Metals[J]. Analytical Chemistry, 1979, 51(7): 844-851. DOI:10.1021/ac50043a017 (  0) 0) |
| [19] |
URE A M, QUEVAUVILLER P, MUNTAU H, et al. Speciation of Heavy Metals in Soils and Sediments:An Account of the Improvement and Harmonization of Extraction Techniques Undertaken Under the Auspices of the BCR of the Commission of the European Communities[J]. International Journal of Environmental Analytical Chemistry, 1993, 51(1/2/3/4): 135-151. (  0) 0) |
| [20] |
NANNONI F, PROTANO G. Chemical and Biological Methods to Evaluate the Availability of Heavy Metals in Soils of the Siena Urban Area (Italy)[J]. Science of the Total Environment, 2016, 568: 1-10. DOI:10.1016/j.scitotenv.2016.05.208 (  0) 0) |
| [21] |
BECQUER T, DAI J, QUANTIN C, et al. Sources of Bioavailable Trace Metals for Earthworms From a Zn-, Pb-and Cd-Contaminated Soil[J]. Soil Biology and Biochemistry, 2005, 37(8): 1564-1568. DOI:10.1016/j.soilbio.2005.01.007 (  0) 0) |
| [22] |
LIU S J, JIANG J Y, WANG S, et al. Assessment of Water-Soluble Thiourea-Formaldehyde (WTF) Resin for Stabilization/Solidification (S/S) of Heavy Metal Contaminated Soils[J]. Journal of Hazardous Materials, 2018, 346: 167-173. DOI:10.1016/j.jhazmat.2017.12.022 (  0) 0) |
| [23] |
罗军, 王晓蓉, 张昊, 等. 梯度扩散薄膜技术(DGT)的理论及其在环境中的应用Ⅰ:工作原理、特性与在土壤中的应用[J]. 农业环境科学学报, 2011, 30(2): 205-213. [ LUO Jun, WANG Xiao-rong, ZHANG Hao, et al. Theory and Application of Diffusive Gradients in Thin Films in Soils[J]. Journal of Agro-Environment Science, 2011, 30(2): 205-213.] (  0) 0) |
| [24] |
GU X Y, LIU Z M, WANG X R, et al. Coupling Biological Assays With Diffusive Gradients in Thin-Films Technique to Study the Biological Responses of Eisenia foetida to Cadmium in Soil[J]. Journal of Hazardous Materials, 2017, 339: 340-346. DOI:10.1016/j.jhazmat.2017.06.049 (  0) 0) |
| [25] |
BADE R, OH S, SHIN W S. Diffusive Gradients in Thin Films (DGT) for the Prediction of Bioavailability of Heavy Metals in Contaminated Soils to Earthworm (Eisenia foetida) and Oral Bioavailable Concentrations[J]. Science of the Total Environment, 2012, 416: 127-136. DOI:10.1016/j.scitotenv.2011.11.007 (  0) 0) |
| [26] |
PEIJNENBURG W J G M, BAERSELMAN R, DE GROOT A C, et al. Relating Environmental Availability to Bioavailability:Soil-Type-Dependent Metal Accumulation in the Oligochaete Eisenia andrei[J]. Ecotoxicology and Environmental Safety, 1999, 44(3): 294-310. DOI:10.1006/eesa.1999.1838 (  0) 0) |
| [27] |
刘智敏, 顾雪元, 王晓蓉, 等. 化学提取法预测土壤中镉对蚯蚓的毒性效应[J]. 农业环境科学学报, 2013, 32(10): 1971-1978. [ LIU Zhi-min, GU Xue-yuan, WANG Xiao-rong, et al. The Relationship Between Chemical Extractable Cadmium Levels in Soils and Toxic Responses of Earthworms[J]. Journal of Agro-Environment Science, 2013, 32(10): 1971-1978. DOI:10.11654/jaes.2013.10.010] (  0) 0) |
| [28] |
PEARSON M S, MAENPAA K, PIERZYNSKI G M, et al. Effects of Soil Amendments on the Bioavailability of Lead, Zinc, and Cadmium to Earthworms[J]. Journal of Environment Quality, 2000, 29(5): 1611-1617. (  0) 0) |
| [29] |
SESHADRI B, BOLAN N S, CHOPPALA G, et al. Potential Value of Phosphate Compounds in Enhancing Immobilization and Reducing Bioavailability of Mixed Heavy Metal Contaminants in Shooting Range Soil[J]. Chemosphere, 2017, 184: 197-206. DOI:10.1016/j.chemosphere.2017.05.172 (  0) 0) |
| [30] |
OK Y S, YANG J E, ZHANG Y S, et al. Heavy Metal Adsorption by a Formulated Zeolite-Portland Cement Mixture[J]. Journal of Hazardous Materials, 2007, 147(1/2): 91-96. (  0) 0) |
| [31] |
BRADHAM K D, DAYTON E A, BASTA N T, et al. Effect of Soil Properties on Lead Bioavailability and Toxicity to Earthworms[J]. Environmental Toxicology and Chemistry, 2006, 25(3): 769-775. DOI:10.1897/04-552R.1 (  0) 0) |
| [32] |
MING H, HE W X, LAMB D T, et al. Bioavailability of Lead in Contaminated Soil Depends on the Nature of Bioreceptor[J]. Ecotoxicology and Environmental Safety, 2012, 78: 344-350. DOI:10.1016/j.ecoenv.2011.11.045 (  0) 0) |
| [33] |
EDWARDS C A. Trace Elements in the Terrestrial Environment. D. C. Adriano[J]. The Quarterly Review of Biology, 1986, 61(3): 427. (  0) 0) |
| [34] |
KABATA-PENDIAS A. Trace Elements in Soils and Plants[M]. Boca Raton, USA: CRC Press, 2010: 951-974. DOI:10.1201/b10158
(  0) 0) |
| [35] |
NANNONI F, ROSSI S, PROTANO G. Soil Properties and Metal Accumulation by Earthworms in the Siena Urban Area (Italy)[J]. Applied Soil Ecology, 2014, 77: 9-17. DOI:10.1016/j.apsoil.2014.01.004 (  0) 0) |
| [36] |
DELGADILLO V, VERDEJO J, MONDACA P, et al. Proposed Modification to Avoidance Test With Eisenia foetida to Assess Metal Toxicity in Agricultural Soils Affected by Mining Activities[J]. Ecotoxicology and Environmental Safety, 2017, 140: 230-234. DOI:10.1016/j.ecoenv.2017.02.038 (  0) 0) |
| [37] |
JANSSEN R P T, POSTHUMA L, BAERSELMAN R, et al. Equilibrium Partitioning of Heavy Metals in Dutch Field Soils:Ⅱ.Prediction of Metal Accumulation in Earthworms[J]. Environmental Toxicology and Chemistry, 1997, 16(12): 2479-2488. DOI:10.1002/etc.5620161207 (  0) 0) |




