2. 齐齐哈尔大学生命科学与农林学院, 黑龙江 齐齐哈尔 161006
2. College of Life Science and Agriculture and Forestry, Qiqihar University, Qiqihar 161006, China
植物根际促生菌(plant growth promoting rhizo bacteria,PGPR)是生活在土壤或附生于植物根系的有益微生物,PGPR可促进植物生长及其对矿质营养的吸收和利用,并能抑制有害生物的生长[1],由于其环境友好的特性而被誉为化肥最有效的替代品。水稻是我国单产最高、种植面积最大、总产最多的粮食作物[2],在我国粮食生产中占有非常重要的地位,与国计民生密切相关[3],微生物肥料的研究与开发对水稻种植业有重要意义。
PGPR在植物根际的定殖能力是评估其促生效果的关键。土壤细菌定殖是一个复杂的过程,涉及细菌性状与植物反应的相互作用[4]。植物和土壤细菌共同建立特异性的分子信号联系,这种联系因植物而异[5]。传统形态学与抗性标记等分子生物学技术相结合能够更好地跟踪PGPR在植物根际的变化及所在生境的微生物群落演替规律,对预测PGPR与植物的交互作用有重要意义[6]。抗生素标记是最早的标记方法,通常使用利福平、卡那霉素、四环素和氨苄青霉素等作为筛选药物。然而,传统的抗生素标记法难以区分标记菌株与其他抗性菌株,因此,笔者采用多个药物梯度对菌株进行筛选和标记,以期消除其他抗性菌株对实验的干扰,得到抗性更强的PGPR。
解钾功能菌(Bacillus aryabhattai LZP01,简称LZP01)、解磷功能菌(Bacillus pumilus LZP02,简称LZP02)和溶磷功能菌(Bacillus megaterium LZP03,简称LZP03)是3株高效的水稻根际促生菌,这3株菌株对水稻生长的促进作用主要与其分泌植物生长素和赤霉素有关[7]。采用抗生素药物标记法研究3株菌株在水稻根际和土壤中的定殖存活能力,并分别在灭菌土与未灭菌土条件下测定3株菌株对水稻根系的促生效果,为植物根际促生菌个体生态学研究提供实验参数,对阐释PGPR根际促生机制和指导菌肥生产实践具有重要意义。
1 材料与方法 1.1 供试材料LZP01、LZP02和LZP03为黑龙江省抗性基因工程与寒地生物多样性保护重点实验室分离保存的菌株[8],具有促进水稻植株与根系生长的功能。试验用土取自齐齐哈尔嫩江大坝,土壤类型为砂土,晾干后过筛备用。土壤w(有机质)为20.35 g·kg-1,w(有效磷)为26.52 mg·kg-1,w(速效钾)为79.00 mg·kg-1,土壤pH值为6.49,可溶性盐浓度(EC值)为0.76 mS·cm-1。供试水稻品种为龙粳46,抗性药物为沈阳红旗制药有限公司生产的利福平(纯度w为98.4%,分子式为C43H58N4O12)。
1.2 培养基配方LB培养基(1 L):琼脂20 g,酵母5 g,NaCl 8 g,蛋白胨10 g,pH值7.0,液体培养基不加琼脂。
K-LB培养基(1 L):琼脂20 g,酵母5 g,NaCl 8 g,蛋白胨10 g,利福平根据需要添加,pH值7.0,液体培养基不加琼脂。
PKO无机培养基(1 L):葡萄糖10.0 g,MgSO4· 7H2O 0.3 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,Ca3(PO4)2 2.0 g,KCl 0.3 g,MnSO4·H2O 0.03 g,FeSO4·7H2O 0.036 g,琼脂20.0 g。
蒙金娜有机培养基(1 L):葡萄糖10.0 g,(NH4)2SO4 0.5 g,MgSO4·7H2O 0.3 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·H2O 0.03 g,卵磷脂0.2 g,CaCO3 1.0 g,酵母粉0.5 g,琼脂20.0 g。
亚历山大罗夫培养基(1 L):蔗糖5.0 g,Na 2HPO4 2.0 g,MgSO4·7H2O 0.5 g,CaCO3 0.1 g,FeCl 3·6H2O 0.005 g,钾长石粉1.0 g,琼脂20.0 g[8]。
以上所有培养基配成培养液时不加琼脂。
1.3 菌株标记及生长特性 1.3.1 菌株抗性标记将LZP01、LZP02和LZP03未标记菌株分别在LB培养基上划线活化后,分别挑取单菌落转入含有5 μg·mL-1利福平的K-LB液体培养基中,在30 ℃和200 r·min-1条件下振荡培养24 h,然后在含有5 μg· mL-1利福平的K-LB平板上划线培养,待长出单菌落后依次经含有10、20、50、100、150、180和200 μg· mL-1利福平的K-LB培养基诱导,直至筛选出稳定的抗200 μg·mL-1利福平的突变菌株作为标记菌株[9],分别为K-LZP01、K-LZP02和K-LZP03。
1.3.2 菌株生长变化及功能保留将K-LZP01、K-LZP02和K-LZP03标记菌株分别接种于含有200 μg·mL-1利福平的K-LB液体培养基中,LZP01、LZP02和LZP03未标记菌株分别接种于LB液体培养基中,在30 ℃和200 r·min-1条件下振荡培养24 h后作为6种菌株的种子液。按φ为1%将种子液分别接种于上述两种培养基中,每2 h对菌株进行吸光值(D600)测定并绘制生长曲线。按φ为1%将LZP01和K-LZP01菌液分别于亚历山大罗夫培养基中培养3 d,采用原子吸收分析仪(Z- 5000)测定培养基钾含量,初始钾含量记为CK;分别吸取100 μL的LZP02和K-LZP02菌液涂布于蒙金娜有机培养基中,24 h后采用游标卡尺测定菌株透明圈;分别吸取100 μL的LZP03和K-LZP03菌液涂布于PKO无机培养基中,24 h后开始测定透明圈。每个处理重复3次[10]。
1.4 水稻幼苗根系对标记菌株的吸附首先采用清水洗去水稻种子外层灰尘,并在清水中浸泡12 h后将其转移至φ为75%乙醇中处理5 min,再用无菌水清洗5次,将处理好的水稻种子使用灭菌纱布包裹,置于大平皿中,于33 ℃条件下在暗处萌发2 d。挑选已萌发且健壮的水稻种子,转移至用纱布包裹含有无菌水的大平皿中,放入28 ℃条件下人工气候箱中在每天光照时间为14 h、黑暗时间为10 h,湿度为60%条件下培养4 d,得到水稻幼苗。将3株标记菌株分别接种于含有200 μg·mL-1利福平的K-LB培养基中,于30 ℃条件下培养到稳定期待用[11]。
1.4.1 时间与吸附量的关系将培养好的水稻幼苗在无菌条件下从大平皿中取出,将培养的K-LZP01、K-LZP02和K-LZP03这3株标记菌株按10 mL(D600=0.5)分装于9个平皿中,每个平皿浸入3棵水稻幼苗,浸入温度为室温,分别浸入30 s以及1、2、3、5、10、30、60和120 min后取出幼苗。去掉水稻幼苗茎叶,将水稻幼苗根部菌液使用无菌滤纸吸干并称重后,置于加入5 mL无菌水的灭菌研钵中研碎,混匀后取悬液稀释浓度分别为1×10-6、1×10-7和1×10-8并进行平板涂布,重复3次,以测定菌株吸附速率。
1.4.2 菌液浓度与吸附量的关系先将3株标记菌株使用无菌水分别稀释为5× 10、5×102、5×103、5×104、5×105、5×106、5×107和5×108 CFU·mL-1,把洗净的水稻幼苗分别浸入含有不同标记菌株浓度的平皿中,在室温条件下吸附30 min[11]后取出。去掉水稻幼苗茎叶,将水稻幼苗根部菌液使用无菌滤纸吸干并称重后,置于加入5 mL无菌水的灭菌研钵中研碎,混匀后取稀释浓度分别为1× 10-4、1×10-5和1×10-6的悬液并进行平板涂布,每个处理重复3次,以测定菌株吸附速率。
1.5 标记菌株的土壤存活率检测分别取3组灭菌土壤(121 ℃条件下灭菌2 h)和未灭菌土壤各400 g,分别加入40 mL 3株标记菌株悬液并充分搅拌后,分别装于水稻育苗盘中,依次标记为SK-LZP01、SK-LZP02、SK-LZP03、NKLZP01、NK-LZP02和NK-LZP03,并保持含水量w约为30%,每5 d对土壤中标记菌株浓度进行检测,共测5次,每个处理重复3次[12]。
1.6 标记菌株的促生及定殖检测 1.6.1 标记菌株对水稻根系促生能力测定使用K-LB培养基分别培养3株标记菌株至浓度为D600=0.5。将水稻种子分别播种于添加了30 mL菌液的灭菌土壤(SK-01、SK-02和SK-03)和未灭菌土壤(NK-01、NK-02和NK-03)中,每个处理播种5粒种子,并设置未加菌液的灭菌对照(S-CK)和未灭菌对照(N-CK),共8个处理。置于智能人工气候箱内培养20 d(光照30 ℃/12 h,黑暗18 ℃/12 h,湿度为60%),每个处理随机挑取3株水稻幼苗,冲洗泥土并保持根部完整,采用根系分析仪(Scan Maker i800 plus)扫描获得根系图像后,采用根系分析软件(Scan Wizard EZ)分析根系长度、根直径、根体积和根表面积。
1.6.2 标记菌株在水稻根际定殖检测于20 d后收集水稻幼苗根际(0~0.2 cm)、近根(1~ 2 cm)、远根(5~6 cm)土壤各1 g,加入到10 mL无菌水中,按120 r·min-1振荡30 min后分别按1×10-4、1×10-5和1×10-6梯度稀释,将稀释液涂布于含有200 μg·mL-1利福平的K-LB平板中,30 ℃条件下培养2 d后进行平板计数,每个处理重复3次,计算单位为CFU·g-1[13]。
1.7 数据处理采用SPSS 20.0软件对数据进行方差分析,并采用Duncan新复极差法进行差异显著性分析,采用SigmaPlot 12.5软件制图。
2 结果与分析 2.1 菌株生长特性与功能保留由图 1可知,K-LZP01和LZP01、K-LZP02和LZP02、K-LZP03和LZP03在菌株生长各个时期均表现出相似态势,虽然标记菌株比未标记菌株生物量偏低,但差异不显著,在18 h后有趋于一致的趋势。
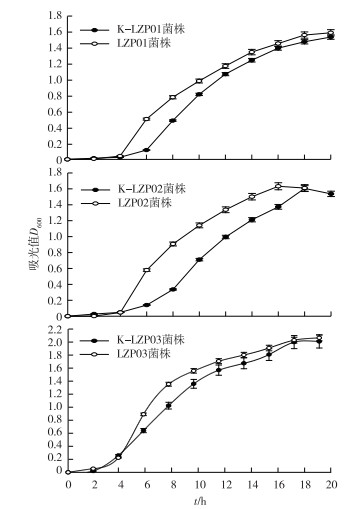
|
K-LZP01、K-LZP02和K-LZP03分别为LZP01、LZP02和LZP03水稻根际促生菌的标记菌株。 图 1 3株芽孢杆菌标记和未标记菌株生长特性 Fig. 1 Growth characteristics of three Bacillus strains |
对标记菌株进行原始功能保留测定结果见图 2。由图 2可知,菌液培养3 d后用原子吸收仪测量K-LZP01和LZP01培养基ρ(钾)分别为2.07和2.13 mg·L-1,差异不显著。而CK处理ρ(钾)为1.73 mg·L-1,这说明菌株生长期间培养基钾浓度升高,K-LZP01保持了LZP01的解钾功能。LZP02、LZP03、K-LZP02和K-LZP03透明圈测定结果表明,在培养基中生长24 h后,4个处理均具有透明圈,比值分别为1.39(K-LZP02)、1.23(K-LZP03)、1.55 (LZP02)和1.55(LZP03),均大于1,这说明KLZP02具有解磷功能,K-LZP03具有溶磷功能。
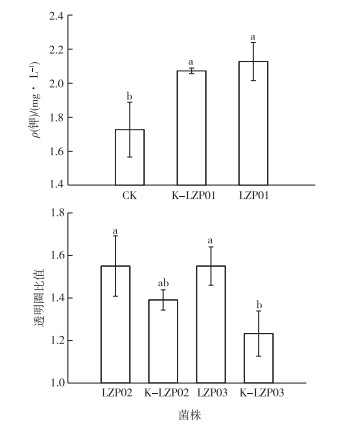
|
同一幅图中直方柱上方英文小写字母不同表示不同菌株间某指标差异显著(P<0.05)。 图 2 3株芽孢杆菌标记菌株功能测定 Fig. 2 Functional determination of three Bacillus resistant strains |
水稻幼苗根系对3株标记菌株的吸附见图 3。由图 3可知,水稻幼根浸入菌液后,吸附量随浸入时间的增加而增大,在10 min后对K-LZP01的吸附基本稳定;在50 min时对K-LZP02的吸附达到最大,随后有小幅下降趋势;在5 min时对K-LZP03的吸附达到最大,最大吸附量为12×107 CFU·g-1,随后趋于动态稳定。将水稻幼苗浸入不同浓度菌悬液中,吸附量随菌株浓度的增大而增大,K-LZP01和KLZP02浓度达到5×107 CFU·mL-1时,水稻根系吸附量基本达到饱和;K-LZP03浓度达到5×108 CFU· mL-1时,水稻根系吸附量依旧有增加趋势。水稻幼苗对菌株吸附量随时间的变化先增加,后趋于稳定;随菌株浓度的增加先趋于稳定,后逐渐增大。
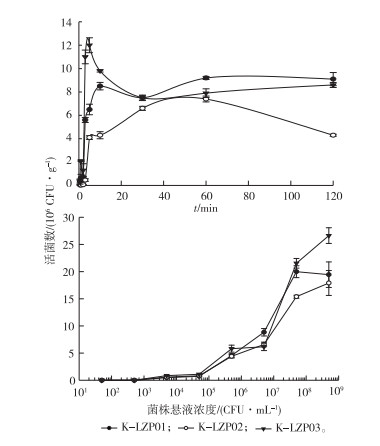
|
图 3 时间与浓度对水稻根系吸附3株标记菌株的影响 Fig. 3 Effects of time and concentration on the adsorption of the three Bacillus resistance strains of rice roots |
由图 4可知,加入K-LZP01和K-LZP02后,灭菌和未灭菌土壤菌株生物量均开始下降,0~10 d时下降速率最为显著,10~20 d时下降速率趋缓;加入KLZP03后5 d内,土壤菌株量略有上升,随即开始下降,5~10 d时下降速率最为显著,10~20 d时下降速率趋缓。在20 d的监测期内,加入K-LZP01和KLZP03的灭菌土壤中菌株生物量均高于未灭菌土壤,说明这两种菌株在灭菌土壤中定殖能力较强;加入K-LZP02的未灭菌土壤中菌株生物量高于灭菌土壤,说明K-LZP02在未灭菌土壤中定殖能力较强。
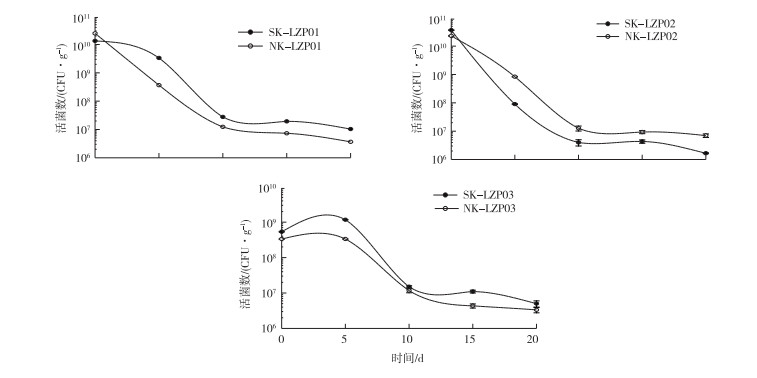
|
图 4 时间对3株标记菌株土壤存活量的影响 Fig. 4 Effect of time on soil viability of three Bacillus resistant strains |
3株标记菌株对水稻幼苗根系的影响见图 5。
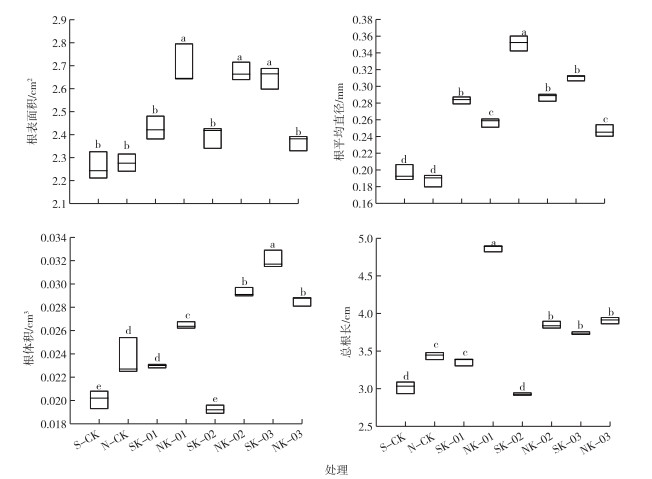
|
SK-01、SK-02和SK-03分别表示灭菌土中K-LZP01、K-LZP02和K-LZP03标记菌株对水稻根系促生效果;NK-01、NK-02和NK-03分别表示未灭菌土中K-LZP01、K-LZP02和K-LZP03标记菌株对水稻根系促生效果。箱图上下横线分别表示最大值和最小值,方框表示50%变异区间,方框中横线表示对应指标的中值。同一幅图中直方柱上方英文小写字母不同表示不同处理间某指标差异显著(P<0.05)。 图 5 3株标记菌株对水稻幼苗根系的影响 Fig. 5 Effects of three Bacillus resistant strains on root system of rice seedlings |
由图 5可知,在灭菌土壤中,相较于S-CK处理,SK-03处理水稻幼苗根表面积显著增加;在未灭菌土壤中,相较于N-CK处理,NK-01和NK-02处理水稻幼苗根表面积均显著增加(P<0.05)。在灭菌土壤中,SK-LZP02处理促进效果最好,根平均直径达0.35 mm;在未灭菌土壤中,NK-02处理促进效果最好,根表面积达0.29 mm。在灭菌土壤中,SK-03处理促进效果最好,根体积达到0.032 cm3;在未灭菌土壤中,相较于N-CK处理,NK-01、NK-02和NK-03处理水稻幼苗根体积均显著增加(P<0.05)。在灭菌土壤中,相较于S-CK处理,SK-01和SK-03处理水稻幼苗总根长均显著增加(P<0.05);在未灭菌土壤中,NK-01处理促进效果最好,总根长达到4.87 cm。在对水稻根表面积影响方面,K-LZP03灭菌土处理大于未灭菌土处理,K-LZP01和K-LZP02未灭菌土处理大于灭菌土处理;在对水稻根平均直径影响方面,3株标记菌株均是灭菌土处理大于未灭菌土处理;在对水稻根体积影响方面,K-LZP03灭菌土处理大于未灭菌土处理,K-LZP01和K-LZP02未灭菌土处理大于灭菌土处理;在对水稻总根长影响方面,3株标记菌株均是未灭菌土处理大于灭菌土处理。
2.5 标记菌株在水稻根际中的定殖能力由图 6可知,在灭菌和未灭菌土壤中,3株抗性标记菌株定殖量由多到少均依次为根际、近根和远根。在水稻根际区域,灭菌土中K-LZP02处理定殖量显著最大,定殖量为3×106 CFU·g-1;在水稻近根区域,灭菌土中K-LZP02处理定殖量也显著最大,为1×106 CFU·g-1;在水稻远根区域,未灭菌土中K-LZP03处理定殖量显著最大,为0.16×106 CFU·g-(1 P<0.05)。
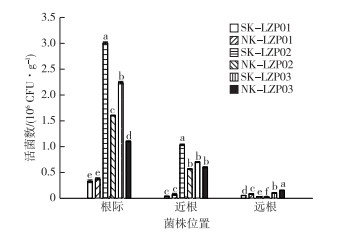
|
SK-LZP01、SK-LZP02和SK-LZP03分别表示K-LZP01、K-LZP02和K-LZP03标记菌株灭菌土处理;NK-LZP01、NK-LZP02和NK-LZP03表示K-LZP01、K-LZP02和K-LZP03标记菌株未灭菌土处理。直方柱上方英文小写字母不同表示不同处理间水稻根际某部位土壤活菌数差异显著(P<0.05)。 图 6 3株标记菌株在不同根系范围的定殖情况 Fig. 6 Colonization of three Bacillus resistant strains in different root regions |
PGPR具有溶磷、解磷、解钾和分泌植物激素等生理活性,可以进而促进植物生长,因此常被用来研发微生物肥料[14-15]。随着PGPR研究的兴起,越来越多的优良菌株被应用到大田中[16]。PGPR在植物根部的定殖能力是影响其促生能力的关键因素[17-18]。研究PGPR在植株体内外的定殖方法最常用的是单一抗生素标记法[19]。王海霞等[20]采用单一抗生素标记法对高产菌株连续转接5次,最终获得4株遗传稳定的高产突变菌,多杀菌素平均发酵产量较出发菌株ASAGF W2显著提高。利用单一抗生素抗性筛选技术选育菌株,简单易行且效果显著。笔者通过梯度法筛选出对利福平抗性较高的菌株,为后期菌株定殖与存活研究提供基础。车建美等[21]标记的清枯雷尔氏菌与野生株相比出现生长滞后现象,而笔者研究中与未标记菌株相比标记菌株生长初期生物量略有下降,但生长后期有趋于一致的趋势,并且标记菌株保留了原始菌株的生物学功能,完全可以应用于后续研究。
PGPR吸附于水稻根表是其定殖的必要条件,也是其起到促生作用的关键[22]。刘庆丰等[23]发现枯草芽胞杆菌XF-1能定殖在大白菜根部,在大白菜根际处定殖量变化规律为先降低后上升再降低,最后基本保持稳定;而在根内部定殖量变化规律为先上升后降低。CHEN等[24]发现芽孢杆菌JM-1128在棉花植株上7 d内定殖量显著下降,但7~21 d内定殖量下降缓慢。笔者研究发现水稻幼根浸入菌液后,吸附量随浸入时间的增加而增大,之后趋于动态稳定;将水稻幼苗浸入不同浓度菌悬液中,幼根吸附量随菌株浓度的增大而增大。与其他研究[25]相比,笔者标记菌株时菌株因为直接与水稻根系接触,定殖速度更快,定殖能力更加稳定,该方法较传统方法更加简便且效果更加显著,为研究PG PR引入土壤的生态行为提供了有效的检测手段。
在20 d监测期内,K-LZP01和K-LZP03灭菌土壤处理中生物量高于未灭菌土壤,这表明这两种菌株在灭菌土壤中定殖能力较强,而K-LZP02未灭菌土壤处理中生物量高于灭菌土壤,说明K-LZP02菌株在未灭菌土壤中定殖能力较强。K-LZP02与KLZP01和K-LZP03生长差异可能与菌株种类和功能有关。THEODULOZ等[26]发现Bacillus subtilis在温室条件下在番茄叶片上至少可存活45 d,其菌量仅下降2.5个单位。余国运等[27]研究发现小麦增产菌a-47菌株可在营养条件好、温湿度适宜、比较隐蔽、微环境相对稳定的一些有利位点上定殖。笔者研究中,3株标记菌株总体趋势是生物量随时间增加而减少,最后趋于稳定。在灭菌和未灭菌土壤中,标记菌株均对水稻根系有促生效应,说明菌株在土壤中具有明显竞争优势,能够显著优化根系结构,促进根系总根长、根表面积和根体积增加,这与吕雅悠等[28]研究结果一致。在灭菌土壤中,3株抗性标记菌株在土壤中定殖量由大到小均依次为根际、近根和远根,此与王珍等[29]研究结果一致。距离水稻根际越近,土壤中标记菌株含量就越高,这说明菌株具有良好的定殖能力和竞争优势[30],且与水稻根系间可能存在互利共生关系。
4 结论采用抗性药物利福平梯度筛选方法对3株具有促生功能的PGPR菌株进行抗性标记,得到能稳定生长且保留原始功能的K-LZP01、K-LZP02和KLZP03标记菌株。标记菌株可在土壤及水稻根际很好地定殖,并对水稻根系具有很好的促进作用,并且标记菌株主要定殖于水稻根际处。该试验为阐释水稻根际促生菌的促生机制提供了试验依据,对微生物菌剂的商业化发展具有较大意义。
| [1] |
NICO M, RIBAUDO C M, GORI J I, et al. Uptake of Phosphate and Promotion of Vegetative Growth in Glucose-Exuding Rice Plants(Oryza sativa) Inoculated With Plant Growth-Promoting Bacteria[J]. Applied Soil Ecology, 2012, 61: 190-195. DOI:10.1016/j.apsoil.2011.10.016 (  0) 0) |
| [2] |
付景, 杨建昌. 中国水稻栽培理论与技术发展的回顾与展[J]. 作物杂志, 2010(5): 1-4. [ FU Jing, YANG Jian-chang. Retrospect and Prospect for the Development of Theory and Technology of Rice Cultivation in China[J]. Crops, 2010(5): 1-4. DOI:10.3969/j.issn.1001-7283.2010.05.001] (  0) 0) |
| [3] |
曹丹, 白林燕, 冯建中, 等. 东北三省水稻种植面积时空变化监测与分析[J]. 江苏农业科学, 2018, 46(10): 260-265. [ CAO Dan, BAI Lin-yan, FENG Jian-zhong, et al. Monitoring and Analysis of Temporal and Spatial Variation of Rice Planting Area in Northeastern China[J]. Jiangsu Agricultural Sciences, 2018, 46(10): 260-265.] (  0) 0) |
| [4] |
WIEHE W, HÖFLICH G. Survival of Plant Growth Promoting Rhizosphere Bacteria in the Rhizosphere of Different Crops and Migration to Non-Inoculated Plants Under Field Conditions in North-East Germany[J]. Microbiological Research, 1995, 150(2): 201-206. DOI:10.1016/S0944-5013(11)80057-1 (  0) 0) |
| [5] |
甄静, 李冠杰, 王继雯, 等. 固定化菌株在土壤中的繁殖释放及性能分析[J]. 中国农学通报, 2016, 32(9): 155-158. [ ZHEN Jing, LI Guan-jie, WANG Ji-wen, et al. Immobilized Strain Propagation and Release and Its Performance[J]. Chinese Agricultural Science Bulletin, 2016, 32(9): 155-158.] (  0) 0) |
| [6] |
孙真, 郑亮, 邱浩斌. 植物根际促生细菌定殖研究进展[J]. 生物技术通报, 2017, 33(2): 8-15. [ SUN Zhen, ZHENG Liang, QIU Hao-bin. Research Advances on Colonization of Plant Growth-Promoting Rhizobacteria[J]. Biotechnology Bulletin, 2017, 33(2): 8-15.] (  0) 0) |
| [7] |
徐伟慧, 刘泽平, 符春敏, 等. 根际芽孢杆菌对水稻根系的促生效应[J]. 河南农业科学, 2018, 47(4): 59-63. [ XU Wei-hui, LIU Ze-ping, FU Chun-min, et al. Promoting Effect of Bacillus Rhizobacteria on Rice Root[J]. Journal of Henan Agricultural Sciences, 2018, 47(4): 59-63.] (  0) 0) |
| [8] |
王志刚, 胡云龙, 徐伟慧, 等. 鞘氨醇单胞菌菌株CL01的分离鉴定及其对连作西瓜的促生效应[J]. 农业生物技术学报, 2015, 23(10): 1360-1367. [ WANG Zhi-gang, HU Yun-long, XU Wei-hui, et al. Isolation and Identification of Sphingomonas sp.CL01 and Its Promoting Effects on Watermelon(Citrullus lanatus)in Continuous Cropping Soil[J]. Journal of Agricultural Biotechnology, 2015, 23(10): 1360-1367.] (  0) 0) |
| [9] |
余贤美, 侯长明, 王海荣, 等. 枯草芽孢杆菌Bs-15在枣树体内和土壤中的定殖及其对土壤微生物多样性的影响[J]. 中国生物防治学报, 2014, 30(4): 497-502. [ YU Xian-mei, HOU Chang-ming, WANG Hai-rong, et al. Colonization of Bacillus subtilis Bs-15 in Jujube Plant and Soil and Its Influence on the Microbial Diversity in the Soil[J]. Chinese Journal of Biological Control, 2014, 30(4): 497-502.] (  0) 0) |
| [10] |
刘泽平, 王志刚, 徐伟慧, 等. 水稻根际促生菌的筛选鉴定及促生能力分析[J]. 农业资源与环境学报, 2018, 35(2): 119-125. [ LIU Ze-ping, WANG Zhi-gang, XU Wei-hui, et al. Screen, Identification and Analysis on the Growth-Promoting Ability for the Rice Growth-Promoting Rhizobacteria[J]. Journal of Agricultural Resources and Environment, 2018, 35(2): 119-125.] (  0) 0) |
| [11] |
JI S H, GURURANI M A, CHUN S C. Isolation and Characterization of Plant Growth Promoting Endophytic Diazotrophic Bacteria From Korean Rice Cultivars?[J]. Microbiological Research, 2014, 169(1): 83-98. DOI:10.1016/j.micres.2013.06.003 (  0) 0) |
| [12] |
CASTANHEIRA N L, DOURADO A C, PAIS I, et al. Colonization and Beneficial Effects on Annual Ryegrass by Mixed Inoculation With Plant Growth Promoting Bacteria[J]. Microbiological Research, 2017, 198: 47-55. DOI:10.1016/j.micres.2017.01.009 (  0) 0) |
| [13] |
吴蔼民, 顾本康, 傅正擎, 等. 内生菌73a在不同抗性品种棉花体内的定殖和消长动态研究[J]. 植物病理学报, 2001, 31(4): 289-294. [ WU Ai-min, GU Ben-kang, FU Zheng-qing, et al. Studies on the Population Fluctuation of Entophytic Bacteria 73a in Cotton Plant[J]. Acta Phytopathologica Sinica, 2001, 31(4): 289-294. DOI:10.3321/j.issn:0412-0914.2001.04.001] (  0) 0) |
| [14] |
NIMNOI P, PONGSILP N, RUANPANUN P. Monitoring the Efficiency of Streptomyces galilaeus Strain KPS-C004 Against Root Knot Disease and the Promotion of Plant Growth in the Plant-Parasitic Nematode Infested Soils[J]. Biological Control, 2017, 114: 158-166. DOI:10.1016/j.biocontrol.2017.08.016 (  0) 0) |
| [15] |
SANTOS A R S, ETTO R M, FURMAM R W, et al. Labeled Azospirillum brasilense Wild Type and Excretion-Ammonium Strains in Association With Barley Roots[J]. Plant Physiology and Biochemistry, 2017, 118: 422-426. DOI:10.1016/j.plaphy.2017.07.003 (  0) 0) |
| [16] |
王志远, 吴兴兴, 吴毅歆, 等. 解淀粉芽孢杆菌B9601-Y2抗性基因标记及其在作物根部的定殖能力[J]. 华中农业大学学报, 2012, 31(3): 313-319. [ WANG Zhi-yuan, WU Xing-xing, WU Yi-xin, et al. Resistance Genes Labeling and Colonization Ability of a Biocontrol Agent B9601-Y2 of Bacillus amylolIquefaciens in Crop Rhizospheres[J]. Journal of Huazhong Agricultural University, 2012, 31(3): 313-319. DOI:10.3969/j.issn.1000-2421.2012.03.009] (  0) 0) |
| [17] |
GLANDORF D C, VERHEGGEN P, JANSEN T, et al. Effect of Genetically Modified Pseudomonas putida WCS358r on the Fungal Rhizosphere Microflora of Field-Grown Wheat[J]. Applied and Environmental Microbiology, 2001, 67(8): 3371-3378. DOI:10.1128/AEM.67.8.3371-3378.2001 (  0) 0) |
| [18] |
OMER Z S, TOMBOLINI R, GERHARDSON B. Plant Colonization by Pink-Pigmented Facultative Methylotrophic Bacteria (PPFMs)[J]. FEMS Microbiology Ecology, 2010, 47(3): 319-326. (  0) 0) |
| [19] |
BRETON Y L, MOHAPATRA N, HALDENWANG W G. In Vivo Random Mutagenesis of Bacillus subtilis by Use of TnYLB-1, a mariner-based Transposon[J]. Applied and Environmental Microbiology, 2006, 72(1): 327-333. DOI:10.1128/AEM.72.1.327-333.2006 (  0) 0) |
| [20] |
王海霞, 陈园, 王超, 等. 组合抗生素抗性选育多杀菌素高产菌株[J]. 粮油食品科技, 2017, 25(4): 70-75. [ WANG Hai-xia, CHEN Yuan, WANG Chao, et al. Breeding of Spinosad High-Producing Strains by Combinatorial Antibiotic Resistance[J]. Science and Technology of Cereals, Oils and Foods, 2017, 25(4): 70-75. DOI:10.3969/j.issn.1007-7561.2017.04.014] (  0) 0) |
| [21] |
车建美, 蓝江林, 刘波. 转绿色荧光蛋白基因的青枯雷尔氏菌生物学特性[J]. 中国农业科学, 2008, 41(11): 3626-3635. [ CHE Jian-mei, LAN Jiang-lin, LIU Bo. GFP Tagging Ralstoniasolanacearum With gfp/luxAB Mini-Tn5[J]. Scientia Agricultura Sinica, 2008, 41(11): 3626-3635. DOI:10.3864/j.issn.0578-1752.2008.11.024] (  0) 0) |
| [22] |
GUERRERO-MOLINA M F, WINIK B C, PEDRAZA R O. More Than Rhizosphere Colonization of Strawberry Plants by Azospirillum brasilense[J]. Applied Soil Ecology, 2012, 61: 205-212. DOI:10.1016/j.apsoil.2011.10.011 (  0) 0) |
| [23] |
刘庆丰, 熊国如, 毛自朝, 等. 枯草芽胞杆菌XF-1的根围定殖能力分析[J]. 植物保护学报, 2012, 39(5): 425-430. [ LIU Qing-feng, XIONG Guo-ru, MAO Zi-chao, et al. Analyses for the Colonization Ability of Bacillus subtilis XF-1 in the Rhizosphere[J]. Acta Phytophylacica Sinica, 2012, 39(5): 425-430.] (  0) 0) |
| [24] |
CHEN C, BAUSKE E M, MUSSON G, et al. Biological Control of Fusarium Wilt on Cotton by Use of Endophytic Bacteria[J]. Biological Control, 1995, 5(1): 83-91. DOI:10.1006/bcon.1995.1009 (  0) 0) |
| [25] |
齐飞飞, 夏觅真, 唐欣昀, 等. luxAB基因标记的K2116L菌株在棉花根际中的定殖[J]. 生态学杂志, 2008, 27(2): 192-196. [ QI Fei-fei, XIA Mi-zhen, TANG Xin-yun, et al. Colonization of luxAB Gene-Marked Bacillus K2116 Strain in Cotton Rhizosphere[J]. Chinese Journal of Ecology, 2008, 27(2): 192-196.] (  0) 0) |
| [26] |
THEODULOZ C, VEGA A, SALAZAR M, et al. Expression of a Bacillus thuringiensis δ-Endotoxin cry1Ab Gene in Bacillus subtilis and Bacillus licheniformis Strains That Naturally Colonize the Phylloplane of Tomato Plants(Lycopersicon esculentum, Mills)[J]. Journal of Applied Microbiology, 2003, 94(3): 375-381. DOI:10.1046/j.1365-2672.2003.01840.x (  0) 0) |
| [27] |
余国运, 唐文华, 陈延熙. 增产菌在小麦叶面定殖的研究[J]. 生物防治通报, 1992, 8(2): 83-86. [ YU Guo-yun, TANG Wen-hua, CHEN Yan-xi. Colonization of "Yield-Increasing Bacteria" on the Phylloplane of Wheat[J]. Chinese Journal of Biologi-cal Control, 1992, 8(2): 83-86.] (  0) 0) |
| [28] |
吕雅悠, 丁方丽, 王娟, 等. 两株促植物生长根际细菌对辣椒的促生效果及其在辣椒根际定殖能力[J]. 北方园艺, 2015(18): 26-30. [ LÜ Ya-you, DING Fang-li, WANG Juan, et al. Effect of Two PGPR Strains on Plant Growth Promoting and Its Root Colonization Ability in Pepper[J]. Northern Horticulture, 2015(18): 26-30.] (  0) 0) |
| [29] |
王珍, 曹翠玲, 库永丽, 等. 巨大芽胞杆菌WY4的GFP标记及其在小白菜上的定殖[J]. 农业生物技术学报, 2016, 24(12): 1925-1934. [ WANG Zhen, CAO Cui-ling, KU Yong-li, et al. Ba-cillus megatherium WY4 Labeled by GFP and Its Colonization in Chinese Cabbage(Brassica chinensis)[J]. Journal of Agricultural Biotechnology, 2016, 24(12): 1925-1934.] (  0) 0) |
| [30] |
杜立新, 冯书亮, 曹克强, 等. 枯草芽孢杆菌BS-208和BS-209菌株在番茄叶面及土壤中定殖能力的研究[J]. 河北农业大学学报, 2004, 27(6): 78-82. [ DU Li-xin, FENG Shu-liang, CAO Ke-qiang, et al. Study on Colonization of Bacillus subtilis Strains BS-208 and BS-209 on Phylloplane of Tomato and Soil[J]. Jour-nal of Agricultural University of Hebei, 2004, 27(6): 78-82. DOI:10.3969/j.issn.1000-1573.2004.06.019] (  0) 0) |




