2. 江苏省水土环境生态修复工程实验室, 江苏 南京 210023
2. Jiangsu Engineering Laboratory of Water and Soil Eco-remediation, Nanjing 210023, China
碳是土壤有机质的重要组成部分,也是植物体的主要组成元素。植物光合作用是陆地和大气间碳循环的驱动力,也是土壤有机碳的重要来源[1]。植物通过光合作用吸收大气中的CO2,并将光合作用固定的碳输送到植物各个部位,以根际沉积物形式输入土壤,包括根系分泌物、死亡根系和作物残体等[2]。光合碳是“大气-植物-土壤”系统碳循环的重要组成部分,与大气环境及土壤质量变化关系密切[3]。N和P作为植物的基本营养元素,制约植物生长发育和遗传等重要生命过程,也是陆地生态系统初级生产力的主要限制因子[4]。在农业生态系统中,N、P添加改变土壤养分状况,从而对盐沼土壤碳循环过程产生影响,改变土壤有机碳组分[5],改变玉米、水稻和小麦等作物的光合碳分配[6-8]。自互花米草(Spartina alterniflora)引入我国以来,在沿海地区潮间带广泛分布,对沿海湿地碳循环产生多重生态效应[9-11]。近年来,沿海地区径流、海水中N和P营养盐浓度在增加,其对互花米草光合碳分配的影响尚不明确。笔者采用13C脉冲标记法研究N、P添加对互花米草光合碳在互花米草-土壤系统分配比例的影响,有助于定量化评估互花米草-土壤系统碳循环过程。
1 材料与方法 1.1 互花米草的培养于2015年4月采集江苏盐城湿地表层0~20 cm土壤以及互花米草幼苗植株,将互花米草幼苗植株移栽至PVC管(直径为10 cm,高为35 cm)中,2015年4—9月进行室内培养。土壤w(有机碳)为7.00 g·kg-1,w(全氮)为1.70 g·kg-1,w(全磷)为0.31 g·kg-1,每盆装风干土约5 kg,种植互花米草1株,每个处理组设置3个重复,标记4次,共种植120盆。
共设置3种处理,分别为N处理组(单独添加N)、P处理组(单独添加P)和NP处理组(N和P复合添加),其中,N、P和NP处理组各设低、中和高3个添加水平(表 1),上述9个处理分别标记为N1、N2、N3、P1、P2、P3、NP1、NP2和NP3,同时设置对照(不添加组,CK),每月按照设定浓度和总量对互花米草进行N、P浇灌处理,直至标记结束。
|
|
表 1 营养添加处理 Table 1 Nutrients addition treatments |
标记实验在特制的有机玻璃箱(长×宽×高为1.5 m×0.9 m×1.2 m)内进行。每隔30 d向玻璃箱中通入NaH13CO3与HCl溶液反应产生的13CO2气体,NaH13CO3每次用量为10 g,共标记4次。标记在晴朗天气上午8:00—12:00进行。在标记过程中,箱内温度控制在28.5~37.6 ℃之间,加入适量冰块防止箱内温度过高。在箱内顶部安装2个小型风扇保证气体混合均匀。标记步骤:(1)标记前将栽植互花米草的PVC盆放入标记箱的底座上,在底座里加入适量冰块,并放置4个250 mL烧杯,其中2个各盛放5 g NaH13CO3,另外2个各盛放5 g NaH12CO3;(2)将有机玻璃箱放在底座槽内,向底座槽内注满自来水使整个系统处于密封状态,然后开启风扇。互花米草在密封系统中进行光合作用15 min,消耗箱内空气中残留的CO2达到饥饿状态,以提高对添加13CO2的吸收能力;(3)15 min后用黑布遮住有机玻璃箱,用医用塑料滴管迅速向装有NaH13CO3的烧杯中注入250 mL浓度为2 mol∙L-1的HCl溶液,待反应5 min后,将黑布移开,让互花米草在有机玻璃箱内进行光合作用;(4)待标记45 min后,重复步骤(3)继续向装有NaH13CO3的另一个烧杯中注入HCl溶液以产生13CO2气体,最后2次,向装有NaH12CO3的烧杯中注入HCl溶液以产生12CO2,从而达到较好的标记效果。在2015年6—9月对互花米草每月进行1次脉冲标记实验,共进行4次。
1.3 样品采集与分析在每次标记后第10天,从每个处理组和对照组中均随机选择3盆互花米草,进行破坏性取样,收获互花米草的叶、茎、根、根际土壤以及PVC管中土体。互花米草用蒸馏水洗净后,放入烘箱内60 ℃条件下烘干至恒重,磨碎备用。从根际土壤和土体中挑出贝壳、植物根系后自然风干,研磨,过0.147 mm孔径筛备用。
互花米草根、茎、叶、根际土壤以及土体的全碳含量、δ13C值用同位素质谱仪(Sercon intergra CN)测定。
1.4 指标计算方法(1)土壤或植物的稳定同位素13C自然丰度用δ13C值(‰)表示,δ13C表示碳稳定同位素相对其标准物的比值, 计算公式[12]为
| $ δ_{^{13}{\rm C}}= (R_样/R_{\rm PDB}-1) ×1 \;000 。$ | (1) |
式(1)中,R样为样品13C和12C的稳定同位素丰度比值;RPDB为标准物质13C和12C的稳定同位素丰度比值,是一个常数,为0.011 237 2。
而标记、未标记的土壤或植物一般用同位素相对丰度(F,%,以下简称丰度)表示,δ13C和F可以相互转换,转换公式[13-14]为
| $ \begin{aligned} F=&\left[\left(\delta_{^{13}{\rm C}}+1\;000\right) \times R_{\mathrm{PDB}}\right] /\left[\left(\delta_{^{13}{\rm C}}+1\;000\right) \times R_{\mathrm{PDB}}+\right.\\ & 1\;000 ] \times 100。\end{aligned} $ |
(2)互花米草-土壤系统各组分13C固定量(Ri,mg)计算公式[14]为
| $ R_i=Q_i× (F_标-F_{未标}) /100×1 \;000 。$ | (2) |
式(2)中,Qi为各组分碳量,g;F标为标记互花米草组分13C丰度,%;F未标为未标记互花米草组分13C丰度, %。
各组分13C分配比例(Pi,%)计算公式[15]为
| $ P_i= R_i /R_{\rm tot} ×100 。$ | (3) |
式(3)中,Rtot为互花米草根、茎、叶、根际土壤以及土体13C固定量的总和,mg。
1.5 统计分析采用Excel 2016软件整理数据,采用IBM SPSS Statistics 22软件进行统计分析。采用OriginPro 8.0软件制图。
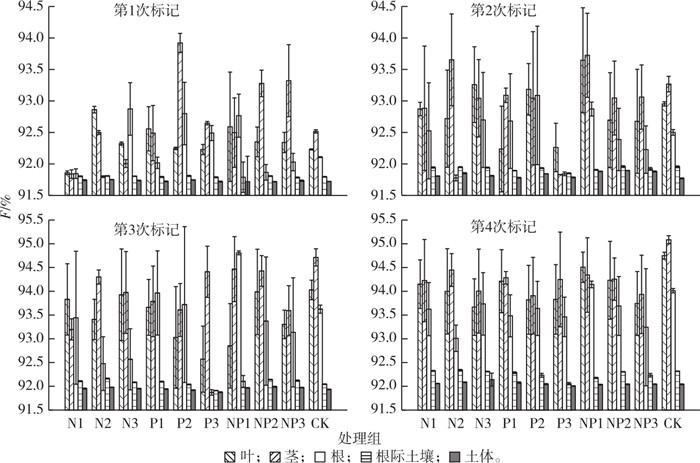
2 结果与分析 2.1 N和P添加对互花米草-土壤系统中各组分13C丰度的影响4次标记后不同处理组互花米草-土壤系统各组分13C丰度见图 1。
|
图 1 4次标记后不同处理组互花米草-土壤系统各组分13C丰度(F) Fig. 1 The value of F in Spartina alterniflora‑soil system after 13C-labelling |
由图 1可知,不同N、P添加处理及添加水平显著影响系统各组分13C丰度。第4次标记后就N添加处理而言,高N(N3)水平下互花米草-土壤系统地上部分(叶、茎)13C丰度最小,中等N(N2)水平下地上部分13C丰度最高;就P添加处理而言,在中等P(P2)水平下地上部分13C丰度最小;就NP添加处理而言,在高NP(NP3)水平下地上部分13C丰度最小,且地上部分13C丰度随NP水平增加而降低。
由图 1可知,第4次标记后各处理组(CK除外)互花米草叶13C丰度在93.67% ~ 94.51%之间,茎13C丰度在93.91% ~ 94.47%之间,根13C丰度在93.01% ~ 94.14%之间,根际土壤13C丰度在92.05% ~ 92.34%之间,土体13C丰度在92.00% ~ 92.14%之间。第4次脉冲标记后除处理NP1外其他处理13C丰度总体都呈现茎、叶、根、根际土壤、土体递减的规律。
随着植物生长期的变化,互花米草植株13C丰度变化明显。前2次标记时,植物处于快速生长期,中、高水平营养盐添加处理能提高植株13C丰度;后2次标记时,植物处于稳定生长期,营养盐添加对13C的吸收没有明显的促进作用。各处理组植物13C丰度与CK组接近,或者略低于CK组。
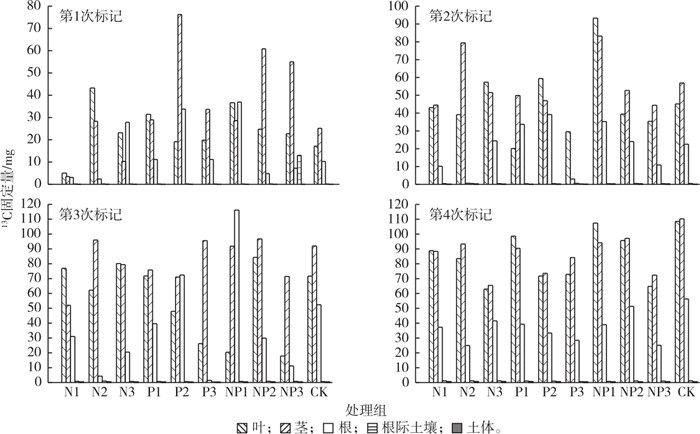
2.2 N和P添加对互花米草-土壤系统光合13C分配的影响 2.2.1 N和P添加对互花米草-土壤系统各组分13C固定量的影响由图 2可知,N、P添加方式及添加水平显著影响互花米草-土壤系统13C固定量。第4次标记后各NP处理13C固定量由大到小依次为NP2(245.81 mg·株-1)、NP1(241.98 mg·株-1)和NP3(163.80 mg·株-1),均低于CK组(276.82 mg·株-1)。第4次标记后各组分13C固定总量呈现CK组、NP添加组、N或P单独添加组依次递减趋势。安婷婷等[15]在研究N、P添加对玉米光合碳转移影响的实验中也发现了同样的现象。
|
图 2 4次标记后不同处理组互花米草-土壤系统各组分13C固定量 Fig. 2 Net photosynthesized 13C in each part of Spartina alterniflora‑soil system after 13C‑labelling |
由图 2可知,就N添加组而言,第4次标记后低N处理(N1)13C固定量(216.22 mg·株-1)最大,其后依次为N2(203.68 mg·株-1)和N3(171.85 mg·株-1),此与山楠等[16]的研究结果一致。就P添加组而言,低P处理组(P1)13C固定量(230.03 mg·株-1)最大,其后依次为P3(186.75 mg·株-1)和P2(180.29 mg·株-1)。就NP添加组而言,中等NP添加组(NP2)高于低水平和高水平NP添加组。总体而言,NP添加组13C固定量平均值大于N和P单独添加组,说明复合营养添加更有利于互花米草光合碳固定量的提高。
植物生长阶段也影响营养盐添加的作用效果。由图 2可知,第1次标记时互花米草处于生长初期,除了低N添加组外,其余各处理组13C固定量均高于CK组,表明在互花米草生长早期,N、P营养盐添加均促进植物对13C的固定。第2~4次标记后,互花米草处于成熟期,各处理组13C固定量均低于CK组,表明成熟期营养盐添加对光合碳固定没有促进作用。
各组分13C固定量主要集中在地上部分(叶、茎),其次是根、根际土壤和土体。第1次脉冲标记后,互花米草叶13C丰度在91.86%~92.86%之间,茎13C丰度在91.84%~93.92%之间,根13C丰度在91.80%~92.87%之间,根际土壤13C丰度在91.78%~91.81%之间,土体13C丰度在91.72%~91.75%之间。第4次脉冲标记后各处理13C丰度除处理NP1呈现叶 > 茎 > 根 > 根际土壤 > 土体的规律外,其余处理13C丰度均呈现茎 > 叶 > 根 > 根际土壤 > 土体的规律(图 1),叶13C丰度在93.67%~94.51%之间,茎13C丰度在93.91%~94.47%之间,根13C丰度在93.01%~94.14%之间,根际土壤13C丰度在92.05%~92.34%之间,土体13C丰度在92.00%~92.14%之间。由图 2可知,经过4次标记,互花米草-土壤系统根、茎、叶、根际土壤和土体13C固定总量均增加,13C固定总量主要集中在地上部分,土体13C固定量增加说明碳在土壤中富集。
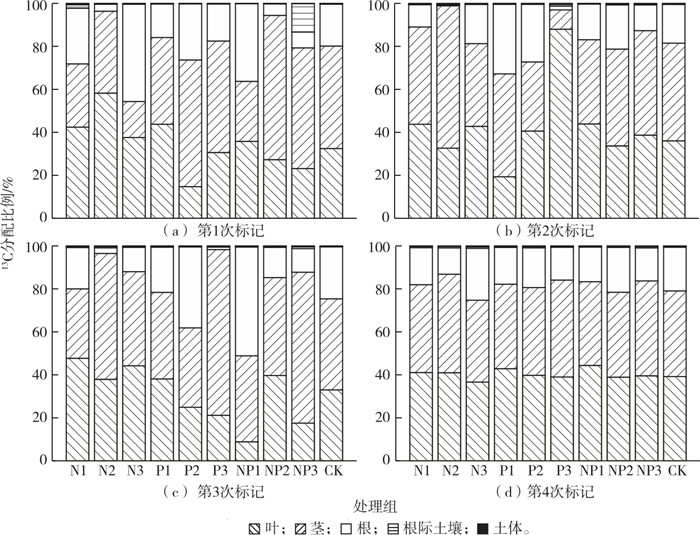
2.2.2 N和P添加对互花米草-土壤系统13C分配比例的影响由图 3可知,在植物快速生长期,即第1次标记后,N添加水平对互花米草13C分配比例影响显著,N2处理组地上部分(叶、茎)13C分配比例最大,为96.38%。而低N和高N则促进光合碳向土壤和根部转移,低N处理地下部分(根、根际土壤和土体)13C分配比例为28.15%,而高N处理地下部分分配比例为45.65%。就P添加组而言,互花米草地上部分13C分配比例以中P水平组为最低,为73.68%,低P和高P水平有利于光合碳向地上部分转移。就NP添加组而言,与CK组相比,低NP添加(NP1)降低了地上部分13C分配比例,中NP添加(NP2)则增加地上部分13C分配比例,最高可达94.40%。同时,随着NP添加水平上升,互花米草-土壤系统土体13C分配比例下降,N或P单独添加对土体13C分配比例无显著影响。
|
图 3 4次标记后不同处理组互花米草-土壤系统各组分13C分配比例 Fig. 3 The 13C allocation proportion of Spartina alterniflora‑soil system after 13C-labelling |
由图 3可知,在植物成熟期,即第4次标记后,营养盐添加对各组分13C分配比例无显著影响,对照组和各处理组13C分配比例接近。其中,叶13C分配比例在36.63%~44.38%之间,茎13C分配比例在38.09%~45.82%之间,根13C分配比例在12.24%~24.16%之间,根际土壤13C分配比例在0.34%~0.61%之间,土体13C分配比例在0.22%~0.43%之间。
3 讨论有研究表明玉米根系光合碳分配比例随着植物生育期的变化而呈先上升后下降趋势,这是因为在植物幼苗期叶面积小,光合碳分配到地下部分的比例较小,拔节期植物根生长迅速,增加了地下部分分配比例;成熟期植物主要进行生殖生长,分配到根系的比例较小[17]。笔者研究中,经过4次脉冲标记,植物固定的光合碳中有13.19%~25.27%累积在土壤,分配到根系的碳比例随着时间的推移并未呈现这一规律,可能是因为地下部分光合碳的分配受植物生长和养分有效性之间平衡的影响。如WAREMBOURG等[18]认为在不施肥情况下土壤养分缺乏,植物为维持生长必须分配更多的碳到地下部分来支持根系的结构和功能运行,较高比例的根际沉积碳可以使根系养分的有效性增大。但也有研究者认为植物对土壤养分的吸收需要消耗更多的碳源,分配到根系的碳大部分通过土壤呼吸损失。
在不同生长时期,植物光合产物的分配也不相同。齐鑫等[7]研究2种施N水平下冬小麦不同生育期光合碳在植株-土壤系统中的分配,收获时,N150处理分配到根和土壤中的光合碳比例均高于N0处理,说明施N会影响植物光合碳的分配[19]。笔者研究中3种施N水平(N1、N2和N3)下,除第3次标记外,N3处理光合碳分配到地下部分(根、根际土壤和土体)比例均高于N1和N2处理,分配到地上部分(茎、叶)比例均低于N1和N2处理,这是因为N添加水平的增加,促进了植物地上部分生物量的增加,相当于起到稀释作用,最终致使N3处理地上部分13C丰度小于N1和N2处理。由于植物具有自身调节机制,在营养元素缺乏情况下,大量光合产物向地下部分运移,根部通过增加根系分泌有机酸类物质来获取作物所需要的养分,根13C丰度较大。
在3种施P水平(P1、P2和P3)下,除第2次标记外其他标记情况下P2处理光合碳分配到地下部分(根、根际土壤和土体)比例均高于P1和P3处理,说明P肥不足和过量施P肥均会影响植物光合碳的分配。笔者试验中光合作用固定的13C大部分保留在植株地上部分,但是地下部分13C分配比例在逐渐增加,说明光合作用产物在向地下部分转移。KUZYAKOV等[20]和WERTH等[21]通过研究不同种类植物地下碳转移的差异时也发现了这一规律。SPIVAK等[22]将13C标记的二氧化碳应用于地上的叶子并追踪其在地下根和细菌脂质中的分布情况。在24 h内,由互花米草固定的13CO2中有41%~64%留在叶片中,2.7%~6.4%转移到根部,30%~55%通过呼吸而损失。笔者研究中,在第4次脉冲标记后各处理地上部分(茎和叶)13C分配比例在74.72%~86.81%之间,地下部分(根、根际土壤和土体)13C分配比例在13.19%~25.27%之间,地上部分13C固定量高的原因可能是由于标记周期长,标记次数多。谭立敏等[23]研究发现,5种施N水平下标记水稻,水稻固定13C含量在地上部、地下部比例分别为67.6%~71.2%和22.2%~39.5%,笔者研究与之相比,地下部分固定13C比例稍低;这可能是因为植物种类不同,光合碳的分配存在差异,除此之外,互花米草是在室内PVC管中培养的,供试土壤体积较小,限制了植物根系的生长以及根系对土壤养分的吸收[24, 25]。BUTLER等[26]发现黑麦草在标记8 d后其茎叶、根和土体的13C分配比例分别为70%、20%和10%,其中,地上部分13C固定量占主要部分。LAWLOR[27]发现不同N水平下地上部、地下部固定13C含量在水稻-土壤系统中分别为70%和30%,笔者研究结果与之基本一致。
4 结论(1)NP复合添加处理13C固定量大于单独N添加或P添加处理;(2)随着标记时间的推移,土壤中有机碳富集,互花米草地上部分13C分配比例逐渐减小,地下部分13C分配比例逐渐增大;(3)施N能促进光合碳向土壤转移,中等水平P添加最利于光合碳向地下转移。富营养化水平和营养盐类型会影响互花米草盐沼土壤碳循环过程。
| [1] |
DANNENBERG S, CONRAD R. Effect of Rice Plants on Methane Production and Rhizospheric Metabolism in Paddy Soil[J]. Biogeochemistry, 1999, 45(1): 53-71. (  0) 0) |
| [2] |
申建波, 张福锁, 毛达如. 根际微生态系统中的碳循环[J]. 植物营养与肥料学报, 2001, 7(2): 232-240. [ SHEN Jian-bo, ZHANG Fu-suo, MAO Da-ru. Carbon Cycling in Rhizosphere Microecological System[J]. Plant Nutrition and Fertilizer Science, 2001, 7(2): 232-240. DOI:10.3321/j.issn:1008-505X.2001.02.019] (  0) 0) |
| [3] |
周广胜, 王玉辉, 许振柱, 等. 中国东北样带碳循环研究进展[J]. 自然科学进展, 2003, 13(9): 917-922. DOI:10.3321/j.issn:1002-008X.2003.09.004 (  0) 0) |
| [4] |
HIDAKA A, KITAYAMA K. Divergent Patterns of Photosynthetic Phosphorus-Use Efficiency Versus Nitrogen-Use Efficiency of Tree Leaves Along Nutrient-Availability Gradients[J]. Journal of Ecology, 2009, 97(5): 984-991. DOI:10.1111/jec.2009.97.issue-5 (  0) 0) |
| [5] |
安婷婷, 汪景宽, 李双异, 等. 施用有机肥对黑土团聚体有机碳的影响[J]. 应用生态学报, 2008, 19(2): 369-373. [ AN Ting-ting, WANG Jing-kuan, LI Shuang-yi, et al. Effects of Manure Application on Organic Carbon in Aggregates of Black Soil[J]. Chinese Journal of Applied Ecology, 2008, 19(2): 369-373.] (  0) 0) |
| [6] |
乔云发, 韩晓增, 赵兰坡. 长期定量施肥对玉米光合碳分配的影响[J]. 水土保持学报, 2010, 24(4): 208-212. [ QIAO Yun-fa, HAN Xiao-zeng, ZHAO Lan-po. The Respond of Photosynthetic Carbon Allocation of Maize to Long-Term Fertilization[J]. Journal of Soil and Water Conservation, 2010, 24(4): 208-212.] (  0) 0) |
| [7] |
齐鑫, 王敬国. 应用13C脉冲标记方法研究不同施氮量对冬小麦净光合碳分配及其向地下输入的影响[J]. 农业环境科学学报, 2008, 27(6): 2524-2530. [ QI Xin, WANG Jing-guo. Distribution and Translocation of Assimilated C Pulse-Labeled With 13C for Winter Wheat (Trticum aestivums L.), as Affected by Nitrogen Supply[J]. Journal of Agro-Environment Science, 2008, 27(6): 2524-2530. DOI:10.3321/j.issn:1672-2043.2008.06.073] (  0) 0) |
| [8] |
TONG C, WANG C, HUANG J F, et al. Ecosystem Respiration Does not Differ Before and After Tidal Inundation in Brackish Marshes of the Min River Estuary, Southeast China[J]. Wetlands, 2014, 34(2): 225-233. DOI:10.1007/s13157-013-0478-x (  0) 0) |
| [9] |
王刚, 杨文斌, 王国祥, 等. 互花米草海向入侵对土壤有机碳组分、来源和分布的影响[J]. 生态学报, 2013, 33(8): 2474-2483. [ WANG Gang, YANG Wen-bin, WANG Guo-xiang, et al. The Effects of Spartina alterniflora Seaward Invasion on Soil Organic Carbon Fractions, Sources and Distribution[J]. Acta Ecologica Sinica, 2013, 33(8): 2474-2483.] (  0) 0) |
| [10] |
WANG M, WANG Q, SHA Y C, et al. Spartina alterniflora Invasion Affects Soil Carbon in a C3 Plant-Dominated Tidal Marsh[J]. Scientific Reports, 2018, 8(1): 628. DOI:10.1038/s41598-017-19111-1 (  0) 0) |
| [11] |
陈怀璞, 张天雨, 葛振鸣, 等. 崇明东滩盐沼湿地土壤碳氮储量分布特征[J]. 生态与农村环境学报, 2017, 33(3): 242-251. [ CHEN Huai-pu, ZHANG Tian-yu, GE Zhen-ming, et al. Distribution of Soil Carbon and Nitrogen Stocks in Salt Marsh Wetland in Dongtan of Chongming[J]. Journal of Ecology and Rural Environment, 2017, 33(3): 242-251.] (  0) 0) |
| [12] |
刘萍, 江春玉, 李忠佩. 13C脉冲标记定量研究施氮量对光合碳在水稻-土壤系统中分布的影响[J]. 土壤学报, 2015, 52(3): 567-575. [ LIU Ping, JIANG Chun-yu, LI Zhong-pei. Quantitative Research on Effects of Nitrongen Application Rate on Distribution of Photosynthetic Carbon in Rice-Soil System Using 13C Pulse Labeling Technique[J]. Acta Pedologica Sinica, 2015, 52(3): 567-575.] (  0) 0) |
| [13] |
NIKLAUS P A, GlCKLER E, KRNER R S. Carbon Allocation in Calcareous Grassland Under Elevated CO2:A Combined 13C Pulse-Labelling/Soil Physical Fractionation Study[J]. Functional Ecology, 2001, 15(1): 43-50. DOI:10.1046/j.1365-2435.2001.00485.x (  0) 0) |
| [14] |
LU Y, WATANABE A, KIMURA M. Carbon Dynamics of Rhizodeposits, Rootand Shoot-Residues in a Rice Soil[J]. Soil Biology & Biochemistry, 2003, 35(9): 1223-1230. (  0) 0) |
| [15] |
安婷婷, 汪景宽, 李双异, 等. 用13C脉冲标记方法研究施肥与地膜覆盖对玉米光合碳分配的影响[J]. 土壤学报, 2013, 50(5): 948-955. [ AN Ting-ting, WANG Jing-kuan, LI Shuang-yi, et al. Effect of Fertilization and Plastic Film Mulching on Distribution of Photosynthetically Fixed Carbon in Maize:Explored With 13C Pulse Labeling Technique[J]. Acta Pedologica Sinica, 2013, 50(5): 948-955.] (  0) 0) |
| [16] |
山楠, 杜连凤, 毕晓庆, 等. 用15N肥料标记法研究潮土中玉米氮肥的利用率与去向[J]. 植物营养与肥料学报, 2016, 22(4): 930-936. [ SHAN Nan, DU Lian-feng, BI Xiao-qiang, et al. Nitrogen Use Efficiency and Behavior Studied With 15N Labeled Fertilizer in Maize in Fluvo-Aquic Soils[J]. Plant Nutrition and Fertilizer Science, 2016, 22(4): 930-936.] (  0) 0) |
| [17] |
何敏毅, 孟凡乔, 史雅娟, 等. 用13C脉冲标记法研究玉米光合碳分配及其向地下的输入[J]. 环境科学, 2008, 29(2): 446-453. [ HE Min-yi, MENG Fan-qiao, SHI Ya-juan, et al. Estimating Photosynthesized Carbon Distribution and Inputs Into BelowGround in a Maize Soil Following 13C Pulse-Labeling[J]. Environmental Science, 2008, 29(2): 446-453. DOI:10.3321/j.issn:0250-3301.2008.02.029] (  0) 0) |
| [18] |
WAREMBOURG F R, ESTELRICH H D. Plant Phenology and Soil Fertility Effects on Below-Ground Carbon Allocation for an Annual (Bromus madritensis)and a Perennial (Bromus erectus) Grass Species[J]. Soil Biology and Biochemistry, 2001, 33(10): 1291-1303. DOI:10.1016/S0038-0717(01)00033-5 (  0) 0) |
| [19] |
WANG G, LIU F. Carbon Allocation of Chinese Pine Seedlings Along a Nitrogen Addition Gradient[J]. Forest Ecology and Management, 2014, 334: 114-121. DOI:10.1016/j.foreco.2014.09.004 (  0) 0) |
| [20] |
KUZYAKOV Y, DOMANSKI G. Carbon Input by Plants Into the Soil[J]. Journal of Plant Nutrition and Soil Science, 2015, 163(4): 421-431. (  0) 0) |
| [21] |
WERTH M, KUZYAKOV Y. Three-Source Partitioning of CO2 Efflux From Maize Field Soil by 13C Natural Abundance[J]. Journal of Plant Nutrition and Soil Science, 2009, 172(4): 487-499. DOI:10.1002/jpln.v172:4 (  0) 0) |
| [22] |
SPIVAK A C, REEVE J. Rapid Cycling of Recently Fixed Carbon in a Spartina alterniflora System:A Stable Isotope Tracer Experiment[J]. Biogeochemistry, 2015, 125(1): 97-114. DOI:10.1007/s10533-015-0115-2 (  0) 0) |
| [23] |
谭立敏, 吴昊, 李卉, 等. 不同施氮量下水稻分蘖期光合碳向土壤碳库的输入及其分配的量化研究:13C连续标记法[J]. 环境科学, 2014, 35(5): 1933-1938. [ TAN Li-min, WU Hao, LI Hui, et al. Input and Distribution of Rice Photosynthesized Carbon in the Tillering Stage Under Different Nitrogen Application Following Continuous 13C Labeling[J]. Environmental Science, 2014, 35(5): 1933-1938.] (  0) 0) |
| [24] |
GE T D, YUAN H Z, ZHU H H, et al. Biological Carbon Assimilation and Dynamics in a Flooded Rice-Soil System[J]. Soil Biology and Biochemistry, 2012, 48: 39-46. DOI:10.1016/j.soilbio.2012.01.009 (  0) 0) |
| [25] |
LU Y H, WATANABE A, KIMURA M. Input and Distribution of Photosynthesized Carbon in a Flooded Rice Soil[J]. Global Biogeochemical Cycles, 2002, 16(4): 32. DOI:10.1029/2002GB001864 (  0) 0) |
| [26] |
BUTLER J L, BOTTOMLEY P J, GRIFFITH S M, et al. Distribution and Turnover of Recently Fixed Photosynthate in Ryegrass Rhizospheres[J]. Soil Biology and Biochemistry, 2004, 36(2): 371-382. DOI:10.1016/j.soilbio.2003.10.011 (  0) 0) |
| [27] |
LAWLOR D W. Carbon and Nitrogen Assimilation in Relation to Yield:Mechanisms Are the Key to Understanding Production Systems[J]. Journal of Experimental Botany, 2002, 53(370): 773-787. DOI:10.1093/jxb/53.370.773 (  0) 0) |




