溶解有机质(DOM)是一类分子量分布范围宽泛、组成和结构复杂、物理不均匀的有机混合物, 主要来源于动植物残体生化分解过程[1], 其广泛分布于海洋、河流、湖沼及沉积物等水生生态系统, 总存量达万亿吨[2-3], 且是这些水生环境中最活跃的组分。在生态系统中, DOM不仅是全球碳循环和能量循环的重要纽带, 而且控制着水环境中重金属和有机污染物的存在形态、行为及生态毒性[4-6]。因此, DOM的水环境行为及其生态效应一直是环境地球化学研究领域的热点。
在水环境中, DOM通常表现出高度不确定的光化学行为及生态效应, 因而受到环境科学领域研究者的广泛关注[7-9]。研究表明, DOM受到光照后发生的一系列光化学变化不仅能为植物、微生物等生长提供营养物质, 如碳源、氮源和能量, 影响生命必需无机元素的锁定、转运及生物有效性等, 还能改变水体污染物组成、性质、归趋及生态毒性等, 以及改变水体透光性及水生生态系统结构和功能[10-11]。鉴于此, 笔者综述了近年来国内外针对环境水体DOM光化学行为及其效应的研究, 有助于深入了解DOM在环境水体中的行为和功能, 并探讨了该研究方向中今后应关注的一些科学问题。
1 水体中DOM的来源及组成特征自然条件下, 水体中DOM可被分为内源性和外源性物质两大类[12]。内源性DOM主要由水体中动物、植物和微生物代谢活动, 以及动植物残体生化分解过程产生, 包括羧酸、氨基酸、糖类、烃类和肽类物质等, 这类DOM是生命活动旺盛的水生生态系统DOM的主要组成部分; 而外源性DOM则是生命活动缓和或衰退的水生生态系统中DOM的主要组成部分, 通常是由地表径流、溪流和浅层地下水从陆生生态系统携带进入的顽拗性有机质[13]25-30。由此可见, 决定环境水体中这两类DOM相对丰度的因素较多, 如水动力学条件、气候条件、流域特征及水体营养状态等。通常情况下, 内陆水体DOM主要为外源性有机质, 而海洋水体DOM则以内源性物质为主。根据荧光特性的差异, 大多数研究者将环境水体DOM划分为类腐殖酸、类富里酸、高激发色氨酸、高激发酪氨酸、低激发色氨酸和低激发酪氨酸6类[14](图 1)。
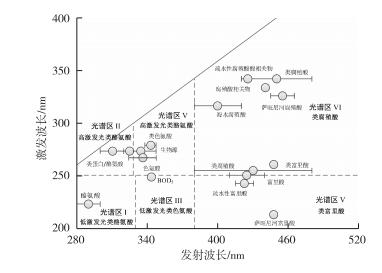
|
图 1 溶解性有机质荧光光谱归属分类 Fig. 1 Attribution of fluorescence spectrum for dissolved organic matter |
环境水体不同, 各类DOM组分含量不尽一致。湖泊、河流和海洋水体均含有上述6类DOM组分, 但河流和湖泊的主要补充源, 大气降水通常不含低激发氨基酸类物质[15-16]。因此, 湖泊和河流中这些物质主要是由地表径流携带进入。值得注意的是, 随着经济的快速发展, 人为活动不断加剧, 其排放的废水通常也包含上述6类组分, 并正成为湖泊和河流水体中DOM的重要来源[17]。
尽管不同水体DOM中的内源和外源性物质组成比例不尽一致, 但其由动植物残体经生物化学和地球化学作用形成的部分均远多于生物体活动释放的部分[13]25-30, 即溶解性腐殖质(溶解胡敏酸和富里酸)是水体DOM的重要组成部分。以碳含量计, 溶解性腐殖质分别占海洋、河流和湿地有机碳的20%、60%和70%[12]。从元素组成来看, 溶解性腐殖质含碳量高于生物体活动释放的DOM, 而后者氧含量则显著高于前者[18-20]。总体来讲, 碳和氧是构成DOM的主要元素, 两者含量可占DOM元素组成的80%左右。其中, 碳元素是DOM的骨架元素, 构成DOM分子的基本结构框架; 而氧元素则多以羟基、羧基和酮基等官能团存在, 仅较少部分构成DOM的杂环结构[21]。前期研究显示, 即使是水体中稳定的溶解腐殖质, 其结构组成也易被物理、化学和生物过程所改变, 如吸附-解吸、沉淀、氧化还原、络合和生物化学作用等。然而, 目前受表征技术限制, 人们对水体中不同来源DOM的了解仍然有限, 对其组成及结构特征方面的认识也较为匮乏。
2 环境水体中DOM的光学特性DOM含有大量羟基、羧基、羰基、醌基、甲氧基和苯环等活性结构, 是环境水体中重要吸光物质, 其对太阳光的吸收不仅影响环境水体透光层深度, 而且控制着该层水体中污染物的光化学行为[18, 22]。因此, 理解DOM吸光特性具有重要生态环境意义。然而, DOM吸光特性非常复杂, 不但受其自身来源和种类的影响, 而且受多种水环境因素制约。
2.1 DOM的紫外-可见吸光特性不同水体DOM的来源和组成各不相同, 但由于其结构中各活性官能团吸收光谱的相互重叠, 以及结构中电子供受体间的相互作用, 形成了相似的紫外-可见吸光特征。总体来讲, DOM对光的吸收能力随光波长增大呈指数模式减小, 整体呈现出宽而钝的吸收光谱[23], 不具有明显的特征吸收, 这与其他溶解性物质的紫外-可见吸光特性显著不同。DOM的紫外-可见吸光系数随光波长变化规律可用指数衰减模型进行有效表述, 计算公式为
| $ \alpha_{\lambda}=\alpha_{\lambda_{\mathrm{ref}}} \mathrm{e}^{-S\left(\lambda-\lambda_{\mathrm{ref}}\right)}。$ | (1) |
式(1)中,
尽管DOM对太阳光谱表现出无特征性吸收, 但其吸收光谱的一些特征参数仍能有效描述其结构和性质, 各吸收光谱特征参数及其指示意义见表 1[21, 24, 25]。其中, SUVA254常随DOM分子量增大和芳香类结构比例增加而增大, 例如陆源腐殖酸的分子量和芳香度比水生腐殖酸大, 也具有更大的SUVA254值。因此, SUVA254常被用来表述DOM的分子量和芳香度[21]。与此相似, 由吸收光谱计算获得的E2/E3、光谱斜率和光谱斜率比(SR)等特征指数也分别能有效地描述DOM的分子量、电子转移复合结构和光漂白特性等[24-25]。另外, 采用二阶紫外-可见吸收光谱(d2 a/d λ2-λ)也可对不同来源DOM的一些结构特征进行有效地描述[26]。
|
|
表 1 紫外-可见光谱特征指数计算方法及指示意义 Table 1 Calculation methods and significance of UV-vis spectra characteristic index |
在不同水环境条件下, DOM会呈现不同的分子形态, 表现出不同的紫外-可见吸光特性[27]。因此, 除自身结构和组成外, 水环境条件也是影响DOM紫外-可见吸光特性的重要因素。例如, 腐殖酸吸光度随pH增大而增大, 这是腐殖酸分子结构中苯环上的羟基和羧基发生解离, 电子离域过程导致的[28]; Fe3+能显著导致SUVA254值增大、E2/E3减小和SR减小等变化[29]。此外, 环境水体温度、离子强度等也能显著增强DOM的光吸收能力[30]。由此可见, 在分析DOM紫外-可见吸收光谱, 及描述其吸光特性时, 必须充分考虑DOM所处的水环境条件。否则, 分析结果将失去指示DOM结构及其生态环境功能的意义。
2.2 DOM的荧光特征在DOM中, 一部分有机质在受到光激发时会发射出荧光光谱, 具有特殊的荧光特性, 这部分有机质常被定义为荧光性DOM[31]。荧光性DOM的荧光量子产率常介于0.1%~2.0%之间, 且随DOM分子量增大而减小, 这主要是由分子间和分子内的荧光淬灭作用所引起的[32]。荧光光谱属于典型的指纹光谱, 能表征丰富的DOM组成和结构信息。
与纯净物不同, DOM荧光结构丰富且相互作用激烈, 这使得其荧光光谱宽而松散且最大发射波长常表现出红移现象[32-33]。因此, 研究者们常采用三维荧光光谱-平行因子法(EEM-PARAFAC)来分析DOM组成、结构、来源和性质[34-35]。STUBBINS等[35]采用EEM-PARAFAC和傅里叶变换离子回旋共振质谱相结合的手段分析出20余种不同来源和性质的DOM分子, 并建立了这些分子与PARAFAC组分间的相关关系。但值得注意的是, DOM荧光特性与水环境条件也密切相关, 不同水环境条件下, DOM会表现出不同的荧光特性。TIMKO等[36]发现, 随pH增大, DOM荧光发光强度增强, 且高pH条件下DOM荧光组分容易被光照所破坏; POULIN等[29]发现Fe3+淬灭DOM荧光发光强度的能力与Fe3+浓度、DOM组成和溶液pH条件等相关; 此外, PARKER等[37]还发现离子强度和卤素离子对激发三线态DOM(3DOM*)的行为及寿命均具有显著影响。因此, 在探究自然水体中DOM的荧光特性时也须充分考虑其所处的地化条件和水化条件。
3 DOM光化学反应及其机制水环境条件和DOM结构的复杂性共同决定了水生生态系统中DOM复杂的光学特性, 也决定了其光化学反应机制的复杂性。简单地讲, DOM的光化学反应可分为直接光降解和间接光降解两大类。
3.1 直接光降解虽然DOM中大部分组分难被生物所利用或降解, 但其分子中的大量发色团, 能够直接吸收光子, 形成不稳定的单线态(1DOM*)或3DOM*, 进而发生裂解、重排或解离等反应过程(图 2), 生成草酸、乙酸、甲酸和碳氧化合物等[38]小分子化合物。
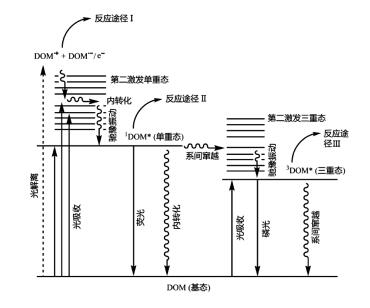
|
图 2 DOM光化学反应转化过程示意 Fig. 2 Schematic diagram for the photochemical transformation of DOM |
总体来讲, 这些光化学反应通常会引起DOM两类变化:一是光漂白, 即DOM中发色官能团吸收紫外-可见光后发生吸光度降低现象[39], 因此光漂白能增加太阳光有效水体辐射穿透深度, 影响环境水体的光学特性, 进而对浮游植物光合作用、微生物生产力和其他水生生化过程产生重要影响[10, 40]; 另一个是光矿化, 即DOM经光化学降解成无机小分子化合物, 如CO和CO2等, 从而影响碳循环周转速率及通量[41]。鉴于此, DOM光矿化机制受到了广泛关注。WHITE等[42]研究指出, DOM光矿化生成CO和CO2的过程与其自身来源、组成、结构和性质密切相关, 且产生这两种碳氧化物的机制截然不同。另外, 越来越多的研究表明, 光漂白过程在控制DOM环境行为及效应方面具有重要作用[10], 因此这是今后DOM光漂白研究的一个重要内容。
3.2 间接光化学转化太阳光照下, 除直接分解外, DOM还能发生多种间接光降解过程, 生成多种活性物质[37, 43](图 3)。通常情况下, DOM吸收光子后会生成1DOM*, 但若被吸收光子的能量足够高, DOM则会形成更高能级的活化态物种, 这些活化态DOM既能通过内转化和弛豫振动生成低能态DOM, 也能进一步发生解离或生成电子转移复合物DOM·+/·-[23, 44](图 2)。值得注意的是, 即使是低能态1DOM*, 其寿命也十分短暂, 会快速释放一个电子, 生成水合电子(
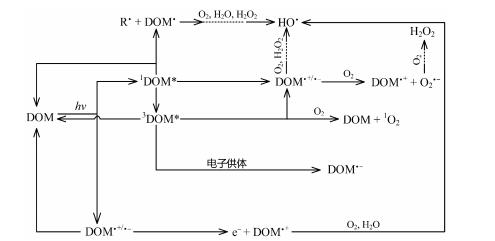
|
R·为烷基;DOM·为电子活化态DOM; 1DOM*为单线态物种; HO·为羟基自由基; O2·-为超氧离子; DOM·+/·-为电子转移复合物; 3DOM*为三线态物种。 图 3 DOM光化学反应产生活性物种的途径 Fig. 3 Pathways of reactive species generated by the photochemical reactions of DOM |
在天然水体中, DOM间接光解是HO·的一个重要来源, 生成HO·的稳态浓度常为10-18~10-16 mol·L-1[46], 这些HO·光化学生成过程大致可分为H2O2(光芬顿和H2O2解离)和非H2O2(低能态羟化物种和DOM激发态物种)两类[44]。与3DOM*生成1O2相比, 尽管HO·的生成途径较多, 但HO·产率仅为1O2产率的千分之一到百分之一[47]。相应地, 天然水体DOM光化学反应生成1O2的稳态浓度常为10-15~10-13 mol·L-1[48], 比HO·稳态浓度高3~5个数量级。因此, 3DOM*是1O2的重要前驱体, 而对HO·光生过程的直接贡献较小[49]。在活性物种时空分布研究方面, LATCH等[50]指出, 1O2在DOM疏水性微环境中的浓度常会比其在水相中浓度高2~3个数量级, 但HO·在DOM中的异质性分布情况至今鲜见报道。
环境水体组成复杂多变, DOM生成活性物种的过程不仅与自身理化性质相关, 而且受多种水环境因子的影响。在DOM光生活性物种稳态浓度与吸光特性关系的研究中, SHARPLESS等[51]发现1O2的稳态浓度及生成速率与DOM光谱特征参数SR和E2/E3呈正相关关系, HO·和H2O2的产率与E2/E3呈负相关关系。MOSTAFA等[52]发现DOM光生1O2产率与自身来源相关, DOM产生1O2组分主要来源于维管束植物残体的腐殖化过程, 这是因为该类有机质分子量大, 结构复杂且含有大量共轭体系。与此相似, DONG等[53]也发现DOM产生HO·的速率及稳态浓度与其分子量大小相关, 分子量越大的DOM越能产生HO·。除此之外, DOM腐殖化程度也会影响光生活性氧物种(ROS)的种类及稳态浓度, 随腐殖化程度增加, DOM产生1O2的能力增强[54]。由于1O2主要由O2与3DOM*反应产生, 因此溶解氧也是影响DOM溶液光生1O2量的重要因素。尽管光化学模拟实验显示, 1O2量子产率与DOM溶液pH呈一定负相关关系, 但这一关系在自然水体的研究中鲜有报道, 这主要与自然水体中DOM本身特性发挥的作用大于水体pH的影响相关[54]。综上, DOM光学特性、理化性质、来源和水体溶氧等条件均能显著影响其光生活性物种的速率和浓度。但值得注意的是, 自然水体组分复杂多样, 水体中活性物种的产生速率和稳态浓度并非只受上述环境因子影响。鉴于此, 探究DOM光生活性物种的时空分布及其受复合环境因子的影响, 是今后DOM间接光化学转化研究的重要内容之一。
4 DOM光化学过程的环境效应大多数有机污染物对抵达地表的日光吸收很少甚至不吸收, 因此直接光降解对水体中这些污染物的去除几乎无贡献。然而, 水体DOM的存在, 使得一些污染物可经光化学转化从水体中去除[55-60]。但是, DOM对污染物光化学转化的影响较为复杂, 其不仅与DOM自身来源和浓度密切相关, 也与其所处水环境条件相关。因此, DOM对有机污染物光降解过程也常表现出抑制效应, 如表 2[55-61]所示。
|
|
表 2 DOM对污染物光化学转化的效应 Table 2 Effects of DOM on the photochemical transformation of pollutants |
由DOM自身光化学行为可知, DOM光生活性物种是其促进水体有机污染物转化的主要原因。因此, 理解DOM加速有机污染物光降解机制的关键是理解光生活性物种与有机污染物间的作用过程。激发态DOM, 尤其是3DOM*是自然水体中重要的活性物种, 其主要经以下3种途径促进污染物转化:(1)直接将能量转移给污染物, 引发污染物转化, 如裂解、异构化等过程; (2)从污染物分子抽取氢原子, 引起污染物氧化降解; (3)从污染物分子芳香结构中抽取电子, 致使其氧化降解[62]。
在DOM光生活性物种中, 1O2是一种特殊的活性氧, 其基态为三线态氧分子。1O2主要是通过进攻有机污染物分子结构中的双键, 从而促使污染物转化和降解[63]。HO·是一种氧化还原电位较高的自由基, 其氧化电位高达2.8 V, 仅次于氟。因此, HO·能通过以下3种途径与大多数有机污染物发生反应:(1)加成到不饱和碳原子结构中, 如C=C、C≡C及芳香环等; (2)从饱和碳原子上抽取氢原子, 如—CH3、—CH2—等; (3)从芳香环、碳碳双键及羧酸盐或酯结构中抽取电子[61]。通常情况下, O2·-和H2O2在有机污染物转化中作用较弱, 但它们能在活性物种循环过程中充当电子湮灭剂或电子发生源[64], 这将影响DOM对有机污染物光化学转化的促进作用。值得注意的是, DOM经光化学反应产生的
DOM本身是一种复杂的混合物, 不仅含有光活性组分, 而且含有大量不具或只具有很弱吸光能力的惰性组分。这些光惰性组分是淬灭活性物种的主要部分[9], 从而抑制有机污染物光降解。除此之外, DOM的抗氧化功能也会影响有机污染物的氧化降解过程。QU等[67]研究发现黑暗条件下DOM能显著还原类固醇激素17α-群勃龙等的光氧化中间体至母体, 从而抑制其光化学降解(图 4)。与此同时, WENK等[57]也发现DOM能通过抗氧化功能抑制甲氧苄啶、磺胺甲唑及N, N-二甲基苯胺等有机污染物光降解。在此基础上, WENK等[68]还探究了O3氧化破坏DOM抗氧化结构对其抑制污染物光降解的影响, 从而证实了DOM还原有机污染物氧化中间体这一机制的存在性。
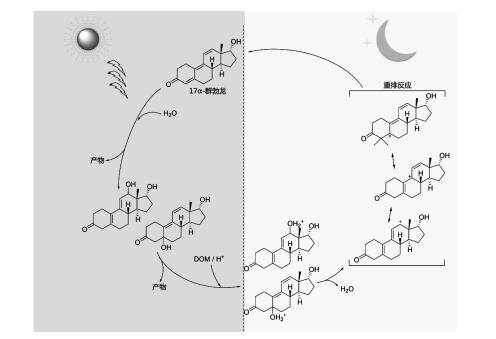
|
图 4 昼夜交替下17α-群勃龙在溶解有机质溶液中的氧化-还原变化过程 Fig. 4 Oxidation-reduction processes of 17α-trenbolone in DOM solutions under day-night cycling condition |
除经淬灭活性物种和还原氧化中间体途径抑制有机污染物光降解外, DOM还能经过滤入射光途径抑制有机污染物光降解。MACMANUS-SPENCER等[69]对自然水体中紫外防晒剂甲氧基肉桂酸乙基己酯光降解过程进行研究, 发现DOM抑制该污染物的主要机制是光过滤效应。事实上, 光过滤效应对有机污染物光降解的抑制效应存在于所有DOM参与的有机污染物光化学降解过程中[70]。然而, 对于不同光化学反应系统, DOM所表现出来的滤光效应强弱程度是不同的, 这一效应的强弱程度可采用光过滤校正手段来考察[28]。
4.3 影响水环境质量DOM是环境水体质量的控制性因素之一。一方面, DOM是构成水体色度和COD的重要因素; 另一方面, 在河流和湖泊水生态系统中, 超过90%的DOM会与颗粒态有机质发生动态转化, 从而改变水体浊度[71-72]。在自然光照条件下, DOM能发生快速光漂白过程[39], 水体色度和浊度会显著降低, 但由于DOM光矿化过程较缓慢, 水体COD变化并不明显[10]。随着DOM光化学转化程度加深, 烷基碳、烷氧基碳和含氮有机质会不断积淀[73], 而这些有机质会在微生物作用下进一步分解[74]。可见, DOM光化学过程可在一定程度上改善自然水体水质状况。值得注意的是, 在自然水体中Cl-、Br-、I-和一些天然矿物作用下, DOM会经光化学等非生物途径生成其他污染物, 如HOCl、HOBr、HOI、卤甲烷和氯乙酸等[75-77], 这无疑将给水质安全带来新的挑战。因此, 综合运用光谱、色谱、质谱等多种表征技术, 切入水环境因子, 全面深入地探究DOM光化学转化对水环境质量的影响是亟待解决的重要科学问题之一。
4.4 影响微生物的生理活性除溶解盐类外, DOM是另一类能显著影响MS2等微生物稳定性的物质[78]。在天然水体中, DOM能抑制MS2向矿物表面沉积[79], 这与WALSHE等[80]发现DOM能导致溶液中MS2具有更高运动速度与更低表观碰撞率相吻合。同时, ROSADO-LAUSELL等[81]研究也指出, DOM光化学转化过程能有效灭活MS2噬菌体等微生物, 这与其光生1O2和HO·过程显著相关。由于DOM物理不均匀性, DOM产生的活性物质通常也呈不均匀性分布, 这使得与DOM相结合的MS2等微生物会被优先灭活[82]。在天然水体中, DOM对MS2、轮状病毒等微生物活性的影响还受到多种水环境因子, 如pH、离子强度和温度等的影响[78, 83]。因此, 探究水化条件与DOM光化学过程交互作用对微生物活性的影响是今后研究中的焦点。
4.5 诱导金属纳米颗粒生成虽然DOM在黑暗条件下诱导银离子发生还原反应的过程较为缓慢, 但其在光照下能诱导银离子快速生成银纳米颗粒, 而这可能是环境水体中银纳米颗粒的重要天然来源[84-85]。近期研究指出, 光照下DOM生成的O2·-是其诱导银离子和金离子等快速还原生成纳米颗粒的主要原因, 这一过程与DOM结构特性、来源和水体溶氧条件等均密切相关[43]。尽管DOM是一种相对分子质量分布较宽的异质性混合物, 同一来源的不同相对分子质量DOM的表观还原作用差异甚大, 但不同相对分子质量DOM组分对银离子等的实际还原能力差异并不大[84-86]。这是由于与低相对分子质量DOM组分相比, 尽管高相对分子质量DOM组分含有更多的生色官能团, 但其也具有更强的光屏蔽作用和活性物质淬灭作用[86]。目前, 关于DOM光化学诱导金属纳米颗粒生成的研究主要集中于腐殖酸和富里酸, 其他类型DOM是否也具有类似功能仍不清楚。此外, DOM光化学反应过程中产生的其他还原性活性物种, 以及水体共存组分与DOM光化学过程相互作用对纳米颗粒生成过程的影响都值得深入探究。
5 结论与展望在自然水体中, DOM广泛存在, 其光化学生成的多种活性物种在调控污染物环境归趋与生态风险中起着重要作用。笔者综述了自然水体不同DOM的来源、组成特征和光化学性质, 水体DOM光化学生成活性物种过程及其受水化条件的影响, 以及DOM光化学转化过程的重要生态环境效应及其在污染物归趋中的作用。
DOM组成、结构和性质的复杂性, 决定了其与环境污染物作用机制的不确定性, 这也导致目前仍未能准确描述DOM组成、结构和性质等与其光化学活性间的关系, 以及未能有效地预测环境水体中活性物种的浓度和分布。从DOM的光化学行为及其环境效应研究现状来看, 尚有以下几方面需要加强:(1)拓宽DOM研究种类, 加强对非腐殖性DOM光化学行为及其环境效应的认识; (2)采用新型表征手段, 对DOM组成精细分类, 探究不同结构DOM与其光化学生成活性物种间的关系, 并建立相应的数学预测模型; (3)充分考虑不同水体的组成及性质差异, 采取室内模拟和实地实验相结合的手段, 探究环境水体基质影响DOM光化学行为及生态环境效应的机制。
| [1] |
LEENHEER J A, CROUÉ J P. Peer Reviewed:Characterizing Aquatic Dissolved Organic Matter[J]. Environmental Science and Technology, 2003, 37(1): 18A-26A. DOI:10.1021/es032333c (  0) 0) |
| [2] |
何伟, 白泽琳, 李一龙, 等. 水生生态系统中溶解性有机质表生行为与环境效应研究[J]. 中国科学:地球科学, 2016, 46(3): 341-355. (  0) 0) |
| [3] |
MASSICOTTE P, ASMALA E, STEDMON C, et al. Global Distribution of Dissolved Organic Matter Along the Aquatic Continuum:Across Rivers, Lakes and Oceans[J]. Science of the Total Environment, 2017, 609: 180-191. DOI:10.1016/j.scitotenv.2017.07.076 (  0) 0) |
| [4] |
REN Z L, TELLA M, BRAVIN M N, et al. Effect of Dissolved Organic Matter Composition on Metal Speciation in Soil Solutions[J]. Chemical Geology, 2015, 398: 61-69. DOI:10.1016/j.chemgeo.2015.01.020 (  0) 0) |
| [5] |
LUO H W, YIN X P, JUBB A M, et al. Photochemical Reactions Between Mercury (Hg)and Dissolved Organic Matter Decrease Hg Bioavailability and Methylation[J]. Environmental Pollution, 2017, 220(Part B): 1359-1365. (  0) 0) |
| [6] |
LIU X Y, CHEN W, QIAN C, et al. Interaction Between Dissolved Organic Matter and Long-Chain Ionic Liquids:A Microstructural and Spectroscopic Correlation Study[J]. Environmental Science & Technology, 2017, 51(9): 4812-4820. (  0) 0) |
| [7] |
TIMKO S A, ROMERA-CASTILLO C, JAFFÉ R, et al. Photo-Reactivity of Natural Dissolved Organic Matter From Fresh to Marine Waters in the Florida Everglades, USA[J]. Environmental Science:Processes and Impacts, 2014, 16(4): 866-878. DOI:10.1039/C3EM00591G (  0) 0) |
| [8] |
MCNEILL K, CANONICA S. Triplet State Dissolved Organic Matter in Aquatic Photochemistry:Reaction Mechanisms, Substrate Scope, and Photophysical Properties[J]. Environmental Science:Processes & Impacts, 2016, 18(11): 1381-1399. (  0) 0) |
| [9] |
JANSSEN E M, ERICKSON P R, MCNEILL K. Dual Roles of Dissolved Organic Matter as Sensitizer and Quencher in the Photooxidation of Tryptophan[J]. Environmental Science & Technology, 2014, 48(9): 4916-4924. (  0) 0) |
| [10] |
REN D, HUANG B, YANG B Q, et al. Photobleaching Alters the Photochemical and Biological Reactivity of Humic Acid Towards 17α-Ethynylestradiol[J]. Environmental Pollution, 2017, 220(Part B): 1386-1393. (  0) 0) |
| [11] |
CHU C H, ERICKSON P R, LUNDEEN R A, et al. Photochemical and Nonphotochemical Transformations of Cysteine With Dissolved Organic Matter[J]. Environmental Science & Technology, 2016, 50(12): 6363-6373. (  0) 0) |
| [12] |
吴丰昌, 王立英, 黎文, 等. 天然有机质及其在地表环境中的重要性[J]. 湖泊科学, 2008, 20(1): 1-12. [ WU Feng-chang, WANG Li-ying, LI Wen, et al. Natural Organic Matter and Its Significance in Terrestrial Surface Environment[J]. Journal of Lake Sciences, 2008, 20(1): 1-12. DOI:10.3321/j.issn:1003-5427.2008.01.001] (  0) 0) |
| [13] |
HESSEN D O, TRANVIK L. Aquatic Humic Substances:Ecology and Biogeochemistry[M]. Berlin, Germany: Springer-Verlag Berlin Heidelberg, 2010: 25-30.
(  0) 0) |
| [14] |
吕丽莎, 赵卫红, 苗辉. 三维荧光结合平行因子分析在东海溶解有机物研究中的应用[J]. 光谱学与光谱分析, 2013, 33(3): 653-658. [ LÜ Li-sha, ZHAO Wei-hong, MIAO Hui. Application of Excitation-Emission Matrix Spectrum Combined With Parallel Factor Analysis in Dissolved Organic Matter in East China Sea[J]. Spectroscopy and Spectral Analysis, 2013, 33(3): 653-658. DOI:10.3964/j.issn.1000-0593(2013)03-0653-06] (  0) 0) |
| [15] |
ZHAO C, WANG Z H, WANG C Y, et al. Photocatalytic Degradation of DOM in Urban Stormwater Runoff With TiO2 Nanoparticles Under UV Light Irradiation:EEM-PARAFAC Analysis and Influence of Co-Existing Inorganic Ions[J]. Environmental Pollution, 2018, 243(Part A): 177-188. (  0) 0) |
| [16] |
HUANG H P, CHOW C W K, JIN B. Characterisation of Dissolved Organic Matter in Stormwater Using High-Performance Size Exclusion Chromatography[J]. Journal of Environmental Sciences, 2016, 42: 236-245. DOI:10.1016/j.jes.2015.07.003 (  0) 0) |
| [17] |
戴春燕, 吴静, 向熙, 等. 工业废水为主的城市污水的荧光指纹特征[J]. 光谱学与光谱分析, 2013, 33(2): 414-417. [ DAI Chun-yan, WU Jing, XIANG Xi, et al. Fluorescence Properties of Municipal Wastewater With Industrial Wastewater as Major Components[J]. Spectroscopy and Spectral Analysis, 2013, 33(2): 414-417. DOI:10.3964/j.issn.1000-0593(2013)02-0414-04] (  0) 0) |
| [18] |
REN D, HUANG B, YANG B Q, et al. Mitigating 17α-Ethynylestradiol Water Contamination Through Binding and Photosensitization by Dissolved Humic Substances[J]. Journal of Hazardous Materials, 2017, 327: 197-205. DOI:10.1016/j.jhazmat.2016.12.054 (  0) 0) |
| [19] |
WANG B B, LIU X T, CHEN J M, et al. Composition and Functional Group Characterization of Extracellular Polymeric Substances (EPS)in Activated Sludge:The Impacts of Polymerization Degree of Proteinaceous Substrates[J]. Water Research, 2018, 129: 133-142. DOI:10.1016/j.watres.2017.11.008 (  0) 0) |
| [20] |
CHEN Z Q, LI M, WEN Q X, et al. Evolution of Molecular Weight and Fluorescence of Effluent Organic Matter (EfOM) During Oxidation Processes Revealed by Advanced Spectrographic and Chromatographic Tools[J]. Water Research, 2017, 124: 566-575. DOI:10.1016/j.watres.2017.08.006 (  0) 0) |
| [21] |
任东, 杨小霞, 马晓冬, 等. DOM结构特征及其对17β-雌二醇光降解的影响[J]. 中国环境科学, 2015, 35(5): 1375-1383. [ REN Dong, YANG Xiao-xia, MA Xiao-dong, et al. Structural Characteristics of DOM and Its Effects on the Photodegradation of 17β-Estradiol[J]. China Environmental Science, 2015, 35(5): 1375-1383. DOI:10.3969/j.issn.1000-6923.2015.05.012] (  0) 0) |
| [22] |
BATISTA A P S, TEIXEIRA A C S, COOPER W J, et al. Correlating the Chemical and Spectroscopic Characteristics of Natural Organic Matter With the Photodegradation of Sulfamerazine[J]. Water Research, 2016, 93: 20-29. DOI:10.1016/j.watres.2015.11.036 (  0) 0) |
| [23] |
SHARPLESS C M, BLOUGH N V. The Importance of Charge-Transfer Interactions in Determining Chromophoric Dissolved Organic Matter (CDOM)Optical and Photochemical Properties[J]. Environmental Science:Processes and Impacts, 2014, 16(4): 654-671. DOI:10.1039/C3EM00573A (  0) 0) |
| [24] |
MOSTAFA S N, ROSARIO-ORTIZ F L. Singlet Oxygen Formation From Wastewater Organic Matter[J]. Environmental Science and Technology, 2013, 47(15): 8179-8186. DOI:10.1021/es401814s (  0) 0) |
| [25] |
HELMS J R, STUBBINS A, RITCHIE J D, et al. Absorption Spectral Slopes and Slope Ratios as Indicators of Molecular Weight, Source, and Photobleaching of Chromophoric Dissolved Organic Matter[J]. Limnology and Oceanography, 2008, 53(3): 955-969. DOI:10.4319/lo.2008.53.3.0955 (  0) 0) |
| [26] |
BITTAR T B, STUBBINS A, VIEIRA A H, et al. Characterization and Photodegradation of Dissolved Organic Matter (DOM)From a Tropical Lake and Its Dominant Primary Producer, the Cyanobacteria Microcystis aeruginosa[J]. Marine Chemistry, 2015, 177(Part 2): 205-217. (  0) 0) |
| [27] |
CHEN C L, WANG X K, JIANG H, et al. Direct Observation of Macromolecular Structures of Humic Acid by AFM and SEM[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2007, 302(1/2/3): 121-125. (  0) 0) |
| [28] |
REN D, HUANG B, BI T, et al. Effects of pH and Dissolved Oxygen on the Photodegradation of 17α-Ethynylestradiol in Dissolved Humic Acid Solution[J]. Environmental Science:Processes and Impacts, 2016, 18(1): 78-86. DOI:10.1039/C5EM00502G (  0) 0) |
| [29] |
POULIN B A, RYAN J N, AIKEN G R. Effects of Iron on Optical Properties of Dissolved Organic Matter[J]. Environmental Science and Technology, 2014, 48(17): 10098-10106. DOI:10.1021/es502670r (  0) 0) |
| [30] |
GAO Y, YAN M Q, KORSHIN G V. Effects of Ionic Strength on the Chromophores of Dissolved Organic Matter[J]. Environmental Science & Technology, 2015, 49(10): 5905-5912. (  0) 0) |
| [31] |
HUR J, LEE B M, SHIN K H. Spectroscopic Characterization of Dissolved Organic Matter Isolates From Sediments and the Association With Phenanthrene Binding Affinity[J]. Chemosphere, 2014, 111: 450-457. DOI:10.1016/j.chemosphere.2014.04.018 (  0) 0) |
| [32] |
BOYLE E S, GUERRIERO N, THIALLET A, et al. Optical Properties of Humic Substances and CDOM:Relation to Structure[J]. Environmental Science and Technology, 2009, 43(7): 2262-2268. DOI:10.1021/es803264g (  0) 0) |
| [33] |
ANDREW A A, DEL VECCHIO R, SUBRAMANIAM A, et al. Chromophoric Dissolved Organic Matter (CDOM)in the Equatorial Atlantic Ocean:Optical Properties and Their Relation to CDOM Structure and Source[J]. Marine Chemistry, 2013, 148: 33-43. DOI:10.1016/j.marchem.2012.11.001 (  0) 0) |
| [34] |
ISHⅡ S K L, BOYER T H. Behavior of Reoccurring PARAFAC Components in Fluorescent Dissolved Organic Matter in Natural and Engineered Systems:A Critical Review[J]. Environmental Science and Technology, 2012, 46(4): 2006-2017. DOI:10.1021/es2043504 (  0) 0) |
| [35] |
STUBBINS A, LAPIERRE J F, BERGGREN M, et al. What's in an EEM? Molecular Signatures Associated With Dissolved Organic Fluorescence in Boreal Canada[J]. Environmental Science and Technology, 2014, 48(18): 10598-10606. DOI:10.1021/es502086e (  0) 0) |
| [36] |
TIMKO S A, GONSIOR M, COOPER W J. Influence of pH on Fluorescent Dissolved Organic Matter Photo-Degradation[J]. Water Research, 2015, 85: 266-274. DOI:10.1016/j.watres.2015.08.047 (  0) 0) |
| [37] |
PARKER K M, PIGNATELLO J J, MITCH W A. Influence of Ionic Strength on Triplet-State Natural Organic Matter Loss by Energy Transfer and Electron Transfer Pathways[J]. Environmental Science and Technology, 2013, 47(19): 10987-10994. DOI:10.1021/es401900j (  0) 0) |
| [38] |
GOLDSTONE J V, PULLIN M J, BERTILSSON S, et al. Reactions of Hydroxyl Radical With Humic Substances:Bleaching, Mineralization, and Production of Bioavailable Carbon Substrates[J]. Environmental Science and Technology, 2002, 36(3): 364-372. DOI:10.1021/es0109646 (  0) 0) |
| [39] |
HELMS J R, MAO J, STUBBINS A, et al. Loss of Optical and Molecular Indicators of Terrigenous Dissolved Organic Matter During Long-Term Photobleaching[J]. Aquatic Sciences, 2014, 76(3): 353-373. DOI:10.1007/s00027-014-0340-0 (  0) 0) |
| [40] |
HELMS J R, STUBBINS A, PERDUE E M, et al. Photochemical Bleaching of Oceanic Dissolved Organic Matter and Its Effect on Absorption Spectral Slope and Fluorescence[J]. Marine Chemistry, 2013, 155(4): 81-91. (  0) 0) |
| [41] |
CORY R M, CRUMP B C, DOBKOWSKI J A, et al. Surface Exposure to Sunlight Stimulates CO2 Release From Permafrost Soil Carbon in the Arctic[J]. Proceedings of the National Academy of Sciences, 2013, 110(9): 3429-3434. DOI:10.1073/pnas.1214104110 (  0) 0) |
| [42] |
WHITE E M, KIEBER D J, SHERRARD J, et al. Carbon Dioxide and Carbon Monoxide Photoproduction Quantum Yields in the Delaware Estuary[J]. Marine Chemistry, 2010, 118(1/2): 11-21. (  0) 0) |
| [43] |
YIN Y G, LIU J F, JIANG G B. Sunlight-Induced Reduction of Ionic Ag and Au to Metallic Nanoparticles by Dissolved Organic Matter[J]. ACS Nano, 2012, 6(9): 7910-7919. DOI:10.1021/nn302293r (  0) 0) |
| [44] |
MCKAY G, COUCH K D, MEZYK S P, et al. Investigation of the Coupled Effects of Molecular Weight and Charge-Transfer Interactions on the Optical and Photochemical Properties of Dissolved Organic Matter[J]. Environmental Science & Technology, 2016, 50(15): 8093-8102. (  0) 0) |
| [45] |
BODHIPAKSHA L C, SHARPLESS C M, CHIN Y P, et al. Triplet Photochemistry of Effluent and Natural Organic Matter in Whole Water and Isolates From Effluent-Receiving Rivers[J]. Environmental Science and Technology, 2015, 49(6): 3453-3463. DOI:10.1021/es505081w (  0) 0) |
| [46] |
VIONE D, MINELLA M, MAURINO V, et al. Indirect Photochemistry in Sunlit Surface Waters:Photoinduced Production of Reactive Transient Species[J]. Chemistry:A European Journal, 2014, 20(34): 10590-10606. DOI:10.1002/chem.v20.34 (  0) 0) |
| [47] |
VIONE D, BAGNUS D, MAURINO V, et al. Quantification of Singlet Oxygen and Hydroxyl Radicals Upon UV Irradiation of Surface Water[J]. Environmental Chemistry Letters, 2010, 8(2): 193-198. DOI:10.1007/s10311-009-0208-z (  0) 0) |
| [48] |
ZEPP R G, SCHLOTZHAUER P F, SINK R M. Photosensitized Transformations Involving Electronic Energy Transfer in Natural Waters:Role of Humic Substances[J]. Environmental Science and Technology, 1985, 19(1): 74-81. DOI:10.1021/es00131a008 (  0) 0) |
| [49] |
AL H F, VIONE D, CHIRON S, et al. Reactive Photoinduced Species in Estuarine Waters. Characterization of Hydroxyl Radical, Singlet Oxygen and Dissolved Organic Matter Triplet State in Natural Oxidation Processes[J]. Photochemical and Photobiological Sciences, 2010, 9(1): 78-86. DOI:10.1039/B9PP00030E (  0) 0) |
| [50] |
LATCH D E, MCNEILL K. Microheterogeneity of Singlet Oxygen Distributions in Irradiated Humic Acid Solutions[J]. Science, 2006, 311(5768): 1743-1747. DOI:10.1126/science.1121636 (  0) 0) |
| [51] |
SHARPLESS C M, AESCHBACHER M, PAGE S E, et al. Photooxidation-Induced Changes in Optical, Electrochemical, and Photochemical Properties of Humic Substances[J]. Environmental Science and Technology, 2014, 48(5): 2688-2696. DOI:10.1021/es403925g (  0) 0) |
| [52] |
MOSTAFA S, ROSARIO-ORTIZ F L. Singlet Oxygen Formation From Wastewater Organic Matter[J]. Environmental Science and Technology, 2013, 47(15): 8179-8186. DOI:10.1021/es401814s (  0) 0) |
| [53] |
DONG M M, ROSARIO-ORTIZ F. Photochemical Formation of Hydroxyl Radical From Effluent Organic Matter[J]. Environmental Science and Technology, 2013, 48(1): 3788-3794. (  0) 0) |
| [54] |
PETERSON B M, MCNALLY A M, CORY R M, et al. Spatial and Temporal Distribution of Singlet Oxygen in Lake Superior[J]. Environmental Science and Technology, 2012, 46(13): 7222-7229. DOI:10.1021/es301105e (  0) 0) |
| [55] |
LEECH D M, SNYDER M T, WETZEL R G. Natural Organic Matter and Sunlight Accelerate the Degradation of 17β-Estradiol in Water[J]. Science of the Total Environment, 2009, 407(6): 2087-2092. DOI:10.1016/j.scitotenv.2008.11.018 (  0) 0) |
| [56] |
VIONE D, FABBRI D, MINELLA M, et al. Effects of the Antioxidantt Moieties of Dissolved Organic Matter on Triplet-Sensitized Phototransformation Processes:Implications for the Photochemical Modeling of Sulfadiazine[J]. Water Research, 2018, 128: 38-48. DOI:10.1016/j.watres.2017.10.020 (  0) 0) |
| [57] |
WENK J, VON GUNTEN U, CANONICA S. Effect of Dissolved Organic Matter on the Transformation of Contaminants Induced by Excited Triplet States and the Hydroxyl Radical[J]. Environmental Science and Technology, 2011, 45(4): 1334-1340. DOI:10.1021/es102212t (  0) 0) |
| [58] |
QIAN Y, YIN X P, LIN H, et al. Why Dissolved Organic Matter Enhances Photodegradation of Methylmercury[J]. Environmental Science and Technology Letters, 2014, 1(10): 426-431. DOI:10.1021/ez500254z (  0) 0) |
| [59] |
XU H, COOPER W J, JUNG J, et al. Photosensitized Degradation of Amoxicillin in Natural Organic Matter Isolate Solutions[J]. Water Research, 2011, 45(2): 632-638. DOI:10.1016/j.watres.2010.08.024 (  0) 0) |
| [60] |
ZENG C, JI Y F, ZHOU L, et al. The Role of Dissolved Organic Matters in the Aquatic Photodegradation of Atenolol[J]. Journal of Hazardous Materials, 2012, 239/240: 340-347. DOI:10.1016/j.jhazmat.2012.09.005 (  0) 0) |
| [61] |
REN D, HUANG B, XIONG D, et al. Photodegradation of 17α-Ethynylestradiol in Dissolved Humic Substances Solution:Kinetics, Mechanism and Estrogenicity Variation[J]. Journal of Environmental Sciences, 2017, 54: 196-205. DOI:10.1016/j.jes.2016.03.002 (  0) 0) |
| [62] |
CANONICA S, HELLRUNG B, WIRZ J. Oxidation of Phenols by Triplet Aromatic Ketones in Aqueous Solution[J]. The Journal of Physical Chemistry A, 2000, 104(6): 1226-1232. DOI:10.1021/jp9930550 (  0) 0) |
| [63] |
HAAG W R, HOIGNE' J, GASSMAN E, et al. Singlet Oxygen in Surface Waters:Part Ⅰ:Furfuryl Alcohol as a Trapping Agent[J]. Chemosphere, 1984, 13(5/6): 631-640. (  0) 0) |
| [64] |
PETASNE R G, ZIKA R G. Fate of Superoxide in Coastal Sea Water[J]. Nature, 1987, 325(6104): 516-518. DOI:10.1038/325516a0 (  0) 0) |
| [65] |
ZEPP R G, BRAUN A M, HOIGNE J A, et al. Photoproduction of Hydrated Electrons From Natural Organic Solutes in Aquatic Environments[J]. Environmental Science and Technology, 1987, 21(5): 485-490. DOI:10.1021/es00159a010 (  0) 0) |
| [66] |
GREBEL J E, PIGNATELLO J J, MITCH W A. Effect of Halide Ions and Carbonates on Organic Contaminant Degradation by Hydroxyl Radical-Based Advanced Oxidation Processes in Saline Waters[J]. Environmental Science and Technology, 2010, 44(17): 6822-6828. DOI:10.1021/es1010225 (  0) 0) |
| [67] |
QU S, KOLODZIEJ E P, LONG S A, et al. Product-to-Parent Reversion of Trenbolone:Unrecognized Risks for Endocrine Disruption[J]. Science, 2013, 342(6156): 347-351. DOI:10.1126/science.1243192 (  0) 0) |
| [68] |
WENK J, AESCHBACHER M, SANDER M, et al. Photosensitizing and Inhibitory Effects of Ozonated Dissolved Organic Matter on Triplet-Induced Contaminant Transformation[J]. Environmental Science & Technology, 2015, 49(14): 8541-8549. (  0) 0) |
| [69] |
MACMANUS-SPENCER L A, TSE M L, KLEIN J L, et al. Aqueous Photolysis of the Organic Ultraviolet Filter Chemical Octyl Methoxycinnamate[J]. Environmental Science and Technology, 2011, 45(9): 3931-3937. DOI:10.1021/es103682a (  0) 0) |
| [70] |
SILVA C P, LIMA D L D, GROTH M B, et al. Effect of Natural Aquatic Humic Substances on the Photodegradation of Estrone[J]. Chemosphere, 2016, 145: 249-255. DOI:10.1016/j.chemosphere.2015.11.068 (  0) 0) |
| [71] |
VARELA M M, BODE A, GONZÁLEZ N, et al. Fate of Organic Matter in the Ría de Ferrol (Galicia, NW Spain):Uptake by Pelagic Bacteria vs. Particle Sedimentation[J]. Acta Oecologica, 2003, 24: S77-S86. DOI:10.1016/S1146-609X(03)00015-8 (  0) 0) |
| [72] |
ENGEL A, THOMS S, RIEBESELL U, et al. Polysaccharide Aggregation as a Potential Sink of Marine Dissolved Organic Carbon[J]. Nature, 2004, 428(6986): 929-932. DOI:10.1038/nature02453 (  0) 0) |
| [73] |
THORN K A, YOUNGER S J, COX L G. Order of Functionality Loss During Photodegradation of Aquatic Humic Substances[J]. Journal of Environmental Quality, 2010, 39(4): 1416-1428. DOI:10.2134/jeq2009.0408 (  0) 0) |
| [74] |
BUSHAW K L, ZEPP R G, TARR M A, et al. Photochemical Release of Biologically Available Nitrogen From Aquatic Dissolved Organic Matter[J]. Nature, 1996, 381(6581): 404-407. DOI:10.1038/381404a0 (  0) 0) |
| [75] |
ALLARD S, GALLARD H. Abiotic Formation of Methyl Iodide on Synthetic Birnessite:A Mechanistic Study[J]. Science of the Total Environment, 2013, 463/464: 169-175. DOI:10.1016/j.scitotenv.2013.05.079 (  0) 0) |
| [76] |
HAO Z N, YIN Y G, CAO D, et al. Probing and Comparing the Photobromination and Photoiodination of Dissolved Organic Matter by Using Ultra-High-Resolution Mass Spectrometry[J]. Environmental Science & Technology, 2017, 51(10): 5464-5472. (  0) 0) |
| [77] |
HAO Z N, WANG J, YIN Y G, et al. Abiotic Formation of Organoiodine Compounds by Manganese Dioxide Induced Iodination of Dissolved Organic Matter[J]. Environmental Pollution, 2018, 236: 672-679. DOI:10.1016/j.envpol.2018.02.001 (  0) 0) |
| [78] |
MYLON S E, RINCIOG C I, SCHMIDT N W, et al. Influence of Salts and Natural Organic Matter on the Stability of Bacteriophage MS2[J]. Langmuir, 2010, 26(2): 1035-1042. DOI:10.1021/la902290t (  0) 0) |
| [79] |
YUAN B, PHAM M, NGUYEN T H. Deposition Kinetics of Bacteriophage MS2 on a Silica Surface Coated With Natural Organic Matter in a Radial Stagnation Point Flow Cell[J]. Environmental Science and Technology, 2008, 42(20): 7628-7633. DOI:10.1021/es801003s (  0) 0) |
| [80] |
WALSHE G E, PANG L, FLURY M, et al. Effects of pH, Ionic Strength, Dissolved Organic Matter, and Flow Rate on the Co-Transport of MS2 Bacteriophages With Kaolinite in Gravel Aquifer Media[J]. Water Research, 2010, 44(4): 1255-1269. DOI:10.1016/j.watres.2009.11.034 (  0) 0) |
| [81] |
ROSADO-LAUSELL S L, WANG H, GUTIERREZ L, et al. Roles of Singlet Oxygen and Triplet Excited State of Dissolved Organic Matter Formed by Different Organic Matters in Bacteriophage MS2 Inactivation[J]. Water Research, 2013, 47(14): 4869-4879. DOI:10.1016/j.watres.2013.05.018 (  0) 0) |
| [82] |
KOHN T, GRANDBOIS M, MCNEILL K, et al. Association With Natural Organic Matter Enhances the Sunlight-Mediated Inactivation of MS2 Coliphage by Singlet Oxygen[J]. Environmental Science and Technology, 2007, 41(13): 4626-4632. DOI:10.1021/es070295h (  0) 0) |
| [83] |
ROMERO O, STRAUB A P, KOHN T, et al. Role of Temperature and Suwannee River Natural Organic Matter on Inactivation Kinetics of Rotavirus and Bacteriophage MS2 by Solar Irradiation[J]. Environmental Science and Technology, 2011, 45(24): 10385-10393. DOI:10.1021/es202067f (  0) 0) |
| [84] |
ADEGBOYEGA N F, SHARMA V K, SISKOVA K, et al. Interactions of Aqueous Ag+ With Fulvic Acids:Mechanisms of Silver Nanoparticle Formation and Investigation of Stability[J]. Environmental Science & Technology, 2013, 47(2): 757-64. DOI:10.1021/es302305f (  0) 0) |
| [85] |
AKAIGHE N, MACCUSPIE R I, NAVARRO D A, et al. Humic Acid-Induced Silver Nanoparticle Formation Under Environmentally Relevant Conditions[J]. Environmental Science and Technology, 2011, 45(9): 3895-3901. DOI:10.1021/es103946g (  0) 0) |
| [86] |
YIN Y Y, SHEN M, ZHOU X X, et al. Photoreduction and Stabilization Capability of Molecular Weight Fractionated Natural Organic Matter in Transformation of Silver Ion to Metallic Nanoparticle[J]. Environmental Science and Technology, 2014, 48(16): 9366-9373. DOI:10.1021/es502025e (  0) 0) |




