2. 上海海洋大学水产种质资源发掘与利用教育部重点实验室, 上海 201306;
3. 上海海洋大学水产科学国家级实验教学示范中心, 上海 201306
2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
附着藻类是水体中重要的初级生产者之一, 占有独特的生态位, 且其生物量、种类组成和群落结构均对水环境变化反应敏感, 在水生态系统中扮演着重要角色[1]。附着藻类常被用作评估和指示水生态系统富营养化和重金属污染程度等多种健康状况的重要指示类群[2-4]。有研究表明, 附着藻类对一些新型污染物也有良好指示作用, 如TANG等[5]利用附着藻类研究Fe2O3纳米颗粒的生态毒性响应机制。
目前, 国内外关于利用人工基质收集附着藻类评价不同水生态系统的研究已有较多报道[6-7], 但采集时间和频次均无统一标准, 采集时间常为2~7周, 频次为2~14 d·次-1[8-9]。早期有学者对附着藻类建群过程和采集时间进行研究并提出在群落发育成熟时采集样本更为科学[10]。我国水体类型众多, 附着藻类在不同生境条件下的建群过程也各不相同, 目前对于不同生境条件下附着藻类群落发育过程的研究还相对匮乏。
上海临港地区毗邻杭州湾, 是咸淡水交汇区域, 属于典型的河口区。河口生态系统物种多样性高, 环境因子多变, 物种与生境之间关系更复杂[11]。目前, 淡水生境中附着藻类的研究较多[12-13], 而关于河口型水体中附着藻类的研究鲜有报道[8], 且未见有关微咸水体附着藻类建群过程的研究。笔者于2015年冬季选取上海临港地区某河口型景观湖, 利用载玻片法探究附着藻类的建群过程和建群过程中附着藻类光合荧光参数变化趋势, 并研究附着藻类群落成熟时间, 以期为监测和评估河口型水体生态状况提供科学数据。
1 材料与方法 1.1 采样地点布设于2015年1月选择上海临港地区明湖(与滴水湖毗邻的1个景观湖)进行为期一个月的试验。明湖地理坐标为30°53′11.01″ N, 121°53′26.85″ E, 水体总面积为0.061 km2, 平均水深为3.20 m[14], 紧邻杭州湾, 属河口型小型景观水体, 水体流速较慢。
1.2 样品采集以70个载玻片(2.6 cm×7.6 cm)作为人工附着基质采集附着藻类, 将载玻片浸泡于酒精中24 h并用燃烧法去除其表面脂质成分[15]后, 垂直排列(10×7)于装有固定海绵的塑料框中[16], 悬挂于水深0.5 m处。设置3组平行, 每组每日随机选取2片载玻片放于原位水中带回实验室, 共持续30 d; 每隔5 d采集1次水样, 共采集7次。
1.3 物种鉴定与定量研究采用硬毛牙刷将1片载玻片表面附着藻类分别收集于3个容量为50 mL的血清瓶中, 滴加w为4%甲醛溶液4 mL和φ为15‰鲁哥氏碘液0.6 mL固定。物种鉴定方法参考文献[17], 附着藻类的定量计数在10×40倍OLMPUS CX21光学显微镜下进行, 计数前浓缩至一定体积后充分摇匀, 采用100 μL移液枪立即吸取0.1 mL藻样放入帕尔默计数框, 每次观察25个小格, 重复计数3次, 取平均值, 乘以4得到0.1 mL藻液中细胞个数, 根据浓缩体积得到总细胞个数后再除以载玻片双面面积计算得到细胞丰度[18]。
1.4 光合荧光参数的测定采用硬毛牙刷收集另1片载玻片表面附着藻类并制成100 mL藻液。取10 mL混匀藻样采用调制叶绿素荧光仪(Phyto-PAM, Walz)测定硅藻叶绿素a(Chl-a)浓度、光响应曲线线性区段斜率(a)、最大电子传递速率(RET,max)和半饱和光强(Ik)以及附着藻类PSⅡ最大光能转换效率(Fv/Fm)和PSⅡ实际光能转化效率〔d (Fv/Fm)〕。
1.5 水质参数的测定采用YSI多参数水质分析仪(美国)测定水温(T)、溶氧(DO)浓度、电导率(Spc)、盐度(Sal)、pH等指标; 采用钼锑抗分光光度法测定总磷(TP)、可溶性总磷(DTP)和活性磷(PO43--P)浓度; 采用过硫酸钾氧化紫外分光光度法测定总氮(TN)和可溶性总氮(DTN)浓度; 采用纳氏试剂分光光度法测定氨氮(NH4+-N)浓度; 采用碱性高锰酸钾法测定高锰酸盐指数(CODMn); 采用紫外分光光度法测定Chl-a浓度, 具体步骤参照《水和废水监测分析方法》[19]进行。
1.6 数据分析方法采用OriginPro 2017软件绘制折线图和柱状图, 采用PRIMER 6软件对附着藻类群落数据进行平方根转化, 并采用Bray-Curtis相似性系数进行聚类分析(CA)、非度量多维尺度(N-MDS)分析和相似性分析(ANOSIM)。
2 结果与分析 2.1 水体环境因子研究区水体营养盐指标和理化因子变化范围均不大。营养盐指标:ρ(TN)日均值为(1.67±0.09) mg·L-1, 变化范围为1.49~1.76 mg·L-1; ρ(DTN)日均值为(1.52±0.12) mg·L-1, 变化范围为1.30~1.63 mg·L-1; ρ(TP)日均值为(0.10±0.02) mg·L-1, 变化范围为0.08~0.12 mg·L-1; ρ(DTP)日均值为(0.04±0.01) mg·L-1, 变化范围为0.02~0.06 mg·L-1; ρ(PO43--P)日均值为(0.02±0.02) mg·L-1, 变化范围为0.002~0.049 mg·L-1; ρ(NH4+-N)日均值为(0.80±0.38) mg·L-1, 变化范围为0.33~1.30 mg·L-1。其他理化因子:ρ(CODMn)日均值为(12.55±1.96) mg·L-1, 变化范围为8.59~14.59 mg·L-1; ρ(Chl-a)日均值为(23.50±7.30) μg·L-1, 变化范围为11.12~33.27 μg·L-1; ρ(DO)日均值为(9.72±0.92) mg·L-1, 变化范围为8.76~11.33 mg·L-1; T日均值为(8.41±0.80) ℃, 变化范围为7.20~9.60 ℃; Spc日均值为(827.71±27.53) μS·cm-1, 变化范围为787.00~859.00 μS·cm-1; Sal日均值为(0.61±0.02)‰, 变化范围为0.58‰~0.63‰; pH值日均值为8.10±1.42, 变化范围为7.06~11.21。其中, ρ(TN)和ρ(CODMn)处于Ⅴ类水质, 符合一般景观水域要求。从盐度可知, 该水域属于河口型水体[20]; 从pH可知, 该水域水体呈中性偏碱性。
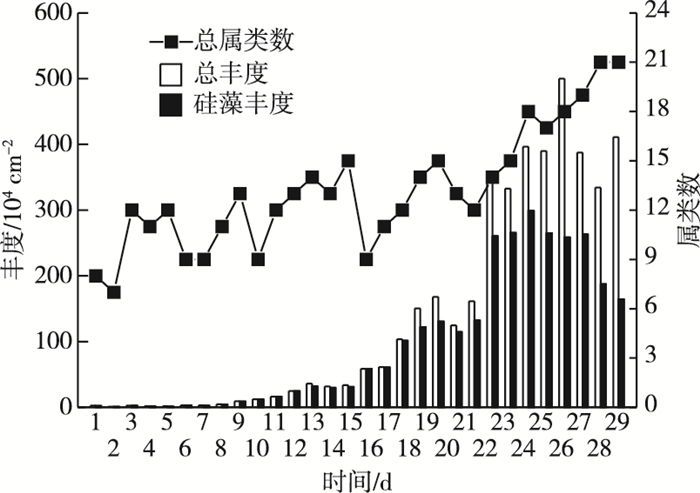
2.2 附着藻类丰度及属种类的日变化由图 1可知, 研究区水体附着藻类丰度为1.13×104~500.00×104 cm-2之间, 日平均丰度为137.04×104 cm-2, 于试验8 d时开始指数增长, 27 d时出现最高峰后下降。整个试验过程共鉴定出37属65种附着藻类, 分别隶属于绿藻门(Chlorophyta)、蓝藻门(Cyanophyta)、黄藻门(Xanthophyta)和硅藻门(Bacillariophyta)4个门,绿藻纲(Chlorophyceae)、蓝藻纲(Cyanophyceae)、黄藻纲(Xanthophyceae)、羽纹纲(Centriae)和中心纲(Pennatae)5个纲。优势类群硅藻丰度达1.13×104~299.05×104 cm-2, 日平均丰度为95.34×104 cm-2, 占总丰度的69.57%, 也于试验8 d时开始指数增长, 25 d时达最高峰后下降。属种类数随试验过程呈现上升趋势, 29~30 d时达最高峰, 为21种。
|
图 1 附着藻类的属类数和总丰度及硅藻丰度的日变化 Fig. 1 Daily variations of genus number and abundance of periphyton and abundance of Bacillariophyta |
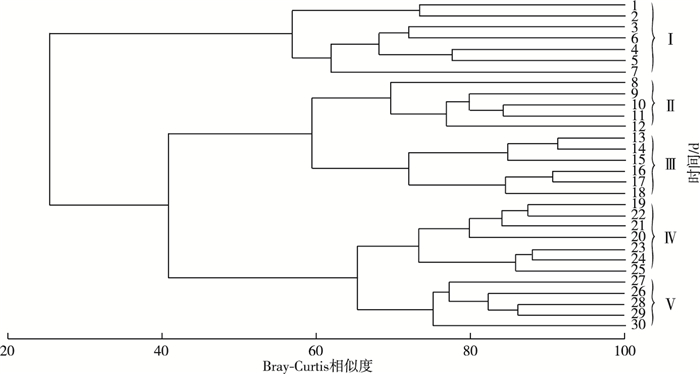
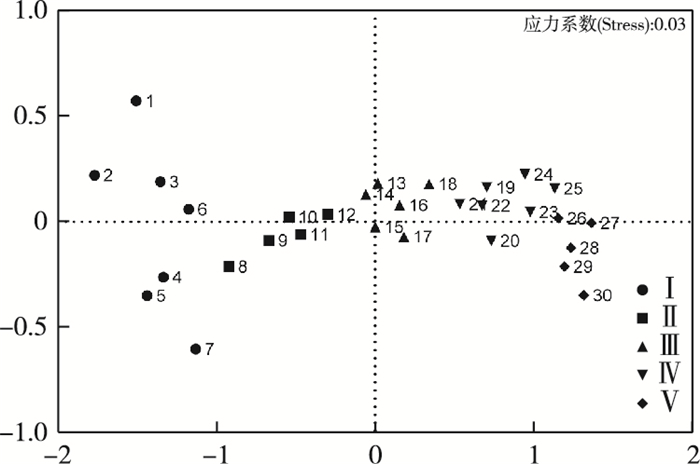
由CA结果(图 2)可知, 附着藻类建群过程可分为5个阶段:第Ⅰ阶段为试验开始后1~7 d; 第Ⅱ阶段为8~12 d; 第Ⅲ阶段为13~18 d; 第Ⅳ阶段为19~25 d; 第Ⅴ阶段为26~30 d。对5个阶段进行N-MDS(图 3)和ANOSIM分析发现, 5个阶段群落结构之间存在极显著差异(P < 0.001, r=0.879)。
|
图 2 附着藻类群落的聚类分析树状图 Fig. 2 Clustering dendrogram of the periphyton communities |
|
图 3 附着藻类群落的非度量多维尺度分析 Fig. 3 N-MDS of the periphyton communities |
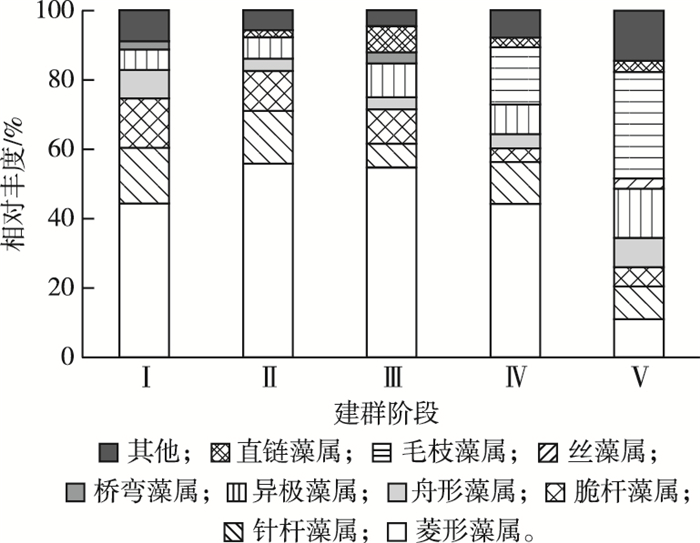
定义相对丰度大于2%为优势属。由图 4可知, 第Ⅰ阶段主要优势属为菱形藻属(Nitzschia)、针杆藻属(Synedra)和脆杆藻属(Fragilaria), 分别占该阶段总丰度的44.38%、16.11%和14.09%;第Ⅱ阶段菱形藻属占比为55.96%, 超过该阶段总丰度的50%, 其次为针杆藻属, 占比为15.12%;第Ⅲ阶段主要优势属为菱形藻属, 占比为54.73%;第Ⅳ阶段主要优势属为菱形藻属和毛枝藻属(Stigeoclonium), 分别占该阶段总丰度的44.30%和16.53%;第Ⅴ阶段主要优势属为异极藻属(Gomphonema)和毛枝藻属, 分别占该阶段总丰度的14.15%和30.60%。2015年冬季研究区附着藻类建群过程为菱形藻属、针杆藻属和脆杆藻属, 菱形藻属和针杆藻属, 菱形藻属, 菱形藻属和毛枝藻属, 以及异极藻属和毛枝藻属。
|
图 4 附着藻类各建群阶段优势属的相对丰度 Fig. 4 Relative abundance of dominant genus of periphyton in each stage of colonization |
对5种主要优势属丰度及相对丰度趋势进行分析, 并绘制Loess拟合曲线(Span取0.5)。由图 5可知, 5种藻类丰度在试验过程中均呈先缓慢上升达到成熟期后略有下降的趋势。菱形藻属在前4个阶段均占有绝对优势, 相对丰度为0.06~0.79;脆杆藻属相对丰度在第Ⅰ阶段后期达到高峰, 变化范围为0.02~0.23;针杆藻属相对丰度在试验7 d时达到高峰, 为0.51;毛枝藻属自第Ⅳ阶段开始附着后, 相对丰度持续上升, 在30 d时达到0.38;异极藻属相对丰度在28 d时达到高峰, 变化范围为0.02~0.17。
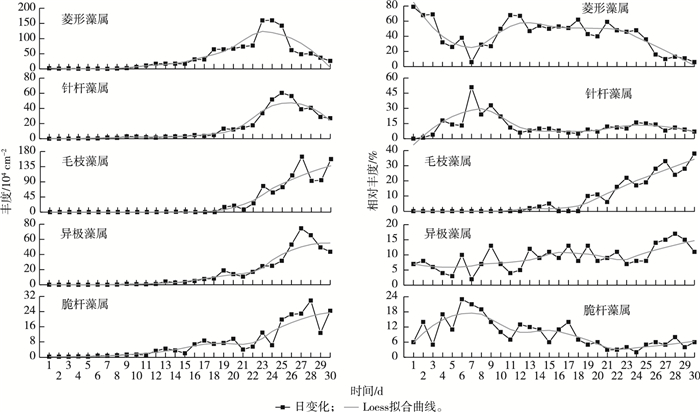
|
图 5 附着藻类主要优势属丰度及相对丰度的日变化 Fig. 5 Daily variations of density and relative abundance on main dominant genus of periphyton |
由图 6可知, 附着藻类Fv/Fm日变化趋势与附着藻类总丰度变化趋势相似性较高(P < 0.01), 第Ⅰ~Ⅱ阶段Fv/Fm呈指数增长趋势; 第Ⅲ~Ⅳ阶段Fv/Fm变化不大, 达到稳定期; 第Ⅴ阶段Fv/Fm有所下降。附着藻类d(Fv/Fm)以及硅藻a、ETRmax和Ik这4个参数均在第Ⅲ阶段达到顶峰, 第Ⅳ阶段开始下降; 硅藻Chl-a浓度在5个阶段均呈现上升趋势。
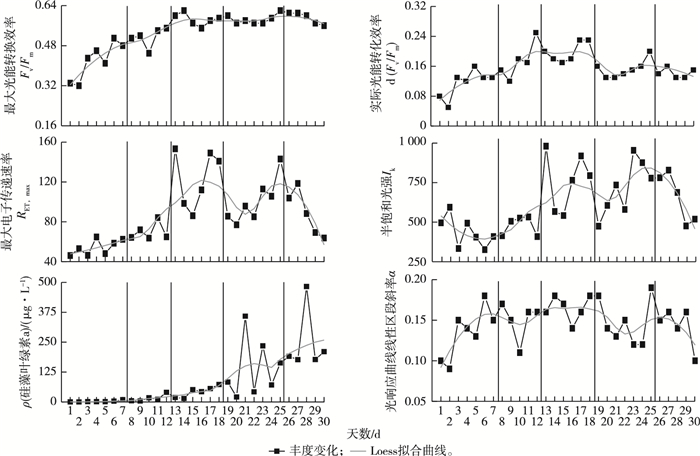
|
黑色实线表示附着藻类建群过程的5个阶段。 图 6 叶绿素荧光参数的日变化趋势 Fig. 6 Daily variations trend of chlorophyll fluorescence parameters |
附着藻类总丰度和硅藻丰度在整个试验过程中均呈现先上升后下降的趋势, 分别在27和25 d时达到最高峰。硅藻丰度占附着藻类总丰度的约70%, 这与DIJK[21]对荷兰Veluwe湖和韦丽丽等[22]对新疆伊犁河的研究结论一致。硅藻占绝对优势可能与其自身会产生胶质柄或硅质壳面,易附着于人工基质有关, 也可能是因为冬季温度较低, 喜温性的藻类停止生长, 而硅藻能在较低温度条件下大量繁殖[23]。
ERIKSSON等[24]在瑞典西海岸Kristineberg市鉴定出海洋附着藻类32个属, 主要为双眉藻属(Amphora)和菱形藻属等; 冯佳等[25]在汾河源头鉴定出附着藻类24个属, 主要优势属为绿藻门的刚毛藻属(Cladophora)、水绵属(Spirogyra)和丝藻属(Ulothrix)和硅藻门的直链藻属(Melosira)等。笔者鉴定出附着藻类4个门、37个属, 优势属为硅藻门的菱形藻属、针杆藻属、脆杆藻属、舟形藻属(Navicula)、异极藻属和直链藻属以及绿藻门的丝藻属和毛枝藻属, 多样性较高, 这可能是由于景观水体中尤其是河口型景观湖水生植物较多, 能够促进附着藻类生长[26], 且河口型水体拥有充足营养物质,更利于藻类繁殖。
3.2 附着藻类的建群过程及群落成熟时间根据文献[27-29]可知, 硅藻门的针杆藻属、异极藻属、菱形藻属和脆杆藻属均适合生存于低温、水浅、营养盐丰富的水体中, 其中菱形藻更适应偏碱性水体; 绿藻门的毛枝藻属具有耐低温的特性。研究区水体水质特性满足以上优势属生存条件, 使其更好地发育并建群成为优势属。菱形藻属为一类运动型硅藻, 在建群开始阶段便能通过水体流动或自身运动到载玻片上, 使其作为先锋物种更易定植于载玻片上, 且始终占据绝对优势, 直至第Ⅴ阶段出现丝状藻类(如毛枝藻属和丝藻属)后相对丰度才开始降低。脆杆藻属作为一种真性附着硅藻, 是以壳面着生于基质上的“面着生藻”, 常以群体出现, 喜着生在流水处的岩石、木头上, 因此丰度在第Ⅰ阶段时发育较快。针杆藻属也是一种非运动型“面着生藻”, 着生类型为放射状或扇状群体, 适宜生境与脆杆藻属类似, 相对丰度同样于前期快速增大。在前2个阶段, 附着硅藻群落仍处于发育初期, 未达到稳定。随着群落发育, 第Ⅳ阶段出现具有丝状特性的毛枝藻属, 其拥有较厚胶被, 常固着于水中物体上, 相对丰度在试验末期的第Ⅴ阶段仍处于上升趋势。异极藻属也是一种真性附着硅藻, 它是常以胶质柄着生于基质上的“具柄硅藻”, 因此其能够在发育后期成功竞争过其他物种[17]。笔者研究中附着藻类整体建群过程与HOAGLAND等[30]研究结果一致, 首先,水体中颗粒或溶解态有机物吸附于基质上, 为其他有机体吸附生长创造了条件; 随后,以面着生的硅藻开始吸附于基质上并开始生长; 最后,以点着生的直立短茎或长茎型硅藻以及丝状藻类开始出现。但易科浪等[9]发现的早期优势藻类为生活在空胶质管中的舟形藻, 这可能与水体生境不同有关。
在海水、淡水和半咸水水体中, 附着藻类建群过程不同, 成熟时间也有所不同, 如章宗涉等[3]认为图们江中附着藻类群落于2周后成熟, KREUZINGER-JANIK等[31]认为中营养湖泊中附着藻类成熟时间为6周, 谈冰畅等[32]认为实验室水族缸中培养附着藻类在30 d后成熟, 取出后可用于探究碳氮计量特征对铜锈环棱螺生长的影响。笔者研究发现附着藻类成熟期为27 d左右, 硅藻成熟期为25 d左右。因此, 河口型水体长期生态监测时为了获得成熟的附着藻类群落, 建议采集期为3.5~4周。
3.3 PSⅡ最大光能转换效率(Fv/Fm)的指示作用Fv/Fm表征最大量子产量, 反映植物潜在最大光合能力, 其对外界胁迫非常敏感, 常被用作衡量植物生理状态的重要参数[11]。由图 6可知, Fv/Fm与附着藻类总丰度在发育阶段的变化趋势相似性较高, 在第Ⅰ~Ⅱ阶段, Fv/Fm呈指数增长趋势, 表明此时附着藻类群落的叶绿素活性不断增强, 处于发育初期; 第Ⅲ~Ⅳ阶段Fv/Fm变化不大, 此时附着藻类叶绿素活性达到最大值并相对稳定, 且附着藻类总丰度也达到最高峰, 发育过程达到稳定期; 第Ⅴ阶段Fv/Fm有所下降, 表明此时附着藻类细胞开始衰老死亡, 导致活性下降。通过分析Fv/Fm变化趋势, 同样发现第Ⅳ阶段后期至第Ⅴ阶段前期细胞数量和活性均达到最高峰且保持稳定, 此期间采集附着藻类最佳。Fv/Fm可以作为表征附着藻类建群过程的一个重要参考指标。
4 结论(1) 2015年冬季研究区附着藻类建群过程为菱形藻属、针杆藻属和脆杆藻属, 菱形藻属和针杆藻属, 菱形藻属, 菱形藻属和毛枝藻属, 以及异极藻属和毛枝藻属。
(2) 挂片3.5~4周后, 附着藻类群落发育趋于成熟, 此时间段采样较佳。
(3) PSⅡ最大光能转换效率(Fv/Fm)具有表征附着藻类建群过程的潜在功能。
| [1] |
VERA M S, LAGOMARSINO L, SYLVESTER M, et al. New Evidences of Roundup® (Glyphosate Formulation) Impact on the Periphyton Community and the Water Quality of Freshwater Ecosystems[J]. Ecotoxicology, 2010, 19(4): 710-721. DOI:10.1007/s10646-009-0446-7 (  0) 0) |
| [2] |
陈重军, 韩志英, 朱荫湄, 等. 周丛藻类及其在水质净化中的应用[J]. 应用生态学报, 2009, 20(11): 2820-2826. [ CHEN Chong-jun, HAN Zhi-ying, ZHU Yin-mei, et al. Periphyton and Its Application in Water Purification[J]. Chinese Journal of Applied Ecology, 2009, 20(11): 2820-2826.] (  0) 0) |
| [3] |
章宗涉, 莫珠成, 戎克文, 等. 用藻类监测和评价图们江的水污染[J]. 水生生物学集刊, 1983, 8(1): 97-104. [ ZHANG Zong-she, MO Zhu-cheng, RONG Ke-wen, et al. Monitoring and Evaluation of Water Pollution in Tumen River by Means of Algae[J]. Acta Hydrobiologica Sinica, 1983, 8(1): 97-104.] (  0) 0) |
| [4] |
ŽIŽEK S, MILAČIČ R, KOVAČ N, et al. Periphyton as a Bioindicator of Mercury Pollution in a Temperate Torrential River Ecosystem[J]. Chemosphere, 2011, 85(5): 883-891. (  0) 0) |
| [5] |
TANG J, ZHU N Y, ZHU Y, et al. Responses of Periphyton to Fe2O3 Nanoparticles:A Physiological and Ecological Basis for Defending Nanotoxicity[J]. Environmental Science and Technology, 2017, 51(18): 10797-10805. DOI:10.1021/acs.est.7b02012 (  0) 0) |
| [6] |
ERIKSSON K M, JOHANSSON C H, FIHLMAN V, et al. Long-Term Effects of the Antibacterial Agent Triclosan on Marine Periphyton Communities[J]. Environmental Toxicology and Chemistry, 2015, 34(9): 2067-2077. DOI:10.1002/etc.v34.9 (  0) 0) |
| [7] |
徐肖莹.上海市河道附着藻类群落结构特征及其对水环境指示作用的研究[D].上海: 上海海洋大学, 2017. [XU Xiao-ying.Study on the Characters of Attached Algae Community Structure and Its Indication for Environment of Rivers in Shanghai[D].Shanghai: Shanghai Ocean University, 2017.] http://cdmd.cnki.com.cn/Article/CDMD-10264-1017854398.htm
(  0) 0) |
| [8] |
LAVIALE M, PRYGIEL J, LEMOINE Y, et al. Stream Periphyton Photoacclimation Response in Field Conditions:Effect of Community Development and Seasonal Changes[J]. Journal of Phycology, 2009, 45(5): 1072-1082. DOI:10.1111/jpy.2009.45.issue-5 (  0) 0) |
| [9] |
易科浪, 代志刚, 刘碧云, 等. 空间层次及人工基质对着生藻类建群特性的影响[J]. 生态学报, 2016, 36(15): 4864-4872. [ YI Ke-lang, DAI Zhi-gang, LIU Bi-yun, et al. Effects of Vertical Location and Artificial Substrate on Colonization of Algal Periphyton[J]. Acta Ecological Sinica, 2016, 36(15): 4864-4872.] (  0) 0) |
| [10] |
FERREIRA S, SEELIGER U. The Colonization Process of Algal Epiphytes on Ruppia-Maritima L[J]. Botanica Marina, 1985, 28(6): 245-249. (  0) 0) |
| [11] |
ALBERTO B, ENRICO B, MICHAEL E, et al. A Unifying Approach to Understanding Transitional Waters:Fundamental Properties Emerging From Ecotone Ecosystems[J]. Estuarine, Coastal and Shelf Science, 2013, 132: 5-16. DOI:10.1016/j.ecss.2012.04.012 (  0) 0) |
| [12] |
VADEBONCOEUR Y, LODGE D M, CARPENTER S R. Whole-Lake Fertilization Effects on Distribution of Primary Production Between Benthic and Pelagic Habitats[J]. Ecology, 2001, 82(4): 1065-1077. DOI:10.1890/0012-9658(2001)082[1065:WLFEOD]2.0.CO;2 (  0) 0) |
| [13] |
POULICKOVÁ A, HASLER P, LYSÁKOVÁ M, et al. The Ecology of Freshwater Epipelic Algae:An Update[J]. Phycologia, 2008, 47(5): 437-450. DOI:10.2216/07-59.1 (  0) 0) |
| [14] |
王丽卿, 郝瑞娟, 李雪琪, 等. 六种淡水纤毛虫形态学研究[J]. 水生生物学报, 2016, 40(2): 343-349. (  0) 0) |
| [15] |
吴晓敏, 郝瑞娟, 王丽卿, 等. 景观水体周丛生纤毛虫群落结构及其与环境因子的关系[J]. 生态学报, 2018, 38(15): 5541-5553. [ WU Xiao-min, HAO Rui-juan, WANG Li-qing, et al. Community Structure of Periphytic Ciliates in Scenic Water and Its Relationship With Environmental Factors[J]. Acta Ecologica Sinica, 2018, 38(15): 5541-5553.] (  0) 0) |
| [16] |
XU H L, MIN G S, CHOI J K, et al. An Approach to Analyses of Periphytic Ciliate Colonization for Monitoring Water Quality Using a Modified Artificial Substrate in Korean Coastal Waters[J]. Marine Pollution Bulletin, 2009, 58(9): 1278-1285. DOI:10.1016/j.marpolbul.2009.05.003 (  0) 0) |
| [17] |
胡鸿钧, 魏印心. 中国淡水藻类:系统、分类及生态[M]. 北京: 科学出版社, 2006: 1023. [ HU Hong-jun, WEI Yin-xin. The Freshwater Algae of China:System, Taxonomy and Ecology[M]. Beijing: Science Press, 2006: 1023.]
(  0) 0) |
| [18] |
ANISHCHENKO O V, GLADYSHEV M I, KRAVCHUK E S, et al. Seasonal Variations of Metal Concentrations in Periphyton and Taxonomic Composition of the Algal Community at a Yenisei River Littoral Site[J]. Central European Journal of Biology, 2010, 5(1): 125-134. (  0) 0) |
| [19] |
国家环境保护总局, 水和废水监测分析方法编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 200-284.
(  0) 0) |
| [20] |
张邦杰. 河口性鱼类在海岸池塘集约化养殖模式研讨(续一)[J]. 水产科技, 1995(1): 14-16. (  0) 0) |
| [21] |
DIJK G M V. Dynamics and Attenuation Characteristics of Periphyton Upon Artificial Substratum Under Various Light Conditions and Some Additional Observations on Periphyton Upon Potamogeton pectinatus L.[J]. Hydrobiologia, 1993, 252(2): 143-161. DOI:10.1007/BF00008152 (  0) 0) |
| [22] |
韦丽丽, 周琼, 谢从新, 等. 新疆伊犁河周丛藻类群落结构及其水质生物学评价[J]. 水生态学杂志, 2015, 36(6): 40-49. [ WEI Li-li, ZHOU Qiong, XIE Cong-xin, et al. Community Structure of Periphyton and Biological Assessment of Water Quality in the Yili River, Xinjiang Uyghur Autonomous Region[J]. Journal of Hydroecology, 2015, 36(6): 40-49.] (  0) 0) |
| [23] |
郑凌凌.汉江硅藻水华优势种生理生态学研究[D].福州: 福建师范大学, 2005. [ZHEN Ling-ling.The Physiological and Ecological Research About the Dominant Species in Han-Jiang River Diatom Bloom[D].Fuzhou: Fujian Normal University, 2005.] http://cdmd.cnki.com.cn/Article/CDMD-10394-2005124681.htm
(  0) 0) |
| [24] |
ERIKSSON K M, CLARKE A K, FRANZEN L G, et al. Community-Level Analysis of PsbA Gene Sequences and Irgarol Tolerance in Marine Periphyton[J]. Applied and Environmental Microbiology, 2009, 75(4): 897-906. DOI:10.1128/AEM.01830-08 (  0) 0) |
| [25] |
冯佳, 谢树莲. 汾河源头周丛藻类植物群落结构特征[J]. 生态科学, 2007, 26(5): 408-414. [ FENG Jia, XIE Shu-lian. Characteristerics of Periphyton Community in the Source of Fenhe River, North China[J]. Ecological Science, 2007, 26(5): 408-414. DOI:10.3969/j.issn.1008-8873.2007.05.004] (  0) 0) |
| [26] |
BRÖNMARK C. Interactions Between Epiphytes, Macrophytes and Freshwater Snails:A Review[J]. Journal of Molluscan Studies, 1989, 55(2): 299-311. DOI:10.1093/mollus/55.2.299 (  0) 0) |
| [27] |
郭季芳. 偏生毛枝藻的培养和生活史[J]. 植物学报, 1958, 11(2): 87-96. [ GUO Ji-fang. On the Laboratory Culture and Life History of Stigeoclonium subsecundum[J]. Acta Botanica Sinica, 1958, 11(2): 87-96.] (  0) 0) |
| [28] |
黄国佳, 李秋华, 陈椽, 等. 贵州高原三板溪水库浮游植物功能群时空分布特征[J]. 环境科学学报, 2015, 35(2): 418-428. [ HUANG Guo-jia, LI Qiu-hua, CHEN Chuan, et al. Phytoplankton Functional Groups and Their Spatial and Temporal Distribution Characteristics in Sanbanxi Reservoir, Guizhou Province[J]. Acta Scientiae Circumstantiae, 2015, 35(2): 418-428.] (  0) 0) |
| [29] |
REYNOLDS C S, HUSZAR V, KRUK C, et al. Towards a Functional Classification of the Freshwater Phytoplankton[J]. Journal of Plankton Research, 2002, 24(5): 417-428. DOI:10.1093/plankt/24.5.417 (  0) 0) |
| [30] |
HOAGLAND K D, ROEMER S C, ROSOWSKI J R. Colonization and Community Structure of Two Periphyton Assemblages, With Emphasis on the Diatoms (Bacillariophyceae)[J]. American Journal of Botany, 1982, 69(2): 188-213. DOI:10.1002/ajb2.1982.69.issue-2 (  0) 0) |
| [31] |
KREUZINGER-JANIK B, SCHROEDER F, MAJDI N, et al. Depth-Related Effects on a Meiofaunal Community Dwelling in the Periphyton of a Mesotrophic Lake[J]. PLoS One, 2015, 10(9): e0137793. DOI:10.1371/journal.pone.0137793 (  0) 0) |
| [32] |
谈冰畅, 蔡永久, 安苗, 等. 着生藻碳氮计量特征对铜锈环棱螺生长的影响[J]. 水生态学杂志, 2017, 38(1): 35-40. [ TAN Bing-chang, CAI Yong-jiu, AN Miao, et al. Effect of the Periphyton C:N Ratio on the Growth of Bellamya aeruginosa[J]. Journal of Hydroecology, 2017, 38(1): 35-40.] (  0) 0) |




