2. 国家环境保护生物安全重点实验室, 江苏 南京 210042
2. Key Laboratory on Biosafety of Environment Protection, Nanjing 210042, China
据2014年原环境保护部发布的《全国土壤污染状况调查公报》,全国土壤Cd污染严重,超标点位占7.0%。针对Cd污染土壤修复问题,近年来国内外开发了各不同的修复技术[1],其中超富集植物修复技术因其安全、廉价、无二次污染等优点,被业界视为最具发展潜力的土壤修复技术(尤其是针对重金属污染的农田土壤),并开展了一系列超富集植物的特性研究[2]。目前报道的Cd超富集植物至少有7科12种,包括景天科的东南景天(Sedum alfredii)[2]和伴矿景天(Sedum plumbizincicola)[3]、堇菜科的宝山堇菜(Viola baoshanensis)[4]、茄科的龙葵(Solanum nigrum)[5]、十字花科的圆锥南芥(Arabis paniculata)[6]、苋科的青葙(Celosia argentea)[7]等。现已发现的这些超富集植物生物量相对较小,如东南景天干重为400~700 mg·株-1[2],主要生长在我国东南部;圆锥南芥干重为50~70 mg·株-1[6],主要生长在云南省及贵州省。因此,针对一些生物量较大、自然分布范围较广、对Cd耐性和吸收能力都较好的潜在Cd超富集植物,开展其Cd吸收特性研究仍具有现实意义。
据一些研究报道,商陆(Phytolacca acinosa)和垂序商陆(Phytolacca americana)对Cd都具有超富集特性[8-9],且生物量较大,但垂序商陆的茎秆(1~2 m)通常高于商陆(0.5~1.5 m)。垂序商陆干重为2 500~23 000 mg·株-1,在我国大部分地区均有分布,能在Cd含量为65 mg·kg-1的污染土壤中正常生长[10],对Cd具有很强的主动吸收累积能力,茎叶Cd含量均可超过100 mg·kg-1,最高可达600 mg·kg-1[9]。此外,少量研究还初步探讨了垂序商陆对Cd的吸收机制[9]、组织分布[11]以及相关解毒机制等内容。在农田修复实践中,为了提高修复植物对重金属的富集效率,一些研究探讨了施用氮肥、磷肥、钾肥和有机肥等对部分修复植物吸收重金属的强化效果,结果表明施肥能影响土壤中重金属的生物有效性[12-13]。目前,国内外研究均发现Cd是磷肥中常见的杂质之一,施用磷肥会导致土壤中Cd含量增加[14],并且磷肥的主要作用是提高作物品质,仅在很高浓度的情况下会提高水稻产量。总体来看,目前国内外关于垂序商陆Cd富集特性的研究有限,特别是较少涉及其相关累积动力学参数的分析,施肥对垂序商陆吸收Cd的影响研究也鲜见报导。该研究主要有2个目的:一是利用温室盆栽实验较系统地研究垂序商陆对Cd的吸收特性,并计算分析其累积的动力学参数特征;二是初步探讨施用氮肥和钾肥对垂序商陆吸收Cd的影响,以期为垂序商陆在Cd污染农田的修复调控技术方面提供实验数据。
1 材料与方法 1.1 供试土壤与材料供试土壤取自江西省赣州市大余县某行政村水稻田,属于Cd污染土壤,0~20 cm土层Cd平均含量为0.814 mg·kg-1,其基本理化性质如下:pH值为5.76,有机质含量为31.5 g·kg-1,全氮含量为1.45 g·kg-1,有效磷含量为73.9 mg·kg-1,速效钾含量为62.4 mg·kg-1,阳离子交换量(CEC)为13.0 cmol·kg-1。供试土壤采集后于阴凉处风干,粉碎后过0.15 mm孔径筛备用。
垂序商陆种子购自深圳市龙岗区高凤园农资销售部,原产地为湖南省邵阳市邵东县(27.236° N,111.736° E),属亚热带湿润气候区,年降水量为1 300~1 400 mm。将垂序商陆种子洗净后放入φ=65%的浓硝酸中浸泡10 min,取出后用超纯水(Milli-Q,电阻率1.82×105 Ω·m)洗净,挑出颗粒饱满的种子,置于底部垫有湿润滤纸的培养皿中。将培养皿置于人工培养箱(I-36VL,Percival,美国)中,在温度25 ℃、湿度80%、t(光照):t(黑暗)=12 h:12 h、光合有效辐射80 μmol·m-2·s-1条件下培养20 d后,挑出芽高6~7 cm的垂序商陆幼苗备用。
1.2 盆栽实验实验共设置5个Cd含量处理组和10个施肥处理组,每个处理皆设置5个重复。Cd含量处理组:取过筛后的供试土壤2 kg与1 L Cd储备液(CdCl2,分析纯,国药集团化学试剂有限公司)充分混合,制备成Cd含量为0(对照)、5、10、20、50 mg·kg-1的备用土壤。将备用土壤放置在25 ℃温室中老化30 d,待盆栽用。
施肥处理组:取过筛后的供试土壤2 kg与1 L肥料储备液充分混合,制备成氮肥。硫酸铵〔(NH4)2SO4,分析纯,上海凌峰化学试剂有限公司〕和尿素(CH4N2O,分析纯,西陇科技股份公司)N含量梯度皆为100、200、400 mg·kg-1,分别记作N100、N200、N400、NN100、NN200、NN400;钾肥氯化钾(KCl,分析纯,上海凌峰化学试剂有限公司)K含量梯度为100、300、600 mg·kg-1,分别记作K100、K300、K600。施肥处理实验共设置1个对照组,不施用任何氮肥和钾肥。配制400 mg·kg-1的N相当于每1 hm2土壤施用4 908 kg (NH4)2SO4或2 229 kg CH4N2O。
盆土准备好后,将芽高较一致(6~7 cm)的垂序商陆幼苗分别移栽到不同Cd含量处理组和3种施肥处理组的塑料盆土中,每盆2颗幼苗,置于平均气温为(25±6) ℃的温室内,保持盆内土壤持水率在80%左右,培养90 d,每周移动塑料盆1次,保证盆内各植物均匀受到光照。
1.3 分析与测定植物样品:在15、30、60、90 d时分别取不同Cd含量处理组的垂序商陆4株,90 d时分别取不同施肥处理组的垂序商陆4株,所有植株用超纯水洗净后,将根和地上部剪开,分别放入烘箱中105 ℃杀青0.5 h,70 ℃烘干至恒重。根据EPA2001b方法,微波消解器(Mars 6,CEM,美国)消解样品,并用电感耦合等离子体质谱仪(ICP-MS,Thermofisher,美国)测定总Cd含量。同时消解空白与标准物质(GSB-6),标准物质回收率为95.3%,满足实验精度要求。
土壤样品:在垂序商陆幼苗种植前及收获后,取100 g土壤样品,晾干后粉碎。根据HJ 832—2017《土壤和沉积物金属元素总量的消解微波消解法》,取0.1 g土壤样品,加入φ=60%的浓硝酸后微波消解,采用ICP-MS测定其总Cd含量,采用0.01 mol·L-1 CaCl2提取法测定土壤中有效态Cd含量[15]。
1.4 垂序商陆对Cd的吸收速率以及动力学参数计算为进一步了解垂序商陆在暴露时间内对Cd的累积动力学特征,利用生物动力学模型计算垂序商陆在不同Cd含量下的吸收速率[16],并对吸收速率与Cd含量进行线性拟合,斜率即垂序商陆对Cd的吸收速率常数,其值只与目标物质以及垂序商陆本身性质相关[17],是最重要的累积动力学参数之一。在短时间暴露以及土壤中Cd含量变化不大的条件下,式(1)可用于植物对重金属的吸收动力学参数计算。
| $ {v_{{\rm{Cd}}}} = {k_{\rm{u}}} \times {w_{{\rm{Cd}}}}。$ | (1) |
式(1)中,vCd为垂序商陆对Cd的吸收速率,mg·kg1·d-1;ku为垂序商陆对Cd的吸收速率常数,d-1;wCd为土壤Cd含量,mg·kg-1。
1.5 统计与分析实验数据使用Microsoft Office软件进行数据整理,采用SPSS 24.0软件进行单因子方差分析(one-way ANOVA),选用Tukey检验,显著性水平设置为0.05,并用Origin 9.0软件绘图。
2 结果与分析 2.1 Cd对垂序商陆生长的影响Cd对垂序商陆生物量的影响如图 1所示。5~50 mg·kg-1的Cd暴露对垂序商陆的生长基本没有影响。仅高污染处理组(20和50 mg·kg-1)实验15 d时发现垂序商陆根部生物量显著高于对照组(P < 0.05),其余处理组中垂序商陆根部和地上部生物量与对照组均没有显著性差异(P>0.05)。
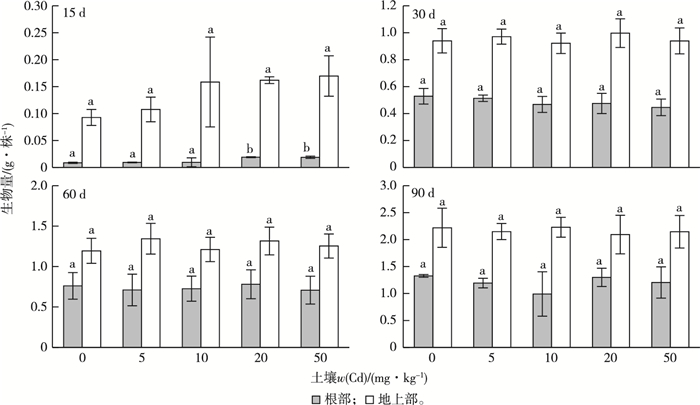
|
同一幅图中同一部位直方柱上方英文小写字母不同表示不同处理组间某部位生物量差异显著(P < 0.05)。 图 1 Cd暴露对垂序商陆生物量的影响 Fig. 1 Effects of Cd exposure on the biomass of Phytolacca americana |
不同Cd含量处理组土壤中垂序商陆根部和地上部Cd含量变化见图 2。暴露时间相同时,垂序商陆根部和地上部Cd含量随着土壤中Cd含量的增加而增加。实验15 d时,50 mg·kg-1处理组中垂序商陆根部和地上部Cd含量显著高于20 mg·kg-1处理组(P < 0.05)。在同一时间点的不同处理组中,垂序商陆地上部Cd含量均高于根部,且其转移系数(TF)≥1(表 1)。实验15 d时,20 mg·kg-1处理组垂序商陆地上部Cd含量为(126.4±9.5) mg·kg-1,30 d时20 mg·kg-1处理组、60 d时10 mg·kg-1处理组以及90 d时10 mg·kg-1处理组垂序商陆地上部Cd含量均大于100 mg·kg-1。垂序商陆具有较高的累积系数(BCF,4.51~10.37)和转移系数(TF,0.99~2.78)。随着暴露时间的延长,垂序商陆地上部Cd含量不断增加,其BCF和TF均呈上升趋势。垂序商陆BCF最大值(10.37)和TF最大值(2.78)分别出现在90 d时的10 mg·kg-1处理组和60 d时的10 mg·kg-1处理组。
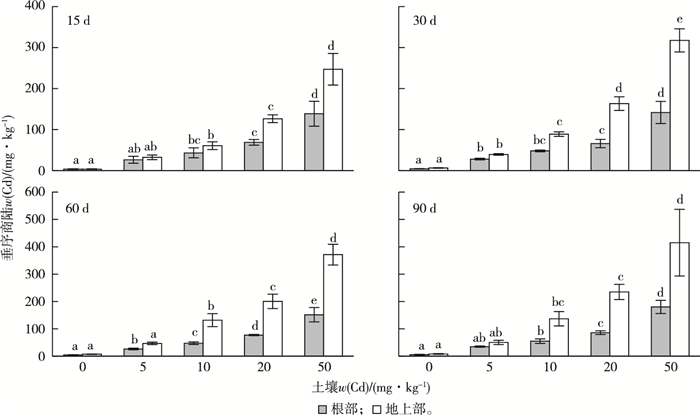
|
同一幅图中同一部位直方柱上方英文小写字母不同表示不同处理组间垂序商陆Cd含量差异显著(P < 0.05)。 图 2 不同Cd含量土壤中垂序商陆各部位Cd含量随时间变化 Fig. 2 The Cd uptake of Phytolacca americana exposed different Cd concentration in soils at different time points |
|
|
表 1 垂序商陆的累积系数(BCF)及转移系数(TF) Table 1 The bioconcentration factors and transport factors of Phytolacca americana |
由图 3可见,相同暴露浓度下,垂序商陆地上部Cd含量随着暴露时间的延长而增加(P < 0.05),但其根部Cd含量没有明显变化(P>0.05)。
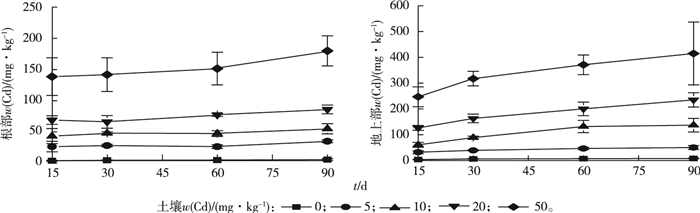
|
图 3 不同暴露时间垂序商陆根部和地上部Cd含量 Fig. 3 Cd concentration in roots and shoots of Phytolacca americana at different exposure days |
经过线性拟合(图 4和表 2)发现,15、30、60和90 d时垂序商陆对Cd的吸收速率与土壤中Cd含量具有显著线性相关性,R2均大于0.95,P值均小于0.01。吸收速率常数最大值出现在15 d时,为(0.35±0.02) d-1。随着暴露时间的延长,垂序商陆对Cd的吸收速率常数逐渐降低,30、60、90 d时分别为(0.21±0.01)、(0.11±0.01)和(0.09±0.01) d-1。通过方差分析可知,仅60和90 d时的吸收速率常数没有显著性差异(P>0.05),其余组间均存在显著性差异(P<0.05)。
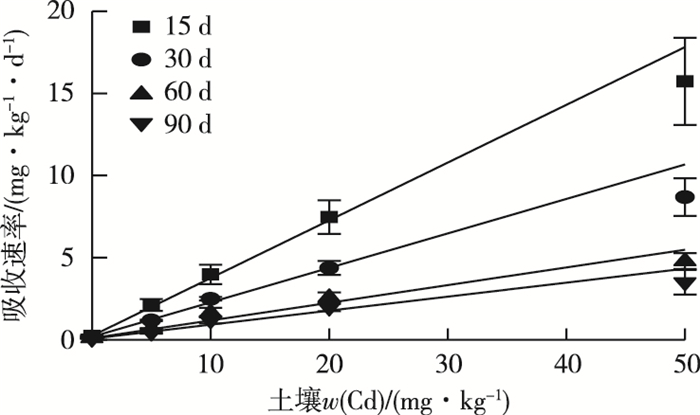
|
图 4 垂序商陆对Cd的吸收速率与土壤Cd含量的线性拟合图 Fig. 4 The fitting curve between Cd uptake rates of Phytolacca americana and Cd concentrations in soils |
|
|
表 2 不同时间垂序商陆对Cd的吸收速率与土壤Cd含量的线性拟合参数 Table 2 The results of fitting curves between Cd uptake rates of Phytolacca americana and Cd concentrations in soils at different time points |
就垂序商陆对Cd的累积量来看,暴露时间越长,暴露浓度越高,垂序商陆的Cd累积量越高(图 5)。从0~15、15~30、30~60、60~90 d这4个时段来看,15~30 d时段垂序商陆累积了最多的Cd。例如,50 mg·kg-1处理组中,15~30 d时垂序商陆Cd累积量为316.5 μg·株-1,分别占0~30、0~60和0~90 d累积量的89.8%、53.8%和30.5%,15~30 d的Cd累积速度为21.1 μg·d-1,远高于0~15、30~60和60~90 d的累积速度(3.0、7.3、16.0 μg·d-1)。
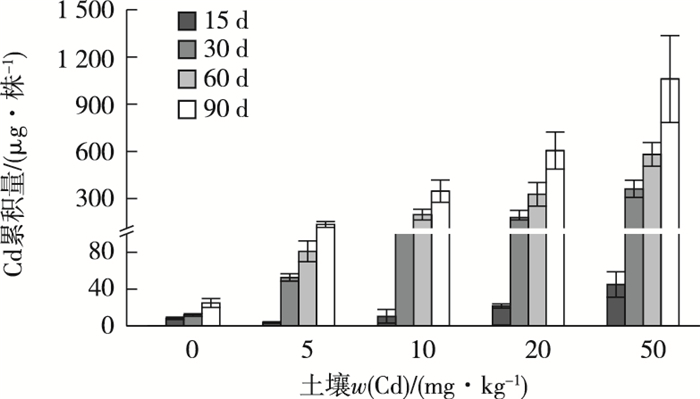
|
图 5 不同Cd含量土壤中垂序商陆对Cd的累积量 Fig. 5 Cd accumulation of Phytolacca americana after exposed to different Cd concentrations at different exposure days |
Cd含量处理组垂序商陆种植前和收获后土壤中有效态Cd占比如图 6所示。随着土壤中Cd含量从0增加到20 mg·kg-1,种植前土壤中有效态Cd比例呈上升趋势。种植前与收获后土壤中有效态Cd比例发生显著变化,收获后土壤中有效态Cd比例显著低于种植前(P < 0.05)。
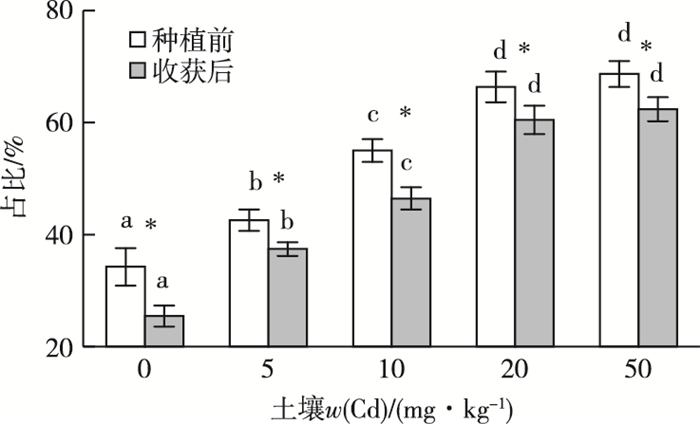
|
同一时期直方柱上方英文小写字母不同表示不同处理组之间土壤有效态Cd比例差异显著(P < 0.05);*表示同一处理组种植前和收获后土壤有效态Cd比例差异显著(P < 0.05)。 图 6 不同Cd含量处理组土壤有效态Cd比例 Fig. 6 The proportion of bioavailable Cd in soil after treated by different Cd concentrations |
不同施肥处理会影响土壤中有效态Cd的比例(图 7)。种植前在土壤中施入钾肥和氮肥均会导致土壤中有效态Cd比例增加,钾肥处理组有效态Cd比例高于氮肥处理组(P < 0.05)。而不同氮肥处理组中,(NH4)2SO4处理组土壤有效态Cd比例与CH4N2O处理组相似。各处理组垂序商陆种植前和收获后土壤中有效态Cd比例大多有显著变化(P < 0.05)。
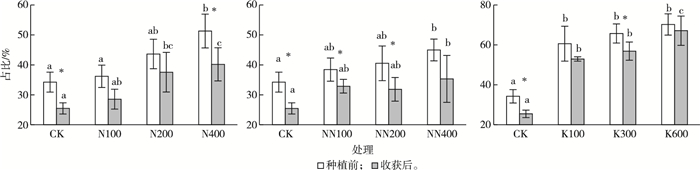
|
同一幅图中同一时期直方柱上方英文小写字母不同表示不同处理组之间土壤有效态Cd比例差异显著(P < 0.05);*表示同一处理组种植前和收获后土壤有效态Cd比例差异显著(P < 0.05)。CK为对照;N100、N200、N400表示施用(NH4)2SO4,N含量梯度分别为100、200、400 mg·kg-1;NN100、NN200、NN400表示施用CH4N2O,N含量梯度分别为100、200、400 mg·kg-1;K100、K300、K600表示施用KCl,K含量梯度分别为100、300、600 mg·kg-1。 图 7 不同施肥处理组土壤有效态Cd比例 Fig. 7 The proportion of bioavailable Cd in soil after treated by different fertilizations |
不同施肥处理会影响垂序商陆对Cd的吸收(图 8)。对于氮肥处理组,在较高N含量情况下(200和400 mg·kg-1),垂序商陆地上部Cd含量较对照组有明显增加。N200处理组垂序商陆地上部Cd含量为(17.8±2.0) mg·kg-1,约为对照组〔(7.1±0.9) mg·kg-1〕的2.5倍。不同氮肥形态对垂序商陆吸收Cd的影响不大。N400处理组垂序商陆地上部Cd含量为(20.1±3.0)mg·kg-1,高于NN400处理组的(17.2±2.5) mg·kg-1,但两者并没有显著性差异(P=0.186)。相比于对照,氮肥处理提高了垂序商陆对Cd的吸收量及其自身的生物量。N400和NN400处理组垂序商陆地上部Cd含量较对照分别增加183.6%和142.3%,生物量较对照分别增加165.3%和150.4%。
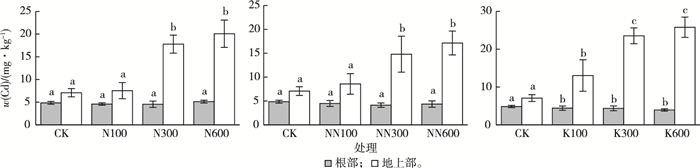
|
同一幅图中同一部位直方柱上方英文小写字母不同表示不同处理组之间某指标差异显著(P < 0.05)。CK为对照;N100、N200、N400表示施用(NH4)2SO4,N含量梯度分别为100、200、400 mg·kg-1;NN100、NN200、NN400表示施用CH4N2O,N含量梯度分别为100、200、400 mg·kg-1;K100、K300、K600表示施用KCl,K含量梯度分别为100、300、600 mg·kg-1。 图 8 不同施肥处理组垂序商陆根部和地上部Cd含量 Fig. 8 Cd concentrations in the tissues of Phytolacca americana after treated by different fertilizations |
对于钾肥处理组,随着钾肥施用量的增加,垂序商陆地上部Cd含量逐渐增加,并且高于对照组和氮肥处理组,但是其生物量却没有显著性变化。K600处理组垂序商陆地上部Cd含量较对照增加264.4%,但其生物量较对照仅增加1.4%。钾肥处理组的垂序商陆Cd累积量高于对照组(图 9),却小于氮肥处理组,如对照、N400、NN400和K600处理组的垂序商陆Cd累积量分别为12.5、72.1、54.5和29.4 μg·株-1。
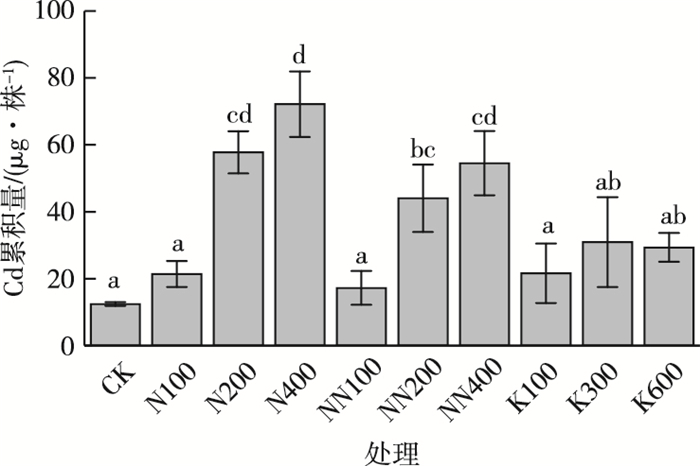
|
直方柱上方英文小写字母不同表示不同处理组之间Cd累积量差异显著(P < 0.05)。CK为对照;N100、N200、N400表示施用(NH4)2SO4,N含量梯度分别为100、200、400 mg·kg-1;NN100、NN200、NN400表示施用CH4N2O,N含量梯度分别为100、200、400 mg·kg-1;K100、K300、K600表示施用KCl,K含量梯度分别为100、300、600 mg·kg-1。 图 9 不同施肥处理组垂序商陆对Cd的累积量 Fig. 9 Cd accumulation in Phytolacca americana treated by different fertilizations |
垂序商陆对Cd的吸收量随着土壤中Cd含量的增加而增加。短时间、高含量的Cd暴露(如15 d的20和50 mg·kg-1处理组)会促进垂序商陆的生长[18],以应对Cd胁迫。在90 d的10、20、50 mg·kg-1处理组中,垂序商陆地上部Cd含量均超过100 mg·kg-1,且其TF均≥1,表明研究选用的垂序商陆对Cd具有较强的累积作用[11]。徐小逊等[8]、严明理等[10]以及笔者均在盆栽实验中发现垂序商陆的TF大于1,另外对于同属商陆的盆栽实验也发现其TF大于1。但是,LIU等[9]和FU等[11]则在水培实验中发现垂序商陆的地上部含量低于根部,即垂序商陆TF小于1。这可能是由于土培和水培实验条件存在差异所致。另外,不同的生态型植物也会出现TF不同的情况,XIONG等[19]发现景天(Sedum alfredii)的富集型TF大于1,而非富集型TF小于1。目前针对垂序商陆的TF是否大于1并无统一的结论,垂序商陆是否存在不同的生态型及其对TF的影响仍需进一步研究。在该研究设定的Cd含量范围内(5~50 mg·kg-1),垂序商陆的生物量均未因受到Cd的毒害而下降,说明其具有较高的Cd耐性,严明理等[10]发现垂序商陆在65 mg·kg-1Cd污染条件下能完成其正常的生长周期。垂序商陆对于Cd的耐受含量不仅与其所属的种有关[8-10],而且与土壤性质有关。在相同Cd污染程度的土壤中,低土壤pH值[20]、低土壤有机质含量[21]、低黏土矿物组分[22]均会增加土壤中有效态Cd含量,从而加剧Cd对垂序商陆的毒害,降低垂序商陆对Cd的耐性。
在90 d生长期内,垂序商陆组织内Cd含量呈逐步增加趋势。笔者研究发现,垂序商陆在15~30 d时累积了大量的Cd,0~30 d垂序商陆生物量增加了1.4 g(干重),是垂序商陆增重最快的时期,这说明在15~30 d时,处于快速生长期的垂序商陆对Cd能够起到较强的累积效果。在30~90 d,垂序商陆对Cd的吸收速率逐渐降低,吸收速率常数也有所下降。造成这种现象的原因可能是多方面的,首先,垂序商陆在暴露初期(0~30 d)吸收了较多的Cd,需要一个解毒的过程[23];其次,随着生长时间的延长,根系土壤中的有效态Cd含量开始降低,而根际周围土壤中的Cd又因迁移较为困难[24],不能及时对根际土壤Cd进行补充;最后,吸收速率常数与垂序商陆的生长周期相关,在垂序商陆生长的中后期(60~90 d),其生长速率逐渐变慢[25],对Cd的吸收开始减少。
以(NH4)2SO4和CH4N2O作为氮肥能够显著提高垂序商陆的生物量、地上部Cd含量以及其对Cd的累积量,并且其对垂序商陆地上部Cd含量的贡献大于对生物量的贡献。ZHU等[26]发现随着N水平的增加,积累性型与非积累型景天体内Cd含量均有所增加,并且相比于Ca(NO3)2和NH4NO3,(NH4)2SO4具有更好的促进效果。笔者实验结果表明,(NH4)2SO4与CH4N2O均能够提高土壤中有效态Cd含量,从而促进垂序商陆对Cd的吸收。(NH4)2SO4作为氮肥能够显著提高商陆的生物量,同时其作为一种酸性肥料能降低土壤pH值,从而增加土壤中有效态Cd比例[27-28]。当(NH4)2SO4进入土壤后,NH4+可以通过硝化作用使土壤pH值降低,而SO42-以及NH4+的硝化产物NO3-能够通过淋溶作用带走一部分盐基离子,使土壤进一步酸化[29]。CH4N2O作为一种酰胺态氮肥,其进入土壤后经过脲酶作用水解成碳酸铵或碳酸氢铵[30],随后NH4+通过硝化作用使土壤pH值降低。RODRÍGUEZ-ORTÍZ等[31]在土培条件下发现氮肥对烟草(Nicotiana tabacum)吸收Cd和Pb存在促进作用,在50 d的实验过程中,与CH4N2O相比,NH4NO3能进一步提高烟草地上部Cd和Pb含量。RODRÍGUEZ-ORTÍZ等[31]认为这可能是NH4+作为阳离子在土壤中发生了离子交换反应,从而增加了土壤溶液中Cd2+浓度。WANGSTRAND等[32]发现小麦、燕麦籽粒中Cd含量随着土壤中N水平的增加而增加,肥料中阳离子在土壤中的离子交换反应可能会导致土壤溶液中Cd2+浓度增加,最终导致小麦籽粒中Cd含量增加。但是,FLORIJN等[33]发现在水培条件下NH4+仍能促进莴苣(Lactuca saliva)对Cd的吸收,这说明NH4+不仅能影响土壤中的Cd,而且能影响植物本身的生理过程,从而促进植物对Cd的累积。但NH4+、土壤以及植物3者之间的内在作用机理仍需进一步研究。
以KCl作为钾肥能够提高垂序商陆地上部Cd含量,但是降低了垂序商陆的生物量,因此导致垂序商陆对Cd的累积量没有明显增加。ZHAO等[34]研究发现,随着土壤K水平的提高,小麦地上部Cd含量逐渐增加,在添加166 mg·kg-1的KCl处理组中,小麦地上部Cd含量从42.9 mg·kg-1(对照组)增加到74.6 mg·kg-1,但是其根部与地上部生物量分别减少19%和28%。K元素增强植物对Cd的吸收可能是由于K+与土壤中的Ca2+、Mg2+、Cd2+等阳离子发生交换,从而提高了土壤中有效态Cd含量[35]。但是,关于K+与Cd2+相互作用从而促进植物吸收Cd的内在机理仍需进一步的研究。MCLAUGHLIN等[36]认为Cl-会增加植物对Cd的吸收。一些研究发现当土壤中Cl-含量高于10 mmol·L-1时,Cd会从土壤固体迁移到土壤溶液中[37],使水溶态Cd浓度增加,从而提高Cd的流动性和生物有效性。KCl作为钾肥的主要作用是提高植物品质,对植物生物量的影响很小,而Cd流动性和生物有效性的增加会抑制植物生长,从而导致垂序商陆地上部Cd含量虽有所提高,但垂序商陆对Cd的累积量并未增加。
值得注意的是,无论是Cd含量处理组还是施肥处理组,垂序商陆收获后与种植前相比,土壤有效态Cd含量均存在下降的情况,这与之前的研究结果相似,植物对土壤中重金属的富集作用主要是通过吸收土壤中有效态重金属实现[38]。这表明通过施用氮肥降低土壤pH值或者施用钾肥增加土壤K+含量,从而进一步增加土壤有效态Cd含量,是提高垂序商陆对土壤中Cd累积量的有效措施。
4 结论(1) 对于Cd污染土壤,垂序商陆的最佳累积条件为10 mg·kg-1的土壤Cd含量和30 d的暴露时间。10 mg·kg-1处理组中垂序商陆表现出了最高的BCF(10.37)和TF(2.78),实验15~30 d时垂序商陆具有较高的累积速度(21.1 μg·d-1)。垂序商陆对Cd的吸收速率常数随着暴露时间的增加而逐渐降低,15、30、60、90 d时分别为(0.35±0.02)、(0.21±0.01)、(0.11±0.01)、(0.09±0.01) d-1。
(2) 硫酸铵和尿素作为氮肥能增加土壤中有效态Cd比例,并通过提高垂序商陆的生物量来增加其对Cd的累积量。钾肥能够提高垂序商陆地上部Cd含量,但会降低垂序商陆的生物量,从而导致其对Cd的累积量低于氮肥处理组。
| [1] |
VIRKUTYTE J, SILLANPÄÄ M, LATOSTENMAA P. Electrokinetic Soil Remediation:Critical Overview[J]. Science of the Total Environment, 2002, 289(1/2/3): 97-121. (  0) 0) |
| [2] |
YANG X E, LONG X X, YE H B, et al. Cadmium Tolerance and Hyperaccumulation in a New Zn-Hyperaccumulating Plant Species (Sedum alfredii Hance)[J]. Plant and Soil, 2004, 259(1/2): 181-189. DOI:10.1023/B:PLSO.0000020956.24027.f2 (  0) 0) |
| [3] |
CAO D, ZHANG H Z, WANG Y D, et al. Accumulation and Distribution Characteristics of Zinc and Cadmium in the Hyperaccumulator Plant Sedum Plumbizincicola[J]. Bulletin of Environmental Contamination and Toxicology, 2014, 93(2): 171-176. DOI:10.1007/s00128-014-1284-8 (  0) 0) |
| [4] |
刘威, 束文圣, 蓝崇钰. 宝山堇菜(Viola baoshanensis):一种新的镉超富集植物[J]. 科学通报, 2003, 48(19): 2046-2049. DOI:10.3321/j.issn:0023-074X.2003.19.009 (  0) 0) |
| [5] |
魏树和, 周启星, 王新, 等. 一种新发现的镉超积累植物龙葵(Solanum nigrum L.)[J]. 科学通报, 2004, 49(24): 2568-2573. DOI:10.3321/j.issn:0023-074X.2004.24.013 (  0) 0) |
| [6] |
QIU R L, ZHAO X, TANG Y T, et al. Antioxidative Response to Cd in a Newly Discovered Cadmium Hyperaccumulator, Arabis paniculata F[J]. Chemosphere, 2008, 74(1): 6-12. DOI:10.1016/j.chemosphere.2008.09.069 (  0) 0) |
| [7] |
姚诗音, 刘杰, 王怡璇, 等. 青葙对镉的超富集特征及累积动态研究[J]. 农业环境科学学报, 2017, 36(8): 1470-1476. [ YAO Shi-yin, LIU Jie, WANG Yi-xuan, et al. Cd Hyperaccumulation and Accumulative Kinetics of Celosia argentea Linn. for Phytoremediation of Cd-Contaminated Soil[J]. Journal of Agro-Environment Science, 2017, 36(8): 1470-1476.] (  0) 0) |
| [8] |
徐小逊, 张世熔, 解姗姗, 等. 垂序商陆对Cd胁迫的生长响应和富集特征研究[J]. 西南农业学报, 2012, 25(4): 1358-1362. [ XU Xiao-xun, ZHANG Shi-rong, XIE Shan-shan, et al. Effect of Cadmium Stress on Growth Response and Accumulation Characteristics of Phytolacca americana L.[J]. Southwest China Journal of Agricultural Sciences, 2012, 25(4): 1358-1362. DOI:10.3969/j.issn.1001-4829.2012.04.048] (  0) 0) |
| [9] |
LIU X Q, PENG K J, WANG A G, et al. Cadmium Accumulation and Distribution in Populations of Phytolacca americana L. and the Role of Transpiration[J]. Chemosphere, 2010, 78(9): 1136-1141. DOI:10.1016/j.chemosphere.2009.12.030 (  0) 0) |
| [10] |
严明理, 刘丽莉, 王海华, 等. 3种植物对红壤中镉的富集特性研究[J]. 农业环境科学学报, 2009, 28(1): 72-77. [ YAN Ming-li, LIU Li-li, WANG Hai-hua, et al. Accumulation Characteristics of Cadmium for Three Plants in Red Soil[J]. Journal of Agro-Environment Science, 2009, 28(1): 72-77. DOI:10.3321/j.issn:1672-2043.2009.01.014] (  0) 0) |
| [11] |
FU X P, DOU C M, CHEN Y X, et al. Subcellular Distribution and Chemical Forms of Cadmium in Phytolacca americana L.[J]. Journal of Hazardous Materials, 2011, 186(1): 103-107. DOI:10.1016/j.jhazmat.2010.10.122 (  0) 0) |
| [12] |
WEI S H, LI Y M, ZHOU Q X, et al. Effect of Fertilizer Amendments on Phytoremediation of Cd-Contaminated Soil by a Newly Discovered Hyperaccumulator Solanum nigrum L.[J]. Journal of Hazardous Materials, 2010, 176(1/2/3): 269-273. (  0) 0) |
| [13] |
WEI S H, ZHU J G, ZHOU Q X, et al. Fertilizer Amendment for Improving the Phytoextraction of Cadmium by a Hyperaccumulator Rorippa globosa (Turcz.) Thell[J]. Journal of Soils and Sediments, 2011, 11(6): 915-922. DOI:10.1007/s11368-011-0389-5 (  0) 0) |
| [14] |
PÉREZ A L, ANDERSON K A. DGT Estimates Cadmium Accumulation in Wheat and Potato From Phosphate Fertilizer Applications[J]. Science of the Total Environment, 2009, 407(18): 5096-5103. DOI:10.1016/j.scitotenv.2009.05.045 (  0) 0) |
| [15] |
PETERSEN G R. Methods of Soil Analysis Part 3[M]. Madison, USA: American Society of Agronomy, 1965: 50-55.
(  0) 0) |
| [16] |
LUOMA S N, STOIBER T, CROTEAU M N, et al. Effect of Cysteine and Humic Acids on Bioavailability of Ag From Ag Nanoparticles to a Freshwater Snail[J]. Nanoimpact, 2016, 2: 61-69. DOI:10.1016/j.impact.2016.06.006 (  0) 0) |
| [17] |
ZHANG W, YAO Y, SULLIVAN N, et al. Modeling the Primary Size Effects of Citrate-Coated Silver Nanoparticles on Their Ion Release Kinetics[J]. Environmental Science & Technology, 2011, 45(10): 4422-4428. (  0) 0) |
| [18] |
黄五星, 高境清, 黄宇, 等. 商陆对镉锌铜胁迫的生理响应与金属积累特性[J]. 环境科学与技术, 2010, 33(1): 77-79. [ HUANG Wu-xing, GAO Jing-qing, HUANG Yu, et al. Bioaccumulation and Physiological Response to Cadmium, Zinc and Copper Stress in Phytolacca Acinosa[J]. Environmental Science & Technology, 2010, 33(1): 77-79. DOI:10.3969/j.issn.1003-6504.2010.01.019] (  0) 0) |
| [19] |
XIONG Y H, YANG X E, YE Z Q, et al. Characteristics of Cadmium Uptake and Accumulation by Two Contrasting Ecotypes of Sedum alfredii Hance[J]. Journal of Environmental Science and Health(Part A:Toxic), 2004, 39(11/12): 2925-2940. (  0) 0) |
| [20] |
COLLINS R N, MERRINGTON G, MCLAUGHLIN M J, et al. Organic Ligand and pH Effects on Isotopically Exchangeable Cadmium in Polluted Soils[J]. Soil Science Society of America Journal, 2003, 67(1): 112-121. DOI:10.2136/sssaj2003.1120 (  0) 0) |
| [21] |
ERIKSSON J E. The Effects of Clay, Organic Matter and Time on Adsorption and Plant Uptake of Cadmium Added to the Soil[J]. Water Air & Soil Pollution, 1988, 40(3/4): 359-373. (  0) 0) |
| [22] |
AYULUNGIT I N, BALWANT S, EDITH M L. Cadmium Bioaccumulation in Proisotoma minuta in Relation to Bioavailability in Soils[J]. Ecotoxicology and Environmental Safety, 2009, 72(6): 1767-1773. DOI:10.1016/j.ecoenv.2009.05.009 (  0) 0) |
| [23] |
BROWN S L, CHANEY R L, ANGLE J S, et al. Zinc and Cadmium Uptake by Hyperaccumulator Thlaspi caerulescens and Metal Tolerant Silene vulgaris Grown on Sludge-Amended Soils[J]. Environmental Science & Technology, 1995, 29(6): 1581-1585. (  0) 0) |
| [24] |
SEUNTJENS P, MALLANTS D, ŠIMŮNEK J, et al. Sensitivity Analysis of Physical and Chemical Properties Affecting Field-Scale Cadmium Transport in a Heterogeneous Soil Profile[J]. Journal of Hydrology, 2002, 264(1/2/3/4): 185-200. (  0) 0) |
| [25] |
XUE S G, CHEN Y X, REEVES R D, et al. Manganese Uptake and Accumulation by the Hyperaccumulator Plant Phytolacca acinosa Roxb.(Phytolaccaceae)[J]. Environmental Pollution, 2004, 131(3): 393-399. DOI:10.1016/j.envpol.2004.03.011 (  0) 0) |
| [26] |
ZHU E, LIU D, LI J G, et al. Effect of Nitrogen Fertilizer on Growth and Cadmium Accumulation Insedum alfrediihance[J]. Journal of Plant Nutrition, 2010, 34(1): 115-126. (  0) 0) |
| [27] |
赵晶, 冯文强, 秦鱼生, 等. 不同氮磷钾肥对土壤pH和镉有效性的影响[J]. 土壤学报, 2010, 47(5): 953-961. [ ZHAO Jing, FENG Wen-qiang, QIN Yu-sheng, et al. Effects of Application of Nitrogen, Phosphorus and Potassium Fertilizers on Soil pH and Cadmium Availability[J]. Acta Pedologica Sinica, 2010, 47(5): 953-961.] (  0) 0) |
| [28] |
WANG Y H, AI S Y, LI M J, et al. Effect of Nitrogen Fertilization on Cadmium Translocation in Soil-Mustard System[J]. Chinese Journal of Eco-Agriculture, 2010, 18(3): 649-653. DOI:10.3724/SP.J.1011.2010.00649 (  0) 0) |
| [29] |
CHIENS H, GEARHART M M, COLLAMER D J. The Effect of Different Ammonical Nitrogen Sources on Soil Acidification[J]. Soil Science, 2008, 173(8): 544-551. DOI:10.1097/SS.0b013e31817d9d17 (  0) 0) |
| [30] |
SANZ-COBENA A, MISSELBROOK T H, ARCE A, et al. An Inhibitor of Urease Activity Effectively Reduces Ammonia Emissions From Soil Treated With Urea Under Mediterranean Conditions[J]. Agriculture, Ecosystems & Environment, 2008, 126(3/4): 243-249. (  0) 0) |
| [31] |
RODRÍGUEZ-ORTÍZ J C, VALDEZ-CEPEDA R D, LARA-MIRELES J L, et al. Soil Nitrogen Fertilization Effects on Phytoextraction of Cadmium and Lead by Tobacco (Nicotiana tabacum L.)[J]. Bioremediation Journal, 2006, 10(3): 105-114. DOI:10.1080/10889860600939815 (  0) 0) |
| [32] |
WANGSTRAND H, ERIKSSON J, OBORN I. Cadmium Concentration in Winter Wheat as Affected by Nitrogen Fertilization[J]. European Journal of Agronomy, 2007, 26(3): 209-214. DOI:10.1016/j.eja.2006.09.010 (  0) 0) |
| [33] |
FLORIJN P J, NELEMANS J A, VAN BEUSICHEM M L. The Influence of the Form of Nitrogen Nutrition on Uptake and Distribution of Cadmium in Lettuce Varieties[J]. Journal of Plant Nutrition, 1992, 15(11): 2405-2416. DOI:10.1080/01904169209364483 (  0) 0) |
| [34] |
ZHAO Z Q, ZHU Y G, LI H Y, et al. Effects of Forms and Rates of Potassium Fertilizers on Cadmium Uptake by Two Cultivars of Spring Wheat (Triticum aestivum L.)[J]. Environment International, 2004, 29(7): 973-978. DOI:10.1016/S0160-4120(03)00081-3 (  0) 0) |
| [35] |
GRANT C A, BAILEY L D, MCLAUGHLIN M J, et al.Management Factors Which Influence Cadmium Concentrations in Crops[M]//Cadmium in Soils and Plants.Dordrecht, Netherlands: Springer, 1999: 151-198.
(  0) 0) |
| [36] |
MCLAUGHLIN M J, MAIER N A, FREEMAN K, et al. Effect of Potassic and Phosphatic Fertilizer Type, Fertilizer Cd Concentration and Zinc Rate on Cadmium Uptake by Potatoes[J]. Fertilizer Research, 1995, 40(1): 63-70. DOI:10.1007/BF00749863 (  0) 0) |
| [37] |
NORVELL W A, WU J, HOPKINS D G, et al. Association of Cadmium in Durum Wheat Grain With Soil Chloride and Chelate-Extractable Soil Cadmium[J]. Soil Science Society of America Journal, 2000, 64(6): 2162-2168. DOI:10.2136/sssaj2000.6462162x (  0) 0) |
| [38] |
FITZ W J, WENZEL W W, ZHANG H, et al. Rhizosphere Characteristics of the Arsenic Hyperaccumulator Pteris vittata L. and Monitoring of Phytoremoval Efficiency[J]. Environmental Science & Technology, 2003, 37(21): 5008-5014. (  0) 0) |




