2. 中国科学院东北地理与农业生态研究所, 吉林 长春 130102;
3. 东北林业大学园林学院功能性草业技术工程中心, 黑龙江 哈尔滨 150040
2. Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Changchun 130102, China;
3. Technology Engineering Center of Functional Grass Industry, College of Landscape Architecture, Northeast Forestry University, Harbin 150040, China
植物在生长发育过程中需要应对不同的胁迫环境, 包括生物胁迫和非生物胁迫[1]。低温对植物生长发育和生产力具有重要的影响[2-3]。低温胁迫会造成植物水分流失[4]、光合能力减弱[5]、质膜通透性增大[6]、酶活性降低、大量活性氧(reactive oxygen species, ROS)和有毒物质产生[7], 最终可能导致植物死亡。
丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)可以与大部分陆生植物形成共生体系, 在自然界中广泛分布[8-9]。植物将光合作用产生的碳源传递给AMF, 为其菌丝生长和孢子发育提供碳骨架和能量, 以完成生活史。菌丝可以与植物根系形成庞大的根系-菌丝网络, 使植物从土壤中汲取更多的营养, 从而促进植物生长发育[10]。AMF还可以影响植物的生理代谢, 进而增强植物抵御生物和非生物胁迫的能力。
植物在其漫长的进化过程中, 产生了一系列保护机制以应对低温胁迫, 而与AMF共生是一种十分有效的应对低温胁迫策略[11-12]。AMF提高植物低温胁迫抗性的可能机制包括:提高根系导水率, 增强吸水能力[13]; 诱导超氧化物歧化酶(SOD)等抗氧化酶系统清除活性氧, 降低膜脂过氧化水平, 减轻膜损伤[14]; 增加可溶性糖和脯氨酸等物质含量, 调节渗透平衡[15]; 改变氮磷代谢, 提高植物利用营养元素的能力[16]; 减缓叶绿素分解, 促进光合作用[17](图 1)。AMF与植物形成的共生体正是通过这些生理生化变化以及相关分子机制的调控来达到增强抵御低温胁迫能力的目的。该研究主要从水分吸收、质膜通透性改变和ROS清除、碳水化合物合成与转化、氮磷吸收、次级代谢产物合成等方面进行归纳, 并对所涉及的基因和酶进行总结, 探讨AMF提高植物抵御低温胁迫能力的潜在生理和分子机制, 以期为相关研究提供参考。
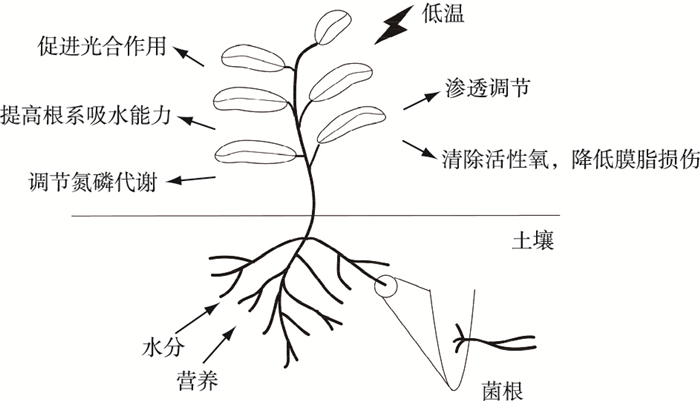
|
图 1 丛枝菌根共生提高植物抵御低温胁迫能力的机制 Fig. 1 The mechanism of arbuscular mycorrhizal symbiosis improving plant resistance to low temperature |
在植物生长周期中, 水分起着至关重要的作用, 低温胁迫会降低植物根系吸收水分的能力[18]。AMF可以通过提高植物根系导水率来提高其吸水能力, 以缓解胁迫所带来的危害[19-20], 在低温胁迫下接种AMF植株会比未接种AMF植株保持更高的相对含水量。AROCA等[21]发现低温胁迫造成未接种AMF菜豆(Phaseolus vulgaris)的根系导水率下降57%, 而接种AMF菜豆的根系导水率与常温相比基本不变。ZHU等[4]发现接种AMF玉米(Zea mays)和未接种AMF玉米的相对含水量都随温度下降而明显降低, 但低温胁迫下接种AMF玉米的相对含水量高于未接种AMF玉米。对接种AMF水稻(Oryza sativa)抵御低温胁迫的研究发现, 接种AMF水稻在低温与常温条件下相对含水量相同, 均显著高于低温胁迫下未接种AMF水稻[13]。AMF不仅可以促进农作物吸收水分的能力, 还可以促进林木的根系长度、根表面积和根体积, 从而增强林木的水分吸收能力[22]。
植物水通道蛋白(aquaporins, AQPs)是一个结构保守、成员众多的内在蛋白家族。AMF提高植物吸收水分的能力与水通道蛋白密切相关[23]。LIU等[13]发现常温情况下接种AMF水稻根系中水通道蛋白基因表达水平显著高于未接种AMF水稻, 包括OsPIP1; 1、OsPIP1; 3、OsPIP2; 1和OsPIP2; 5, 而低温胁迫会诱导接种AMF水稻的OsPIP1; 1、OsPIP1; 3、OsPIP2; 1和OsPIP2; 5的表达, 并且这些基因的表达水平高于未接种AMF水稻; 低温胁迫显著诱导AMF水通道蛋白GintAQPF1和GintAQPF2表达, GintAQPF2比GintAQPF1具有更高的转录水平, 表明AMF可以诱导植物根中PIP基因和AMF水通道蛋白GintAQPF基因的表达, 以达到提高植物在低温胁迫条件下吸收水分能力的目的。AROCA等[21]发现在低温胁迫下, 未接种AMF植株中的PIP2和磷酸化的PIP2蛋白丰度降低, 而接种AMF植株则保持恒定, 这说明AMF对根系水力特性的调节与PIP2状态的调节密切相关。因此, AMF在2个方面对低温胁迫产生应答以提高植物吸收水分的能力, 一是调节植物根中PIP基因的表达, 主要是PIP1和PIP2, 并改变AMF自身水通道蛋白基因的表达; 二是AMF使水通道蛋白产生可逆磷酸化以应答低温胁迫。因此相比于未接种AMF植物, 接种AMF植物有更好的应对低温胁迫的水分策略。
2 质膜通透性改变以及ROS清除质膜(plasma membrane, PM)对温度胁迫敏感, 易受到低温胁迫伤害。植物在低温胁迫下产生大量ROS, 引起植物ROS清除系统失衡, 造成膜脂过氧化, 影响营养物质转移, 并且导致膜透性增大, 从而使电解质有不同程度的外渗[6]。
AMF可以通过提高抗氧化酶活性以加强低温胁迫下宿主植物的ROS清除能力。研究发现, 接种AMF可以增强低温胁迫下大麦(Hordeum vulgare)的SOD、过氧化氢酶(CAT)和过氧化物酶(POD)活性[24]。对枳(Poncirus trifoliata)的试验表明, 低温胁迫下接种AMF枳根系具有更高的SOD和CAT活性[25]。刘爱荣等[26]研究了低温胁迫下接种AMF黄瓜(Cucumis sativus)抗氧化酶活性以及抗氧化酶基因表达, 发现常温下接种AMF可以提高黄瓜幼苗叶片SOD、POD、CAT和抗坏血酸过氧化物酶(APX)活性, 比未接种AMF黄瓜幼苗叶片分别增加21.47%、23.16%、38.29%和20.62%。低温条件下, 接种AMF黄瓜幼苗叶片SOD、POD、CAT和APX活性比未接种AMF分别增加10.59%、20.78%、19.31%和20.44%。另外, AMF可以促进黄瓜叶片中SOD、G-POD、CAT和APX基因的表达, 常温条件下, 接种AMF黄瓜叶片分别比未接种AMF增加1.35、1.44、1.70、2.46倍; 低温胁迫下接种AMF黄瓜叶片SOD、G-POD、CAT和APX基因表达量分别比未接种AMF黄瓜增加1.68、1.37、1.52、1.83倍。由此可见, AMF通过增加抗氧化酶基因的表达来提高植物清除ROS的能力。早期研究还发现抗氧化酶基因SOD、APX过量表达可以提高光能的利用率, 减轻冷胁迫条件下对光系统的抑制[27]。AMF不仅可以通过提高植物抗氧化酶活性和诱导抗氧化酶基因表达来清除ROS的积累, 还可以通过抑制还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶活性来减少低温胁迫造成的过氧化氢(H2O2)积累, 从而减少ROS产生。LIU等[28]发现低温胁迫下NADPH氧化酶活性提高, 诱导黄瓜产生H2O2, 接种AMF的黄瓜根系中NADPH氧化酶活性比未接种AMF黄瓜根系降低41.28%, 接种AMF黄瓜根系中H2O2比未接种AMF降低49.41%。
膜脂的改变还会影响ATP酶活性。AMF与植物共生使ATP酶活性增加, 诱导ATP酶基因表达。ATP酶通过C端自身抑制结构域的磷酸化, 调节细胞内pH值并产生二次活性转运的电化学梯度[29]。LIU等[28]发现在低温胁迫条件下, AMF处理的黄瓜P型H+-ATP酶、V型H+-ATP酶、总ATP酶活性、ATP和质膜蛋白浓度分别比对照增加74.56%、24.66%、35.24%、45.77%和74.26%;利用实时定量PCR分析与H+-ATP酶相关基因的相对表达水平, 发现接种AMF后, CsHA2、CsHA3、CsHA4、CsHA8、CsHA9、CsHA10显著诱导表达, 分别增加1.66、1.42、1.19、6.53、5.13、6.12倍。这说明AMF会增加ATP酶基因的表达并增强H+-ATP酶活性。在丛枝菌根共生植物中, 细胞生长和营养主要依赖于由PM H+-ATP酶产生的H+电化学梯度[30]。对菌根根部运输位点和机制的研究发现, H+-ATP酶可作为共生膜的标志物, H+-ATP酶产生的H+电化学梯度可为共生膜上的营养物和溶质提供驱动力, 参与营养转移[31]。
3 碳水化合物合成与转化在大多数植物中, 有机碳是以蔗糖形式利用韧皮部筛管分子/伴胞复合体从叶源转运到根库[10]。在AMF与植物形成的共生体中, AMF可以增强植物叶片的光合作用, 使其产生大量的碳水化合物[32], 同时增加植物叶片和共生根系中蔗糖/单糖转运体的表达, 将蔗糖及单糖转运至共生体界面, 再由AM真菌单糖转运体负责将单糖运输至菌丝内, 并通过代谢转化为糖原、三酰甘油及海藻糖后被菌丝体利用[10]。
低温胁迫下, AMF可以增强植物碳水化合物的合成和转运, 积累可溶性糖, 调节渗透势, 维持共生体的生长。ZHU等[14]发现低温胁迫下接种AMF玉米根系中可溶性糖含量明显高于未接种组。另外, 有研究发现, AMF可以降低君迁子(Diospyros lotus)的冻害指数, 提高木质部和韧皮部淀粉、韧皮部可溶性糖含量, 其中未接种AMF的君迁子淀粉含量w为3.75%, 接种AMF君迁子木质部淀粉含量w为8.31%, 提高4.56百分点[33]。陈笑莹[34]发现低温、接种AMF以及两者交互作用对玉米叶片可溶性糖和还原性糖产生显著影响, 与对照相比, 低温胁迫下接种AMF玉米叶片可溶性糖和还原性糖含量分别增加44%和95%。另外, LIU等[13]发现低温胁迫下, 接种AMF水稻根系中海藻糖浓度显著高于未接种AMF水稻。
AMF增强低温胁迫下植物碳水化合物合成与多种酶的诱导表达有关。在低温条件下, 接种AMF植物比未接种AMF植物具有更高的蔗糖合成酶(sucrose synthase, SS)和蔗糖磷酸合成酶(sucrose phosphate synthase, SPS)活性。有研究发现, 低温、低氮条件下, 接种AMF水稻根系比未接种AMF水稻根系中SPS和SS活性分别增加24.92%和4.81%, 低温、高氮条件下则分别增加6.47%和5.31%[32]。ZHU等[15]也证明在低温胁迫下接种AMF玉米的SPS活性增强, 并且与可溶性糖含量和还原糖含量呈正相关, 表明丛枝菌根增强了共生体低温胁迫下的蔗糖代谢。此外, 低温胁迫还会改变与淀粉代谢相关酶的活性。ZHU等[15]发现低温胁迫下, 接种AMF玉米中淀粉酶(amylase, AMS)活性高于未接种AMF植株。AMS能够催化淀粉水解成糖,淀粉水解加速导致可溶性糖含量增加以响应低温胁迫, 并且为AMF的生长提供能量。除蔗糖和淀粉外, 海藻糖也是菌根植物中不容忽视的碳水化合物。菌根真菌被证明可以合成海藻糖[35]。LIU等[13]发现低温胁迫下, 接种AMF水稻中具有更高的OsTPS1、OsTPS2和OsTPP1转录水平, 海藻糖浓度的增加也可能与淀粉积累有关。
4 氮磷吸收氮素是植物生长和发育的主要限制性营养元素[15]。植物根系吸收硝酸盐之后使之还原为铵, 铵可以直接参与氨基酸等物质的合成和转化[36]。低温胁迫会抑制植物吸收养分, 影响植物氮代谢过程。AMF利用自身菌丝的转运蛋白将土壤中NO3-吸收之后经过硝酸还原酶(nitrate reductase, NR)转变为NH4+, 然后经过一系列过程进行氮同化, 最终将氮素传递给宿主植物[37], 促进宿主植物对营养元素的吸收, 从而改善菌根植物的营养状况, 提高植物的抵御低温胁迫能力[38-39](图 2)。马俊[36]发现低温胁迫下, 接种AMF黄瓜叶片和根系中氮含量均高于未接种AMF黄瓜。另有研究发现, 低温胁迫使未接种AMF玉米茎和根系中氮含量分别下降18.6%和7.7%, 接种AMF玉米茎和根系中氮含量分别下降16.7%和5.4%, 说明接种AMF可以减缓低温胁迫下植物氮含量的下降[15]。另外, 接种AMF植物可以通过改变氮代谢相关酶活性来提高氮含量, 以应对低温胁迫。研究表明, 低温、高氮情况下, 接种AMF水稻的NR和谷氨酰胺合成酶(glutamine synthetase, GS)活性分别比未接种AMF植株高10.89%和12.98%, 低温、低氮情况下, 接种AMF水稻的NR和GS活性分别比未接种AMF植株高47.29%和29.84%[32]。ZHU等[15]发现低温胁迫下, 接种AMF玉米的谷草转氨酶(glutamate oxaloacetate transaminase, GOT)和谷丙转氨酶(glutamic-pyruvic transaminase, GPT)活性比未接种AMF玉米分别提高48%和17%。LIU等[40]发现低温胁迫下, 接种AMF玉米的NR活性高于未接种AMF玉米, 这说明AMF与植物共生可以提高低温胁迫下多种氮代谢相关酶活性。
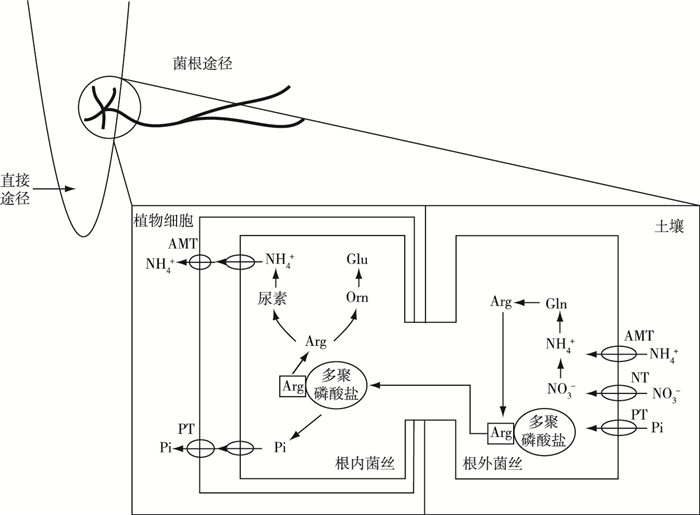
|
AMT—铵转运蛋白;Arg—精氨酸;Gln—谷氨酰胺;Glu—谷氨酸;NT—硝酸盐转运蛋白;Orn—鸟氨酸;PT—磷转运体。 图 2 丛枝菌根共生氮磷吸收途径[55-56] Fig. 2 The pathways for uptake of P, N in AM symbiosis process |
磷是植物必需的矿质元素之一, 是植物代谢过程不可或缺的元素[41]。植物磷素的吸收和代谢会受到低温胁迫的影响。AMF可增加宿主植物对磷素的吸收和利用, 有利于植物应对低温胁迫。AMF通过自身菌丝网络增大宿主植物根系与土壤的接触面积, 使其吸收更多磷素, 并利用自身的多聚磷酸酶将土壤中的多聚磷酸盐转化为正磷酸盐以被植物利用[39, 42](图 2)。LIU等[43]发现在低温胁迫下, 接种AMF蓝莓(Vaccinium spp.)叶和根中磷含量比未接种AMF蓝莓高。对黄瓜的试验发现, 低温胁迫下接种AMF黄瓜茎和根系磷含量显著高于未接种处理, 表明AMF可以为宿主植物提供磷元素[44]。KARASAWA等[45]对车前(Plantago lanceolata)的研究发现, 低温条件下的车前磷含量比常温低21%, 接种AMF使车前磷含量从(9.1±0.5) mg·株-1增加到(11.1±0.9) mg·株-1。
磷转运蛋白在植物吸收磷素过程中起到关键作用。植物中编码磷转运蛋白基因家族有Pht1、Pht2[46]、MPT[47]、PHO1[48]等。真菌中编码磷转运蛋白基因包括GvPT[49]、GintPT[49]和GmosPT[50]。AM植物磷转运蛋白主要是Pht1转运体, 包括AM特异性诱导的磷转运蛋白, 植物磷转运蛋白以及AM真菌中的磷转运蛋白[39]。AMF可以诱导不同植物的磷转运蛋白表达, 例如马铃薯(Solanum tuberosum)中的StPT3[51]、蒺藜苜蓿(Medicago truncatula)中的MtPT3[52]、水稻中的OsPT11[53]以及草莓(Fragaria ananassa)中的FaPT4、FaPT5和FaPT8[54]等。MA等[44]发现低温胁迫下, AMF会显著诱导黄瓜的CsPT2-1、CsMPT3、CsPHO1-H1、CsPT1-11表达。CsPT1-11在低温和常温情况下均被AMF显著诱导表达, 而CsPT2-1、CsMPT3、CsPHO1-H1在低温接种AMF情况下被显著诱导表达。
5 次级代谢产物合成次级代谢产物如黄酮类、木质素和酚类等化合物可以通过植物防御系统和抗氧化系统减轻生物胁迫和非生物胁迫对植物造成的损伤。植物与AMF共生可以通过增加植物次级代谢物含量影响次级代谢途径来抵御低温胁迫。有研究表明药用植物积雪草(Centella asiatica)与AMF共生条件下其整株和叶的苷类物质含量约为未接种对照的2倍[57]。CHEN等[58]发现在常温条件下, AMF可以使黄瓜叶片中酚类、黄酮类和木质素含量分别增加61.20%、62.02%和144.08%。在低温胁迫下, 与未接种AMF对照相比, 接种AMF植株显著提高了相关次生代谢产物含量, 酚类、黄酮类和木质素化合物分别增加73.11%、50.64%和26.96%。
AMF增强低温胁迫下次生代谢途径中酶活性。在对黄瓜的试验中发现, 低温胁迫下, 6-磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase, G6PDH)、莽草酸脱氢酶(shikimate dehydrogenase, SKDH)、苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL)、肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase, CAD)、多酚氧化酶(polyphenol oxidase, PPO)、愈创木酚过氧化物酶(guaiacol peroxidase, G-POD)、咖啡酸过氧化物酶(caffeic acid peroxidase, CA-POD)和绿原酸过氧化物酶(chlorogenic acid peroxidase, CGA-POD)活性分别增加90.57%、51.51%、44.44%、70.32%、56.43%、109.83%、128.30%和34.71%, 这些酶促进了酚酸、类黄酮和木质素的积累[58]。HAJIBOLAND等[24]发现低温条件下, 地表球囊霉(Glomus versiforme)可以增加冬大麦PPO和PAL活性, 并且可以增加春大麦中PAL活性。CHEN等[58]还发现胁迫温度越低,AM共生植株次级代谢相关的基因越被诱导表达, 与低温胁迫相比,寒冷胁迫下WRKY30、PR-1、C4H、CCOMT、CAD、G6PDH、PAL和LPO表达水平分别上调2.46、2.90、1.84、2.47、1.96、2.52、1.89、1.93倍, 这表明低温胁迫会激活植物次生代谢途径的一些基因, 这些基因可以增强一些次级代谢途径关键酶的合成, 增加其酶活性, 酶和次级代谢产物通过防御系统和抗氧化系统提高植物响应低温胁迫的能力。
6 展望低温胁迫对农业生产具有重要的影响, 研究AMF提高植物抵御低温胁迫的生理分子机制具有重要的理论和应用价值。AMF可以从多方面提高植物应对低温胁迫的能力。但是, 目前关于AMF提高植物抵御低温胁迫的作用机制还不是很清楚。今后可以从以下几个方面对丛枝菌根真菌提高植物抵御低温胁迫的能力进行深入研究:
(1) 目前, 对于AMF提高植物应对低温胁迫能力的研究主要集中在AMF对植物生长发育和生理特性的影响上。今后既要加强AMF对植物中编码功能蛋白基因的影响的研究, 又要关注AMF对植物中信号转导相关基因表达和转录因子调控作用。
(2) 深入研究AMF对于植物抗寒调控基因和抗寒功能基因表达的影响, 以便于为AMF提高植物适应温度能力提供理论依据。
(3) 低温胁迫下AMF在响应胁迫过程中扮演了十分重要的角色,应深入研究低温胁迫下共生体中AMF自身变化及其响应机理, 从而更加全面了解AMF在提高植物抵御低温胁迫过程中发挥的作用。
(4) 利用当前广泛应用的基因组学、转录组学和蛋白质组学等组学技术分析低温胁迫下AMF与植物, 尤其是农作物共生的基因和蛋白质表达变化, 以便更加精确地分析AM植物应对低温胁迫的生理过程和分子机理。
(5) 植物菌根共生体对低温胁迫的响应不是受单一机制的调控。目前对碳、氮、磷代谢之间的相互影响有一定了解, 还需解析更多关于丛枝菌根共生响应低温胁迫分子机制之间的相互关系以及调控网络的知识, 从而更加系统地了解AMF提高植物抵御低温胁迫的分子机制。
| [1] |
ZHU J K. Abiotic Stress Signaling and Responses in Plants[J]. Cell, 2016, 167(2): 313-324. DOI:10.1016/j.cell.2016.08.029 (  0) 0) |
| [2] |
ZHU X C, SONG F B, LIU S Q, et al. Effects of Arbuscular Mycorrhizal Fungus on Photosynthesis and Water Status of Maize Under High Temperature Stress[J]. Plant and Soil, 2011, 346(1/2): 189-199. (  0) 0) |
| [3] |
ZHU X C, SONG F B, LIU F L. Altered Amino Acid Profile of Arbuscular Mycorrhizal Maize Plants Under Low Temperature Stress[J]. Journal of Plant Nutrition and Soil Science, 2016, 179(2): 186-189. DOI:10.1002/jpln.201400165 (  0) 0) |
| [4] |
ZHU X C, SONG F B, XU H W. Arbuscular Mycorrhizae Improves Low Temperature Stress in Maize via Alterations in Host Water Status and Photosynthesis[J]. Plant and Soil, 2010, 331(1/2): 129-137. (  0) 0) |
| [5] |
李晓靖, 崔海军. 低温胁迫下植物光合生理研究进展[J]. 山东林业科技, 2018, 8(6): 90-94. [ LI Xiao-jing, CUI Hai-jun. Research Progress on the Physiological Response of Plants to Environmental Stress[J]. Journal of Shandong Forestry Science and Technology, 2018, 8(6): 90-94. DOI:10.3969/j.issn.1002-2724.2018.06.027] (  0) 0) |
| [6] |
朱鹏锦, 庞新华, 梁春, 等. 低温胁迫对甘蔗幼苗活性氧代谢和抗氧化酶的影响[J]. 作物杂志, 2018(4): 131-137. [ ZHU Peng-jin, PANG Xin-hua, LIANG Chun, et al. Effects of Cold Stress on Reactive Oxygen Metabolism and Antioxidant Enzyme Activities of Sugarcane Seedlings[J]. Crops, 2018(4): 131-137.] (  0) 0) |
| [7] |
THEOCHARIS A, CLEMENT C, BARKA E A. Physiological and Molecular Changes in Plants Grown at Low Temperatures[J]. Planta, 2012, 235(6): 1091-1105. DOI:10.1007/s00425-012-1641-y (  0) 0) |
| [8] |
HARLEY J L, SMITH S E. Mycorrhizal Symbiosis[J]. Quarterly Review of Biology, 2008, 3(3): 273-281. (  0) 0) |
| [9] |
曹际玲, 冯有智, 林先贵. 丛枝菌根真菌和纳米磁性氧化铁对玉米生长和Fe吸收的影响[J]. 生态与农村环境学报, 2017, 33(6): 555-563. [ CAO Ji-ling, FENG You-zhi, LIN Xian-gui. Influence of Arbuscular Mycorrhizal Fungi and Iron Oxide Magnetic Nanoparticles on Maize Growth and Fe-Uptake[J]. Journal of Ecology and Rural Environment, 2017, 33(6): 555-563.] (  0) 0) |
| [10] |
王浩, 方燕, 刘润进, 等. 丛枝菌根中养分转运、代谢、利用与调控研究的最新进展[J]. 植物生理学报, 2018, 54(11): 1645-1658. [ WANG Hao, FANG Yan, LIU Run-jin, et al. Recent Advances in the Studies of Nutrient Transportation, Metabolism, Utilization and Regulation in Arbuscular Mycorrhizas[J]. Plant Physiology Journal, 2018, 54(11): 1645-1658.] (  0) 0) |
| [11] |
DUY N, RIEU I, MARIANI C, et al. How Plants Handle Multiple Stresses:Hormonal Interactions Underlying Responses to Abiotic Stress and Insect Herbivory[J]. Plant Molecular Biology, 2016, 91(6): 727-740. DOI:10.1007/s11103-016-0481-8 (  0) 0) |
| [12] |
ZHU X C, SONG F B, LIU F L. Arbuscular Mycorrhizal Fungi and Tolerance of Temperature Stress in Plants[M]. Singapore: Springer, 2017: 163-194.
(  0) 0) |
| [13] |
LIU Z L, MA L, HE X Y, et al. Water Strategy of Mycorrhizal Rice at Low Temperature through the Regulation of PIP Aquaporins with the Involvement of Trehalose[J]. Applied Soil Ecology, 2014, 84: 185-191. DOI:10.1016/j.apsoil.2014.07.010 (  0) 0) |
| [14] |
ZHU X C, SONG F B, XU H W. Influence of Arbuscular Mycorrhiza on Lipid Peroxidation and Antioxidant Enzyme Activity of Maize Plants Under Temperature Stress[J]. Mycorrhiza, 2010, 20(5): 325-332. DOI:10.1007/s00572-009-0285-7 (  0) 0) |
| [15] |
ZHU X C, SONG F B, LIU F L, et al. Carbon and Nitrogen Metabolism in Arbuscular Mycorrhizal Maize Plants Under Low-Temperature Stress[J]. Crop & Pasture Science, 2015, 66(1): 62-70. (  0) 0) |
| [16] |
CHEN X Y, SONG F B, ZHU X C, et al. Effect of Arbuscular Mycorrhizal Fungus on Nitrogen Metabolism of Maize Seedlings Under Low Temperature Stress[J]. Acta Agriculturae Boreali-Sinica, 2014, 29(4): 205-212. (  0) 0) |
| [17] |
LIU A R, CHEN S C, LIU Y Y, et al. Effects of AM Fungi on Leaf Photosynthetic Physiological Parameters and Antioxidant Enzyme Activities Under Low Temperature[J]. Acta Ecologica Sinica, 2011, 31(12): 3497-3503. (  0) 0) |
| [18] |
KUWAGATA T, ISHIKAWA-SAKURAI J, HAYASHI H, et al. Influence of Low Air Humidity and Low Root Temperature on Water Uptake, Growth and Aquaporin Expression in Rice Plants[J]. Plant and Cell Physiology, 2012, 53(8): 1418-1431. DOI:10.1093/pcp/pcs087 (  0) 0) |
| [19] |
EVELIN H, KAPOOR R, GIRI B. Arbuscular Mycorrhizal Fungi in Alleviation of Salt Stress:A Review[J]. Annals of Botany, 2009, 104(7): 1263-1280. DOI:10.1093/aob/mcp251 (  0) 0) |
| [20] |
刘德良, 杨期和. 接种丛枝菌根对鬼针草吸收煤矿区土壤重金属的影响[J]. 生态与农村环境学报, 2013, 29(3): 342-347. [ LIU De-liang, YANG Qi-he. Effect of Inoculation of Arbuscular Mycorrhizal Fungi on Bidens bipinnata Absorbing Soil Heavy Metals in Coal Mining Area[J]. Journal of Ecology and Rural Environment, 2013, 29(3): 342-347. DOI:10.3969/j.issn.1673-4831.2013.03.012] (  0) 0) |
| [21] |
AROCA R, PORCEL R, RUIZ-LOZANO J M. How Does Arbuscular Mycorrhizal Symbiosis Regulate Root Hydraulic Properties and Plasma Membrane Aquaporins in Phaseolus Vulgaris Under Drought, Cold or Salinity Stresses?[J]. New Phytologist, 2007, 173(4): 808-816. DOI:10.1111/j.1469-8137.2006.01961.x (  0) 0) |
| [22] |
陈伟玉, 麦志通, 蔡开朗, 等. 不同丛枝菌根菌株对3种珍贵树种促生效应试验[J]. 广东农业科学, 2017, 44(11): 13-19. [ CHEN Wei-yu, MAI Zhi-tong, CAI Kai-lang, et al. Study on Promotion Effects of Different Arbuscular Mycorrhizas Fungi on Rare Tree Species[J]. Guangdong Agricultural Sciences, 2017, 44(11): 13-19.] (  0) 0) |
| [23] |
LUU D T, MAUREL C. Aquaporins in a Challenging Environment:Molecular Gears for Adjusting Plant Water Status[J]. Plant Cell and Environment, 2005, 28(1): 85-96. DOI:10.1111/j.1365-3040.2004.01295.x (  0) 0) |
| [24] |
HAJIBOLAND R, JOUDMAND A, ALIASGHARZAD N, et al. Arbuscular Mycorrhizal Fungi Alleviate Low-Temperature Stress and Increase Freezing Resistance as a Substitute for Acclimation Treatment in Barley[J]. Crop & Pasture Science, 2019, 70(3): 218-233. (  0) 0) |
| [25] |
潘传威, 刘小芳, 屈鹏飞, 等. 丛枝菌根真菌提高温度胁迫下枳根系抗氧化能力[J]. 长江大学学报(自然科学版), 2011, 8(9): 245-247, 218. [ PAN Chuan-wei, LIU Xiao-fang, QUE Peng-fei, et al. Enhancement of Arbuscular Mycorrhizal Fungi on Antioxidant Capacity of Roots of Trifoliate Orange Under Temperature Stress Conditions[J]. Journal of Yangtze University(Natural Science Edition), 2011, 8(9): 245-247, 218.] (  0) 0) |
| [26] |
刘爱荣, 陈双臣, 刘燕英, 等. 丛枝菌根真菌对低温下黄瓜幼苗光合生理和抗氧化酶活性的影响[J]. 生态学报, 2011, 31(12): 3497-3503. [ LIU Ai-rong, CHEN Shuang-chen, LIU Yan-ying, et al. Effects of AM Fungi on Leaf Photosynthetic Physiological Parameters and Antioxidant Enzyme Activitie Under Low Temperature[J]. Acta Ecologica Sinica, 2011, 31(12): 3497-3503.] (  0) 0) |
| [27] |
KORNYEYEV D, LOGAN B A, PAYTON P, et al. Enhanced Photochemical Light Utilization and Decreased Chilling-Induced Photoinhibition of Photosystem Ⅱ in Cotton Overexpressing Genes Encoding Chloroplast-Targeted Antioxidant Enzymes[J]. Physiologia Plantarum, 2001, 113(3): 323-331. DOI:10.1034/j.1399-3054.2001.1130304.x (  0) 0) |
| [28] |
LIU A R, CHEN S C, CHANG R, et al. Arbuscular Mycorrhizae Improve Low Temperature Tolerance in Cucumber via Alterations in H2O2 Accumulation and ATPase Activity[J]. Journal of Plant Research, 2014, 127(6): 775-785. DOI:10.1007/s10265-014-0657-8 (  0) 0) |
| [29] |
KIM H S, OH J M, LUAN S, et al. Cold Stress Causes Rapid but Differential Changes in Properties of Plasma Membrane H+-ATPase of Camelina and Rapeseed[J]. Journal of Plant Physiology, 2013, 170(9): 828-837. DOI:10.1016/j.jplph.2013.01.007 (  0) 0) |
| [30] |
SONDERGAARD T E, SCHULZ A, PALMGREN M G. Energization of Transport Processes in Plants Roles of the Plasma Membrane H+-ATPase[J]. Plant Physiology, 2004, 136(1): 2475-2482. (  0) 0) |
| [31] |
ROSEWARNE G M, SMITH F A, SCHACHTMAN D P, et al. Localization of Proton-ATPase Genes Expressed in Arbuscular Mycorrhizal Tomato Plants[J]. Mycorrhiza, 2007, 17(3): 249-258. DOI:10.1007/s00572-006-0101-6 (  0) 0) |
| [32] |
LIU Z L, LI Y J, HOU H Y, et al. Differences in the Arbuscular Mycorrhizal Fungi-Improved Rice Resistance to Low Temperature at Two N Levels:Aspects of N and C Metabolism on the Plant Side[J]. Plant Physiology and Biochemistry, 2013, 71: 87-95. DOI:10.1016/j.plaphy.2013.07.002 (  0) 0) |
| [33] |
齐国辉, 杨文利, 张林平, 等. 丛枝菌根真菌对君迁子贮藏营养及抗冻性的影响[J]. 河北农业大学学报, 2005(1): 62-64. [ QI Guo-hui, YANG Wen-li, ZHANG Lin-ping, et al. Effects of Arbuscular Mycorrhizal Fungi on Storage Nutrient and Cold Resistance of Diospyros lotus L.[J]. Journal of Hebei Agricultural University, 2005(1): 62-64. DOI:10.3969/j.issn.1000-1573.2005.01.018] (  0) 0) |
| [34] |
陈笑莹.低温胁迫下丛枝菌根真菌对玉米碳氮代谢的影响[D].长春: 中国科学院研究生院, 2014. [CHEN Xiao-ying.Effect of Arbuscular Mycorrhizal Fungi on Carbon and Nitrogen Metabolism of Maize Under Low Temperature Stress[D].Changchun: University of Chinese Academy of Sciences, 2014.] http://cdmd.cnki.com.cn/Article/CDMD-80062-1014042656.htm
(  0) 0) |
| [35] |
OCON A, HAMPP R, REQUENA N. Trehalose Turnover During Abiotic Stress in Arbuscular Mycorrhizal Fungi[J]. New Phytologist, 2007, 174(4): 879-891. DOI:10.1111/j.1469-8137.2007.02048.x (  0) 0) |
| [36] |
马俊.丛枝菌根真菌对黄瓜幼苗低温胁迫的缓解效应及其调控机理[D].杨凌: 西北农林科技大学, 2016. [MA Jun.Alleviative Effects and Its Mechanism of Exogenous Arbuscular Mycorrhizal Fungi(AMF) on Cucumber Seedlings Under Cold Stress[D].Yangling: Northwest A & F University, 2016.] http://cdmd.cnki.com.cn/Article/CDMD-10712-1016161613.htm
(  0) 0) |
| [37] |
HE X H, CRITCHLEY C, BLEDSOE C. Nitrogen Transfer Within and between Plants Through Common Mycorrhizal Networks (CMNs)[J]. Critical Reviews in Plant Sciences, 2003, 22(6): 531-567. DOI:10.1080/713608315 (  0) 0) |
| [38] |
张伟珍, 古丽君, 段廷玉. AM真菌提高植物抗逆性的机制[J]. 草业科学, 2018, 35(3): 491-507. [ ZHANG Wei-zhen, GU Li-jun, DUAN Ting-yu. Research Progress on the Mechanism of AM Fungi for Improving Plant Stress Resistance[J]. Pratacultural Science, 2018, 35(3): 491-507.] (  0) 0) |
| [39] |
GHISLAINE R, COSETTE A, JENNY R, et al. Protein Actors Sustaining Arbuscular Mycorrhizal Symbiosis:Underground Artists Break the Silence[J]. New Phytologist, 2013, 199(1): 26-40. DOI:10.1111/nph.12287 (  0) 0) |
| [40] |
LIU N, CHEN X Y, SONG F B, et al. Effects of Arbuscular Mycorrhiza on Growth and Nutrition of Maize Plants Under Low Temperature Stress[J]. Philippine Agricultural Scientist, 2016, 99(3): 246-252. (  0) 0) |
| [41] |
SCHACHTMAN D P, REID R J, AYLING S M. Phosphorus Uptake by Plants:From Soil to Cell[J]. Plant Physiology, 1998, 116(2): 447-453. DOI:10.1104/pp.116.2.447 (  0) 0) |
| [42] |
SCHROEDER J I, DELHAIZE E, FROMMER W B, et al. Using Membrane Transporters to Improve Crops for Sustainable Food Production[J]. Nature, 2013, 497(7447): 60-66. DOI:10.1038/nature11909 (  0) 0) |
| [43] |
LIU X M, XU Q L, LI Q Q, et al. Physiological Responses of the Two Blueberry Cultivars to Inoculation With an Arbuscular Mycorrhizal Fungus Under Low-Temperature Stress[J]. Journal of Plant Nutrition, 2017, 40(18): 2562-2570. DOI:10.1080/01904167.2017.1380823 (  0) 0) |
| [44] |
MA J, JANOUSKOVA M, LI Y S, et al. Impact of Arbuscular Mycorrhizal Fungi (AMF) on Cucumber Growth and Phosphorus Uptake Under Cold Stress[J]. Functional Plant Biology, 2015, 42(12): 1158-1167. DOI:10.1071/FP15106 (  0) 0) |
| [45] |
KARASAWA T, HODGE A, FITTER A H. Growth, Respiration and Nutrient Acquisition by the Arbuscular Mycorrhizal Fungus Glomus Mosseae and Its Host Plant Plantago Lanceolata in Cooled Soil[J]. Plant Cell and Environment, 2012, 35(4): 819-828. DOI:10.1111/j.1365-3040.2011.02455.x (  0) 0) |
| [46] |
VERSAW W K, HARRISON M J. A Chloroplast Phosphate Transporter, PHT2;1, Influences Allocation of Phosphate Within the Plant and Phosphate-Starvation Responses[J]. Plant Cell, 2002, 14(8): 1751-1766. DOI:10.1105/tpc.002220 (  0) 0) |
| [47] |
TAKABATAKE R, HATA S, TANIGUCHI M, et al. Isolation and Characterization of cDNAs Encoding Mitochondrial Phosphate Transporters in Soybean, Maize, Rice, and Arabidopsis[J]. Plant Molecular Biology, 1999, 40(3): 479-486. DOI:10.1023/A:1006285009435 (  0) 0) |
| [48] |
SECCO D, BAUMANN A, POIRIER Y. Characterization of the Rice Pho1 Gene Family Reveals a Key Role for OsPHO1; 2 in Phosphate Homeostasis and the Evolution of a Distinct Clade in Dicotyledons[J]. Plant Physiology, 2010, 152(3): 1693-1704. DOI:10.1104/pp.109.149872 (  0) 0) |
| [49] |
FIORILLI V, LANFRANCO L, BONFANTE P. The Expression of Gintpt, the Phosphate Transporter of Rhizophagus Irregularis, Depends on the Symbiotic Status and Phosphate Availability[J]. Planta, 2013, 237(5): 1267-1277. DOI:10.1007/s00425-013-1842-z (  0) 0) |
| [50] |
BALESTRINI R, G MEZ-ARIZA J, LANFRANCO L, et al. Laser Microdissection Reveals that Transcripts for Five Plant and One Fungal Phosphate Transporter Genes Are Contemporaneously Present in Arbusculated Cells[J]. Molecular Plant-Microbe Interactions, 2007, 20(9): 1055-1062. DOI:10.1094/MPMI-20-9-1055 (  0) 0) |
| [51] |
RAUSCH C, DARAM P, BRUNNER S, et al. A Phosphate Transporter Expressed in Arbuscule-Containing Cells in Potato[J]. Nature, 2001, 414(6862): 462-466. DOI:10.1038/35106601 (  0) 0) |
| [52] |
HARRISON M J, DEWBRE G R, LIU J Y. A Phosphate Transporter From Medicago Truncatula Involved in the Acquisiton of Phosphate Released by Arbuscular Mycorrhizal Fungi[J]. Plant Cell, 2002, 14(10): 2413-2429. DOI:10.1105/tpc.004861 (  0) 0) |
| [53] |
PASZKOWSKI U, KROKEN S, ROUX C, et al. Rice Phosphate Transporters include an Evolutionarily Divergent Gene Specifically Activated in Arbuscular Mycorrhizal Symbiosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(20): 13324-13329. DOI:10.1073/pnas.202474599 (  0) 0) |
| [54] |
曹庆芹, 邓杰, 朱丽静, 等. '红颜'草莓菌根磷转运蛋白基因的克隆及荧光定量表达分析[J]. 园艺学报, 2013, 40(4): 641-650. [ CAO Qing-qin, DENG Jie, ZHU Li-jing, et al. The Cloning and Quantitative Expression Analysis of Mycorrhizal Phosphate Transporter Gene in Fragaria Ananassa[J]. Acta Horticulturae Sinica, 2013, 40(4): 641-650.] (  0) 0) |
| [55] |
WANG W X, SHI J C, XIE Q J, et al. Nutrient Exchange and Regulation in Arbuscular Mycorrhizal Symbiosis[J]. Molecular Plant, 2017, 10(9): 1147-1158. DOI:10.1016/j.molp.2017.07.012 (  0) 0) |
| [56] |
金海如, 刘洁, 刘静, 等. 丛枝菌根真菌氮吸收、运转和传递机理的总述[J]. 中国科学:生命科学, 2012, 42(5): 355-364. [ JIN Hai-ru, LIU Jie, LIU Jing, et al. Forms of Nitrogen Uptake, Translocation, and Transfer via Arbuscular Mycorrhizal Fungi:A Review[J]. Scientia Sinica(Vitae), 2012, 42(5): 355-364.] (  0) 0) |
| [57] |
SATHEESAN J, NARAYANAN A K, SAKUNTHALA M. Induction of Root Colonization by Piriformospora Indica Leads to Enhanced Asiaticoside Production in Centella Asiatica[J]. Mycorrhiza, 2012, 22(3): 195-202. DOI:10.1007/s00572-011-0394-y (  0) 0) |
| [58] |
CHEN S C, JIN W J, LIU A R, et al. Arbuscular Mycorrhizal Fungi (AMF) Increase Growth and Secondary Metabolism in Cucumber Subjected to Low Temperature Stress[J]. Scientia Horticulturae, 2013, 160(3): 222-229. (  0) 0) |




