山茶(Camellia japonica)为山茶科山茶属植物, 山茶品种冬春季节开花, 花期较长, 花色、花型等变异丰富, 为盆栽和园林绿化的重要花卉种类。花色为山茶品种重要观赏性状, 主要包括白色、粉色、红色、黑色和复色等。山茶丰富的花色变异为其花色育种提供了良好的物质基础, 通过芽变、杂交和远缘杂交有望选育出花色各异的新品种。影响植物花色的色素主要包括类黄酮、类胡萝卜素和生物碱, 类黄酮色素中花青苷为主要的呈色因子[1]。山茶花色的色素成分主要为花青苷[2-5]。因此, 研究山茶品种不同花色花瓣中花青苷成分与含量, 明确花色变异与花青苷关系, 对山茶种质资源遗传分析、鉴定及特异新奇花色新品种选育具有重要意义。
已有山茶属植物花青苷的研究主要集中于花瓣中花青苷成分的分离与鉴定方面。HAYASHI等[6]利用纸层析发现山茶中含有矢车菊素-3-O-β-葡萄糖苷(Cy3G); SAKATA等[7]从短柄山茶(C. japonica ssp. rusticana)红色花瓣中发现矢车菊素-3-O-β-半乳糖苷(Cy3Ga); SAITO等[8]从茶梅(C.sasanqua)中分离出矢车菊素-3-O-β-葡萄糖苷、矢车菊素-3-O-[6-O-(E)-p-香豆酰]-β-葡萄糖苷(Cy3GEpC)和飞燕草素-3-O-β-葡萄糖苷。LI等[2-5]从滇山茶(C. reticulata)中鉴定出10种花青苷, 怒江山茶(C. saluenensis)中鉴定出7种花青苷, 香港红山茶(C. hongkongensis)中鉴定出12种花青苷。到目前为止, 山茶品种花色变异与花青苷的关系尚不清楚。该试验应用高效液相色谱-光电二极管阵列检测(HPLC-DAD)和超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF-MS)联用技术, 对山茶品种白色、粉色、红色和黑色4个色系22个品种花瓣中花青苷成分与含量进行研究, 结合花色表型分析, 探讨其花色变异与花青苷之间的关系, 揭示山茶品种花色形成的物质基础, 从而为山茶花色育种提供科学依据。
1 材料与方法 1.1 材料试验材料为山茶白色、粉色、红色和黑色4个色系22个品种, 其中白色品种7个, 粉色、红色和黑色品种各5个(表 1)。所有材料来源于中国林业科学研究院亚热带林业研究所山茶种质资源圃。每品种选取生长一致的植株5株, 各取树冠外围盛开期花朵3朵。
|
|
表 1 山茶品种花色数据 Table 1 The data of flower colors in cultivars of Camellia japonica |
采集新鲜花朵测定其花色, 花色测定按照国际照明委员会制定的CIE L*a*b*表色系法, 用分光色差仪(NF555, Spectrophotometer, TRISUM)测定花色的明度L*、色相a*值、色相b*值、彩度C*和色调角h。CIE L*a*b*体系中, L*值表示花色的明度, 随L*值增大花色由暗变亮; 色相a*值表示花色的红绿变化, 由负到正说明绿色减退、红色增强; 色相b*值表示花色的黄蓝变化, 由负到正、蓝色减退、黄色增强[9]; 彩度C*表示色彩的鲜艳程度, C*值越大, 颜色越深; 色调角h是对红、橙、黄、绿、青、蓝、紫7种颜色色调的描述, 红色区域分布于0°附近, 逆时针旋转经过橙色到达90°, 其附近为黄色, 180°附近是绿色区域, 270°附近是蓝色区域, 经过紫色区域, 360°时回到红色区域[10-11]。花色测定位置为花瓣上表皮中央部位, 光源为C/2°。每样品测量5朵花的花色, 取平均值[12-13]。
1.2.2 定性分析取新鲜花瓣0.6 g, 液氮研磨至粉末, 按照HASHIMOTO等[14]的方法,加V(甲醇) :V(水) :V(甲酸) :V〔三氟乙酸(TFA)〕=70 :27 :2 :1的提取液2 mL, 浸提24 h后用0.22 μm孔径滤膜过滤, 滤液保存在-20 ℃冰箱备用[15]。
利用高效液相色谱-光电二极管阵列检测和超高效液相色谱-四极杆-飞行时间质谱联用技术对花瓣中花青苷成分进行定性与定量分析, 包括ACQUITYTM UPLC I-Class超高效液相色谱系统(Waters Corporation, Milford, MA, USA)和Xevo G2-XS QTof MS质谱系统(Waters Corporation, Manchester, UK)。色谱柱为ACQUITY BEH C18(2.1 mm×100 mm, 1.7 μm)。流速0.3 mL·min-1, 进样量2 μL, 柱温40 ℃。以φ=0.1%甲酸水溶液(A)和乙腈(B)为流动相, 洗脱程序:0~1.5 min, φ=5%的B; 1.5~11 min, 5%~40% B; 11~14 min, 40%~95% B; 14~16.5 min, 95% B; 16.5~16.8 min, B相占比由95%降至5%;16.8~20 min, 5% B。电喷雾电离离子源(ESI), 正离子模式, 全离子扫描。脱溶剂气体为高纯度氮气, 温度为450 ℃, 流速为600 L·h-1, 毛细管电压为1 kV, 锥孔电压为40 V。低能量扫描时电压为6 eV, 高能量扫描时电压为20~45 eV。
1.2.3 定量分析运用HPLC-DAD方法, 在525 nm处检测花瓣中花青苷。采用标准品半定量法分别计算花瓣中含有的相对于标准品Cy3G的花青苷含量[16-17], 重复3次。标准品Cy3G和Cy3Ga购于Sigma公司, 纯度w≥98%。应用SPSS 17.0软件进行多元逐步回归分析。
2 结果与分析 2.1 山茶品种花色变异由表 1可知, CIE L*a*b*体系中, 白色花瓣L*值平均值为88.36, 粉色、红色和黑色花瓣L*值分别为67.21、41.03和29.46, 随花瓣红色加深L*值降低, 花色明亮度降低。白色花瓣a*均为负值, 平均值为-1.15;粉色、红色和黑色花瓣a*平均值分别为35.82、51.36和34.97, 随红色加深a*值先升高后降低。白色花瓣b*值为4.69, 粉色、红色和黑色花瓣b*值分别为4.80、13.74和13.42, 随红色加深b*值先升高后降低。白色花瓣C*值为5.24, 粉色、红色和黑色花瓣C*值分别为36.45、53.19和37.52, 随红色加深C*值先升高后降低。白色花瓣h值范围为90°~180°, 平均值为101.26°; 粉色、红色和黑色花瓣h值范围为0°~90°, 平均值分别为5.09°、14.96°和21.29°, 随红色加深h值升高。
从图 1可以看出, 22个不同花色的山茶品种分别集中分布在4个色相区域, 相应地归属于4个色系类型。白色类型色相a*值均为负值, b*值较小。粉色、红色和黑色类型色相a*值均为正值, 其中粉色类型靠近a*轴, 其b*值较小; 红色类型远离a*轴和b*轴, 其a*值和b*值均较大; 黑色类型位于粉色和红色类型之间, 其b*值均大于粉色类型, a*值均小于红色类型。
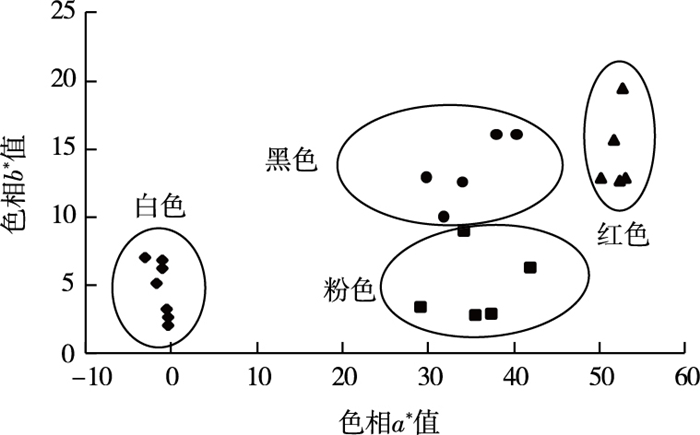
|
图 1 山茶品种花色分布 Fig. 1 Distribution of flower colors in cultivars of Camellia japonica |
根据UPLC-Q-TOF-MS图谱, 参照文献[18-26], 对山茶品种花瓣中主要花青苷成分进行结构鉴定。山茶品种白色花瓣中均未检测到花青苷, 粉色、红色和黑色花瓣中共检测到7种花青苷成分(图 2), 其紫外-可见光谱及质谱数据见表 2。Cy糖苷在513~520 nm有特征吸收峰且碎片离子m/z为287, 推测7种花青苷均为Cy型花青苷[18-20]; 花青苷在440 nm与可见光区最大吸收波长(λvis,max)处的吸收值之比A440/Avis,max变化范围为32%~36%, 据此确定7种花青苷均为3-O-糖苷类型[21]; 根据峰P3~峰P7在311~317 nm波长下出现肩峰, 推定化合物被芳香酸酰化[22-23]。
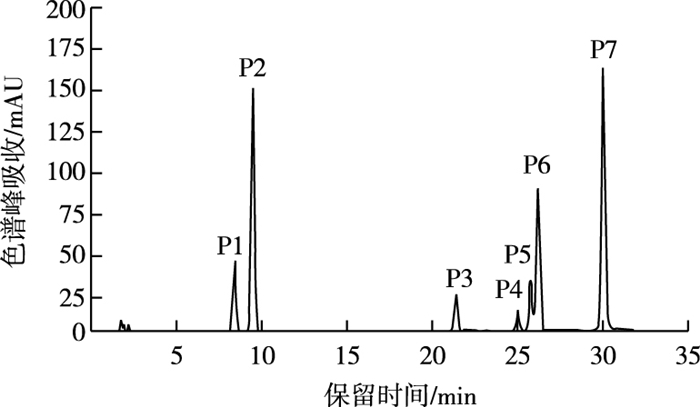
|
图 2 山茶品种花青苷的HPLC图谱 Fig. 2 HPLC chromatogram of anthocyaninsin cultivars of Camellia japonica |
|
|
表 2 山茶品种花青苷成分的紫外-可见吸收光谱与质谱数据 Table 2 Chromatographic and spectral data of anthocyanins in cultivars of Camellia japonica |
峰P1和峰P2质谱数据为分子离子m/z 449, 碎片离子m/z 287, 其中m/z 287为Cy苷元特征质荷比, m/z449到m/z287丢失162 u, 根据峰P1和峰P2与标准品Cy3Ga和Cy3G共洗脱特性, 及花青素半乳糖洗脱时间小于花青素葡萄糖苷特性[18, 20, 24], 确定峰P1为Cy3Ga, 峰P2为Cy3G。峰P3和峰P4质谱数据为分子离子m/z 611, 碎片离子m/z 449, 287, m/z 611到m/z 449丢失162 u, m/z 449到m/z 287丢失162 u, 判定其为Cy-3-O-p-咖啡酰型葡萄糖苷或半乳糖苷[23]; 花青素半乳糖苷洗脱时间小于花青素葡萄糖苷, 据此判断峰P3和峰P4分别为矢车菊素-3-O-[6-O-(E)-咖啡酰]-β-半乳糖苷(Cy3GaECaf)和矢车菊素-3-O-[6-O-(E)-咖啡酰]-β-葡萄糖苷(Cy3GECaf)。
峰P5、峰P6和峰P7质谱数据为分子离子m/z 595、碎片离子m/z 449和287, m/z 595到m/z 449丢失146 u, m/z 449到m/z 287丢失162 u, 判定其为Cy-3-O-p-香豆酰型葡萄糖苷或半乳糖苷[23]; 根据顺式花青苷洗脱时间小于反式花青苷[25-26]及花青素半乳糖苷洗脱时间小于花青素葡萄糖苷特性, 判断峰P5为矢车菊素-3-O-[6-O-(Z)-p-香豆酰]-β-葡萄糖苷(Cy3GZpC), 峰P6和峰P7分别为矢车菊素-3-O-[6-O-(E)-p-香豆酰]-β-半乳糖苷(Cy3GaEpC)和Cy3GEpC。
2.3 山茶品种花青苷定量分析由表 3可知,山茶品种粉色、红色和黑色花瓣中均含有Cy3G、Cy3GEpC和Cy3Ga这3种主要花青苷; 粉色和红色花瓣中Cy3G含量最高, 其次为Cy3GEpC和Cy3Ga; 黑色花瓣中Cy3G含量最高, 其次为Cy3Ga和Cy3GEpC。红色花瓣中花青苷总量平均值为粉色花瓣的7.36倍, 红色花瓣中主要花青苷Cy3G、Cy3GEpC和Cy3Ga含量均远高于粉色花瓣, 平均值分别为粉色花瓣的9.11、4.47和9.90倍。黑色花瓣中花青苷总量平均值为红色花瓣的4.84倍, 黑色花瓣主要花青苷Cy3G、Cy3GEpC和Cy3Ga含量均远高于红色花瓣, 平均值分别为红色花瓣的5.56、1.36和7.54倍。从粉色、红色到黑色, 随花色加深, 山茶品种花瓣中主要花青苷含量及花青苷总量均明显增加。
|
|
表 3 山茶品种花青苷含量 Table 3 The contents of anthocyanins in cultivars of Camellia japonica |
山茶品种粉色花瓣中主要花青苷Cy3G、Cy3GEpC和Cy3Ga占比分别为49.92%、28.52%和9.00%, 合计为87.44%;红色花瓣中Cy3G、Cy3GEpC和Cy3Ga占比分别为59.90%、19.55%和11.35%, 合计为90.80%;黑色花瓣中Cy3G、Cy3GEpC和Cy3Ga占比分别为72.92%、4.41%和18.17%, 合计为95.50%。山茶品种粉色、红色和黑色花瓣中主要花青苷均为Cy3G、Cy3GEpC和Cy3Ga, 随花色加深, 花瓣中3种主要花青苷总比例升高, 其中Cy3Ga和Cy3G占比升高, 而Cy3GEpC占比降低。
2.4 山茶品种花色变异与花青苷的关系以山茶品种花瓣中花青苷成分Cy3Ga、Cy3G、Cy3GaECaf、Cy3GECaf、Cy3GZpC、Cy3GaEpC和Cy3GEpC含量为自变量, 分别用x1、x2、x3、x4、x5、x6、x7表示, 以描述花色的L*、a*、b*、C*、h为因变量, 进行多元逐步回归分析, 研究山茶品种花色变异与花青苷的关系,得到回归方程式L*=56.420-0.047x2, 调整R2=0.982, P=0;a*=10.938+0.018x2+0.590x7, 调整R2=0.927, P=0。山茶品种花色变异与花青苷含量呈极显著相关(P < 0.001), 回归系数绝对值的大小反映了花青苷成分对花色形成的贡献。回归方程表明, Cy3G含量与明度L*值呈显著负相关, 山茶品种花瓣花色从白色、粉色、红色到黑色, Cy3G含量增加, L*值降低, 花色明度降低。色相a*值正方向反映花瓣红色程度, a*值越大, 花色越红。Cy3G和Cy3GEpC含量与色相a*值呈显著正相关, 且Cy3GEpC决定系数远大于Cy3G, 说明其对红色花瓣形成的贡献较大。因此, Cy3G和Cy3GEpC是决定山茶品种花色的主要花青苷, 其含量的积累可使花瓣红色程度增加。
3 讨论山茶属植物花瓣中花青苷主要为Cy型和Dp型, 其中Cy型花青苷在所有山茶属植物粉色和红色花瓣中均广泛存在[2-5], 而Dp型花青苷主要存在于香港红山茶和部分茶梅品种中[5, 8]。山茶属Cy型花青苷的研究表明, 不同物种的花青苷结构具有较大差异, 其Cy结构上通常连有3-单糖基, 部分物种Cy结构上除连接3-单糖基外, 还可能连接特异基团。山茶、浙江红山茶(C. chekiangoleosa)和南山茶(C. semiserrata)等Cy结构上只连接3-单糖基[5, 27-28]; 滇山茶和窄叶西南红山茶(C. pitardii var. yunnanica)Cy型花青苷结构上除具有3-单糖基外, 部分花青苷还具有特有的3-(2-xylosyl)-单糖基[2-3]; 怒江山茶和西南红山茶(C. pitardii)部分花青苷Cy结构上连接特有的3, 5-二糖基[4]。笔者试验山茶品种粉色、红色和黑色花瓣中7种花青苷均为Cy-3-O-糖苷型, 除矢车菊素-3-O-[6-O-(Z)-p-香豆酰]-β-半乳糖苷(Cy3GaZpC)未能检测到之外, 其余花青苷均与山茶鉴定结果相符[5]。
孙卫等[29]研究表明, 菊花(Dendranthema morifolium)不同色系间花青苷含量差异显著, 从白色、粉色、红色、紫色、红紫色到墨色, 花青苷含量快速增加, 花青苷含量越高则花色越深, 墨色菊花品种花青苷含量显著高于其他花色品种。该试验山茶品种白色花瓣中均未检测到花青苷, 从粉色、红色到黑色花瓣,花青苷含量明显增加, 红色花瓣中花青苷总量及主要花青苷含量远高于粉色花瓣, 黑色花瓣中花青苷总量及主要花青苷含量远高于红色和粉色花瓣, 花色越深花青苷含量越高, 相关结果与已有研究一致[29]。多元线性回归结果表明, Cy3G含量与L*值呈显著负相关, 其含量的积累可显著降低花色明度; Cy3G和Cy3GEpC含量分别与色相a*值呈显著正相关, 且Cy3GEpC的决定系数大于Cy3G, 说明其对红色花瓣贡献较大。从粉色、红色到黑色, 花瓣中Cy3G、Cy3GEpC和Cy3Ga含量及花青苷总量均表现为增加, 3种花青苷总比例升高, Cy3Ga和Cy3G比例升高,而Cy3GEpC比例降低, 其色相a*值先升高后降低, 说明除色素成分、含量外, 不同色素成分比例亦影响花色呈现[30], 具体原因有待进一步研究。
试验应用高效液相色谱-光电二极管阵列检测和超高效液相色谱-四极杆-飞行时间质谱联用技术, 分析了山茶品种白色、粉色、红色和黑色4个色系22个品种花瓣中花青苷成分与含量, 明确了山茶花色变异与花青苷的关系, 揭示了山茶品种花色形成的物质基础。山茶花色丰富, 广泛应用的品种通常极易发生花色变异, 通过性状分离能够培育出花色各异的品种。将花青苷总量及Cy3G和Cy3GEpC等含量较高的山茶品种作为亲本, 通过杂交、回交有望选育出深红色、黑色等特异花色品种。此外, 植物中花青苷具有重要的生物活性, 如消炎、杀菌、抗氧化和抗肿瘤等功效, B环具邻二羟基苯结构的花青苷(如Cy衍生物)能有效抑制肿瘤生长[31]。山茶品种粉色、红色和黑色花瓣花青苷均为Cy衍生物, 尤其黑色花瓣中花青苷含量较高, 其花青苷总量平均值为733.27 μg·(100 mg)-1, 可用于花青苷功能色素的开发利用。
4 结论山茶品种白色花瓣中未检测到花青苷, 粉色、红色和黑色花瓣中主要花青苷均为Cy3G、Cy3GEpC和Cy3Ga。从粉色、红色到黑色, 山茶品种花瓣中主要花青苷含量及花青苷总量均明显增加, Cy3Ga和Cy3G比例增大, 而Cy3GEpC比例减小。Cy3G和Cy3GEpC是决定山茶品种花色的主要花青苷, 其含量积累使得花瓣红色程度增加。
| [1] |
TANAKA Y, TSUDA S, KUSUMI T. Metabolic Engineering to Modify Flower Color[J]. Plant and Cell Physiology, 1998, 39(11): 1119-1126. DOI:10.1093/oxfordjournals.pcp.a029312 (  0) 0) |
| [2] |
LI J B, HASHIMOTO F, SHIMIZU K, et al. Anthocyanins From Red Flowers of Camellia reticulata LINDL[J]. Bioscience, Biotechnology, and Biochemistry, 2007, 71(11): 2833-2836. DOI:10.1271/bbb.70124 (  0) 0) |
| [3] |
LI J B, HASHIMOTO F, SHIMIZU K, et al. Anthocyanins From Red Flowers of Camellia cultivar 'Dalicha'[J]. Phytochemistry, 2008, 69(18): 3166-3171. DOI:10.1016/j.phytochem.2008.03.014 (  0) 0) |
| [4] |
LI J B, HASHIMOTO F, SHIMIZU K, et al. Anthocyanins From the Red Flowers of Camellia saluenensis Stapf ex Bean[J]. Journal of the Japanese Society for Horticultural Science, 2008, 77(1): 75-79. DOI:10.2503/jjshs1.77.75 (  0) 0) |
| [5] |
LI J B, HASHIMOTO F, SHIMIZU K, et al. A New Acylated Anthocyanin Form the Red Flowers of Camellia hongkongensis and Characterization of Anthocyanins in the Section Camellia species[J]. Journal of Integrative Plant Biology, 2009, 51(6): 545-552. DOI:10.1111/j.1744-7909.2009.00828.x (  0) 0) |
| [6] |
HAYASHI K, ABE Y, STUDIEN U A. Papier-Chromatographische Ubersicht Der Anthocyane Im Pflanzenreich I[J]. Miscellaneous Reports of the Research Institute for Natural Resources, 1953, 29: 1-8. (  0) 0) |
| [7] |
SAKATA Y, ARISUMI K I, MIYAJIMA I. Cyanidin-3-Galactoside, a New Anthocyanin From Camellia japonica ssp.Rusticana(Honda) Kitamura and Its Occurrence in the Garden Forms of Camellia of Japanese Origin[J]. Journal of the Japanese Society for Horticultural Science, 1986, 55(1): 82-88. DOI:10.2503/jjshs.55.82 (  0) 0) |
| [8] |
SAITO N, YOKOI M, YAMAJI M, et al. Cyanidin 3-P-Coumaroylglucoside in Camellia Species and Cultivars[J]. Phytochemistry, 1987, 26(10): 2761-2762. DOI:10.1016/S0031-9422(00)83587-6 (  0) 0) |
| [9] |
HE Q L, SHEN Y, WANG M X, et al. Natural Variation in Petal Color in Lycoris longituba Revealed by Anthocyanin Components[J]. PLoS One, 2011, 6(8): e22098. DOI:10.1371/journal.pone.0022098 (  0) 0) |
| [10] |
GONNET J F. Colour Effects of Co-Pigmentation of Anthocyanins Revisited:1.A Colorimetric Definition Using the CIELAB Scale[J]. Food Chemistry, 1998, 63(3): 409-415. DOI:10.1016/S0308-8146(98)00053-3 (  0) 0) |
| [11] |
GONNET J F. Colour Effects of Co-Pigmentation of Anthocyanins Revisited:2.A Colorimetric Look at the Solutions of Cyanin Co-Pigmented Byrutin Using the CIELAB Scale[J]. Food Chemistry, 1999, 66(3): 387-394. DOI:10.1016/S0308-8146(99)00088-6 (  0) 0) |
| [12] |
UDDIN A F M J, HASHIMOTO F, MIWA T, et al. Seasonal Variation in Pigmentation and Anthocyanidin Phenetics in Commercial Eustoma Flowers[J]. Scientia Horticulturae, 2004, 100(1/2/3/4): 103-115. (  0) 0) |
| [13] |
BYAMUKAMA R, JORDHEIM M, KIREMIRE B, et al. Anthocyanins From Flowers of Hippeastrum Cultivars[J]. Scientia Horticulturae, 2006, 109(3): 262-266. DOI:10.1016/j.scienta.2006.05.007 (  0) 0) |
| [14] |
HASHIMOTO F, TANAKA M, MAEDA H, et al. Changes in Flower Coloration and Sepal Anthocyanins of Cyanic Delphinium Cultivars During Flowering[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(8): 1652-1659. DOI:10.1271/bbb.66.1652 (  0) 0) |
| [15] |
LI J J, SAKATA Y, WANG L S, et al. Chemical Taxonomy of the Xibei Tree Peony From China by Floral Pigmentation[J]. Journal of Plant Research, 2004, 117(1): 47-55. DOI:10.1007/s10265-003-0130-6 (  0) 0) |
| [16] |
WANG L S, SHIRAISHI A, HASHIMOTO F, et al. Analysis of Petal Anthocyanins to Investigate Flower Coloration of Zhongyuan (Chinese) and Daikon Island (Japanese) Tree Peony Cultivars[J]. Journal of Plant Research, 2001, 114(1): 33-43. DOI:10.1007/PL00013966 (  0) 0) |
| [17] |
钟培星, 王亮生, 李珊珊, 等. 芍药开花过程中花色和色素的变化[J]. 园艺学报, 2012, 39(11): 2271-2282. [ ZHONG Pei-xing, WANG Liang-sheng, LI Shan-shan, et al. The Changes of Floral Color and Pigments Composition During the Flowering Period in Paeonia lactiflora Pallas[J]. Acta Horticulturae Sinica, 2012, 39(11): 2271-2282.] (  0) 0) |
| [18] |
DA SILVA F L, ESCRIBANO-BAILÓN T, PÉREZ ALONSO J J, et al. Anthocyanin Pigments in Strawberry[J]. LWT-Food Science and Technology, 2007, 40(2): 374-382. DOI:10.1016/j.lwt.2005.09.018 (  0) 0) |
| [19] |
OH Y S, LEE J H, YOON S H, et al. Characterization and Quantification of Anthocyanins in Grape Juices Obtained From the Grapes Cultivated in Korea by HPLC/DAD, HPLC/MS, and HPLC/MS/MS[J]. Journal of Food Science, 2008, 73(5): 378-389. DOI:10.1111/j.1750-3841.2008.00756.x (  0) 0) |
| [20] |
张洁, 王亮生, 高锦明, 等. 贴梗海棠花青苷组成及其与花色的关系[J]. 园艺学报, 2011, 38(3): 527-534. [ ZHANG Jie, WANG Liang-sheng, GAO Jin-ming, et al. Identification of Anthocyanins Involving in Petal Coloration in Chaenomeles speciosa Cultivars[J]. Acta Horticulturae Sinica, 2011, 38(3): 527-534.] (  0) 0) |
| [21] |
HARBORNE J B. Spectral Methods of Characterizing Anthocyanins[J]. Biochemical Journal, 1958, 70(1): 22-28. (  0) 0) |
| [22] |
FOSSEN T, ANDERSEN Ø M. Cyanidin 3-O-(6″-Succinyl-glucopyranoside) and Other Anthocyanins From Phragmites australis[J]. Phytochemistry, 1998, 49(4): 1065-1068. DOI:10.1016/S0031-9422(98)00064-8 (  0) 0) |
| [23] |
张洁, 李崇晖, 王亮生, 等. 植物花青苷液质联用方法的分析鉴定[J]. 食品安全质量检测学报, 2013, 4(3): 760-768. [ ZHANG Jie, LI Chong-hui, WANG Liang-sheng, et al. Golden Rules of Separation and Characterization of Plant Anthocyanins by High Pressure Liquid Chromatography-Tandem Mass Spectrometry[J]. Journal of Food Safety & Quality, 2013, 4(3): 760-768.] (  0) 0) |
| [24] |
WU X L, PRIOR R L. Systematic Identification and Characterization of Anthocyanins by HPLC-ESI-MS/MS in Common Foods in the United States:Fruits and Berries[J]. Journal of Agricultural and Food Chemistry, 2005, 53(7): 2589-2599. DOI:10.1021/jf048068b (  0) 0) |
| [25] |
DOWNEY M O, ROCHFORT S. Simultaneous Separation by Reversed-Phase High-Performance Liquid Chromatography and Mass Spectral Identification of Anthocyanins and Flavonols in Shiraz Grape Skin[J]. Journal of Chromatography A, 2008, 1201(1): 43-47. (  0) 0) |
| [26] |
ZHANG J, WANG L S, GAO J M, et al. Rapid Separation and Identification of Anthocyanins From Flowers of Viola yedoensis and V.prionantha by High-Performance Liquid Chromatography-Photodiode Array Detection-Electrospray Ionisation Mass Spectrometry[J]. Phytochemical Analysis, 2012, 23(1): 16-22. (  0) 0) |
| [27] |
SAKATA Y, ARISUMI K I, MIYAJIMA I. Constitution of Anthocyanins in Flowers of the Wild Forms of Section Camelllia of Japanese and Formosan Origin[J]. Journal of the Japanese Society for Horticultural Science, 1987, 56(2): 208-214. DOI:10.2503/jjshs.56.208 (  0) 0) |
| [28] |
SAKATA Y, ARISUMI K I. Anthocyanins in Camellia polyodonta How, C. semiserrata Chi and C. chekiangoleosa Hu, and Their Phylogenetic Positions in Section Camellia Based on the Pigmentation[J]. Engei Gakkai Zasshi, 1992, 61(2): 375-381. DOI:10.2503/jjshs.61.375 (  0) 0) |
| [29] |
孙卫, 李崇晖, 王亮生, 等. 菊花不同花色品种中花青素苷代谢分析[J]. 植物学报, 2010, 45(3): 327-336. [ SUN Wei, LI Chong-hui, WANG Liang-sheng, et al. Analysis of Anthocyanins and Flavones in Different-Colored Flowers of Chrysanthemum[J]. Chinese Bulletin of Botany, 2010, 45(3): 327-336. DOI:10.3969/j.issn.1674-3466.2010.03.004] (  0) 0) |
| [30] |
TOMÁS-BARBERÁN F A, HARBORNE J B, SELF R. Dimalonated Anthocyanins From the Flowers of Salvia splendens and S.coccinea[J]. Phytochemistry, 1987, 26(10): 2759-2760. DOI:10.1016/S0031-9422(00)83586-4 (  0) 0) |
| [31] |
HOU D X. Anthocyanidins Inhibit Activator Protein 1 Activity and Cell Transformation:Structure-Activity Relationship and Molecular Mechanisms[J]. Carcinogenesis, 2003, 25(1): 29-36. DOI:10.1093/carcin/bgg184 (  0) 0) |




