多环芳烃(PAHs)是一类含有两个或两个以上苯环,以直链状、角状或串状方式构成的有机化合物,是有机物不完全燃烧或高温裂解的副产品[1-2]。土壤作为一种重要的环境介质,承担着90%以上的PAHs环境负荷。由于PAHs均存在于表层土壤中,且具有高脂溶性和低水溶性,使其比较容易分配到生物体内,并通过食物链进入生态系统,从而对人体健康和整个生态系统的安全构成很大危害[3-4]。因此,如何降低土壤和植物PAHs污染一直备受关注。
近年来,利用具有PAHs降解功能的植物内生细菌与植物来联合修复PAHs污染土壤并降低植物PAHs污染已成为土壤环境领域的研究热点之一。植物内生细菌是能定殖在健康植物组织内,并与寄主植物建立和谐联合关系的一类微生物,具有促进植物生长、提高植物抗逆性和降低植物病虫害发生等生理生态功能[5-6]。陈小兵等[7]从长期受石油污染土壤上生长的植物体内分离筛选出具有菲降解功能的内生细菌7J2,经抗药性标记后能较好地定殖于小麦体内,并能促进小麦生长,更能提高小麦对土壤中菲的去除率。SUN等[8]从PAHs污染区植物体内分离筛选出具有芘降解功能的内生细菌BJ06,抗性标记后能有效定殖于黑麦草体内,并能提高黑麦草对土壤中芘的去除率,降低植物PAHs污染风险。
以PAHs中典型代表芘为目标污染物,采用平板直接分离法从PAHs污染区的铁苋菜(Acalypha australis)、香附子(Cyperus rotundus)和麦冬(Ophiopogon japonicus)体内分离筛选具有芘降解功能的植物内生细菌,并探索不同环境条件对其生长及芘降解效能的影响,从而为研究PAHs降解机制和修复PAHs污染环境提供理论依据和微生物资源。
1 材料与方法 1.1 化学试剂萘、芴、菲、芘、荧蒽和苯并[a]芘均购于德国Fluka公司,纯度w≥98%,其基本理化性质见表 1[9]。甲醇为高效液相色谱纯,其余化学试剂均为分析纯。
|
|
表 1 萘、芴、菲、芘、荧蒽和苯并[a]芘6种PAHs的基本性质[9] Table 1 Selected physical and chemical properties of PAHs in this study |
LB培养基:ρ(蛋白胨)10.00 g·L-1,ρ(酵母粉)5.00 g·L-1,ρ(NaCl)10.00 g·L-1,pH值7.0。
无机盐培养基:ρ[(NH4)2SO4]1.50 g·L-1,ρ(K2HPO4·3H2O)1.91 g·L-1,ρ(KH2PO4)0.50 g·L-1,ρ(NaCl)0.50 g·L-1,ρ(MgSO4·7H2O)0.20 g·L-1,微量元素溶液2 mL,pH值7.0。其中微量元素溶液成分:ρ(CoCl2·6H2O)0.100 g·L-1,ρ(MnCl2·4H2O)0.425 g·L-1,ρ(ZnCl2)0.050 g·L-1,ρ(NiCl2·6H2O)0.010 g·L-1,ρ(CuSO4·5H2O)0.015 g·L-1,ρ(Na2MoO4·2H2O)0.010 g·L-1,ρ(Na2SeO4·2H2O)0.010 g·L-1。
PAH降解培养基:将10 mg·mL-1 PAH丙酮溶液过0.22 μm孔径滤膜除菌后,取一定量置于灭菌的三角瓶中,待丙酮挥发完,加入已灭菌的无机盐培养基,使PAH浓度达到试验设计浓度。
固体培养基:液体培养基中加入琼脂,使其w为1.8%~2%。
灭菌条件:121 ℃条件下高压蒸汽灭菌20 min。
1.3 功能菌株的分离筛选从南京某石化企业芳烃厂排污口附近采集健康的铁苋菜、香附子和麦冬进行芘降解功能植物内生细菌的分离筛选。植物样品用去离子水将表面清洗干净,无菌条件下依次用φ为75%乙醇漂洗3~5 min,无菌水冲洗3~4次,φ为0.1%次氯酸钠漂洗2~5 min,然后用无菌水冲洗至确保植物表面消毒剂去除。将表面灭菌的植物样品移入LB培养基固体平板上,在30 ℃条件下恒温培养72 h,检查植物表面灭菌是否彻底[10]。取1 g表面灭菌完全的植物样品,用10 mL无菌水在灭菌研钵中充分研磨。匀浆液静置20 min后,取适量上清液稀释涂布于芘降解培养基固体平板上,在30 ℃条件下恒温培养3~7 d。挑取不同形态生长良好的单菌落划线纯化获得纯菌株,鉴定其对芘降解效能。
1.4 功能菌株的鉴定采用透射电子显微镜观察功能内生细菌形态并进行生理生化实验[11]。采用细菌基因组DNA提取试剂盒(Tiangen)提取菌株的基因组DNA,并以其为模板采用PCR扩增其16S rRNA基因。16S rRNA基因扩增的正向引物和反向引物分别为16S rRNA-27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和16S rRNA-1492R(5′-TACCTTGTTACGACTT-3′)。PCR反应体系(25 μL):Premix 12.5 μL,模板DNA 1 μL,正向引物和反向引物各0.5 μL,重蒸水10.5 μL。PCR扩增条件:(1)预变性:94 ℃,4 min;变性:94 ℃,30 s;退火:55 ℃,30 s;(2)延伸:72 ℃,30 s,30个循环;(3)终极延伸:72 ℃,10 min;(4)保温:10 ℃,10 min。PCR扩增产物经琼脂糖凝胶电泳验证后,由南京金斯瑞生物技术公司进行纯化测序。测序结果采用BLAST软件(http://blast.ncbi.nlm.nih.gov/Blast.cgi)在GenBank数据库进行比对分析,并采用MEGA 5.05软件构建系统发育树。
1.5 菌悬液的制备将功能菌接种到LB培养基中,并在LB培养基中加入芘丙酮溶液(丙酮φ<0.5‰),使ρ(芘)=50 mg·L-1。在30 ℃条件下以150 r·min-1摇床培养12 h后,以6 000 r·min-1(相对离心力RCF为519)离心10 min,弃掉上清液。收集的菌体加入无机盐培养基冲洗混匀后再次离心收集菌体。洗涤过程重复2~3次以充分去除菌体表面残留的LB培养基。清洗好的功能菌用无机盐培养基制成菌悬液,利用比浊法调整接种浓度至D600为1.0〔单位体积菌落数(以CFU计,下同)约为8.77〕。
1.6 功能菌株的降解特性 1.6.1 菌株芘降解效能的测定在20 mL芘降解培养基中加入菌悬液,使φ(菌悬液)为5%,初始功能菌数对数值约为7.45,30 ℃条件下以150 r·min-1摇床避光培养10 d后取样测定培养液中功能菌数量和芘残留浓度[12]。
1.6.2 菌株降解广谱性的测定选择萘、芴、菲、荧蒽、芘和苯并[a]芘为PAHs代表,研究功能菌对2、3、4和5环PAHs的降解效能。在20 mL PAH降解培养基中加入菌悬液,使φ(菌悬液)为5%,初始功能菌数对数值约为7.45,萘、芴、菲、荧蒽、芘和苯并[a]芘质量浓度分别为500、100、50、50、50和10 mg·L-1。30 ℃条件下以150 r·min-1摇床避光培养7 d后取样测定培养液中萘、芴和菲残留浓度,10 d后取样测定培养液中芘、荧蒽和苯并[a]芘残留浓度。
1.6.3 菌株的降解条件优化通过测定培养液中功能菌数量和芘残留浓度来探究pH、温度、盐浓度、装液量、接种量、芘浓度和外加碳源对功能菌芘降解效能的影响。配制pH值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0的芘降解培养基,研究pH值对功能菌芘降解效能的影响。设置摇床温度分别为15、20、25、30、35、40和45 ℃,研究温度对功能菌芘降解效能的影响。配制NaCl添加量分别为0、5、10、15、20、25、30和35 g·L-1的芘降解培养基,研究盐浓度对功能菌芘降解效能的影响。配制100 mL三角瓶中装液量分别为10、20、30、40、50、60和70 mL的芘降解培养基,研究装液量对功能菌芘降解效能的影响。向芘降解培养基中加入菌悬液,使φ(菌悬液)分别为1%、3%、5%、7%、9%、11%、13%、15%和17%,初始功能菌数对数值分别约为6.77、7.23、7.45、7.59、7.69、7.77和7.83,研究接种量对功能菌芘降解效能的影响。配制ρ(芘)分别为25、50、75、100、125和150 mg·L-1的芘降解培养基,研究功能菌对不同浓度芘的降解效能。配制葡萄糖、果糖、麦芽糖、蔗糖和乳糖质量浓度分别为100 mg·L-1的芘降解培养基,对照CK不加糖,研究外加碳源对功能菌芘降解效能的影响。配制ρ(葡萄糖)分别为0、10、50、100、200 mg·L-1的芘降解培养基,研究不同浓度葡萄糖对功能菌芘降解效能的影响。
除装液量影响试验中设置装液量为70 mL的培养基于培养箱中避光静置培养外,其他试验均以150 r·min-1摇床避光培养10 d。除温度影响试验外,其他试验培养温度均为30 ℃;除装液量影响试验外,其他试验装液量均为20 mL;除功能菌接种量影响试验外,其他试验接种量φ均为5%,使功能菌初始数对数值约为7.45;除芘初始浓度影响试验,其他试验ρ(芘)均为50 mg·L-1。
1.6.4 菌株降解曲线的测定在10 mL含100 mg·L-1葡萄糖的芘降解培养基(50 mg·L-1)中加入菌悬液,使φ(菌悬液)为5%,30 ℃条件下以150 r·min-1摇床避光培养21 d,CK不加菌。每24 h整瓶取样,测定培养液中功能菌数量、芘浓度和降解中间产物(1-羟基-2-萘甲酸,1H2N)浓度。
1.6.5 测定方法培养液中功能菌数量测定:采用固体平板计数法,取培养液稀释涂布于芘降解培养基固体平板上,30 ℃条件下恒温培养48 h,选择菌落数在30~300之间的平板计数,每个处理设置3个重复,计算1 mL培养液含菌量。
培养液中PAHs浓度测定:采用整瓶提取法[12],向培养液中加入等体积甲醇,超声混匀,静置后过0.22 μm孔径滤膜。采用高效液相色谱仪(LC-20AT)测定PAHs浓度。高效液相色谱仪设定参数:Inertsil ODS-SP-C18反相色谱柱(150 mm×4.6 mm, 5 μm),流动相V(甲醇):V(水)=90:10,流速1.0 mL·min-1,柱温40 ℃,检测波长245 nm,进样量20 μL。各污染物出峰时间:萘:4.7 min;芴:5.3 min;菲:5.4 min;芘:6.1 min;荧蒽:5.9 min;苯并[a]芘:7.8 min。
培养液中芘和降解中间产物浓度同时测定:采用整瓶提取法[12],向培养液中加入等体积甲醇,超声混匀,静置后过0.22 μm孔径滤膜。用高效液相色谱仪测定芘与中间产物浓度。高效液相色谱仪设定参数:Inertsil ODS-SP-C18反相色谱柱(150 mm×4.6 mm, 5 μm);流动相甲醇:水(含甲酸φ=0.1%);梯度洗脱,0~12.50 min;φ为100%甲醇,12.50~19 min;φ为70%甲醇,19~27 min;φ为30%甲醇;柱温40 ℃;流速0.80 mL·min-1;检测波长245 nm;进样量20 μL。1H2N和芘的出峰时间分别为12.4和17.0 min。
2 结果与讨论 2.1 功能菌株的分离与鉴定通过分离、培养和纯化获得的8株功能菌,均可在含50 mg·L-1芘降解培养基固体平板上形成直径大于2 mm的菌落,10 d的芘降解率见表 2。从麦冬体内分离获得的菌株PRd5在共代谢基质存在与缺失条件下均具有最高的芘降解效能,且关于肠杆菌属(植物体内的优势菌属)降解PAHs的研究报道不多,所以选其研究植物内生细菌PAHs降解效能。
|
|
表 2 法国功能菌对芘的降解效能 Table 2 Biodegradation of pyrene by functional endophytic bacteria |
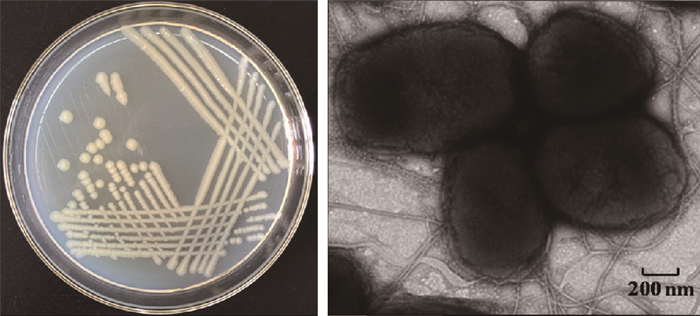
菌株PRd5在LB培养基固体平板上培养2 d时,菌落直径1~3 mm,呈圆形、光滑、隆起、乳白色、有光泽、边缘整齐状态(图 1)。在透射电镜下,菌株PRd5聚集成团,周身鞭毛,球杆状,大小为(0.6~0.9) μm ×(0.8~1.2) μm(图 1)。生理生化特性见表 3。
|
×7.0 K Z00m-1 HC-1 80 KV 图 1 Enterobacter sp. PRd5的菌落形态和透射电镜照片 Fig. 1 The colony morphology and transmission electron micrograph of Enterobacter sp. PRd5 |
|
|
表 3 Enterobacter sp. PRd5的生理生化特性 Table 3 The morphological and biochemical characteristics of Enterobacter sp. PRd5 |
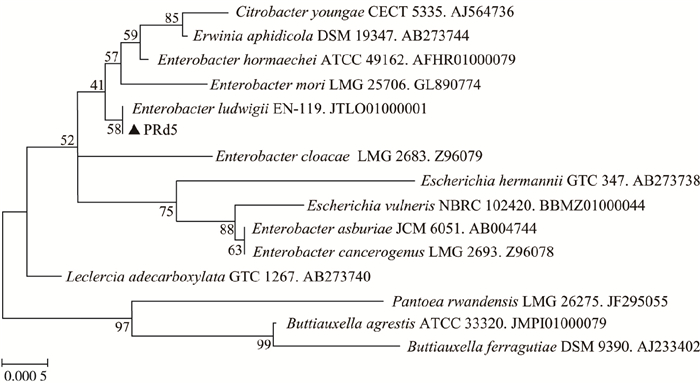
通过Genebank进行BLAST比对表明,菌株PRd5与Enterobacter ludwigii EN-119(JTLO01000001)和Leclercia adecarboxylata GTC 1267(AB273740)的相似度最高(99.5%),其基于16S rRNA基因的系统发育树见图 2。综合菌株PRd5的形态学特征、生理生化特性和16S rRNA基因序列同源性分析,将其鉴定并命名为Enterobacter sp. PRd5。目前,已有多株肠杆菌降解PAHs的报道。GUPTA等[13]从原油污染土壤中分离出1株具有萘降解功能的肠杆菌F3,7 d对萘(100 mg·L-1)的降解率为61.11%。SHENG等[10]从生长于石油冶炼厂的薤白茎内分离出1株具有芘降解功能的肠杆菌12J1,7 d对芘(5 mg·L-1)的降解率为83.8%。
|
图 2 Enterobacter sp. PRd5基于16S rRNA基因序列同源性的系统发育树 Fig. 2 Phylogenetic tree of Enterobacter sp. PRd5 based on the 16S rRNA gene homology |
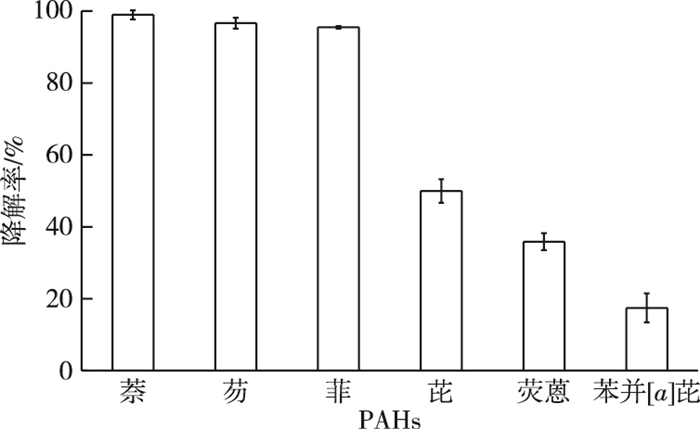
Enterobacter sp. PRd5对多种单一PAH的降解效能见图 3。
|
图 3 Enterobacter sp. PRd5对单一PAH的降解效能 Fig. 3 Biodegradation of PAH by Enterobacter sp. PRd5 |
菌株PRd5 7 d对初始质量浓度为500、100和50 mg·L-1的萘、芴和菲的降解率分别为99.96%、96.65%和95.48%;菌株PRd5 10 d对初始质量浓度为50、50和10 mg·L-1的芘、荧蒽和苯并[a]芘的降解率分别为49.95%、35.89%和17.44%。这表明菌株PRd5不仅可高效降解2~3环的低分子量PAHs(LMW-PAHs),同时可降解4~5环的高分子量PAHs(HMW-PAHs)。
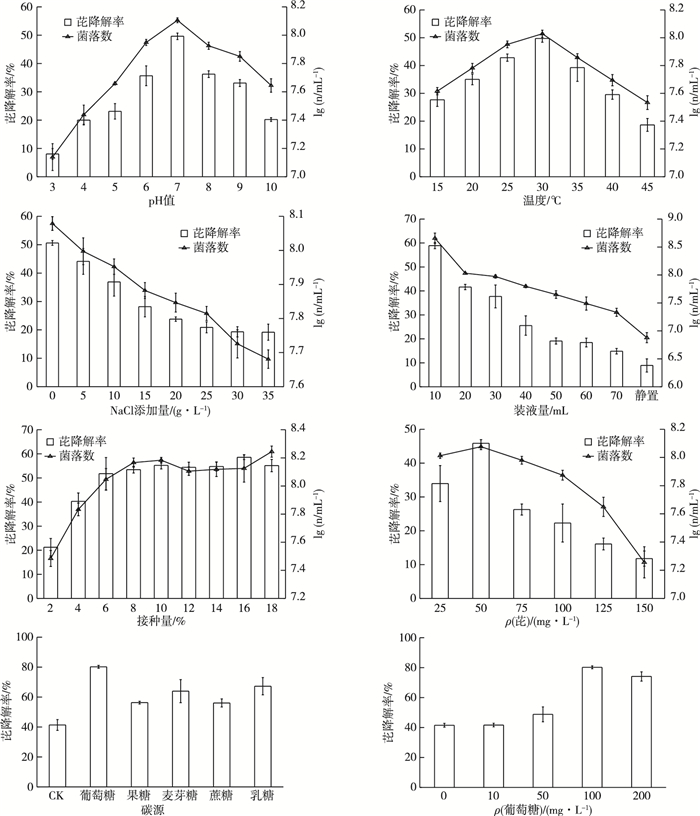
2.3 功能菌株的降解条件优化环境条件可改变Enterobacter sp. PRd5的生长及芘降解效能(图 4)。菌株PRd5生长的最适pH值为7,此时的功能菌数对数值和芘降解率均达到最大值,分别为8.11和49.63%。当pH值< 6或>9时,菌株PRd5的降解率随酸性或碱性程度的增加而降低(图 4)。研究表明,菌株PRd5降解芘的最适温度为30 ℃,此时功能菌数对数值和芘降解率分别为8.03和49.75%。当温度 < 30 ℃时功能菌数量和芘降解率均随温度升高而增加;而当温度>30 ℃时,其均随着温度的升高而降低(图 4)。培养基中额外的NaCl抑制了菌株PRd5的生长与芘降解,功能菌的生长和芘降解效能随NaCl添加量的增加均降低,未添加NaCl处理的功能菌数对数值达到8.08,芘降解率达50.63%(图 4)。随培养基体积的增加,菌株PRd5的生长受到抑制,芘降解率降低,表明其为好氧菌。100 mL的三角瓶中培养基体积为10 mL时,菌株PRd5生长最好,功能菌数对数值为8.66,芘降解率可达58.92%(图 4)。接种量为1%~9%时,功能菌数量和芘降解率随接种量的增加而明显增加;而当接种量>9%时,功能菌数量的增长有所减缓(图 4)。当初始ρ(芘)<50 mg·L-1时,功能菌数量和芘降解效能随芘浓度升高而增加;而当初始ρ(芘)>50 mg·L-1时,功能菌数量和芘降解率则随浓度升高而下降。这表明高浓度芘对菌株PRd5具有较强的抑制作用(图 4)。外加碳源可以增强菌株PRd5降解芘的效能,促进芘降解的能力强弱依次为葡萄糖、乳糖、麦芽糖、果糖、蔗糖和CK(图 4)。外加不同浓度葡萄糖的研究结果表明,当ρ(葡萄糖)为100 mg·L-1时,菌株PRd5芘降解效能提高最多(图 4)。
|
n为单位体积菌落数(以CFU计)。 图 4 环境条件对Enterobacter sp. PRd5生长和降解芘的影响 Fig. 4 The growth and pyrene degradation by Enterobacter sp. PRd5 under different environmental conditions |
研究表明,微生物代谢PAHs的方式主要有两种:一是以LMW-PAHs为唯一碳源和能源进行单一代谢;另一种是HMW-PAHs与其他有机质发生共代谢(co-metabolism)[14]。共代谢作用通过改变微生物碳源与能源的底物结构来扩大微生物对碳源和能源的选择范围,并激活降解酶活性,从而提高微生物降解PAHs的效能,达到难降解物质最终被微生物降解利用的目的[15-16]。郝大程等[17]研究表明,投加营养物质可以刺激有毒难降解有机物的生物降解。笔者将葡萄糖、果糖、麦芽糖、蔗糖和乳糖这5种外加碳源作为共代谢底物,研究其对菌株PRd5降解芘的影响,结果表明不同的外加碳源均促进了菌株PRd5的生长和对芘的降解,其中葡萄糖的效果最佳,与王万清[18]研究结果一致。葡萄糖作为共代谢底物具有来源广泛、无毒害、与芘无竞争性抑制等优点,当ρ(葡萄糖)为100 mg·L-1时,菌株PRd5对芘的降解率可高达64.97%~80.22%,当ρ(葡萄糖)>100 mg·L-1时,菌株PRd5对芘降解率降低,表明葡萄糖浓度过高,微生物会大量利用葡萄糖而使芘降解效能减弱,此与张杰等[19]研究结果相似。
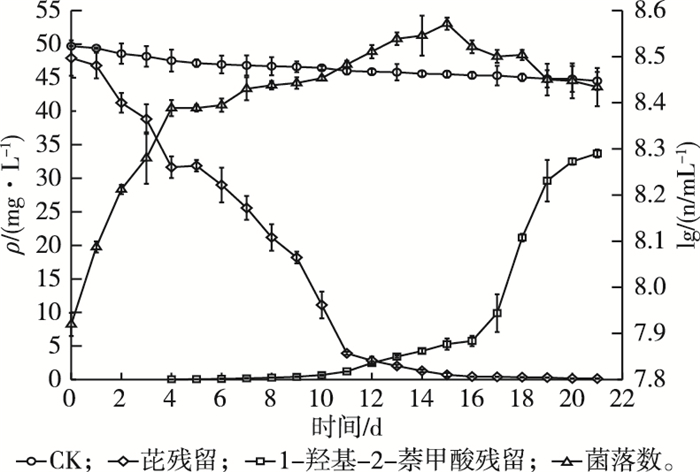
2.4 功能菌株的降解曲线图 5为Enterobacter sp. PRd5的生长曲线和降解动力学曲线。结果显示,菌株PRd5在ρ(葡萄糖)为100 mg·L-1的芘降解培养基(50 mg·L-1)中生长良好。功能菌数量与芘去除量随着培养时间的延长而增多。培养的前4 d,功能菌数量增加迅速,降解速率为4.052 mg·L-1·d-1(R2=0.947);培养的后4 d,受各种降解中间产物的影响,功能菌数量增幅开始减小,菌株PRd5降解芘的速度减缓,降解速率为3.517 mg·L-1·d-1(R2=0.995)。这可能是因为葡萄糖在初期促进了功能菌的生长,从而提高了芘去除。培养16 d后,功能菌数对数值达到最大值,为8.52,此时菌株PRd5对芘降解率达到99%。培养17 d后,功能菌数量逐渐减小,降解中间产物1H2N不断增加,菌株PRd5的生长进入衰退期。该结果与已有的研究报道相似。TIAN等[20]研究假单胞菌(Pseudomonas)CGMCC 1.766在20、50、100、200 mg·L-1的菲降解培养基中的生长发现,1H2N的积累能达到19.3(36 h)、43.3(32 h)、73.4(40 h)和144.4(48 h)mg·L-1,分别是理论值的93.4%、85.7%、70.3%和68.2%。MACCHI等[21]研究鞘脂菌(Sphingomonas)20006FA降解840 mg·L-1菲时发现,161 h的降解率能达到49.1%,同时1H2N积累量达到166 mg·L-1。由此可见,由于培养基中基质的消耗、菌株PRd5的生长和本身生理机理等原因造成中间产物的积累[20]。在芘转化为1H2N的上游降解途径中,编码第一步环羟基化反应所需的起始双加氧酶被认为是PAHs降解的最关键功能基因[22-24]。通过对菌株PRd5进行全基因组测序来挖掘其起始双加氧酶基因,但测序所获得的编码双加氧酶的基因均非特征性PAHs起始双加氧酶基因,可能是因为双加氧酶基因恰好位于测序缺口上,而以精细图呈现的测序结果并没有对缺口区域的基因进行补缺,也可能是PAHs起始双加氧酶基因位于菌株PRd5的质粒上,而DNA提取方法不当导致提取过程中质粒浓度过低或丢失。后续会通过提取菌株质粒,再采用菌株覆盖度高的引物进行PCR或进行质粒全基因组测序以获得对应的起始双加氧酶基因。若仍不能成功获得对应的起始双加氧酶基因,表明该基因位于染色体上,会进一步从双加氧酶引物筛选和PCR条件优化两方面设计试验。
|
n为单位体积菌落数(以CFU计)。 图 5 Enterobacter sp. PRd5培养液中芘、1H2N浓度和生物量随时间的变化 Fig. 5 The degradation kinetics of pyrene, 1H2N and growth curves of biomass in Enterobacter sp. PRd5 culture |
(1) 从PAHs污染区生长良好的植物体内分离筛选出多株对芘具有耐受性和降解性的菌株,从中挑选出1株降解性能最佳的菌株作为研究对象。菌株PRd5分离自麦冬体内,根据其培养特征、生理生化特性和16S rRNA基因序列同源性分析结果,将其命名其为Enterobacter sp. PRd5。
(2) 菌株PRd5在30 ℃条件下以150 r·min-1摇床避光培养10 d后,对芘(50 mg·L-1)的降解率为41.37%~50.63%,并且对萘、芴和菲等LMW-PAHs具有较高的降解效能,对荧蒽和苯并[a]芘等LMW-PAHs也有一定的降解效能。菌株PRd5降解芘的优化条件:pH值为6.0~8.0,温度为25~35 ℃,外加盐浓度为0~10 g·L-1,100 mL三角瓶中装液量为10~30 mL,细菌接种量为3%~17%,初始ρ(芘)为25~50 mg·L-1,外加碳源为葡萄糖(ρ=100 mg·L-1)。
| [1] |
DASTGHEIB S M M, AMOOZEGAR M A, KHAJEH K, et al. Biodegradation of Polycyclic Aromatic Hydrocarbons by a Halophilic Microbial Consortium[J]. Applied Microbiology and Biotechnology, 2012, 95(3): 789-798. DOI:10.1007/s00253-011-3706-4 (  0) 0) |
| [2] |
GHOSAL D, GHOSH S, DUTTA T K, et al. Current State of Knowledge in Microbial Degradation of Polycyclic Aromatic Hydrocarbons (PAHs):A Review[J]. Frontiers in Microbiology, 2016, 7: 1369. DOI:10.3389/fmicb.2016.01369 (  0) 0) |
| [3] |
RAVELET C, GROSSET C, MONTUELLE B, et al. Liquid Chromatography Study of Pyrene Degradation by Two Micromycetes in a Fresh Water Sediment[J]. Chemosphere, 2001, 44(7): 1541-1546. DOI:10.1016/S0045-6535(00)00531-2 (  0) 0) |
| [4] |
WANG C H, WU S H, ZHOU S L, et al. Polycyclic Aromatic Hydrocarbons in Soils From Urban to Rural Areas in Nanjing:Concentration, Source, Spatial Distribution, and Potential Human Health Risk[J]. Science of the Total Environment, 2015, 527/528: 375-383. DOI:10.1016/j.scitotenv.2015.05.025 (  0) 0) |
| [5] |
HHRISH S, KAVINO M, KUMAR N, et al. Induction of Defense-Related Proteins by Mixtures of Plant Growth Promoting Endophytic Bacteria Against Banana bunchy top virus[J]. Biological Control, 2009, 51(1): 16-25. (  0) 0) |
| [6] |
RYAN R P, GERMAINE K, FRANKS A, et al. Bacterial Endophytes:Recent Developments and Applications[J]. FEMS Microbiology Letters, 2008, 278(1): 1-9. DOI:10.1111/fml.2008.278.issue-1 (  0) 0) |
| [7] |
陈小兵, 盛下放, 何琳燕, 等. 具菲降解特性植物内生细菌的分离筛选及其生物学特性[J]. 环境科学学报, 2008, 28(7): 1308-1313. [ CHEN Xiao-bing, SHENG Xia-fang, HE Lin-yan, et al. Isolation and Characteristics of a Plant Growth-Promoting, Phenanthrene-Degrading Endophytic Bacterium From Plants[J]. Acta Scientiae Circumstantiae, 2008, 28(7): 1308-1313. DOI:10.3321/j.issn:0253-2468.2008.07.008] (  0) 0) |
| [8] |
SUN K, LIU J, JIN L, et al. Utilizing Pyrene-Degrading Endophytic Bacteria to Reduce the Risk of Plant Pyrene Contamination[J]. Plant and Soil, 2014, 374(1/2): 251-262. (  0) 0) |
| [9] |
YAWS C L. Chemical Properties Handbook[M]. New York, USA: McGraw-Hill Education, 1999: 340-389.
(  0) 0) |
| [10] |
SHENG X F, CHEN X B, HE L Y. Characteristics of an Endophytic Pyrene-Degrading Bacterium of Enterobacter sp.12J1 From Allium macrostemon Bunge[J]. International Biodeterioration & Biodegradation, 2008, 62(2): 88-95. (  0) 0) |
| [11] |
GARRITY G M, BELL J A, LILBURN T G.Taxonomic Outline of the Prokaryotic Genera.Bergey's Manual of Systematic Bacteriology[R].New York, USA: Springer, 2003.
(  0) 0) |
| [12] |
GAO Y Z, LI Q L, LING W T, et al. Arbuscular Mycorrhizal Phytoremediation of Soils Contaminated With Phenanthrene and Pyrene[J]. Journal of Hazardous Materials, 2011, 185(2/3): 703-709. (  0) 0) |
| [13] |
GUPTA B, RAJOR A, KAUR J.Isolation, Characterisation of Novel Pseudomonas and Enterobacter sp. From Contaminated Soil of Chandigarh for Naphthalene Degradation[M]//GHOSH S.Utilization and Management of Bioresources.Singapore: Springer, 2018: 175-186.
(  0) 0) |
| [14] |
GUPTA S, PATHAK B, FULEKAR M H. Molecular Approaches for Biodegradation of Polycyclic Aromatic Hydrocarbon Compounds[J]. Reviews in Environmental Science and Bio/Technology, 2015, 14(2): 241-269. DOI:10.1007/s11157-014-9353-3 (  0) 0) |
| [15] |
HWANG S, CUTRIGHT T J. Effect of Expandable Clays and Cometabolism on PAH Biodegradability[J]. Environmental Science and Pollution Research, 2003, 10(5): 277-280. DOI:10.1065/espr2003.08.167 (  0) 0) |
| [16] |
蓝慧, 王翀, 杨辉, 等. 原油降解细菌ODB01的筛选、鉴定及降解特性[J]. 生态与农村环境学报, 2017, 33(5): 466-473. [ LAN Hui, WANG Chong, YANG Hui, et al. Isolation, Identification and Degradation Characters of a Crude Oil-Degrading Strain ODB01[J]. Journal of Ecology and Rural Environment, 2017, 33(5): 466-473.] (  0) 0) |
| [17] |
郝大程, 周建强, 韩君. 土壤重金属和有机污染物的微生物修复:生物强化和生物刺激[J]. 生物技术通报, 2017, 33(10): 9-17. [ HAO Da-cheng, ZHOU Jia-qiang, HAN Jun. Microbial Remediation of Soil Heavy Metal and Organic Pollutants:Bioaugmentation and Biostimulation[J]. Biotechnology Bulletin, 2017, 33(10): 9-17.] (  0) 0) |
| [18] |
王万清.具有芘降解功能的植物内生细菌的分离筛选及其在小麦体内的定殖特性[D].南京: 南京农业大学, 2015. WANG Wan-qing.Isolation of Pyrene-Degrading Endophytic Bacteria and Inculation of Them in Wheat[D].Nanjing: Nanjing Agricultural University, 2015. (  0) 0) |
| [19] |
张杰, 刘永生, 孟玲, 等. 多环芳烃降解菌筛选及其降解特性[J]. 应用生态学报, 2003, 14(10): 1783-1786. [ ZHANG Jie, LIU Yong-sheng, MENG Ling, et al. Isolation and Characteristics of PAH-Degrading Strains[J]. Chinese Journal of Applied Ecology, 2003, 14(10): 1783-1786. DOI:10.3321/j.issn:1001-9332.2003.10.043] (  0) 0) |
| [20] |
TIAN L, MA P, ZHONG J J. Kinetics and Key Enzyme Activities of Phenanthrene Degradation by Pseudomonas mendocina[J]. Process Biochemistry, 2002, 37(12): 1431-1437. DOI:10.1016/S0032-9592(02)00032-8 (  0) 0) |
| [21] |
MACCHI M, MARTINEZ M, TAUIL R M N, et al. Insights Into the Genome and Proteome of Sphingomonas paucimobilis Strain 20006FA Involved in the Regulation of Polycyclic Aromatic Hydrocarbon Degradation[J]. World Journal of Microbiology and Biotechnology, 2018, 34(1): 7. DOI:10.1007/s11274-017-2391-6 (  0) 0) |
| [22] |
JIN H M, KIM J M, LEE H J, et al. Alteromonas as a Key Agent of Polycyclic Aromatic Hydrocarbon Biodegradation in Crude Oil-Contaminated Coastal Sediment[J]. Environmental Science & Technology, 2012, 46(14): 7731-7740. (  0) 0) |
| [23] |
ZAFRA G, TAYLOR T D, ABSALÍN A E, et al. Comparative Metagenomic Analysis of PAH Degradation in Soil by a Mixed Microbial Consortium[J]. Journal of Hazardous Materials, 2016, 318: 702-710. DOI:10.1016/j.jhazmat.2016.07.060 (  0) 0) |
| [24] |
ZENG J, ZHU Q H, WU Y C, et al. Characterization of a Polycyclic Aromatic Ring-Hydroxylation Dioxygenase From Mycobacterium sp.NJS-P[J]. Chemosphere, 2017, 185: 67-74. DOI:10.1016/j.chemosphere.2017.07.001 (  0) 0) |




