金花茶(Camellia nitidissima)为国家一级珍稀濒危植物[1],其天然种群主要分布于我国广西南宁及防城港市的防城区和东兴市等[2]。现有茶花品种多为白色、粉色和红色,缺少黄色,而金花茶花朵金黄色,具蜡质光泽,是培育黄色茶花的优良亲本。金花茶花朵和叶片中含有类黄酮、茶多酚及茶多糖等多种活性成分,具有降血糖、降血脂、降血压和抗肿瘤等药理功效[3]。因此,积极开展珍稀濒危植物金花茶的保护遗传学研究,对推动金花茶资源的有效保护及高效利用具有重要意义。
濒危植物的保育研究不仅仅要保护其种群数量,更重要的是保护其遗传多样性[4]。对稀有濒危和受人类干扰破坏的植物,首先应查明当前种群遗传多样性和遗传结构,明确其种群间及种群内的遗传变异及遗传特性[5]。在金花茶遗传多样性研究方面,有关人员已开展了遗传多样性和遗传结构的随机扩增多态性(randomly amplified polymorphic DNA,RAPD)、区间简单重复序列(inter-simple sequence repeats,ISSR)和扩增片段长度多态性(amplified fragment length polymorphism,AFLP)分析[6-9]。目前,对金花茶掠夺式开发利用使其原有天然资源遭到严重破坏,生态环境的恶化进一步导致种群退化,分布范围不断缩小,种群数量急剧减少。因此,开展现有金花茶资源的遗传多样性与遗传结构研究,进一步评估生态环境及人为干扰因素等对金花茶种群数量及遗传多样性的影响具有重要意义。AFLP标记技术具有重复性好、可靠性强和多态性高等优点[10],在遗传多样性研究中被广泛应用[11-12],可有效应用于金花茶遗传多样性和遗传结构研究[7]。鉴于此,笔者应用AFLP技术对我国现有金花茶天然种群的遗传多样性和遗传结构进行分析,研究其遗传变异规律,为金花茶资源的保护和进一步开发利用提供科学依据。
1 材料与方法 1.1 材料2015—2017年,对我国金花茶资源进行了全面系统的勘察,通过查阅资料、访问和实地踏查发现,目前金花茶天然种群主要存在于广西防城港市防城区,且呈现间断性分布特征,生境片断化严重,个体数量不足1 000株。根据金花茶天然种群分布情况,选择4个种群作为研究对象,其中种群1位于广西防城港市防城区大菉镇,种群2、3和4位于广西防城港市防城区华石镇。采用间隔距离取样法[13],在所选择种群内随机采样,植株距离在50 m以上,每个种群采样个体数量取决于群体规模,共选择110株个体(表 1),采集植株枝条中部南面向阳处成熟叶片5个以上,于变色硅胶中干燥保存备用。
|
|
表 1 金花茶种群采样位置 Table 1 Sampling location of Camellia nitidissima populations |
叶片加液氮后研磨,用CTAB法[13]提取总DNA。
1.3 AFLP实验 1.3.1 酶切与连接反应体系总体积为20 μL,含4 μL DNA模板(50 ng·μL-1),1 μL Adapter,2 μL Hind Ⅲ/Mse Ⅰ,2.5 μL 10×Reaction buffer,2.5 μL 10 mmol·L-1 ATP,1 μL T4 Ligase,7 μL H2O。37 ℃条件下消化5 h,8 ℃条件下消化4 h。
1.3.2 PCR扩增预扩增:反应体系总体积为25 μL,含2 μL连接后模板DNA,18.5 μL双蒸水,0.5 μL dNTPs,1 μL Pre-ampmix,2.5 μL 10×PCR buffer,0.5 μL Taq DNA聚合酶。扩增程序:94 ℃条件下2 min;然后94 ℃条件下30 s,56 ℃条件下30 s,72 ℃条件下80 s,30个循环;最后72 ℃条件下5 min。预扩增产物稀释20倍后作为选择扩增模板。
选择扩增:反应体系总体积为25 μL,其中含2 μL稀释后的预扩增产物,17.5 μL双蒸水,2.5 μL 10×PCR buffer,1 μL Hind Ⅲ引物,1 μL Mse Ⅰ引物,0.5 μL dNTPs和0.5 μL Taq DNA聚合酶。扩增程序:94 ℃条件下4 min;94 ℃条件下30 s,65 ℃条件下30 s,72 ℃条件下80 s;然后每循环1次退火温度递减0.7 ℃,12个循环;94 ℃条件下30 s,55 ℃条件下30 s,72 ℃条件下80 s,23个循环;72 ℃条件下5 min。PCR产物用15 g·L-1琼脂糖凝胶(0.5 μg·mL-1溴化乙锭)于5 V·cm-1电压下电泳90 min,用凝胶成像系统(FR-200A)拍照并记录。
1.4 数据分析扩增产物的电泳结果采用“1-0”系统记录谱带,样品有带记为1,无带或弱带则记为0。应用GenAlEx 6.41软件计算遗传多样性各参数。
| $ {L_{{\rm{PP}}}} = P/{P_{\rm{t}}} \times 100\% 。$ | (1) |
式(1)中,LPP为多态位点(种群中某个位点具有两个等位基因时称该位点为多态位点)百分率,%;P为多态位点数;Pt为总位点数。
| $ H = 1-\sum {X_i}^2。$ | (2) |
| $ {I_{\rm{S}}} =-\sum {X_i}{\rm{ln}}\;{X_i}, $ | (3) |
| $ {N_{\rm{e}}} = 1/\left( {1-H} \right)。$ | (4) |
式(2)~(4)中,H为基因多样性指数;Xi为位点i在种群中出现频率;IS为Shannon信息指数;Ne为有效等位基因数。
观测等位基因数(Na)由直接观测统计得到。
| $ I = \sum {X_i}{Y_i}/\sqrt {\sum {X_i}^2{Y_i}^2}, $ | (5) |
| $ D = {\rm{ln}}\;I。$ | (6) |
式(5)~(6)中,I为遗传一致度;Xi、Yi分别为种群X、Y中第i条基因频率;D为遗传距离。
| $ {F_{{\rm{st}}}} = ({H_{\rm{t}}}-{H_{\rm{s}}})/{H_{\rm{t}}}, $ | (7) |
| $ {N_{\rm{m}}} = (1-{F_{{\rm{st}}}})/4\;{F_{{\rm{st}}}}。$ | (8) |
式(7)~(8)中,Fst为遗传分化系数;Ht为种群总基因多样性指数;Hs为种群内基因多样性指数;Nm为基因流。
根据遗传距离(D)矩阵,采用NTSYSpc 2.0软件,按非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)进行聚类分析,构建聚类图[10-12]。
2 结果与分析 2.1 AFLP扩增位点多态性从48对引物中筛选出扩增产物稳定、重复性好、多态性高且分辨能力强的引物8对,对4个金花茶种群110个个体进行扩增,扩增结果见表 2。由表 2可知,8对引物共扩增出1 619个DNA位点,其中1 473个具多态性,多态性位点百分率为90.98%。8对引物扩增出的DNA位点主要位于70~500 bp之间,DNA位点数介于187~214之间,平均为202.38。引物A-1扩增出的DNA位点数最多,为214;引物C-8扩增出的位点数最少,为187;引物A-1多态性位点百分率最高,为96.26%;引物H-4多态性位点百分率最低,为82.32%。部分样品利用引物B-1和H-4的扩增结果见图 1,可见,引物扩增出的DNA位点数及多态性均较高。
|
|
表 2 金花茶AFLP扩增引物 Table 2 Primers used for AFLP amplification of Camellia nitidissima |
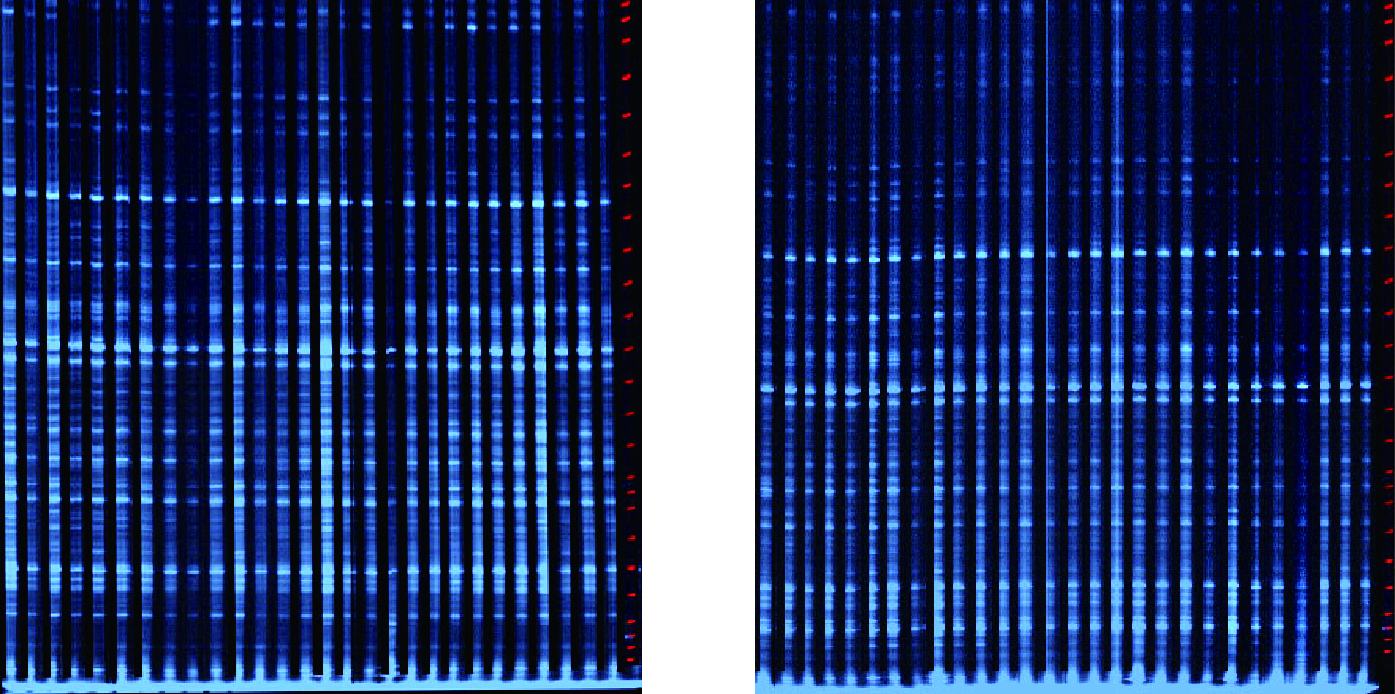
|
图 1 引物B-1和H-4的AFLP扩增结果 Fig. 1 Results of AFLP amplification by prime B-1 and H-4 |
金花茶种群遗传多样性的AFLP分析结果见表 3,金花茶4个天然种群的多态位点百分率以种群3为最低,以种群1为最高。不同种群的基因多样性指数和Shannon信息指数分析结果一致,均以种群2为最高,以种群3为最低。金花茶物种水平基因多样性指数和Shannon信息指数均略高于种群水平, 金花茶物种水平多态位点百分率远高于种群水平。
|
|
表 3 金花茶种群遗传多样性 Table 3 Genetic diversity of Camellia nitidissima populations |
表 4显示,种群间遗传分化系数介于0.139~0.289之间,遗传变异主要存在于种群内;种群间遗传分化系数最小为Pop1和Pop2间,最大为Pop1和Pop3间。种群间的基因流在0.616~1.548之间,最小为Pop1和Pop3间,最大为Pop1和Pop2间。种群遗传变异的分子变异分析(AMOVA)表明,金花茶天然种群间遗传变异为18.48%,种群内遗传变异为81.52%(表 5)。AMOVA分析结果与金花茶种群遗传分化系数结果基本一致,说明金花茶种群间和种群内均发生遗传变异,且种群内变异为主要遗传变异。
|
|
表 4 金花茶种群间遗传分化系数和基因流 Table 4 Genetic differentiation coefficient and gene flow of Camellia nitidissima populations |
|
|
表 5 金花茶种群间和种群内分子变异的方差分析 Table 5 Analysis of molecular variance(AMOVA)among and within Camellia nitidissima populations |
表 6显示,各种群遗传一致度介于0.969~0.984之间,遗传一致度较大,相似性较高,其中Pop1和Pop2种群遗传一致度最高,Pop1和Pop3最低;各种群遗传距离介于0.016~0.032之间,遗传距离较小。根据种群遗传距离,对4个金花茶种群进行UPGMA聚类分析,建立遗传关系的UPGMA聚类图(图 2)。由图 2可知,4个金花茶种群既具有相似遗传背景,又存在一定差异,Pop1和Pop2首先聚类,然后与Pop4聚为一类,Pop3单独聚类。4个金花茶种群未完全按照地理距离进行聚类,说明种群间遗传变异与其地理距离无明显相关性。
|
|
表 6 金花茶种群遗传一致度和遗传距离 Table 6 Genetic identity and genetic distance of Camellia nitidissima populations |
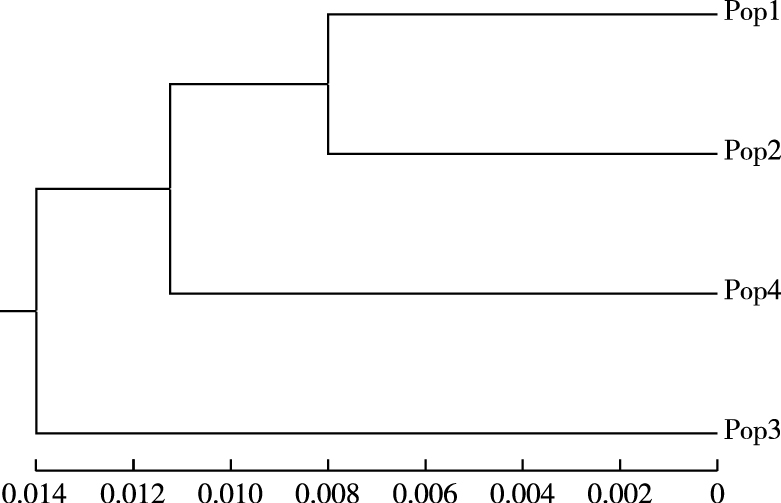
|
图 2 金花茶种群遗传距离聚类 Fig. 2 UPGMA dendrogram of Camellia nitidissima populations based on genetic distance |
RAPD标记通用性强,操作方便,可用于种质资源鉴定及分类研究等,但其可重复性较差,可靠性较低[14];限制性片段长度多态性(restriction fragment length polymorphism,RFLP)标记稳定性强,适用于分析群体遗传变异及亲缘关系,但操作复杂,成本较高,不适于大量样品检测[14];ISSR标记检测便捷,通用性强,在资源鉴定、遗传多样性及系统发育等研究方面被广泛应用[15]。笔者采用的AFLP技术在缺乏分子遗传学背景的植物遗传多样性评价中具有优势,其与RAPD、RFLP和ISSR等均为显性标记,在数据分析上具有一定可比性。4个金花茶天然种群110个个体的AFLP分析结果表明,8对引物共扩增出1 619个DNA位点(平均每条引物202.38个位点),1 473个具有多态性,平均多态位点百分率为90.98%,能有效检测金花茶天然种群遗传多样性。
NYBOM[16]对用不同标记技术研究植物遗传多样性的结果进行了统计分析,结果表明,多年生植物的遗传多样性平均为0.25,区域分布种为0.21。对山茶属广布种山茶(Camellia japonica)的研究表明,我国8个山茶种群和中日13个山茶种群物种水平基因多样性指数分别为0.256 9和0.341 4,高于多年生植物种群平均遗传多样性[17]。毛瓣金花茶(Camellia pubipetala)6个天然种群物种水平基因多样性指数为0.245 1,其遗传多样性亦较高[18]。山茶属濒危植物杜鹃红山茶(Camellia azalea)仅分布于我国广东鹅凰嶂自然保护区,分布范围小于100 km2,仅有1 000余株[19],种群遗传多样性的RAPD和ISSR分析结果表明,杜鹃红山茶基因多样性指数分别为0.143 5和0.219 1[20-21],种群遗传多样性较低。
宾晓芸等[6]利用ISSR技术对4个金花茶天然种群126个个体的研究表明,物种基因多样性指数为0.230 2,Shannon信息指数为0.350 2。TANG等[7]利用RAPD和AFLP技术对6个金花茶天然种群120个个体的研究表明,其物种基因多样性指数为0.269 8和0.244 4,Shannon信息指数为0.404 3和0.368 2。WEI等[8]利用ISSR技术对12个金花茶天然种群的研究发现,金花茶基因多样性指数为0.156 1,Shannon信息指数为0.249 0,且种群规模的大小与其遗传多样性之间无明显相关性。笔者对4个金花茶天然种群110个个体的AFLP分析表明,其物种水平基因多样性指数和Shannon信息指数分别为0.146和0.246,远低于已有金花茶天然种群的ISSR[6]、RAPD和AFLP分析结果[7],亦低于WEI等[8]ISSR研究结果。可见,随着时间推移,金花茶天然种群的遗传多样性大大降低。
山茶遗传结构研究表明,遗传变异主要存在于种群内个体间,地理距离与遗传距离具显著相关性,岛屿地理隔离对山茶种群的遗传分化具有重要影响[17]。罗晓莹等[20]对3种濒危植物的研究表明遗传变异主要存在于种群内,濒危植物杜鹃红山茶的亚种群间遗传分化较小[21]。毛瓣金花茶的遗传变异主要在种群内个体间,种群间的遗传变异较低,种群遗传距离和地理距离之间存在显著相关性[18]。WEI等[8]采用ISSR技术的研究表明,金花茶种群间遗传变异为41.85%,种群内变异为主要遗传变异,TANG等[7]研究亦表明金花茶遗传变异主要存在于种群内。笔者研究中种群遗传变异的AMOVA分析表明,金花茶种群间遗传变异为18.48%,种群内遗传变异为81.52%,种群内变异为主要遗传变异;金花茶种群聚类结果与地理距离不完全相符,种群间遗传变异与其地理距离无明显相关性[18]。
关于金花茶天然种群遗传多样性较低、种群间遗传变异较小等特点,笔者认为主要是两个方面原因共同作用的结果。一是金花茶天然种群虽然曾广泛分布于广西南宁的扈宁区、隆安县和扶绥县及防城港市防城区、东兴市等[2, 9],但随着金花茶开发利用热潮的兴起,强烈的利益驱动使金花茶天然资源几乎被挖掘破坏殆尽。此外,对金花茶花朵的大量需求导致金花茶种子难以形成,进而导致种群幼苗无法获得有效补充。二是随着经济社会发展,大量植被被破坏,金花茶生境严重片断化、破碎化,种群内近交频率、遗传漂变增加,等位基因流失,导致种群的遗传多样性和遗传变异不断降低。可见,人为干扰破坏及生态环境的恶化导致金花茶天然种群严重退化,分布范围不断缩小,种群数量急剧减少,与前期相关研究[6-9]相比,金花茶天然种群的遗传多样性及遗传变异降低,种群间遗传变异与其地理距离无明显相关性。
韦霄等[9]采集了金花茶主要分布区内种子,利用种子培育出的实生树建立了金花茶种质圃,采用ISSR标记对金花茶种质圃内3个种群进行遗传多样性分析,与天然种群遗传参数比较,认为迁地保护基本上保护了金花茶的遗传多样性,具有一定可行性。鉴于金花茶种群遗传变异主要存在于种群内个体间,建议对金花茶现有种群实施就地保护,建立金花茶种群保护区,严禁人为采挖、摘花等干扰活动,同时对其生长环境进行严格保护,保持其生存的生态系统,促进种群自然更新。在就地保护的基础上实施迁地保护,通过采种育苗、扦插繁殖等方式进行人工繁殖,建立种质资源圃进行迁地保护,对人工栽培群体进行仿生栽培、回归自然驯化及回迁等,从而逐渐恢复并保护金花茶种群数量及遗传多样性。
4 结论目前,金花茶物种水平基因多样性指数和Shannon信息指数为0.146和0.246,种群水平基因多样性指数和Shannon信息指数为0.131和0.215,远低于已有金花茶天然种群的研究结果;4个金花茶天然种群的多态位点百分率、基因多样性指数和Shannon信息指数变化趋势一致。金花茶种群内遗传变异为81.52%,种群间遗传变异为18.48%,遗传变异主要存在于种群内个体间;种群间遗传变异与其地理距离无明显相关性。金花茶天然种群遭受了严重的干扰破坏,种群严重退化,分布范围持续缩小,种群数量大幅度减少,遗传多样性大大降低。根据金花茶遗传多样性和遗传结构特点,应建立金花茶天然种群保护区,对种群实施就地保护,同时保护其生境条件及生态系统,促进其种群自然更新;应建立金花茶种质资源圃,进行迁地保护。
| [1] |
傅立国, 金鉴明. 中国植物红皮书:稀有濒危植物(第一册)[M]. 北京: 科学出版社, 1992: 648-649.
(  0) 0) |
| [2] |
梁盛业. 金花茶[M]. 北京: 中国林业出版社, 1993: 1-21.
(  0) 0) |
| [3] |
HE D Y, LI X Y, XUAN S, et al. Camellia nitidissima, C. W. Chi:A Review of Botany, Chemistry and Pharmacology[J]. Phytochemistry Reviews, 2018, 17(2): 327-349. DOI:10.1007/s11101-017-9537-x (  0) 0) |
| [4] |
STINCHCOMBE J R, HOEKSTRA H E. Combining Population Genomics and Quantitative Genetics:Finding the Genes Underlying Ecologically Important Traits[J]. Heredity, 2008, 100(2): 158-170. DOI:10.1038/sj.hdy.6800937 (  0) 0) |
| [5] |
QIU Y X, HONG D Y, FU C X, et al. Genetic Variation in the Endangered and Endemic Species Changium smyrnioides (Apiaceae)[J]. Biochemical Systematics and Ecology, 2004, 32(6): 583-596. DOI:10.1016/j.bse.2003.08.004 (  0) 0) |
| [6] |
宾晓芸, 唐绍清, 周俊亚, 等. 金花茶遗传多样性的ISSR分析[J]. 武汉植物学研究, 2005, 23(1): 20-26. [ BIN Xiao-yun, TANG Shao-qing, ZHOU Jun-ya, et al. ISSR Analysis on Genetic Diversity of Camellia nitidissima Chi(Theaceae) in China[J]. Journal of Wuhan Botanical Research, 2005, 23(1): 20-26. DOI:10.3969/j.issn.2095-0837.2005.01.005] (  0) 0) |
| [7] |
TANG S Q, BIN X Y, WANG L, et al. Genetic Diversity and Population Structure of Yellow Camellia (Camellia nitidissima) in China as Revealed by RAPD and AFLP Markers[J]. Biochemical Genetics, 2006, 44(9/10): 449-461. (  0) 0) |
| [8] |
WEI X, CAO H L, JIANG Y S, et al. Population Genetic Structure of Camellia nitidissima (Theaceae) and Conservation Implications[J]. Botanical Studies, 2008, 49(2): 147-153. (  0) 0) |
| [9] |
韦霄, 韦记青, 蒋水元, 等. 迁地保护的金花茶遗传多样性评价[J]. 广西植物, 2005, 25(3): 215-218. [ WEI Xiao, WEI Ji-qing, JIANG Shui-yuan, et al. Genetic Diversity Evaluation of Ex-Situ Populations of Camellia nitidssima, Detected by ISSR Markers[J]. Guihaia, 2005, 25(3): 215-218. DOI:10.3969/j.issn.1000-3142.2005.03.005] (  0) 0) |
| [10] |
ROSENDAHL S, TAYLOR J W. Development of Multiple Genetic Markers for Studies of Genetic Variation in Arbuscular Mycorrhizal Fungi Using AFLPTM[J]. Molecular Ecology, 1997, 6(9): 821-829. DOI:10.1111/j.1365-294X.1997.tb00136.x (  0) 0) |
| [11] |
CHENG L, LIU L, YU X, et al. A Linkage Map of Common Carp (Cyprinus carpio) Based on AFLP and Microsatellite Markers[J]. Animal Genetics, 2009, 41(2): 191-198. (  0) 0) |
| [12] |
ESCARAVAGE N, QUESTIAU S, PORNON A, et al. Clonal Diversity in a Rhododendron ferrugineum L.(Ericaceae) Population Inferred From AFLP Markers[J]. Molecular Ecology, 1998, 7(8): 975-982. DOI:10.1046/j.1365-294x.1998.00415.x (  0) 0) |
| [13] |
JOSHI S P, GUPTA V S, AGGARWAL P K, et al. Genetic Diversity and Phylogenetic Relationship as Revealed by Inter Simple Sequence Repeat (ISSR) Polymorphism in the Genus Oryza[J]. Theoretical and Applied Genetics, 2000, 100(8): 1311-1320. DOI:10.1007/s001220051440 (  0) 0) |
| [14] |
邱芳, 伏健民, 金德敏, 等. 遗传多样性的分子检测[J]. 生物多样性, 1998, 6(2): 143-150. [ QIU Fang, FU Jian-min, JIN De-min, et al. The Molecular Detection of Genetic Diversity[J]. Chinese Biodiversity, 1998, 6(2): 143-150. DOI:10.3321/j.issn:1005-0094.1998.02.010] (  0) 0) |
| [15] |
王建波. ISSR分子标记及其在植物遗传学研究中的应用[J]. 遗传, 2002, 24(5): 613-616. [ WANG Jian-bo. ISSR Markers and Their Application in Plant Genetics[J]. Hereditas, 2002, 24(5): 613-616. DOI:10.3321/j.issn:0253-9772.2002.05.022] (  0) 0) |
| [16] |
NYBOM H. Comparison of Different Nuclear DNA Markers for Estimating Intraspecific Genetic Diversity in Plants[J]. Molecular Ecology, 2004, 13(5): 1143-1155. DOI:10.1111/mec.2004.13.issue-5 (  0) 0) |
| [17] |
LIN L, HU Z Y, NI S, et al. Genetic Diversity of Camellia japonica(Theaceae), a Species Endangered to East Asia, Detected by Inter-Simple Sequence Repeat (ISSR)[J]. Biochemical Systematics and Ecology, 2013, 50: 199-206. DOI:10.1016/j.bse.2013.03.049 (  0) 0) |
| [18] |
柴胜丰, 庄雪影, 邹蓉, 等. 濒危植物毛瓣金花茶遗传多样性的ISSR分析[J]. 西北植物学报, 2014, 34(1): 93-98. [ CHAI Sheng-feng, ZHUANG Xue-ying, ZOU Rong, et al. Genetic Diversity Analysis of Endangered Plant Camellia pubipetala Detected by ISSR[J]. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(1): 93-98.] (  0) 0) |
| [19] |
李辛雷, 孙振元, 李纪元, 等. 广东鹅凰嶂自然保护区杜鹃红山茶种群结构与空间分布格局[J]. 应用生态学报, 2013, 24(8): 2115-2121. [ LI Xin-lei, SUN Zhen-yuan, LI Ji-yuan, et al. Population Structure and Spatial Distribution Pattern of Camellia azalea in E'huangzhang Nature Reserve of Guangdong, China[J]. Chinese Journal of Applied Ecology, 2013, 24(8): 2115-2121.] (  0) 0) |
| [20] |
罗晓莹, 唐光大, 许涵, 等. 山茶科3种中国特有濒危植物的遗传多样性研究[J]. 生物多样性, 2005, 13(2): 112-121. [ LUO Xiao-ying, TANG Guang-da, XU Han, et al. Genetic Diversity of Three Endemic and Endangered Species of the Family Theaceae in Guangdong, China[J]. Biodiversity Science, 2005, 13(2): 112-121. DOI:10.3321/j.issn:1005-0094.2005.02.004] (  0) 0) |
| [21] |
罗晓莹, 庄雪影, 杨跃生. 杜鹃红山茶遗传多样性的ISSR分析[J]. 热带亚热带植物学报, 2007, 15(2): 93-100. [ LUO Xiao-ying, ZHUANG Xue-ying, YANG Yue-sheng. Genetic Diversity of Camellia changii Ye (Theaceae) Using ISSR Markers[J]. Journal of Tropical and Subtropical Botany, 2007, 15(2): 93-100. DOI:10.3969/j.issn.1005-3395.2007.02.001] (  0) 0) |




