碳纳米管(CNTs)是当前广泛生产和使用的3大纳米材料之一, 已应用于众多领域[1]。由于CNTs持续的开发、生产和应用, 致使其不可避免地释放到环境中, 其在环境中的迁移、转化以及进入环境后的毒性效应和健康风险已越来越引起人们的关注[2]。植物作为生态系统的关键组成部分, 对CNTs存在潜在的累积效应, 被认为是CNTs进入生物循环的重要途径[3-4]。因此, 研究CNTs对植物的生理生化毒性对于评价其生态安全性至关重要。
一般来说, 按照所含石墨烯片的层数可将CNTs分为单壁碳纳米管(SWCNTs)和多壁碳纳米管(MWCNTs)。相对于SWCNTs, MWCNTs更易制取且用途更为广泛。因此人们更为关注MWCNTs的生态安全性。研究表明, MWCNTs对动物[2, 5]、植物[3-4, 6-7]、微生物[8-9]、人体[10-11]均会产生有害作用。CNTs的表面功能化可以改变材料本身的化学和物理学特性, 使其可以更好地分散于介质中, 并具有更佳亲水性、稳定性和生物相容性, 从而增强材料本身的工业化应用潜力[12]。因此, 作为CNTs表面功能化的典型代表, 羧基化多壁碳纳米管(MWCNTs-COOH)比MWCNTs具有更广的市场应用前景, 其进入环境后可能导致的潜在生态风险性更值得关注。
由于具有高比表面积, CNTs进入环境后往往会成为其他污染物的载体, 并对其毒性产生影响[13-14]。重金属污染是一个世界范围内的生态、环境和健康问题, 在多数污染区域能够同时检测到1种以上重金属, 因此, 自然环境中的植物往往暴露于多种重金属的复合污染中。已有研究证明, CNTs具备吸附重金属的能力, 并能够增强重金属离子向植物细胞内部的渗透[14]。在CNTs与重金属复合污染的环境介质中, 两者之间不可避免地会发生相互作用, 进而干扰重金属的环境行为和对生态系统的毒性效应。然而, 国内外有关CNTs复合多种重金属对植物(包括农作物)的生态风险性的研究仍鲜见报道。因此, 研究拟采用蚕豆幼苗作为实验对象, 选取Pb和Cd作为典型重金属, 研究蚕豆幼苗暴露于MWCNTs-COOH、Pb+Cd, 以及Pb+Cd+MWCNTs-COOH复合污染溶液后其叶片组织活性氧(ROS)、抗氧化酶活性及其同工酶图谱、蛋白羰基化产物(氧化损伤蛋白)、热休克蛋白70 (HSP70)、内肽酶(EP)同工酶活性以及非蛋白巯基(NPT)的变化, 以期为早期诊断和科学评价MWCNTs与Pb、Cd复合污染的生态风险性提供科学依据。
1 材料与方法 1.1 MWCNTs-COOHMWCNTs-COOH (纯度w>95%, 羧基质量分数w为2.56%;内径范围3~5 nm; 外径范围8~15 nm; 长度0.5~50 μm; 比表面积233 m·g-2; 灰分w < 1.5%;电导率>100 S·m-1)购自中国科学院成都有机化学研究所。使用前对其进行6次间歇式超声萃取处理〔30 s·(2 min)-1〕, 并利用透射电子显微镜(TEM) (JEM-100CX, 日本)对样品进行表征。在透射电子显微镜下MWCNTs-COOH呈管状结构, 直径为(8.97±1.25) nm (图 1)。

|
图 1 MWCNTs-COOH的透射电镜(TEM)图 Figure 1 TEM image of MWCNTs-COOH |
蚕豆种子(Vicia faba)为淮南当地常见品种(青皮豆)。种子用
超氧自由基(O2·-)的测定参考汪承润等[16]的方法。称取1 g植物叶片, 液氮速冻并立即研磨成粉状, 并在提取液(250 mmol·L-1磷酸缓冲液, pH值8.0, 含10 μmol·L-1磷酸吡哆醛, 1 mmol·L-1乙二胺四乙酸(EDTA), 5 mmol·L-1二硫苏糖醇(DTT)中匀浆, 离心(离心半径9.5 cm, 4 ℃, 10 000 r·min-1)25 min, 上清液用于O2·-测定。分别取1 mmol·L-1NH4Cl和50 mmol·L-1磷酸缓冲液(pH值7.8)各0.5 mL, 加入0.5 mL上清液, 25 ℃水浴60 min, 再分别加入17 mmol·L-1对氨基苯磺酸和7 mmol·L-1 α-萘胺各1 mL, 25 ℃水浴20 min后测定530 nm处吸光度值(OD530 nm), 重复3次。以亚硝酸钠作为底物, 按上述方法制备标准曲线, 根据标准曲线换算出NO2-浓度, 再计算出O2·-含量。
过氧化氢(H2O2)含量测定参考李玲等[17]的方法。称取1 g新鲜叶片, 加入5 mL预冷的丙酮, 冰浴条件下速磨、匀浆, 离心(离心半径9.5 cm, 4 ℃, 12 000 r·min-1)20 min。吸取1 mL上清液, 分别加入0.2 mL浓氨水、0.1 mL
参照WANG等[18-19]的方法制备粗酶液, 所有操作过程均在0~4 ℃条件下进行。参照BRADFORD[20]的方法测定粗酶液蛋白含量。
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)以及过氧化物酶(POD)酶活性参照GARCÍA-LIMONES等[21]的方法测定。SOD酶活性测定:3 mL反应混合液含1.75 mL 50 mmol·L-1磷酸缓冲盐溶液(PBS溶液, pH值7.8)、0.3 mL 0.1 mmol·L-1乙二胺四乙酸二钠(Na2EDTA)、0.3 mL 130 mmol·L-1甲硫氨酸、0.3 mL 750 μmol·L-1 NBT、0.3 mL 20 μmol·L-1核黄素和30 μL酶液, 以酶液抑制氯化硝基四氮唑蓝(NBT)光还原50%的抑制率为1个酶活力单位; CAT酶活性以1 min分解1 μmol H2O2为1个酶活力单位; APX酶活性以1 min氧化1 μmol抗坏血酸为1个酶活力单位; POD酶活性以1 min氧化1 μmol愈创木酚为1个酶活力单位。重复3次。
SOD、APX、POD和CAT同工酶的电泳和显色均参考GARCÍA-LIMONES等[21]的方法进行。应用Bio-Rad Mini-PROTEAN电泳系统和非变性聚丙烯酰胺凝胶电泳(PAGE)分离酶蛋白, 以25 mmol·L-1三羟甲基氨基甲烷(Tris)、192 mmol·L-1甘氨酸(pH值8.3)作为电泳缓冲液, 在4 ℃条件下进行电泳。SOD和APX同工酶电泳的分离胶为100 g·L-1, POD同工酶电泳的分离胶为80 g·L-1, CAT分离胶为60 g·L-1, 积层胶均为50 g·L-1。每个剂量组做3块胶。
1.5 蛋白羰基化产物和HSP70的免疫印迹分析蛋白羰基化产物的免疫印迹参照ROMERO-PUERTAS等[22]的方法并略加改进。50 μL粗酶液与50 μL
HSP70的SDS-PAGE电泳和蛋白质免疫印迹(Western blotting)方法参照WANG等[18]的方法进行。粗酶提取液与裂解缓冲液(0.5 mol·L-1 Tris, pH值6.8,
EP同工酶实验参照DISTEFANO等[23]的方法进行, 略加改进。SDS-PAGE凝胶电泳分离内肽酶同工酶, 80 g·L-1分离胶(内含
NPT产物的测定参照RAMA等[24]提出的方法。称取0.2 g叶片样品, 加5 mL
采用SPSS 16.0统计分析软件进行数据处理与分析, 单因素方差分析(one-way ANOVA)进行数据间的差异显著性检验, 若差异显著(P < 0.05), 采用Duncan法进行多重比较。采用Origin 7.5软件作图。
2 结果与分析 2.1 O2·-和H2O2含量变化如图 2所示,与对照组相比, MWCNTs-COOH单一处理组(以下简称单一组) O2·-含量呈增加趋势, 其中, 5.0~10.0 mg·L-1 MWCNTs-COOH单一组诱导了O2-显著积累(P < 0.05);H2O2含量呈先降低后增加的趋势, 其中5.0~10.0 mg·L-1 MWCNTs-COOH单一组诱导了H2O2显著积累(P < 0.05)。
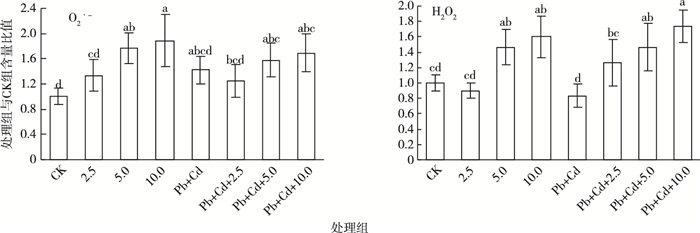
|
图 2 叶片组织超氧自由基(O2·-)和过氧化氢(H2O2)含量变化 Figure 2 Changes of O2·- and H2O2 contents in leaves CK为对照;2.5、5.0、10.0分别表示2.5、5.0、10.0 mg·L-1MWCNTs-COOH;Pb+Cd表示20.0 μmol·L-1Pb+5.0 μmol·L-1Cd。同一幅图中直方柱上方小写字母不同表示处理间某指标差异显著(P < 0.05)。 |
与Pb+Cd处理组相比, MWCNTs-COOH复合Pb+Cd处理组(以下简称复合组) O2·-含量呈先降低后增加的趋势, 但各处理组无显著差异; H2O2含量随着MWCNTs-COOH的浓度增加而显著积累(P < 0.05)。
MWCNTs-COOH复合组与MWCNTs-COOH单一组相比, O2·-含量在MWCNTs-COOH质量浓度为2.5 mg·L-1时, 复合组高于单一组; 在MWCNTs-COOH质量浓度为5.0~10.0 mg·L-1时, 复合组低于单一组。H2O2含量在MWCNTs-COOH质量浓度为2.5和10.0 mg·L-1时, 复合组高于单一组; 在MWCNTs-COOH质量浓度为5.0 mg·L-1时, 复合组低于单一组。
2.2 4种抗氧化酶活性及同工酶图谱的变化如图 3所示,与对照组相比, MWCNTs-COOH单一组SOD酶活性呈升高趋势, 5.0~10.0 mg·L-1MWCNTs-COOH单一组诱导了SOD酶活性显著升高(P < 0.05)。CAT和APX酶活性呈先升高后降低的趋势, 当MWCNTs-COOH质量浓度为5.0 mg·L-1时, CAT和APX酶活性最强, 其中各单一组CAT酶活性显著升高(P < 0.05), 5.0~10.0 mg·L-1MWCNTs-COOH单一组APX酶活性被显著诱导(P < 0.05)。POD酶活性呈先升高后降低的趋势, 当MWCNTs-COOH质量浓度为2.5 mg·L-1时, POD酶活性最强, 其中2.5 mg·L-1 MWCNTs-COOH单一组POD酶活性被显著诱导(P < 0.05)。
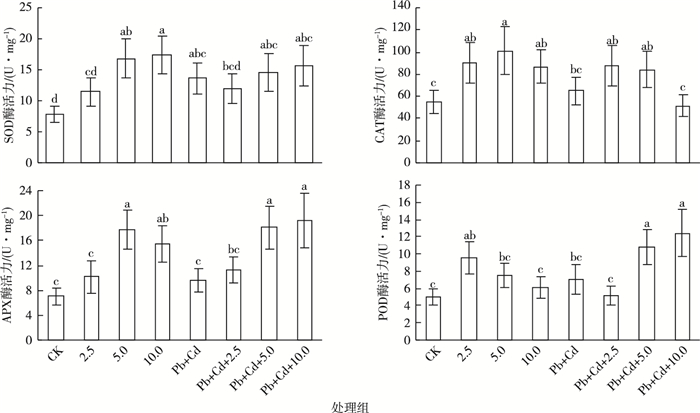
|
图 3 叶片组织SOD、CAT、APX和POD酶活力变化 Figure 3 Changes of SOD, CAT, APX and POD enzymes activities in leaves CK为对照;2.5、5.0、10.0分别表示2.5、5.0、10.0 mg·L-1MWCNTs-COOH;Pb+Cd表示20.0 μmol·L-1Pb+5.0 μmol·L-1Cd。同一幅图中直方柱上方小写字母不同表示处理间某指标差异显著(P < 0.05)。SOD酶活性以酶液抑制NBT光还原50%的抑制率为1个酶活力单位; CAT酶活性以1 min分解1 μmol H2O2为1个酶活力单位; APX酶活性以1 min氧化1 μmol抗坏血酸为1个酶活力单位; POD酶活性以1 min氧化1 μmol愈创木酚为1个酶活力单位。 |
与Pb+Cd处理组相比, MWCNTs-COOH复合组SOD和POD酶活性呈先降低后升高的趋势, 其中各复合组SOD酶活性未见显著性升高(P>0.05), 5.0~10.0 mg·L-1 MWCNTs-COOH复合组诱导了POD酶活性显著升高(P < 0.05)。CAT酶活性呈先升高后降低的趋势, 其中, 各复合组CAT酶活性未见显著性升高。APX酶活性呈升高趋势, 其中5.0~10.0 mg·L-1 MWCNTs-COOH复合组诱导了APX酶活性显著升高(P < 0.05)。
MWCNTs-COOH复合组与MWCNTs-COOH单一组相比, SOD酶活性在MWCNTs-COOH质量浓度为2.5 mg·L-1时, 复合组高于单一组; 在MWCNTs-COOH质量浓度为5.0~10.0 mg·L-1时, 复合组低于单一组。在各浓度MWCNTs-COOH条件下, CAT酶活性均表现为复合组低于单一组, 当MWCNTs-COOH质量浓度为10.0 mg·L-1时, 两者差异显著(P < 0.05)。在各浓度MWCNTs-COOH条件下, APX酶活性均表现为复合组均高于单一组。在MWCNTs-COOH质量浓度为2.5 mg·L-1时, POD酶活性表现为复合组显著低于单一组(P < 0.05);在MWCNTs-COOH质量浓度为5.0~10.0 mg·L-1时, 复合组显著高于单一组(P < 0.05)。
由图 4可以看出, 各处理组4种抗氧化酶同工酶图谱和带型光密度(代表酶活性)变化不尽相同。SOD同工酶图谱均显现4行带。CAT同工酶图谱只出现1行带。APX同工酶图谱在复合组中均诱导了3行带的出现, 而其他处理组只有2行带。POD同工酶图谱在5.0~10.0 mg·L-1单一组诱导了带型数量的减少和带型光密度的变化(与对照组相比); 在2.5 mg·L-1复合组诱导了带型数量和带型光密度明显减少, 而5.0~10.0 mg·L-1复合组诱导了带型光密度显著增加(与Pb+Cd处理组相比)。比较各处理组的酶活性(图 3)与其同工酶带型光密度(图 4), 发现两者变化趋势基本一致。
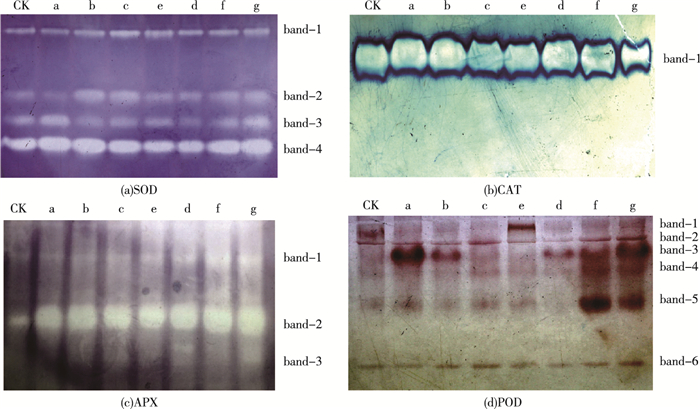
|
图 4 叶片组织SOD、CAT、APX和POD同工酶图谱的变化 Figure 4 Changes of SOD, CAT, APX and POD isozyme patterns in leaves CK为对照组; a为2.5 mg·L-1 MWCNTs-COOH; b为5.0 mg·L-1 MWCNTs-COOH; c为10.0 mg·L-1 MWCNTs-COOH; d为20 μmol·L-1Pb+5μmol·L-1Cd; e为20 μmol·L-1Pb+5 μmol·L-1Cd+2.5 mg·L-1 MWCNTs-COOH; f为20 μmol·L-1 Pb+5 μmol·L-1Cd+5 mg·L-1 MWCNTs-COOH; g为20 μmol·L-1Pb+5 μmol·L-1Cd+10 mg·L-1 MWCNTs-COOH。 |
如图 5所示,与对照组相比, MWCNTs-COOH单一组蛋白羰基化产物的带型光密度呈先降低再升高的趋势。与Pb+Cd处理组相比, MWCNTs-COOH复合组蛋白羰基化产物的带型光密度亦呈先降低再升高的趋势。同一浓度MWCNTs-COOH条件下, MWCNTs-COOH复合组蛋白羰基化产物的带型光密度始终高于MWCNTs-COOH单一组。
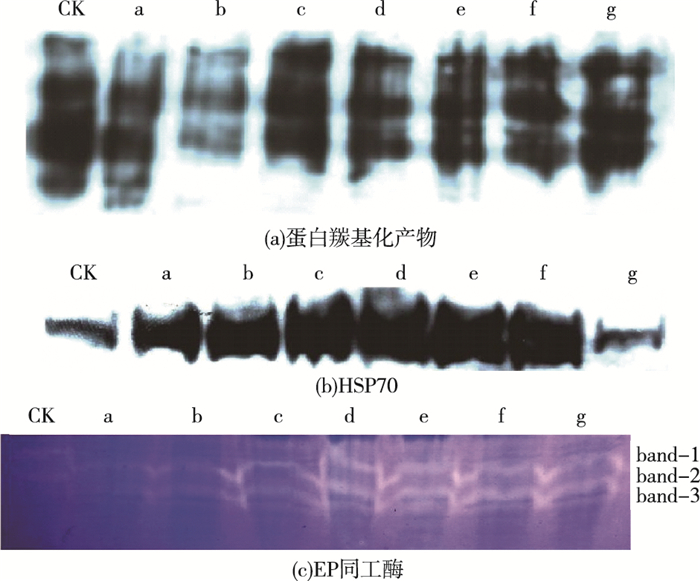
|
图 5 叶片组织蛋白羰基化产物、HSP70和EP同工酶图谱的变化 Figure 5 Changes of carbonylated proteins, HSP70 and EP isozymes patterns in leaves CK为对照组; a为2.5 mg·L-1 MWCNTs-COOH; b为5.0 mg·L-1 MWCNTs-COOH; c为10.0 mg·L-1 MWCNTs-COOH; d为20 μmol·L-1Pb+5μmol·L-1Cd; e为20 μmol·L-1Pb+5 μmol·L-1 Cd+2.5 mg·L-1 MWCNTs-COOH; f为20 μmol·L-1Pb+5 μmol·L-1Cd+ 5 mg·L-1 MWCNTs-COOH; g为20 μmol·L-1Pb+ 5 μmol·L-1Cd+10 mg·L-1 MWCNTs-COOH。 |
与对照组相比, MWCNTs-COOH单一组HSP70含量呈升高趋势。与Pb+Cd处理组相比, MWCNTs-COOH复合组HSP70含量呈降低趋势。MWCNTs-COOH复合组与MWCNTs-COOH单一组相比, 在MWCNTs-COOH质量浓度为2.5~5.0 mg·L-1时, HSP70含量表现为复合组明显高于单一组; 但MWCNTs-COOH质量浓度为10.0 mg·L-1时, HSP70含量表现为复合组远低于单一组。
EP同工酶图谱可见3行白色带, 且带型数量未见增减, 但其光密度发生明显改变。各处理组EP同工酶带型光密度均高于对照组, 且总体呈上升趋势, 表明其酶活性被诱导而升高。
2.4 NPT产物含量的变化如图 6所示,与对照组相比, MWCNTs-COOH单一组NPT含量呈先升高后降低再升高的趋势, MWCNTs-COOH单一组NPT含量始终高于对照组。10.0 mg·L-1 MWCNTs-COOH单一组诱导了NPT含量显著升高(P < 0.05)。与Pb+Cd单一组相比, MWCNTs-COOH复合组NPT含量呈先略微降低再升高趋势, 其中5.0~10.0 mg·L-1 MWCNTs-COOH复合组NPT含量被显著诱导(P < 0.05)。与MWCNTs-COOH单一组相比, MWCNTs-COOH复合组NPT含量在各浓度MWCNTs-COOH条件下均高于单一组, 且MWCNTs-COOH质量浓度为5.0~10.0 mg·L-1时两者差异显著(P < 0.05)。
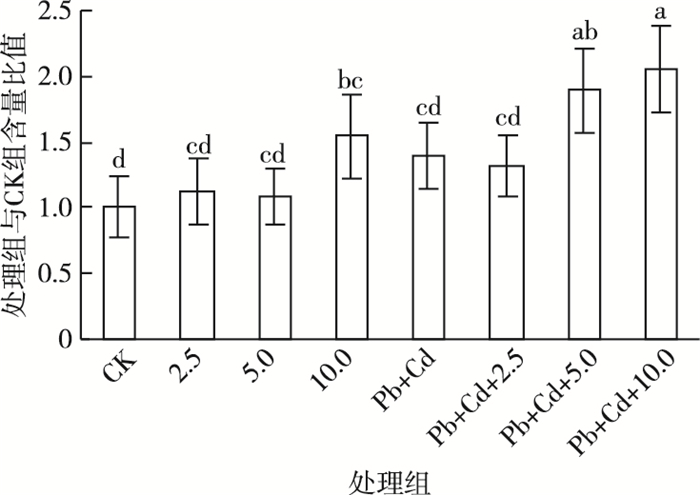
|
图 6 叶片组织非蛋白巯基产物含量变化 Figure 6 Changes of non-protein thiol contents in leaves CK为对照;2.5、5.0、10.0分别表示2.5、5.0、10.0 mg·L-1MWCNTs-COOH;Pb+Cd表示20.0 μmol·L-1Pb+5.0 μmol·L-1Cd。直方柱上方小写字母不同表示处理间某指标差异显著(P < 0.05)。 |
植物通过各种途径产生O2·-和H2O2, 它们性质活泼, 有很强的氧化能力, 对许多生物功能分子都有破坏作用, 称为活性氧(ROS)。有研究表明, ROS的迅速积累及所导致的氧化损伤被认为是MWCNTs积聚而导致植物毒性的根本原因[4, 6-7]。该研究中, 无论是MWCNTs-COOH单一处理还是MWCNTs-COOH与Pb+Cd复合暴露, MWCNTs-COOH均显著诱导了蚕豆幼苗叶片中O2·-和H2O2的大量产生和积累, 且MWCNTs-COOH浓度越高, O2·-和H2O2的累积量越大, ROS的大量产生和积累必然会加剧叶片组织的氧化损伤和毒性效应。而且, 过量的O2·-和H2O2可以通过Haber-Weiss或Fenton途径转变为毒性更强的OH, 导致细胞组分遭受更大的毒性效应。伴随着上述活性氧自由基的积累, 细胞中蛋白质羰基化水平呈上升趋势。
3.2 MWCNTs-COOH、Pb+Cd及其复合暴露对4种抗氧化酶活性及同工酶图谱的影响ROS也是信号分子, 可以诱导植物体的氧化应激反应[25]。为了控制ROS的产生和积累, 植物体通常通过上调一系列抗氧化酶同工酶的合成来缓解ROS积累可能导致的氧化损伤。如SOD酶可以将O2·-转化为H2O2和O2; CAT和POD酶可以将H2O2转化为H2O和O2; APX酶是抗坏血酸-谷胱甘肽循环的重要组分, 参与清除H2O2[16]。该研究中, MWCNTs-COOH单一、Pb+Cd及其复合暴露均诱导了上述4种抗氧化酶同工酶及其活性不同程度升高。这在一定程度上减少了ROS的积累, 缓解了MWCNTs-COOH及Pb+Cd对蚕豆幼苗的氧化胁迫。部分抗氧化酶活性在高浓度MWCNTs-COOH条件下降低, 这可能是由于过量的ROS累积超出了防御酶系统的清除能力, 并抑制了酶活性, 反映出各种抗氧化酶活性对ROS的清除能力及敏感性或耐受力的不同。值得注意的是, 无论是MWCNTs-COOH单一处理, 还是MWCNTs-COOH与Pb+Cd复合暴露, 当MWCNTs-COOH质量浓度为2.5 mg·L-1时, 与对照组相比, 只有CAT酶活性被显著诱导(P < 0.05)。因此, CAT可作为诊断MWCNTs-COOH或MWCNTs-COOH复合重金属环境污染的敏感的生物标志物。这与10.0 mg·L-1 MWCNTs-COOH与Pb+Cd的复合导致CAT酶活性是唯一降低至对照组以下的处理这一结论也是一致的, 即CAT酶活性的敏感性再次被证明。此外, MWCNTs-COOH复合组中SOD和CAT酶活性低于MWCNTs-COOH单一组, APX和POD酶活性高于MWCNTs-COOH单一组, 这应与Pb+Cd的作用有关。
3.3 MWCNTs-COOH、Pb+Cd及其复合暴露对蛋白羰基化产物、HSP70和EP同工酶图谱的影响当ROS自由基的积累超出抗氧化酶的清除能力时, 自由基通过直接氧化修饰蛋白质分子的氨基酸侧链, 或者与脂质过氧化, 或糖基化的醛基产物发生次级作用, 进而诱导多肽链中羰基化基团的产生和积累[22, 26]。因此, 可以利用羰基化衍生物含量的高低来判定植物组织细胞氧化损伤的程度。该研究中, 无论是MWCNTs-COOH单一处理, 还是MWCNTs-COOH与Pb+Cd复合暴露, 当MWCNTs-COOH质量浓度增加至10.0 mg·L-1时, 蛋白质分子的羰基化水平显著升高, 表明此时叶片组织正遭受严重的氧化损伤, 这与O2·-和H2O2在此时累积量最大的结果也是相符的。当MWCNTs-COOH质量浓度为5.0和10.0 mg·L-1, MWCNTs-COOH复合组蛋白羰基化产物的带型光密度要高于Pb+Cd处理组, 当MWCNTs-COOH质量浓度为10.0 mg·L-1时尤为明显, 说明MWCNTs-COOH的添加加剧了叶片的氧化损伤。
有研究报道, 异常蛋白的积累可诱导HSP基因的表达[27]。HSP70的生理功能涉及到变性蛋白质分子的修复或降解、细胞自稳态的维持及生物体对各种胁迫因子的适应, 通常被作为监测植物环境胁迫的生物标志物[28]。该研究中, 羰基化蛋白的含量变化与叶片组织中HSP70产物的合成关系密切。MWCNTs-COOH单一组与对照相比, HSP70的合成呈增加趋势, 且显著升高, 表明由于MWCNTs-COOH加入及浓度的不断升高, 导致了蚕豆幼苗叶片细胞氧化胁迫损伤的加剧, 进一步诱导了HSP70的合成并参与到氧化损伤蛋白的修复过程当中; 随着HSP70含量的增加, 在一定MWCNTs-COOH浓度范围内羰基化蛋白呈现降低, 但当MWCNTs-COOH质量浓度为10.0 mg·L-1时, 虽然HSP含量最多, 但羰基化蛋白反而增加, 这说明自由基诱导的氧化损伤蛋白的积累超出了HSP70的清除能力。MWCNTs-COOH复合组与Pb+Cd处理组相比, HSP70的含量呈下降趋势, 表明MWCNTs-COOH加入抑制了HSP70的合成; 当MWCNTs-COOH质量浓度为2.5和5.0 mg·L-1时, 复合组HSP70及羰基化蛋白的含量明显要高于对照组和MWCNTs-COOH单一组, 表明其细胞氧化损伤程度与MWCNTs-COOH单一组相比更甚; 同时, 当MWCNTs-COOH质量浓度为10.0 mg·L-1时, 虽然羰基化蛋白的含量最高, 但HSP70的含量却出现极为明显的降低, 表明此时氧化胁迫已经远远超出了HSP70蛋白的修复能力, HSP70蛋白本身可能已经失活或损伤。可以看出, MWCNTs-COOH复合组的毒性效应明显更强。
实际上, 复合污染按污染物之间的相互关系可分为非交互作用(剂量加加、效应加加作用)和交互作用(协同、拮抗作用)[29]。该研究中, MWCNTs-COOH复合Pb+Cd污染是属于非交互作用还是交互作用中的协同作用,尚需结合其他实验数据综合判断。如后续研究可以对MWCNTs-COOH复合组蚕豆幼苗叶片组织中的重金属含量进行定量测定, 如与Pb+Cd处理组大体相当, 则可判断是非交互作用, 反之, 则可断定是协同作用。同时, HSP70蛋白的诱导表达和响应水平较敏感, 可作为指示MWCNTs-COOH或MWCNTs-COOH复合重金属环境污染诱导蚕豆幼苗叶片组织早期氧化胁迫的生物标志物。另外, ROS也被证明与HSP70的表达有关[30-31]。结合该研究, 笔者认为, 高浓度的MWCNTs-COOH通过ROS途径诱导了蚕豆幼苗叶片组织内氧化修饰蛋白的产生和积累, 进而诱导了HSP70表达水平的升高。
细胞内被氧化修饰的蛋白质分子通常可被胞内蛋白降解酶(如EP等)选择性降解, 在植物组织中也存在这种现象[32]。EP有多个同工酶, 用于降解衰老或氧化胁迫诱导的损伤蛋白[23, 26]。该研究中, 无论是MWCNTs-COOH单一处理, 还是MWCNTs-COOH与Pb+Cd复合暴露, 均诱导了EP同工酶活性的升高, MWCNTs-COOH浓度越高, 酶活性升高越明显, 且MWCNTs-COOH与Pb+Cd复合后, EP酶活性提升尤为明显, 表明暴露于高浓度的MWCNTs-COOH的蚕豆幼苗叶片组织内大量的氧化损伤蛋白正被EP促进降解。因此, 羰基化蛋白的产生和积累可能是诱导EP同工酶活性升高的因子之一, EP同工酶活性的诱导是蚕豆幼苗解毒的机制之一。值得注意的是, 不论是MWCNTs-COOH单一处理, 还是MWCNTs-COOH与Pb+Cd复合暴露, 在MWCNTs-COOH质量浓度为10.0 mg·L-1时, 虽然EP同工酶的活性升高, 但蛋白羰基化产物的含量反而增加, 这表明蚕豆叶片组织的氧化损伤已非常严重, EP同工酶活性虽趋于升高, 但可能已超出其降解清除能力。
3.4 MWCNTs-COOH、Pb+Cd及其复合暴露对NPT产物的影响巯基化合物在植物对重金属耐受和解毒中起到重要作用, 而其中关系最紧密的当属谷胱甘肽(GSH)、植物络合素(PC)和半胱氨酸(Cys)在内的NPT物质[24, 33]。植物利用NPT中的重要组分, 即GSH合成PC, 与重金属鳌和形成无毒的络合物转运到胞外或储存在液泡等细胞器内, 以降低重金属离子的毒性[34]。该研究中, 所有处理组叶片组织中NPT产物与对照相比均呈增加趋势, 且10.0 mg·L-1 MWCNTs-COOH单一组、5.0和10.0 mg·L-1 MWCNTs-COOH复合组与对照相比差异显著, 表明MWCNTs-COOH和Pb+Cd胁迫下蚕豆幼苗可通过合成大量NPT产物以缓解外源污染物的氧化损伤或毒害程度。同时, NPT产物中的GSH还是植物体内重要的抗氧化剂和信号物质[35], GSH可以直接降低细胞内H2O2含量[36]。因此, MWCNTs-COOH单一组中, 各处理组的NPT均高于对照组, 但溶液中并无重金属, 这应是由于MWCNTs-COOH诱导了H2O2的大量产生和积累, 从而进一步诱导GSH的合成所致。MWCNTs-COOH复合Pb+Cd后, 各处理组的NPT产物含量与Pb+Cd处理组相当或显著高于Pb+Cd处理组, 这可能是由于外源MWCNTs-COOH加剧了植物叶片中Pb+Cd的富集, 而重金属元素的富集进一步诱导了NPT合成及含量的显著增加。
4 结论(1) MWCNTs-COOH单一或MWCNTs-COOH复合Pb+Cd诱导了蚕豆幼苗叶片组织中O2·-和H2O2的大量产生和积累, 且MWCNTs-COOH浓度越高, O2·-和H2O2的累积量越大。ROS的大量产生和积累加剧了蚕豆幼苗叶片组织的氧化损伤和毒性效应, 导致氧化损伤蛋白(蛋白羰基化产物)的显著增加。
(2) ROS作为信号分子诱导了SOD、CAT、APX及POD等同工酶及其酶活性的升高, 增强了蚕豆幼苗叶片清除ROS的能力, 一定程度上减缓了自由基的积累。HSP70的诱导表达和EP同工酶活性的升高表明细胞内损伤蛋白的修复或促进降解活性的增加。同时, NPT产物的合成亦被显著诱导, 以降低重金属离子的毒性和细胞内H2O2的含量。
(3) 与Pb+Cd单一处理相比, MWCNTs-COOH与Pb+Cd复合后抑制了HSP70的合成, 促进了蛋白羰基化和NPT产物的累积, 并显著提升了EP酶活性, 加剧了叶片的氧化损伤和蛋白降解。
| [1] |
DE VOLDER M F, TAWFICK S H, BAUGHMAN R H, et al. Carbon Nanotubes:Present and Future Commercial Applications[J]. Science, 2013, 339(6119): 535-539. DOI:10.1126/science.1222453 (  0) 0) |
| [2] |
贾建博, 江翠娟, 闫兵. 纳米材料在易感群体小鼠模型中的潜在毒性[J]. 科学通报, 2017, 62(24): 2749-2757. [ JIA Jian-bo, JIANG Cui-juan, YAN Bing. Potential Nanotoxicity in Susceptible Populations:Insight From Investigation of Mouse Models[J]. Chinese Science Bulletin, 2017, 62(24): 2749-2757.] (  0) 0) |
| [3] |
LAHIANI M H, DERVISHI E, CHEN J, et al. Impact of Carbon Nanotube Exposure to Seeds of Valuable Crops[J]. ACS Applied Materials & Interfaces, 2013, 5(16): 7695-7973. (  0) 0) |
| [4] |
BEGUM P, IKHTIARI R, FUGETSU B. Potential Impact of Multi-Walled Carbon Nanotubes Exposure to the Seedling Stage of Selected Plant Species[J]. Nanomaterials, 2014, 4(2): 203-221. DOI:10.3390/nano4020203 (  0) 0) |
| [5] |
刘珊珊, 龙奕, 王萌, 等. 沉积物-底栖动物体系中多壁碳纳米管对镉生态毒性的影响[J]. 生态与农村环境学报, 2015, 31(3): 414-419. [ LIU Shan-shan, LONG Yi, WANG Meng, et al. Effects of Multiwalled Carbon Nanotubes on Ecotoxicity of Cd in Sediment-Zoobenthos System[J]. Journal of Ecology Rural Environment, 2015, 31(3): 414-419.] (  0) 0) |
| [6] |
BEGUM P, FUGETSU B. Phytotoxicity of Multi-Walled Carbon Nanotubes on Red Spinach (Amaranthus tricolor L.) and the Role of Ascorbic Acid as an Antioxidant[J]. Journal of Hazardous Materials, 2012, 243: 212-222. DOI:10.1016/j.jhazmat.2012.10.025 (  0) 0) |
| [7] |
TAN X M, LIN C, FUGETSU B. Study on Toxicity of Multi-Walled Carbon Nanotubes on Suspension Rice Cells[J]. Carbon, 2009, 47(15): 3479-3487. DOI:10.1016/j.carbon.2009.08.018 (  0) 0) |
| [8] |
YADAV T, MUNGRAY A A, MUNGRAY A K. Effect of Multiwalled Carbon Nanotubes on UASB Microbial Consortium[J]. Environmental Science & Pollution Research, 2016, 23(5): 4063-4072. (  0) 0) |
| [9] |
SIMON-DECKERS A, LOO S, MAYNE-L'HERMITE M, et al. Size-, Composition-and Shape-Dependent Toxicological Impact of Metal Oxide Nanoparticles and Carbon Nanotubes Toward Bacteria[J]. Environmental Science & Technology, 2009, 43(21): 8423-8429. (  0) 0) |
| [10] |
CAVALLO D, FANIZZA C, URSINI C L, et al. Multiwalled Carbon Nanotubes Induce Cytotoxicity and Genotoxicity in Human Lung Epithelial Cells[J]. Journal of Applied Toxicology, 2012, 32(6): 454-464. DOI:10.1002/jat.v32.6 (  0) 0) |
| [11] |
ZHANG Y, WANG Y B, LIU A J, et al. Modulation of Carbon Nanotubes' Perturbation to the Metabolic Activity of CYP3A4 in the Liver[J]. Advanced Functional Materials, 2016, 26(6): 841-850. DOI:10.1002/adfm.v26.6 (  0) 0) |
| [12] |
MALLAKPOUR S, ZADEHNAZARI A. A Facile, Efficient, and Rapid Covalent Functionalization of Multi-Walled Carbon Nanotubes With Natural Amino Acids Under Microwave Irradiation[J]. Progress in Organic Coatings, 2014, 77(3): 679-684. DOI:10.1016/j.porgcoat.2013.12.003 (  0) 0) |
| [13] |
SUN K, ZHANG Z Y, GAO B, et al. Adsorption of Diuron, Fluridone and Norflurazon on Single-Walled and Multi-Walled Carbon Nanotubes[J]. Science of the Total Environment, 2012, 439: 1-7. DOI:10.1016/j.scitotenv.2012.08.022 (  0) 0) |
| [14] |
KIM K T, EDGINGTON A J, KLAINE S J, et al. Influence of Multiwalled Carbon Nanotubes Dispersed in Natural Organic Matter on Speciation and Bioavailability of Copper[J]. Environmental Science & Technology, 2009, 43(23): 8979-8984. (  0) 0) |
| [15] |
LUCRETTI S, NARDI L, NISINI P T, et al. Bivariate Flow Cytometry DNA/BrdUrd Analysis of Plant Cell Cycle[J]. Methods in Cell Science, 1999, 21(2/3): 155-166. DOI:10.1023/A:1009893008892 (  0) 0) |
| [16] |
汪承润, 王晓蓉, 于红霞, 等. 运用蚕豆幼苗叶片生物标志物评价铅污染土壤[J]. 环境科学, 2008, 29(11): 261-266. [ WANG Cheng-run, WANG Xiao-rong, YU Hong-xia, et al. Evaluation of Soil Contamination by Biomarkers in Leaves of Vicia faba L. Seedlings[J]. Environmental Science, 2008, 29(11): 261-266.] (  0) 0) |
| [17] |
李玲, 李娘辉, 蒋素梅, 等. 植物生理学模块实验指导[M]. 北京: 科学出版社, 2009: 84-86.
(  0) 0) |
| [18] |
WANG C R, LUO X, TIAN Y, et al. Biphasic Effects of Lanthanum on Vicia faba L. Seedlings Under Cadmium Stress, Implicating Finite Antioxidation and Potential Ecological Risk[J]. Chemosphere, 2012, 86(5): 530-537. DOI:10.1016/j.chemosphere.2011.10.030 (  0) 0) |
| [19] |
WANG C R, XIAO J J, TIAN Y, et al. Antioxidant and Prooxidant Effects of Lanthanum Ions on Vicia faba L. Seedlings Under Cadmium Stress, Suggesting Ecological Risk[J]. Environmental Toxicology and Chemistry, 2012, 31(6): 1355-1362. DOI:10.1002/etc.v31.6 (  0) 0) |
| [20] |
BRADFORD M M. A Rapid and Sensitive Method for the Quantification of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding[J]. Analytical Biochemistry, 1976, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 (  0) 0) |
| [21] |
GARCÍA-LIMONES C, HERVÁS A, NAVAS-CORTÉS J A, et al. Induction of an Antioxidant Enzyme System and Other Oxidative Stress Markers Associated With Compatible and Incompatible Interactions Between Chickpea (Cicer arietinum L.) and Fusarium oxysporum f. sp. ciceris[J]. Physiological and Molecular Plant Pathology, 2006, 61(6): 325-337. (  0) 0) |
| [22] |
ROMERO-PUERTAS M C, MCCARTHY I, GÓMEZ M, et al. Reactive Oxygen Species-Mediated Enzymatic Systems Involved in the Oxidative Action of 2, 4-Dichlorophenoxyacetic Acid[J]. Plant, Cell & Environment, 2004, 27(9): 1135-1148. (  0) 0) |
| [23] |
DISTEFANO S, PALMA J M, GÓMEZ M, et al. Characterization of Endoproteases From Plant Peroxisomes[J]. The Biochemical Journal, 1997, 327(2): 399-405. DOI:10.1042/bj3270399 (  0) 0) |
| [24] |
RAMA D S, PRASAD M N V. Copper Toxicity in Ceratophyllum demersum L.(Coontail), a Free Floating Macrophyte:Response of Antioxidant Enzymes and Antioxidants[J]. Plant Science, 1998, 138(2): 157-165. DOI:10.1016/S0168-9452(98)00161-7 (  0) 0) |
| [25] |
VRANOVÁE, INZÉ D, VAN BREUSEGEM F. Signal Transduction During Oxidative Stress[J]. Journal of Experimental Botany, 2002, 53(372): 1227-1236. DOI:10.1093/jexbot/53.372.1227 (  0) 0) |
| [26] |
ROMERO-PUERTAS M C, PALMA J M, GÓMEZ M, et al. Cadmium Causes the Oxidative Modification of Proteins in Pea Plants[J]. Plant, Cell & Environment, 2002, 25(5): 677-686. (  0) 0) |
| [27] |
CRAIG E A, GROSS C A. Is Hsp70 the Cellular Thermometer?[J]. Trends in Biochemical Sciences, 1991, 16: 135-140. DOI:10.1016/0968-0004(91)90055-Z (  0) 0) |
| [28] |
SAIDI Y, DOMINI M, CHOY F, et al. Activation of the Heat Shock Response in Plants by Chlorophenols:Transgenic Physcomitrella Patens as a Sensitive Biosensor for Organic Pollutants[J]. Plant, Cell & Environment, 2007, 30(6): 753-763. (  0) 0) |
| [29] |
陈希超, 韩倩, 向明灯, 等. 重金属和有机物复合污染对土壤酶活力的影响研究进展[J]. 环境与健康杂志, 2016, 33(9): 841-845. [ CHEN Xi-chao, HAN Qian, XIANG Ming-deng, et al. Combined Pollution of Heavy Metals and Organic Pollutants on Soil Enzymes Activity:A Review of Recent Studies[J]. Journal of Environment and Health, 2016, 33(9): 841-845.] (  0) 0) |
| [30] |
GUPTA S C, SIDDIQUE H R, SAXENA D K, et al. Hazardous Effect of Organophosphate Compound, Dichlorvos in Transgenic Drosophila melanogaster (hsp70-lacZ):Induction of Hsp70, Anti-Oxidant Enzymes and Inhibition of Acetylcholinesterase[J]. Biochimica et Biophysica Acta, 2005, 1725(1): 81-92. DOI:10.1016/j.bbagen.2005.04.033 (  0) 0) |
| [31] |
BANZET N, RCHAUD C, DEVEAUX Y, et al. Accumulation of Small Heat Shock Proteins, Including Mitochondrial HSP22, Induced by Oxidative Stress and Adaptive Response in Tomato Cells[J]. The Plant Journal, 1998, 13(4): 519-527. DOI:10.1046/j.1365-313X.1998.00056.x (  0) 0) |
| [32] |
SOLOMON M, BELENGHI B, DELLEDONNE M, et al. The Involvement of Cysteine Proteases and Protease Inhibitor Genes in the Regulation of Programmed Cell Death in Plants[J]. The Plant Cell, 1999, 11(3): 431-443. DOI:10.1105/tpc.11.3.431 (  0) 0) |
| [33] |
王朋, 邓小娟, 黄益安, 等. 镉胁迫下不同大豆品种各器官中镉和非蛋白巯基物质的动态变化[J]. 华南农业大学学报, 2016, 37(2): 42-50. [ WANG Peng, DENG Xiao-juan, HUANG Yi-an, et al. Dynamic Changes of Cadmium and Non-Protein Thiol in Different Organs of Different Soybean Genotypes Under Cadmium Stress[J]. Journal of South China Agricultural University, 2016, 37(2): 42-50.] (  0) 0) |
| [34] |
VERBRUGGEN N, HERMANS C, SCHAT H. Molecular Mechanisms of Metal Hyper Accumulation in Plants[J]. The New Phytologist, 2009, 181(4): 759-776. DOI:10.1111/j.1469-8137.2008.02748.x (  0) 0) |
| [35] |
JOZEFCZAK M, REMANS T, VANGRONSVELD J, et al. Glutathione Is a Key Play in Metal-Induced Oxidative Stress Defenses[J]. International Journal of Molecular Sciences, 2012, 13(3): 3145-3175. DOI:10.3390/ijms13033145 (  0) 0) |
| [36] |
JOZEFCZAK M, KEUNEN E, SCHAT H, et al. Differential Response of Arabidopsis Leaves and Roots to Cadmium:Glutathione-Related Chelating Capacity vs Antioxidant Capacity[J]. Plant Physiology Biochemistry, 2014, 83: 1-9. DOI:10.1016/j.plaphy.2014.07.001 (  0) 0) |




