2. 中国科学院南京土壤研究所/土壤与农业可持续发展国家重点实验室, 江苏 南京 210008;
3. 河南科技大学化工与制药学院, 河南 洛阳 471023
2. Institute of Soil Science, Chinese Academy of Sciences/State Key Laboratory of Soil and Sustainable Agriculture, Nanjing 210008, China;
3. School of Chemical Engineering and Pharmacy, Henan University of Science and Technology, Luoyang 471023, China
铜(Cu)是植物生长的必需元素, 但是过量的Cu2+会对植物产生危害[1], 直接影响区域生态系统稳定和粮食安全, 关系到农业可持续发展和人体健康[2]。冶炼工业废水及尾矿管理不善、含Cu2+农药使用不当、大气沉降和污水灌溉等都会加剧农田土壤Cu2+污染[3]。Cu2+污染程度不仅与含量有关, 很大程度上取决于Cu2+在土壤中的赋存形态[4]。
在厌氧或绝氧条件下对生物质材料进行热解, 可生成一种含碳丰富的固体物质, 称为生物质炭[5]。生物质炭具有多种有利于固定重金属的性质, 如较高比表面积、多孔结构、含丰富官能团的表面以及较高的pH值和阳离子交换量(CEC)[5]。红外光谱(FTIR)和等温吸附等实验表明, 生物质炭对水体中Cu2+有很强的吸附能力[6], 而在高度风化酸性土壤中, 生物质炭官能团数量与Cu2+吸附量直接相关[7]。生物质炭表面所含有机官能团和碱性物质是钝化旱地土壤Cu2+的关键因素, 并且钝化作用在120 d的培养周期内变化不大[8]。
淹水条件下土壤pH值会发生显著变化[9], 而pH值是影响土壤5大化学平衡(酸碱反应、沉淀-溶解、吸附-解吸、氧化-还原和络合解离)的重要参数, 也是影响土壤中重金属化学形态的重要因子[10]。刘晶晶等[11]发现施用50 g·kg-1稻草炭能显著提高浙江富阳水稻土pH值, 显著降低土壤中Cd、Cu、Pb和Zn的二乙基三胺五乙酸(DTPA)有效态和酸溶态含量。许超等[12]研究发现淹水条件下污染土壤中施用生物质炭, 土壤pH值上升-0.01~0.35个单位, 可降低Zn、Cd、Pb和Cu的有效性, 土壤pH值与土壤交换态Cu含量呈显著负相关。
虽然生物质炭可作为电子供体向土壤中还原性微生物提供碳源[13], 但与生物质炭原料相比, 它的结构更加稳定, 性质也更加惰性[14], 因此生物质炭激发厌氧微生物还原的能力比原料弱很多。由于目前添加生物质炭钝化土壤重金属的淹水培养实验大多不添加其他碳源, 而生物质炭钝化重金属污染土壤是一个长期过程, 添加葡萄糖可加速这一过程[15]。因此, 笔者设计添加葡萄糖条件下淹水培养实验, 探究施用生物质炭对Cu2+形态的影响, 观察生物质炭持续钝化效果, 为阐明生物质炭钝化淹水土壤中Cu2+的作用机制提供参考。
1 材料与方法 1.1 供试土壤及其基本性质分析供试土壤(0~20 cm)采自广东徐闻玄武岩发育砖红壤, 土壤经自然风干, 去除植物根系和砾石, 磨细过0.25 mm孔径筛备用。供试土壤基本性质为pH值为5.18〔m(土) :V(水)=1 :2.5〕, w(有机质)为23.7 g·kg-1, CEC为13.35 cmol·kg-1, w(游离态Fe2O3)为124.49 g·kg-1, 总Cu含量为1.69 mmol·kg-1。
pH值、有机质含量和CEC分别采用电位法、重铬酸钾法和醋酸氨法测定; 游离态Fe2O3含量采用连二亚硫酸钠-柠檬酸钠-重碳酸钠(DCB)提取, 电感耦合等离子发射光谱法(ICP, Perkinelmer Optima 8000, 美国)测定; 总Cu含量采用HNO3-HF-HClO4消煮, ICP测定。
1.2 供试生物质炭 1.2.1 供试生物质炭的制备花生和油菜秸秆均采集自江苏省南京市郊, 自然风干过1.7 mm孔径筛后, 投入厌氧条件下马弗炉(SX2-10-13, 上海新苗)中热解, 温度以20 ℃·min-1分别升至指定碳化温度后维持4 h, 待冷却后将制备好的生物质炭取出, 磨细过0.25 mm孔径筛备用。前期研究[8]发现, 豆科(花生、大豆)秸秆生物质炭所含碱性物质和表面官能团量比非豆科(水稻、油菜)多, 对Cu2+的钝化效果也优于后者。因此, 选择300、400、500 ℃ 3个碳化温度的花生秸秆生物质炭(PB300、PB400和PB500), 而油菜秸秆生物质炭只设置400 ℃的碳化温度(CB400)。商品活性炭(AC, 上海通世化工公司)以木屑为原料, 碳化温度为800~1 000 ℃。
1.2.2 供试生物质炭基本性质测定在m(炭) :V(水)为1 :10条件下采用电位法测定生物质炭pH值。生物质炭碱含量采用酸碱滴定原理测定[16]:称取0.100 g炭于50 mL塑料杯中, 添加15 mL去离子水, 并设置不加炭的空白实验, 磁力搅拌2 h; 将悬液用0.05 mol·L-1 HCl经自动电位滴定仪(Radiometer TIM 854, 法国)滴定至pH值为2.0, 滴定过程中通入纯N2以排除溶液中CO2干扰, 滴定速率为1.0 mL·min-1, 每6 s记录1次数据, 碱含量通过空白与样品之间的HCl溶液用量差值计算得到。采用物理吸附仪(Micromeritics ASAP 2020, 美国)测定炭的比表面积, 相对压力(p/p0)为0.05~0.35, 由N2吸附等温线计算得到炭的BET(Brunauer-Emmett-Teller)比表面积。将1 mg于105~110 ℃条件下烘干的生物质炭与KBr充分混合, 压片后经红外光谱仪(Nicolet 8700, 美国)在400~4 000 cm-1波数处进行连续扫描后得到傅里叶红外光谱图(FTIR)。
生物质炭表面酸性官能团含量采用Boehm滴定法测定[8, 16]:称取1.0 g炭于40 mL去离子水中, 将pH值调节至5.0并静置7 d后, 在60 ℃条件下干燥、混匀。再分别称取0.100 g炭于15 mL离心管中, 分别添加10 mL的0.5 mol·L-1 NaHCO3、0.5 mol·L-1 Na2CO3和0.5 mol·L-1 NaOH溶液, 以未加生物质炭处理为空白, 连续振荡24 h后以4 500 r·min-1(相对离心力RCF为3 644)离心5 min, 过0.45 μm孔径滤膜; 取5 mL滤液用10 mL 0.1 mol·L-1 HCl溶液预中和后, 再用0.05 mol·L-1 NaOH溶液经自动电位滴定仪滴定至pH值为7.0, 滴定过程中连续通入纯N2以排除溶液中CO2干扰。炭表面酸性官能团含量通过计算得到, 其中NaHCO3仅中和羧基等强酸性官能团, Na2CO3可中和羰基、内酯类、乳醇和低pKa的酚类化合物等强酸和中等酸性官能团, NaOH可中和总酸性官能团(羰基、内酯类、酚类、羧基和其他酸性组分)。
1.3 淹水培养实验由于砖红壤在厌氧条件下会发生铁解作用影响Fe2O3形态, 向供试土壤分别添加20 g·kg-1葡萄糖和5 mmol·kg-1Cu(NO3)2溶液并混匀后立即添加30 g·kg-1生物质炭或活性炭, 按m(炭) :V(水)为1 :2混匀后置于密闭塑料容器中, 并置于恒温培养箱中在25 ℃条件下进行淹水培养试验。同时进行对照实验(CK)。每隔7 d测定样品上清液pH值, 并取适量土样采用连续提取法(BCR)[17]分析酸溶态、还原态、氧化态和残渣态等不同形态Cu2+含量。该研究中酸溶态Cu2+含量为水溶态和醋酸提取态Cu2+含量之和。以上实验均重复2次。
2 结果与讨论 2.1 生物质炭基本性质生物质炭含有一定量的碱性物质, CB400、PB300、PB400和PB500碱含量显著高于AC, 分别为AC的1.81、2.02、2.49和3.02倍(表 1)。PB400碱含量是CB400的1.37倍, 即相同碳化温度的花生秸秆生物质炭碱含量显著高于油菜秸秆生物质炭(P < 0.05);随热解温度升高, 花生秸秆生物质炭碱含量也显著增加(P < 0.05)。秸秆生物质炭比表面积也随热解温度升高而增大, 由于商品活性炭热解温度较高(800~1 000 ℃), 其比表面积明显大于制备的生物质炭; 低温条件下(< 400 ℃)制备的生物质炭比表面积较低可能是因为孔隙被黏粒和矿物堵塞[18]。
|
|
表 1 供试活性炭和生物质炭基本性质 Table 1 Some basic properties of the activated carbon and crop straw biochars |
不同种类炭的FTIR图谱见图 1。生物质炭含有碳酸盐以及羰基、甲氧基、羧基、亚甲基和羟基等官能团[19], 秸秆生物质炭所含官能团种类和含量明显高于活性炭。FTIR图谱中波数874 cm-1处吸收峰代表碳酸盐的平面外弯曲, 碳酸盐被认为是生物质炭碱性物质的主要来源[20]。通过对比可以发现, AC峰强显著低于秸秆生物质炭, 而CB400低于PB400;花生秸秆生物质炭的碳酸盐峰强随碳化温度增加而增加, 与气量法得到的不同种类炭所含碱性物质含量一致(表 1)。生物质炭表面的羧基、羟基等官能团是络合固定Cu2+的重要官能团, 波数1 589 cm-1处代表羧基的反对称伸缩[21], 可以发现PB400羧基含量高于CB400, 也高于AC; 而随碳化温度的增加, 花生秸秆生物质炭羧基含量下降。
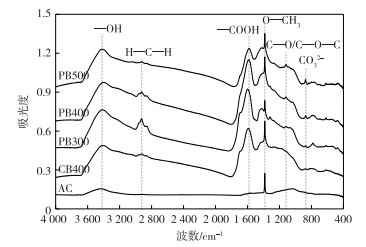
|
图 1 活性炭和秸秆生物质炭的红外光谱图(FTIR) Figure 1 FTIR spectra of the active carbon and biochars produced from straws of canola and peanut AC为商品活性炭, CB400为400 ℃条件下制备的油菜秸秆生物质炭, PB300、PB400和PB500分别为300、400和500 ℃条件下制备的花生秸秆生物质炭。 |
为进一步定量分析不同种类炭官能团含量变化, 通过Boehm滴定比较不同种类炭表面官能团变化(表 1)。结果表明, CB400、PB300、PB400和PB500的酸性官能团总量分别为AC的2.42、3.67、4.06和3.24倍, PB400为CB400的1.68倍, PB400分别为PB300和PB500的1.11和1.25倍, 说明生物质炭酸性官能团含量显著高于AC, 而碳化温度和原料种类是决定生物质炭酸性官能团数量的关键因素[20]。
2.2 生物质炭对淹水土壤pH的影响不同种类炭处理土壤pH值动态变化见图 2。添加秸秆生物质炭在淹水培养初期迅速提高砖红壤pH值。淹水培养第1天, 添加AC、CB400、PB300、PB400和PB500处理土壤pH值较CK(pH值为4.79)分别增加0.24、0.62、0.59、1.22和0.97。添加PB400土壤pH值增加最明显, 这主要与其碱性物质和表面官能团含量较高有关(表 1)。当生物质炭添加到淹水土壤中后, 碳酸盐释放和硅酸盐沉淀中和了土壤部分H+; 同时生物质炭表面含有大量有机官能团(羧基、羟基和酚羟基等)可以缔合土壤中质子[22]; 另外, 生物质炭含有的K+、Na+、Ca2+和Mg2+等盐基离子可以交换土壤中H+和Al3+, 降低交换性酸含量[23]。生物质炭的酸碱缓冲性能降低了土壤酸度, 促进土壤pH值在淹水培养初期显著升高。
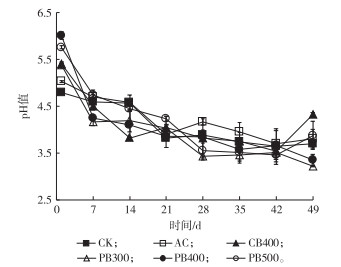
|
图 2 淹水培养土壤pH值的动态变化 Figure 2 Dynamic changes of the waterlogged soil pH amended with activated carbon and different biochars CK为对照组, AC为添加商品活性炭处理, CB400为添加400 ℃条件下制备的油菜秸秆生物质炭处理, PB300、PB400和PB500分别为添加300、400和500 ℃条件下制备的花生秸秆生物质炭处理。 |
随淹水培养时间增加, 所有处理土壤pH值均呈下降趋势, 尤其是添加生物质炭处理土壤pH值下降更加显著; 淹水30 d后, 所有处理pH值基本趋于稳定。土壤pH值下降主要是由于土壤淹水培养过程中, 添加20 g·kg-1葡萄糖促使土壤中微生物活性增强, 葡萄糖和生物质炭提供的有机物质发酵产生各种有机酸[24], 使土壤pH值随着淹水培养时间增加而下降。由于生物质炭处理土壤额外提供了有机物质, 导致生物质炭中和H+的效果在淹水7 d后基本消失, 并且pH值下降幅度高于CK; 随淹水时间增加, pH值达到还原菌生存和发酵下限, 细菌的生理生化和糖的发酵产酸过程停止[24], 土壤pH值维持在较低水平。
2.3 添加不同种类炭对淹水土壤酸溶态Cu2+含量的影响不同处理土壤酸溶态Cu2+含量动态变化见图 3。
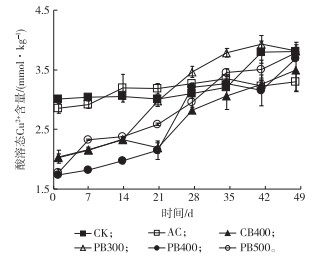
|
图 3 BCR分级提取的酸溶态Cu2+含量动态变化 Figure 3 Acid soluble Cu2+ by BCR sequential extraction method from the studied Oxisol CK为对照组, AC为添加商品活性炭处理, CB400为添加400 ℃条件下制备的油菜秸秆生物质炭处理, PB300、PB400和PB500分别为添加300、400和500 ℃条件下制备的花生秸秆生物质炭处理。 |
由图 3可知, 淹水培养时添加生物质炭明显抑制砖红壤中酸溶态Cu2+含量, 尤其在淹水培养初期(前28 d)效果明显。如淹水培养1 d时, 与CK相比, AC、CB400、PB300、PB400和PB500处理土壤中酸溶态Cu2+含量分别降低5.21%、32.16%、32.70%、42.16%和40.94%。不同种类炭在淹水培养1 d时对Cu2+的钝化效果由强到弱依次为PB400、PB500、PB300、CB400和AC, 与好氧培养结果[8]一致, 也与不同种类炭表面官能团含量排序基本一致, 证明表面有机官能团对钝化Cu2+起主要作用。值得注意的是, 虽然活性炭pH值较高(9.40), 但所含碱性物质较低, 表面官能团含量较秸秆生物质炭也最低(表 1), 因此对土壤pH值的提升效果在培养初期并不如生物质炭明显(图 2)。这也表明生物质炭表面羧基、羟基等官能团一方面可以络合Cu2+而降低酸溶态Cu2+含量[25]; 另一方面可以显著提高生物质炭改良酸性土壤的酸缓冲容量, 提高土壤pH值, 从而提高土壤表面负电荷密度和对Cu2+的静电引力[26]。
随淹水培养时间增加, 酸溶态Cu2+含量逐渐增加, 尤其是生物质炭处理增加更明显。如淹水培养28 d时, AC、CB400、PB300、PB400和PB500处理砖红壤中酸溶态Cu2+含量分别达3.27、2.82、3.46、3.20和2.96 mmol·kg-1, 相比淹水第1天时分别增加0.41、0.78、1.44、1.46和1.18 mmol·kg-1。这可能是因为生物质炭中有机官能团在淹水培养时逐渐丧失钝化Cu2+的能力。虽然有文献报道生物质炭结构稳定, 在土壤中较有惰性, 不易发生矿化分解[14], 但笔者研究发现, 在外源添加微生物代谢所需的碳源和能源(葡萄糖)条件下, 淹水30 d内生物质炭钝化重金属的效果即消失。因此, 生物质炭在改良重金属污染淹水土壤时短期内有钝化作用, 长期来看改良效果会逐渐减弱并消失。
如图 4所示, 土壤酸溶态Cu2+含量与pH值呈极显著负相关(P < 0.01), 即土壤有效态Cu2+含量随pH值降低而增加, 这一结果也与众多报道[10, 27]一致。
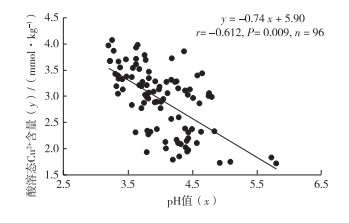
|
图 4 土壤pH值与酸溶态Cu2+的关系 Figure 4 Relationship between soil pH and acid soluble Cu2+ |
一般而言, pH值较低时土壤中重金属阳离子水解程度较弱, 移动性、活性和生物有效性较高; 同时土壤颗粒表面正电荷密度增加, 负电荷密度降低, 对带正电的阳离子亲和能力也随之降低。因此, 酸性土壤中重金属阳离子活性更高。这再次证明淹水培养初期生物质炭可通过表面官能团络合Cu2+和提高土壤pH值以显著降低酸溶态Cu2+含量; 随培养时间增加, 葡萄糖和生物质炭所含有机物质被微生物利用, 代谢产酸使土壤pH值降低, 生物质炭改良效果逐渐消失。
2.4 还原态、氧化态和残渣态Cu2+含量变化砖红壤中还原态、氧化态和残渣态Cu2+含量动态变化如图 5所示。
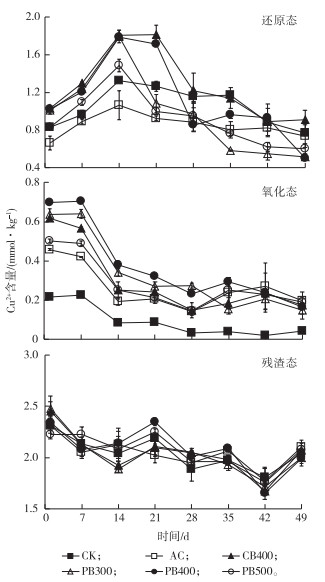
|
图 5 还原态、氧化态和残渣态Cu2+在淹水培养过程中的动态变化 Figure 5 Dynamic changes of reducible, oxidizable and residual Cu2+ during submergence in the Oxisols CK为对照组, AC为添加商品活性炭处理, CB400为添加400 ℃条件下制备的油菜秸秆生物质炭处理, PB300、PB400和PB500分别为添加300、400和500 ℃条件下制备的花生秸秆生物质炭处理。 |
由图 5可知, 所有处理土壤还原态Cu2+含量在淹水培养初期显著增加, 到14~21 d时达到最高, 之后逐渐降低。一般认为, BCR分级提取的还原态Cu2+主要为与土壤中Fe、Mn氧化物结合的Cu2+。淹水培养初期, 添加生物质炭显著提高土壤pH值, 提高土壤与Cu2+之间的静电引力; 同时, 淹水导致土壤中晶态Fe、Mn氧化物转变为表面活性更高的无定形态[28], Cu2+与土壤Fe、Mn氧化物的亲和能力增强。如淹水培养第14天, CB400、PB300、PB400和PB500处理土壤还原态Cu2+含量较CK分别增加36.14%、35.42%、34.76%和12.13%。随淹水时间增加, 还原态Cu2+含量开始降低, 最终趋于稳定。这可能是因为随土壤pH值降低, 土壤颗粒表面负电荷密度和Cu2+水解程度降低, 两者间亲和能力降低, 导致还原态Cu2+含量降低。
BCR分级提取的氧化态Cu2+相当于有机物结合态Cu2+, 整体上随淹水培养时间增加而逐渐下降。氧化态Cu2+含量降低是土壤有机质和生物质炭表面官能团“失活”的综合表现, 且生物质炭处理土壤氧化态Cu2+含量明显高于AC处理和CK(图 5)。如AC、CB400、PB300、PB400和PB500处理土壤淹水培养1 d后, 氧化态Cu2+含量较CK分别增加0.24、0.40、0.42、0.48和0.29 mmol·kg-1, 不同处理土壤氧化态Cu2+含量由大到小依次为PB400、PB300、CB400、PB500、AC和CK, 与生物质炭表面官能团含量排序基本一致。随淹水时间增加, 所有处理氧化态Cu2+含量逐渐降低, 在培养约28 d后趋于稳定。这是因为生物质炭表面富含可以与Cu2+形成络合物的有机官能团, 且在培养初期高pH值条件下生物质炭表面负电荷密度较高, 而Cu2+水解产生的氢氧化物与有机官能团之间的亲和能力较Cu2+高[17], 因此淹水培养初期生物质炭处理土壤氧化态Cu2+含量较高。随淹水培养时间增加, 微生物代谢消耗外源添加的葡萄糖和生物质炭所含有机物质, 导致pH值降低, 生物质炭处理土壤氧化态Cu2+含量显著降低。28 d时AC、CB400、PB300、PB400和PB500处理土壤氧化态Cu2+含量较CK仅分别增加0.11、0.12、0.24、0.20和0.11 mmol·kg-1。
一般而言, 外源添加的重金属在短期培养时不会转变为残渣态[17], 因此笔者研究中残渣态Cu2+含量变化不大。残渣态Cu2+含量在1.66~2.48 mmol·kg-1间波动, 可能是由于BCR分级提取经连续多次操作后, 实验误差增加。残渣态Cu2+含量与土壤Cu2+本底值基本一致, 可能是因为残渣态Cu2+主要源于土壤背景Cu2+, 短期内不受生物质炭处理影响。
3 结论笔者于砖红壤中添加20 g·kg-1葡萄糖和30 g·kg-1不同种类秸秆生物质炭或活性炭, 并在外源添加5 mmol·kg-1 Cu2+条件下淹水培养49 d, 采用BCR分级提取方法研究不同形态Cu2+的动态变化, 得出以下结论:
(1) 由于淹水培养初期生物质炭所含碱性物质和表面官能团共同作用, 酸溶态Cu2+含量显著降低, 还原态和氧化态Cu2+含量增加。
(2) 土壤pH值与酸溶态Cu2+含量间呈极显著负相关, 高pH值能增加土壤表面负电荷密度, 并促进Cu2+水解, 增强Cu2+与土壤颗粒和生物质炭之间静电引力和络合能力。
(3) 葡萄糖能提高土壤微生物活性, 葡萄糖和生物质炭提供的有机物质经微生物发酵产生有机酸, 导致土壤pH值降低, 随淹水培养时间增加, 生物质炭钝化Cu2+效果显著降低。虽然实际操作中不会向农田土壤添加葡萄糖促进土壤还原过程, 但由于厌氧微生物分解导致生物质炭表面官能团失活而降低钝化重金属的能力, 利用秸秆生物质炭钝化厌氧条件下土壤Cu2+的长期效果可能并不理想。
| [1] |
常红岩, 孙百晔, 刘春生. 植物铜素毒害研究进展[J]. 山东农业大学学报(自然科学版), 2000, 31(2): 227-230. CHANG Hong-yan, SUN Bai-ye, LIU Chun-sheng. Advances in the Study of Plants Copper Toxicity[J]. Journal of Shandong Agricultural University (Natural Science), 2000, 31(2): 227-230. (  0) 0) |
| [2] |
朱永官, 陈保冬, 林爱军, 等. 珠江三角洲地区土壤重金属污染控制与修复研究的若干思考[J]. 环境科学学报, 2005, 25(12): 1575-1579. ZHU Yong-guan, CHEN Bao-dong, LIN Ai-jun, et al. Heavy Metal Contamination in Pearl River Delta-Status and Research Priorities[J]. Acta Scientiae Circumstantiae, 2005, 25(12): 1575-1579. DOI:10.3321/j.issn:0253-2468.2005.12.001 (  0) 0) |
| [3] |
BOULARBAH A, SCHWARTZ C, BITTON G, et al. Heavy Metal Contamination From Mining Sites in South Morocco:2.Assessment of Metal Accumulation and Toxicity in Plants[J]. Chemosphere, 2006, 63(5): 811-817. DOI:10.1016/j.chemosphere.2005.07.076 (  0) 0) |
| [4] |
赵江宁, 王云霞, 沈春晓, 等. 土壤外源铜形态的动态变化:5年定位试验[J]. 农业环境科学学报, 2012, 31(5): 926-933. ZHAO Jiang-ning, WANG Yun-xia, SHEN Chun-xiao, et al. Dynamic Variations of Distribution Forms of Exogenous Copper in Soil:A 5-Years Located Experiment[J]. Journal of Agro-Environment Science, 2012, 31(5): 926-933. (  0) 0) |
| [5] |
SOHI S P, KRULL E, LOPEZ-CAPEL E, et al. A Review of Biochar and Its Use and Function in Soil[J]. Advances in Agronomy, 2010, 105: 47-82. DOI:10.1016/S0065-2113(10)05002-9 (  0) 0) |
| [6] |
CAO X D, MA L N, GAO B, et al. Dairy-Manure Derived Biochar Effectively Sorbs Lead and Atrazine[J]. Environmental Science & Technology, 2009, 43(9): 3285-3291. (  0) 0) |
| [7] |
UCHIMIYA M, CHANG S C, KLASSON K T. Screening Biochars for Heavy Metal Retention in Soil:Role of Oxygen Functional Groups[J]. Journal of Hazardous Materials, 2011, 190(1/2/3): 432-441. (  0) 0) |
| [8] |
JIANG J, XU R K. Application of Crop Straw Derived Biochars to Cu(Ⅱ) Contaminated Ultisol:Evaluating Role of Alkali and Organic Functional Groups in Cu(Ⅱ) Immobilization[J]. Bioresource Technology, 2013, 133: 537-545. DOI:10.1016/j.biortech.2013.01.161 (  0) 0) |
| [9] |
MCBRIDE M B. Environmental Chemistry of Soils[M]. Oxford, UK: Oxford University Press, 1994: 240-272.
(  0) 0) |
| [10] |
ZENG F R, ALI S, ZHANG H T, et al. The Influence of pH and Organic Matter Content in Paddy Soil on Heavy Metal Availability and Their Uptake by Rice Plants[J]. Environmental Pollution, 2011, 159(1): 84-91. DOI:10.1016/j.envpol.2010.09.019 (  0) 0) |
| [11] |
刘晶晶, 杨兴, 陆扣萍, 等. 生物质炭对土壤重金属形态转化及其有效性的影响[J]. 环境科学学报, 2015, 35(11): 3679-3687. LIU Jing-jing, YANG Xing, LU Kou-ping, et al. Effect of Bamboo and Rice Straw Biochars on the Transformation and Bioavailability of Heavy Metals in Soil[J]. Acta Scientiae Circumstantiae, 2015, 35(11): 3679-3687. (  0) 0) |
| [12] |
许超, 林晓滨, 吴启堂, 等. 淹水条件下生物炭对污染土壤重金属有效性及养分含量的影响[J]. 水土保持学报, 2012, 26(6): 194-198. XU Chao, LIN Xiao-bin, WU Qi-tang, et al. Impacts of Biochar on Availability of Heavy Metals and Nutrient Content of Contaminated Soil Under Waterlogged Conditions[J]. Journal of Soil and Water Conservation, 2012, 26(6): 194-198. (  0) 0) |
| [13] |
CAYUELA M L, SÁNCHEZMONEDERO M A, ROIG A, et al. Biochar and Denitrification in Soils:When, How Much and Why Does Biochar Reduce N2O Emissions?[J]. Scientific Reports, 2013, 3: 1732. DOI:10.1038/srep01732 (  0) 0) |
| [14] |
AMELOOT N, GRABER E R, FGA V, et al. Interactions Between Biochar Stability and Soil Organisms:Review and Research Needs[J]. European Journal of Soil Science, 2013, 64(4): 379-390. DOI:10.1111/ejss.12064 (  0) 0) |
| [15] |
YADUVANSHI N P S, SETTER T L, SHARMA S K, et al. Influence of Waterlogging on Yield of Wheat (Triticum aestivum), Redox Potentials, and Concentrations of Microelements in Different Soils in India and Australia[J]. Soil Research, 2012, 50(6): 489-499. DOI:10.1071/SR11266 (  0) 0) |
| [16] |
BOEHM H P. Some Aspects of the Surface Chemistry of Carbon Blacks and Other Carbons[J]. Carbon, 1994, 32(5): 759-769. DOI:10.1016/0008-6223(94)90031-0 (  0) 0) |
| [17] |
JIANG J, XU R K, JIANG T Y, et al. Immobilization of Cu(Ⅱ), Pb(Ⅱ) and Cd(Ⅱ) by the Addition of Rice Straw Derived Biochar to a Simulated Polluted Ultisol[J]. Journal of Hazardous Materials, 2012, 229/230(5): 145-150. (  0) 0) |
| [18] |
LIN Y, MUNROE P, JOSEPH S, et al. Chemical and Structural Analysis of Enhanced Biochars:Thermally Treated Mixtures of Biochar, Chicken Litter, Clay and Minerals[J]. Chemosphere, 2013, 91(1): 35-40. DOI:10.1016/j.chemosphere.2012.11.063 (  0) 0) |
| [19] |
KRISTIN L, GEORGIA A K, JOHN D. FT-IR Study of the Changes in Carbohydrate Chemistry of Three New Jersey Pine Barrens Leaf Litters During Simulated Control Burning[J]. Soil Biology and Biochemistry, 2009, 41(2): 340-347. DOI:10.1016/j.soilbio.2008.11.005 (  0) 0) |
| [20] |
YUAN J H, XU R K, ZHANG H. The Forms of Alkalis in the Biochar Produced From Crop Residues at Different Temperatures[J]. Bioresource Technology, 2011, 102(3): 3488-3497. DOI:10.1016/j.biortech.2010.11.018 (  0) 0) |
| [21] |
QIU Y P, CHENG H Y, XU C, et al. Surface Characteristics of Crop-Residue-Derived Black Carbon and Lead(Ⅱ) Adsorption[J]. Water Research, 2008, 42(3): 567-574. DOI:10.1016/j.watres.2007.07.051 (  0) 0) |
| [22] |
YUAN J H, XU R K. The Amelioration Effects of Low Temperature Biochar Generated From Nine Crop Residues on an Acidic Ultisol[J]. Soil Use and Management, 2011, 27(1): 110-115. DOI:10.1111/sum.2011.27.issue-1 (  0) 0) |
| [23] |
ZWIETEN L V, KIMBER S, MORRIS S, et al. Effects of Biochar From Slow Pyrolysis of Papermill Waste on Agronomic Performance and Soil Fertility[J]. Plant and Soil, 2010, 327(1/2): 235-246. (  0) 0) |
| [24] |
于跃跃, 赵炳梓. 无机氮和葡萄糖添加对土壤微生物生物量和活性的影响[J]. 土壤学报, 2012, 49(1): 139-146. YU Yue-yue, ZHAO Bing-zi. Effect of Amendment of Inorganic Nitrogen and Glucose on Soil Microbial Biomass and Activity[J]. Acta Pedologica Sinica, 2012, 49(1): 139-146. DOI:10.11766/trxb201101110015 (  0) 0) |
| [25] |
PEI Z G, SHAN X Q, KONG J J, et al. Coadsorption of Ciprofloxacin and Cu(Ⅱ) on Montmorillonite and Kaolinite as Affected by Solution pH[J]. Environmental Science & Technology, 2010, 44(3): 915-920. (  0) 0) |
| [26] |
蒋田雨, 姜军, 徐仁扣, 等. 不同温度下烧制的秸秆炭对可变电荷土壤吸附Pb(Ⅱ)的影响[J]. 环境科学, 2013, 34(4): 1598-1604. JIANG Tian-yu, JIANG Jun, XU Ren-kou, et al. Effects of Different Temperatures Biochar on Adsorption of Pb(Ⅱ) on Variable Charge Soils[J]. Environmental Science, 2013, 34(4): 1598-1604. (  0) 0) |
| [27] |
WALKER D J, CLEMENTE R, BERNAL M P. Contrasting Effects of Manure and Compost on Soil pH, Heavy Metal Availability and Growth of Chenopodium album L. in a Soil Contaminated by Pyritic Mine Waste[J]. Chemosphere, 2004, 57(3): 215-224. DOI:10.1016/j.chemosphere.2004.05.020 (  0) 0) |
| [28] |
WAHID P A, KAMALAM N V. Reductive Dissolution of Crystalline and Amorphous Fe(Ⅲ) Oxides by Microorganisms in Submerged Soil[J]. Biology and Fertility of Soils, 1993, 15(2): 144-148. DOI:10.1007/BF00336433 (  0) 0) |




