近年来,随着“退二进三”产业结构的调整以及“退城入园”城市规划的推进,土壤及地下水污染问题逐渐成为社会关注热点[1-2]。相对于低密度非水相液体(light non-aqueous phase liquids,LNAPLs),高密度非水相液体(dense non-aqueous phase liquids, DNAPLs)密度大,界面张力低,迁移行为也更复杂[3]。对于DNAPLs长期污染的区域,DNAPLs可通过溶解相不断向弱透水介质内缓慢渗透并在其中扩散。这种富含DNAPLs的弱透水介质较DNAPLs本身更难被发觉和修复。事实上,DNAPLs类污染物由于迁移行为复杂、难以察觉且在化工类企业地块中广泛存在,已成为土壤和地下水污染的重要来源。截至2008年,美国存在15 000~25 000个氯代烃溶剂污染地块[4]。截至2004年,仅德国Bitterfeld地区就有超过25 km2土壤以及2×108 m3地下水遭到氯代烃溶剂污染[5]。DNAPLs污染物进入环境后会对人体健康带来严重危害,如三氯乙烯(trichloroethylene,TCE)可致癌、致畸、致突变[6],已被美国国家环境保护局(Environmental Protection Agency,EPA)列为优先控制污染物[7]。
在DNAPLs污染地块的调查评估中,通过科学的判定调查手段摸清DNAPLs的分布特点,对于后续修复或管控方案的制定具有重要意义。笔者综述了DNAPLs污染地块中DNAPLs污染物的迁移特征及近年来最新的判定调查技术。
1 DNAPLs污染的形成 1.1 DNAPLs污染的成因一般将密度大于1.01 g·cm-3且在水中溶解度小于20 g·L-1的有机污染物称为DNAPLs[8]53-88。通常,DNAPLs发生泄漏后,会在重力作用下迁移进入土壤及地下水。若泄漏量较大,DNAPLs可以穿过整个非饱和带到达饱和带,在迁移途中亦会残留在非饱和带土壤中。到达饱和带的DNAPLs会缓慢溶解于地下水并随地下水流动而形成污染羽。由于密度比水大,DNAPLs在饱和带中可继续向下迁移,但速度放缓,直至到达含水层底部[9]。含水层底部的DNAPLs较难发生垂向迁移,积聚后会向周边扩散。隔水层表面“走势”对DNAPLs的迁移与分布至关重要[10]。对于被DNAPLs长期污染的地块,污染源及污染羽中弱透水介质内也会富集一定数量的DNAPLs。当地下水中溶解相DNAPLs浓度下降时,这些富集DNAPLs的弱透水介质会不断通过反渗透作用向地下水中释放污染物[11],[12]1-145。
1.2 DNAPLs污染物种类常见的DNAPLs污染物有氯代烃化合物、多氯联苯(polychlorinated biphenyl,PCBs)、煤焦油、杂酚油和重油等,基本性质见表 1。
|
|
表 1 常见DNAPLs污染物的物理化学性质[13] Table 1 Physicochemical properties of common DNAPLs |
氯代烃化合物是最常见的DNAPLs污染物,其化学性质稳定,具有易挥发、水溶性低、密度重于水、黏度(viscosity)低等特点,应用广泛[13-14]。TCE和四氯乙烯(tetrafluoroethylene,PCE)为2种常见的氯代烃化合物,被广泛用于制造脱脂剂、干洗剂、清洗剂、有机溶剂和杀虫剂等[4], [8]53-88(表 2)。氯代烃化合物密度较大(约1.46 kg·L-1[13]), 水中溶解度较大[15]、辛醇/水分配系数(Kow)较小(氯代烃化合物的lg Kow为2.61[16]4-98,PCBs的lg Kow范围为4.5~8.2[17]),故其在迁移过程中被疏水性土壤有机质的吸附量较有限,易以溶解态富集在孔隙水内或进入水相形成污染羽。
|
|
表 2 氯代烃化合物的性质与环境行为特点[4] Table 2 Properties and environmental behavior characteristics of chlorinated solvents |
PCBs是无色或淡黄色的黏稠液体,是许多含氯数不同的联苯化合物的统称。PCBs具有化学惰性、抗热性、阻燃性、低蒸气压和高介电常数等特点,被广泛应用于电力、塑料加工、化工和印刷等行业领域[18]。PCBs具有较强的亲脂性和生物蓄积性,故可以通过食物链危害人体健康[19],已被EPA归类为“疑似人类致癌物”[17]。作为1968年日本米糠油中毒事件的罪魁祸首,PCBs于2001年被《关于持久性有机污染物的斯德哥尔摩公约》禁止生产[20]。PCBs具有较高的辛醇/水分配系数,易吸附在土壤有机质中[21],因而其在地下水环境中迁移性较差。据此,若在地下发现PCBs污染,其污染源可能就在附近区域[16]4-98。
1.2.3 煤焦油煤焦油是一种具有刺激性臭味的黑色或黑褐色黏稠液体[22-23],是干馏煤制焦炭和气化过程中的副产物[24],具有致癌性,已被国际癌症研究机构(International Agency for Research on Cancer,IARC)划分为第1类致癌物质[25]。煤焦油成分复杂,主要包括酚类、芳香烃类、杂环类化合物和较复杂的高分子环状烃[26-27]。煤焦油深加工所得的萘(约占10%~12%)、杂酚油(约占22%~30%)、沥青(约占50%~55%)等系列产品可用于合成塑料、合成纤维、农药、染料、医药、涂料、助剂及精细化工产品的生产[16]4-98,同时也是冶金、建材、纺织、造纸、交通等行业的主要原料。相对于氯代烃化合物和PCBs,煤焦油密度较低(约1.01~1.13 kg·L-1),黏度较高(约为20~50 cP),因此其迁移性较差[16]4-98。
1.2.4 杂酚油杂酚油是一种无色或黄色油状液体,主要成分为木馏油和矿物杂酚油。杂酚油主要用作消毒剂和防腐剂,其中包含的愈创木酚、苯酚、甲酚和二甲苯酚等会损害皮肤。此外,杂酚油还含有多种多环芳香烃类化合物,具有较强的毒性和致癌性[25]。在木材处理较为集中的工业区常出现杂酚油污染[15]。杂酚油的密度和黏度与煤焦油相近,因此其迁移性也较差[16]4-98。
2 DNAPLs污染的特点DNAPLs进入地下环境后的行为主要包括迁移、相间分配(液相、吸附相、气相)及自然降解3个方面。由于其密度大于水,DNAPLs主要在重力作用下发生以垂向向下为主的迁移。在迁移过程中,DNAPLs会通过溶解进入液相和挥发进入气相而形成污染羽,污染范围显著扩大。对于未经人为调控的DNAPLs污染地块,DNAPLs的自然降解速度非常缓慢(如PCBs的半衰期约为40 a[28])。在实际案例中,准确掌握污染地块的DNAPLs分布特征有助于降低修复成本,提高修复手段的针对性,对修复方案的制定至关重要[15, 29]。
2.1 DNAPLs的迁移DNAPLs在地下的迁移主要受重力和地层性质影响,同时也会受到毛管压力(capillary pressure, Pc)和流体动压(hydrodynamic pressure)的共同作用[10],其中地下水流(或流体动压)影响相对较小[30]。DNAPLs和土壤水在土壤孔隙中接触时,在两相界面处会存在压力差,这种压力差称为毛管压力。此处的流体动压指DNAPLs受到与其接触的流动地下水的作用力。当两者流动方向相同时,流体动压促进DNAPLs迁移,反之起阻碍作用。在地下非饱和带中,DNAPLs受重力作用向下迁移的同时也会发生横向迁移现象,受毛管压力以及地层性质〔例如可以影响毛管进入压力(capillary entry pressure, Pce)大小的土壤含水量和孔隙〕影响[10, 30-32]。DNAPLs在向下的迁移过程中会优先通过根孔、裂缝等较大的孔隙形成的优势通道,并在界面张力(interfacial tension)的作用下在通道壁形成神经节状残留(ganglia)[33-34]。若DNAPLs泄漏量较小或地下水位较深,DNAPLs会在迁移中被残留相“消耗掉”,不能到达饱和带[10]。降雨时地下水位发生波动,部分残留的DNAPLs可以直接溶解进入地下水,也可通过雨水的淋溶进入地下水,造成持续污染[35]。
穿过非饱和带的DNAPLs进入饱和带后会在重力作用下继续向下迁移。迁移中若遇到低渗透区,DNAPLs会在其上积累并横向迁移(迁移方向由低渗透区表面坡度方向决定[10]),寻找向下迁移的路径继续下沉。少量DNAPLs会克服Pce进入低渗透区内[31]。与在非饱和带类似,DNAPLs会优先通过毛细管阻力较小的高渗透区[15],若泄漏量足够大,DNAPLs可以到达并聚集在含水层底部或遇弱透水层形成DNAPLs池[36]。DNAPLs池和迁移路径上的残留相会缓慢溶解于地下水,持续向地下水中释放污染物[10, 15]。
DNAPLs污染物在地下迁移受其物理化学性质及地质条件共同影响。国内外已对DNAPLs在地下介质中的迁移规律进行了大量研究[37-46]。影响DNAPLs迁移的因素主要有溶解度、密度、界面张力、黏度、挥发性、润湿性(wettability)、饱和度(saturation, S)、残余饱和度(residual saturation, Sr)、相对渗透率(relative permeability, Kr)、毛管压力[10, 15, 30]。MING等[45]采用相对渗透率-饱和度模型(relativepermeability-saturation model,RPM)准确地模拟了PCE在二维沙箱多孔介质中的长期迁移。CHENG等[46]研究了2种表面活性剂(胡敏酸和土温80)对饱和多孔介质中PCE的迁移分布行为,结果表明表面活性剂通过改变多孔介质的润湿性,显著改变DNAPLs的分布及归宿。张蔚等[9]模拟4种DNAPLs的泄露迁移过程,结果显示随着渗透率空间变异性的增强,DNAPLs饱和度的空间变异性增大。GERHARD等[47]通过数值模拟的方法研究6种DNAPLs在砂层中的迁移行为,发现影响DNAPLs迁移停止时间的最重要参数为DNAPLs密度、黏度以及含水层的平均渗透系数。SWEIJEN等[48]对比了汞和PCE在饱和多孔介质中的迁移行为,结果表明虽然汞较大的黏度增加了其迁移过程的阻力,但是汞较大的密度是控制其在地下迁移的主要因素。ZHENG等[49]通过数值模拟方法发现较大的地下水流速可促进多孔介质中低黏度DNAPLs的水平及垂向迁移,地下透镜体的存在会阻碍垂向迁移。此外,DNAPLs混合物的性质(溶解度、黏度、润湿性等)与组成DNAPLs的单一纯相化合物一般会有较大差异,故DNAPLs混合物的性质不能简单以其组成任一化合物的纯相性质来推断[15]。
2.2 DNAPLs的空间分布根据DNAPLs在地下环境所处的位置,可将DNAPLs的空间分布做如下分类[10]。
(1) DNAPLs泄漏只到达非饱和带
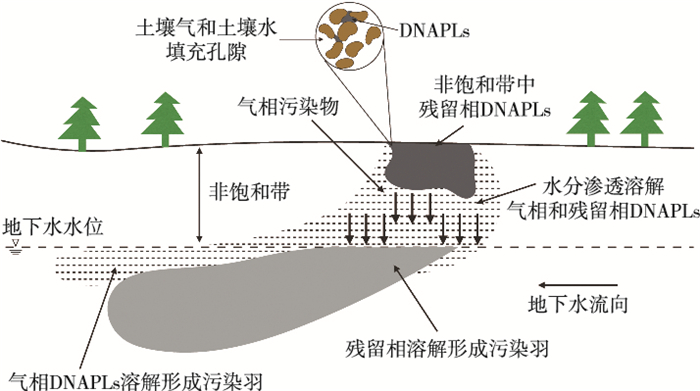
如图 1所示,DNAPLs泄漏至地表后,受到重力作用向下迁移。
|
图 1 DNAPLs泄漏只到达非饱和带时的分布情况[50] Figure 1 Distribution of DNAPLs when they reach the unsaturated zone only |
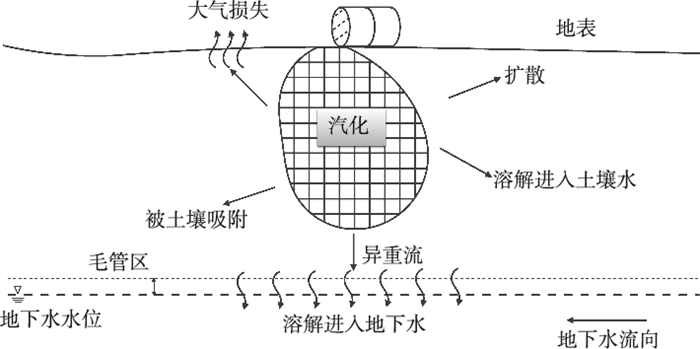
由于泄漏量少,DNAPLs大多被束缚在非饱和带的孔隙及裂缝中。随着地表水和雨水的淋溶,DNAPLs中的污染物组分会不断溶解迁移,形成污染羽。此外,DNAPLs挥发产生的气相污染物也可通过扩散作用及异重流(density flow)直接溶解进入地下水,在地下水位附近形成较浅的溶解相污染羽[10],或溶于降雨渗流进入地下水中。DNAPLs挥发产生的气相污染物的迁移行为见图 2。
|
图 2 DNAPLs中挥发出气相污染物的迁移行为 Figure 2 The behavior of vapors volatilized from DNAPLs |
(2) DNAPLs穿过非饱和带沿弱透水层迁移
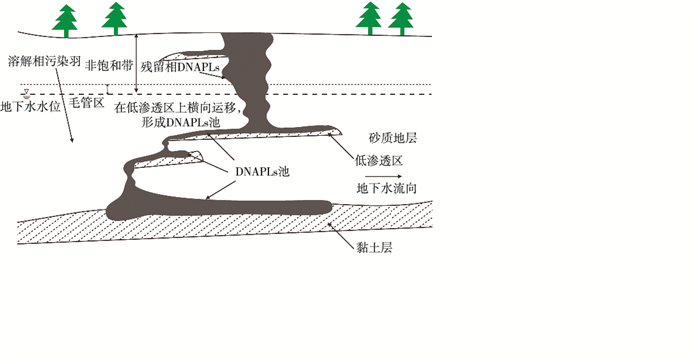
如图 3所示,泄漏量较大的DNAPLs可穿过非饱和带,进入饱和带,随后继续向下迁移直到在隔水层或弱透水层表面形成DNAPLs池。迁移过程中,部分DNAPLs被毛管压力束缚在迁移路径中的土壤孔隙中。
|
图 3 DNAPLs在连续和不连续弱透水层上的迁移[50] Figure 3 The migration of DNAPLs on continuous and discontinuous low Permeability aquitards |
DNAPLs穿过非饱和带在第1含水层中形成污染羽,同时也在不连续的弱透水层表面不断形成DNAPLs池,溢出的DNAPLs通过弱透水层边缘继续向下迁移,直至达到连续的弱透水层表面。若DNAPLs溢出处距离污染源很远,追踪DNAPLs迁移路径的难度将显著增加。
(3) 多层污染
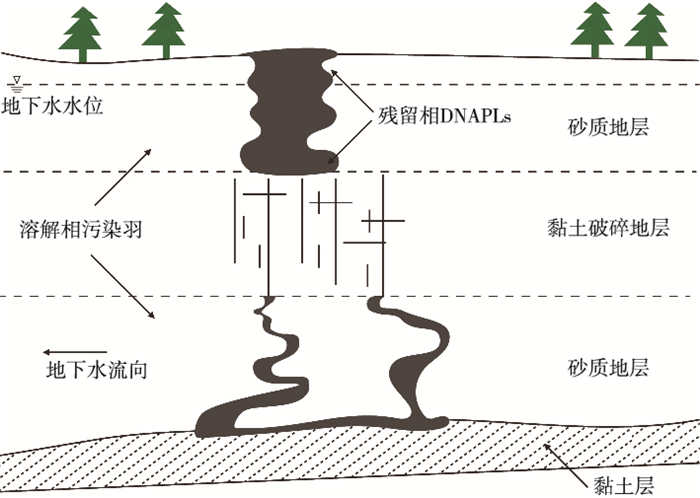
如图 4所示,DNAPLs穿过非饱和带形成了污染羽,同时也在第1含水层底部形成DNAPLs池。DNAPLs池通过含水层底部的裂缝继续向下迁移,到达第2含水层,形成污染羽及污染池。
|
图 4 DNAPLs多层污染[50] Figure 4 Multilayer pollution of DNAPLs |
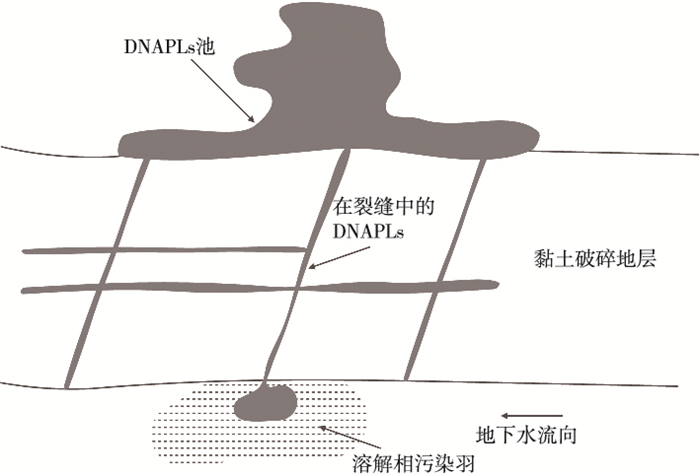
(4) DNAPLs进入岩石或黏土层裂缝
如图 5所示,DNAPLs进入岩石或黏土层裂缝后,其迁移分布由裂缝系统的性质(数量,密度,尺寸、方向等)决定。由于裂缝可能延伸较广,因此DNAPLs可在连通的裂缝中发生较长距离的迁移[51]。裂缝系统具有较强的不可判性,进入其中的DNAPLs会在死端缝隙被捕获或者残留在迁移路径上。残留在死端缝隙内及迁移路径上DNAPLs是治理的难点,是地下水的长期污染源[52-53]。
|
图 5 DNAPLs在岩石或黏土层裂缝中的分布[10] Figure 5 Distribution of DNAPLs in rock or clay layers |
从存在状态上划分,有机化学污染物可分为2大类[54],此处讨论只涉及溶解相、气相、吸附相和非水相(NAPLs相)。
非饱和带中DNAPLs的相间分配主要为挥发进入土壤气相和溶解进入土壤水中成为溶解相[8]53-88。DNAPLs污染物的蒸气压越高,越易挥发。在DNAPLs污染源周围由于挥发作用产生的气相污染物会在几周到几个月之内扩散到几十米外甚至更远,大大扩大了污染范围[55-56]。密度大于空气的气相污染物可下沉达到地下水位,溶解于地下水造成垂向深度较浅的污染[10]。溶解进入土壤水的DNAPLs可挥发进入气相或吸附到土壤固相表面上形成吸附相。同样,吸附相也可以挥发或溶解[30]。刘锐等[13]总结了挥发性氯代烃(volatile chlorinated hydrocarbons,VCHs)在非饱和带土壤中的相间分配特征(图 6)。
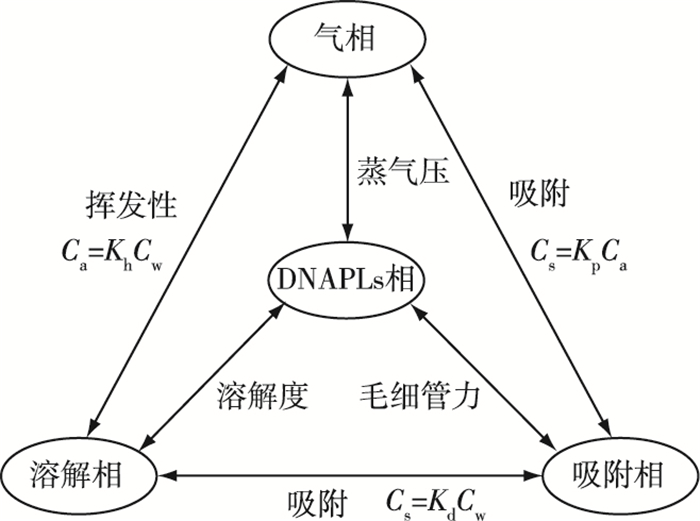
|
图 6 VCHs在非饱和带的相间分配[13] Figure 6 Distribution of VCHs between the phases in the unsaturated zone Cw、Ca、Cs分别为DNAPLs在土壤水、土壤气、固体中浓度,单位分别为mg·L-1、mg·m-3、mg·kg-1; Kh、Kd、Kp分别为亨利常数、液-固分配系数、气-固分配系数,单位分别为L·m-3、L·kg-1、m3·kg-1。 |
DNAPLs-水相之间的分配受污染物本身溶解度的影响,由于DNAPLs多为混合物,组成DNAPLs的任一污染物在地下水中的浓度通常远低于其溶解度。DNAPLs-土壤气间的分配主要受污染物的蒸气压和沸点影响,而污染物在水相-土壤气间的分配关系服从Henry定律[57]。与非饱和带不同的是,饱和带中的孔隙通常被水充满,故鲜有考虑气相,DNAPLs主要是以非水相和溶解相形式存在。
2.4 DNAPLs污染地块的周期特点随着时间的推移,DNAPLs不仅会发生空间的迁移,还会发生相间的转化和再分配,因此需要对污染地块的生命周期进行划分。DNAPLs在各相中的分布见表 3。对于大部分高溶解度DNAPLs(如氯代烃化合物)污染地块,其生命周期可以被分为前期、中期、后期3个阶段[4, 15, 58]。
|
|
表 3 各周期DNAPLs在各相中的分布情况[12]1-145, [15] Table 3 The distribution of DNAPLs in each phase in different stages associated |
在前期阶段,DNAPLs污染物通过孔隙及缝隙向地下迁移,并在迁移路径上产生残留相。若泄漏量足够大,DNAPLs会在隔水层上部汇聚成池。在该阶段中,DNAPLs污染物会不断地向气相和地下水液相中转移,形成污染羽,造成一定范围的污染。除此之外,污染物也会吸附于土壤或沉积物上形成吸附相。上述过程主要发生在高渗透区。该阶段的特点是:污染物主要以高渗透区的非水相为主;残留相普遍存在,DNAPLs池较少;气相、溶解相污染羽开始形成。
在中期阶段,污染物逐渐转移到液相、气相、吸附相中。需要指出的是,DNAPLs较难通过地下水流动而迁移,污染物主要通过DNAPLs的溶解进入地下水。受PCE的影响,DNAPLs难以直接进入渗透性较差的弱透水区域,而主要是溶解于地下水液相,通过分子扩散进入低渗透区域[59-60]。该阶段的特点是:DNAPLs池增多,高渗透区残留相DNAPLs大量消耗;在扩散作用下,溶解在地下水中的污染物逐渐向低渗透区(弱透水区)扩散,在孔隙水中富集并在土壤上大量吸附。
在晚期阶段,非水相DNAPLs往往已经消耗殆尽,在溶解、扩散、生物降解的作用下,高渗透区内的污染物浓度下降较快,但污染物依旧可以在高渗透区的地下水中检测到,这是因为富集在低渗透区内的污染物在周边地下水中污染物浓度下降后发生反扩散作用而向高渗透区迁移[4]。该阶段的特点是:非水相的DNAPLs已几乎不存在,低渗透性区内的污染物仍将持续缓慢释放进入地下水中。对于高溶解度DNAPLs如氯代烃化合物污染地块,其生命周期以中期、晚期为主,故在实际修复工程中,应更多地关注低渗透区的反扩散作用对污染地块修复效果的影响。
对于低溶解度DNAPLs(如煤焦油)污染地块,因污染物具有较低的溶解度及较高的黏度,其污染地块的生命周期以第1阶段为主。此外,高黏度DNAPLs的聚集会造成区域土壤渗透系数下降,阻碍地下水流动,导致DNAPLs更加难以溶解进入地下水,延长DNAPLs存在时间[15]。对于此类DNAPLs污染,在实际工程中应更多地关注污染物在第1阶段的迁移情况。
3 DNAPLs污染的判定在地块污染调查工作中应优先进行DNAPLs存在的判定以避免不必要的无针对性取样监测,节约成本,提高效率。DNAPLs存在的判定工作可从地块历史资料评估和地块现状数据评估2个角度开展[10],[16]4-98,详细步骤见图 7。

|
图 7 判定DNAPLs是否存在的工作流程[10],[16]4-98 Figure 7 DNAPLs occurrence decision chart and DNAPLs site assessment implications matrix |
样品分析评估工作首先应通过目测辨识DNAPLs是否存在(依据表 4)。由于DNAPLs分布的不规则和不连续性,还需通过分析典型污染物(如TCE、PCE等)并依据表 5判定DNAPLs是否存在。若依然无法确定DNAPLs存在,则需分析地块综合调查资料。表 5中的地块情况特征可用来初步判定DNAPLs是否存在。完成上述工作之后,若仍然无法确定DNAPLs的存在,则需再度检查前面的工作是否完备,并依据表 6来论证DNAPLs存在的可能性。检查结果符合表 6中所列的全部条件,方可判定地块DNAPLs存在的可能性较低[16]4-98。
|
|
表 4 目测法判断DNAPLs的存在准则[10], [16]4-98 Table 4 Determining DNAPLs presence by visual examination of subsurface samples |
|
|
表 5 判断DNAPLs是否存在的推荐方法[10], [16]4-98 Table 5 Recommendation of methods for estimating the presence of DNAPLs |
|
|
表 6 排除DNAPLs存在所需的调查工作要点[10] Table 6 Extensive works that can help indicate the absence of DNAPLs |
经过此判定流程,地块可被分为3类。第Ⅰ类:已确认或高度存在DNAPLs可能性的地块;第Ⅱ类:中度存在DNAPLs可能性的地块;第Ⅲ类:低度存在DNAPLs可能性的地块。
4 DNAPLs污染的调查DNAPLs调查技术根据调查对象可以分为:土壤气调查技术、地下水调查技术、土壤调查技术。按照调查方法可以分为:地球物理调查技术、非地球物理调查技术[60]。
土壤气体调查技术通过抽取分析土壤中的气体,由于其不需开挖取样,可以在土壤与地下水采样分析前快速了解地下污染物的分布情况。土壤气体浓度低并不能代表DNAPLs不存在[61]。
地下水调查技术主要是分析DNAPLs在地下水中的浓度或通过视觉与嗅觉辨认DNAPLs是否存在。若地下水中污染物浓度超过该物质纯态溶解度的1%时,通常可以认为DNAPLs很可能存在。
土壤调查技术主要是分析DNAPLs在土壤中的浓度。根据经验,当土壤中污染物含量超过10 g·kg-1,可以认为存在DNAPLs[10, 61]。此外,还可通过视觉和嗅觉辨认[10, 61]。
4.1 地球物理调查技术探地雷达探测技术(ground-penetrating radar method,GPR)是通过发射高频率(1~1 000 MHz)电磁波,分析电磁波碰到介电常数不同的物体而产生反射波的时间、波型、振幅等属性,判别反射界面的性质与位置,从而达到判断地下DNAPLs是否存在及污染分布情况的目的。探地雷达探测技术能够现场提供实时剖面记录,图像清晰直观,工作效率高,重复性好。地层衰减效应和电磁波能量过低是限制探测深度的2个主要因素,正常情况下,探测深度不超过30 m,最有效探测深度不超过10 m。该技术的主要局限性在于:仅适用于污染物浓度相当高的情形,轻微污染并不适用;要配合传统土壤采样分析或其他地质调查结果,无法单独使用;技术可靠性与土壤水分及黏土含量息息相关,土壤含水量过高或黏土层会大幅减弱GPR反射讯号[16]4-98,[62]。
电磁波探测技术(electromagnetic method, EM)应用电磁感应原理,在地表发射圈中通以交流电,可产生随时间变化的原生电磁场。基于不同地层电性特征的差异(被DNAPLs污染的地层的导电性能比未被污染的地层差),原生电磁场会产生变动涡电流。通过记录变动涡电流形成的次生电磁场的强度,了解地层的电导率分布情况即可确定DNAPLs污染分布情况。该方法需要详细的地下水文地质资料。受地质条件限制,界定范围通常只能达到60%~80%[61-62]。
地电阻影像剖面探测技术(resistivity image profiling, RIP)也是通过探测地层电导率在水平和垂直方向的变化情况来判断DNAPLs污染分布情况。通常在地表上沿测线布置若干电极,在电流极上以低频(约1~ 10 Hz)交替直流电通入地下,并在电压极测量相应电压,从而获取测线下方对应的电阻率分布。一般通过判断电阻率较高的异常区域分布确定DNAPLs污染分布情况。该方法受重金属(如电缆、金属管线)和地质情况(如岩层或砾石)影响,同时也无法分辨污染物的种类[16]4-98,[62]。
4.2 非地球物理技术多深度扩散元侦测技术是通过在地下不同深度处设置扩散元,来测定挥发性有机化合物(volatile organic compounds, VOCs)以及溶解氧浓度。相比于传统采样分析,该技术节省了时间与经费,可建立地下污染物的三维分布状况,但不适用于大面积污染,仅为定性与半定量侦测,仍需与传统采样分析实验配合来提供精确调查结果[62]。
直推式技术是三合系统实时检测方案的主要调查技术,采用连续性的非扰动性钻法,组配不同的附属设备,可现场进行采样监测、分析检测、NAPLs侦测等工作。该技术的潜力在于可在钻杆上装置不同的附属设备,以达到侦测DNAPLs位置的目的。常见的附属设备或依托于该技术的探测方法有:膜界面传感器(membrane interface probe,MIP)、卤化物传感器(halo probe)和地下柔性衬管技术(flexibleliner underground technologies,FLUTe)等。该技术的局限性在于其仅适用于砂土、粉土、黏土的地层,在含有卵砾石层中,直推式钻机无法钻进,同时DNAPLs可能沿钻孔向下迁移[16]4-98,[62]。
氡-222(Radon-222)是一种从铀-238天然分解而得的惰性气体,普遍存在于含水层的溶解气体中。没有DNAPLs存在时,含水层中氡-222浓度很快达到平衡并保持不变。当DNAPLs存在时,氡-222会溶解进入DNAPLs导致其在地下空间浓度降低。故通过比较氡-222浓度可判断DNAPLs分布。该技术的局限性在于:监测氡-222需要精密复杂的采样及分析技术;需事先对地块氡-222背景浓度有充分了解,背景值应较平均;是一种创新技术,使用时可供参考的资料不足[62]。
上述每种方法都有各自的优点与限制(表 7),在实际操作中应互相结合,比较对照,从而提高调查的分辨率,提高效率,节约成本。此外还有很多技术(如复电阻率法、电磁波井内测法和氢质子磁振法)应用范围较小,此处不赘述[61-62]。
|
|
表 7 常用DNAPLs判定调查技术 Table 7 Common investigation technologies |
该文综述了DNAPLs在地下环境中的分布特点,旨在提高地块环境调查过程中对DNAPLs的捕获效率。判断DNAPLs污染分布,应综合考虑地块及其周边的水文地质条件和污染时间等因素, 有针对性地设计调查方案。
在调查工作中,需注意分层监测。监测时应立足于地下水,兼顾土壤,灵活运用各种调查技术,以达到摸清污染现状,锁定污染源的目的。结合DNAPLs在地下分布特点,笔者认为在实际调查工作中应加强对于弱透水介质的调查,摸清污染源分布,避免修复结束后地下水中DNAPLs浓度反弹。在采用地球物理技术时,反演的多解性会造成的分析结果的不确定性,可通过先验信息的约束及其他调查方法结果验证来提高调查的准确度。此外,目前对于DNAPLs在地下环境中的迁移行为研究大多忽视了时间尺度上DNAPLs对与其接触土壤矿物表面性质的相互影响。在未来的研究中需关注地下孔隙、裂隙等通道表面在DNAPLs存在的情况下,发生的性质改变及性质变化对DNAPLs迁移行为的影响。
| [1] |
张孝飞, 陈樯, 邓绍坡, 等. 污染场地修复过程中挥发性有机物(VOCs)污染研究进展[J]. 生态与农村环境学报, 2015, 31(6): 831-834. ZHANG Xiao-fei, CHEN Qiang, DENG Shao-po, et al. Advances in the Study on Secondary Pollution of Volatile Orangic Compounds in Remediation of Contaminated Sites[J]. Journal of Ecology and Rural Environment, 2015, 31(6): 831-834. DOI:10.11934/j.issn.1673-4831.2015.06.006 (  0) 0) |
| [2] |
单艳红, 林玉锁, 王国庆. 加拿大污染场地的管理方法及其对我国的借鉴[J]. 生态与农村环境学报, 2009, 25(3): 90-93, 108. SHAN Yan-hong, LIN Yu-suo, WANG Guo-qing. Approach to Management of Polluted Sites in Canada[J]. Journal of Ecology and Rural Environment, 2009, 25(3): 90-93, 108. (  0) 0) |
| [3] |
施小清, 吴吉春, 刘德朋, 等. 饱和介质中重非水相液体迁移的数值模拟及敏感性分析[J]. 南京大学学报(自然科学), 2011, 47(3): 299-307. SHI Xiao-qing, WU Ji-chun, LIU De-peng, et al. Numerical Simulation of Transportation of Dense Nonaqueous Phase Liquids in the Subsurface Environment[J]. Journal of Nanjing University (Natural Sciences), 2011, 47(3): 299-307. (  0) 0) |
| [4] |
SALE T, NEWELL C, STROO H, et al. Frequently Asked Questions: Regarding Management of Chlorinated Solvents in Soils and Groundwater[R]. ESTCP, 2008.
(  0) 0) |
| [5] |
HEIDRICH S, WEISS H, KASCHL A. Attenuation Reactions in a Multiple Contaminated Aquifer in Bitterfeld (Germany)[J]. Environmental Pollution, 2004, 129(2): 277-288. DOI:10.1016/j.envpol.2003.10.029 (  0) 0) |
| [6] |
黄伟英. 铁矿石催化过氧化氢-过硫酸钠去除地下水中三氯乙烯的研究[D]. 北京: 中国地质大学, 2011. HUANG Wei-ying. Using Iron Mineral Catalyzed Hydrogen Peroxide-Sodium Persulfate to Remove Trichloroethylene in Groundwater[D]. Beijing: China University of Geosciences, 2011. (  0) 0) |
| [7] |
U. S. Environmental Protection Agency. Priority Pollutant List[EB/OL]. 2017-07-01]. https://www.epa.gov/eg/toxic-and-priority-pollutants-under-clean-water-act#priority.
(  0) 0) |
| [8] |
PANKOW J F, CHERRY J A. Dense Chlorinated Solvents and Other DNAPLs in Groundwater[M]. Porland: Waterloo Press, 1995.
(  0) 0) |
| [9] |
张蔚, 施小清, 吴剑锋, 等. 渗透率空间变异性对重非水相流体迁移的影响[J]. 高校地质学报, 2013, 19(4): 677-682. ZHANG Wei, SHI Xiao-qing, WU Jian-feng, et al. Impacts of the Spatial Variation of Permeability on the Transport of Dense Non-Aqueous Phase Liquids in Porous Media[J]. Geological Journal of China Universities, 2013, 19(4): 677-682. (  0) 0) |
| [10] |
U. S. Environmental Protection Agency. DNAPL Site Evaluation[Z]. EPA/600/R-93/022, 1993.
(  0) 0) |
| [11] |
KHACHIKIAN C, HARMON T C. Nonaqueous Phase Liquid Dissolution in Porous Media:Current State of Knowledge and Research Needs[J]. Transport in Porous Media, 2000, 38(1/2): 3-28. DOI:10.1023/A:1006667318234 (  0) 0) |
| [12] |
ESTCP. Decision Guide:A Guide for Selecting Remedies for Subsurface Releases of Chlorinated Solvents[M]. Hoboken, USA: John Wiley & Sons, Inc, 2011.
(  0) 0) |
| [13] |
刘锐, 孟凡勇, 文晓刚, 等. 挥发性氯代烃在土壤中的吸附行为研究进展[J]. 土壤学报, 2012, 49(1): 165-172. LIU Rui, MENG Fan-yong, WEN Xiao-gang, et al. A Review of Studies on Sorption Behaviors of Volatile Chlorinated Hydrocarbons in Natural Soil[J]. Acta Pedologica Sinica, 2012, 49(1): 165-172. DOI:10.11766/trxb201010090415 (  0) 0) |
| [14] |
SCHWARZENBACH R P, GSCHWARZENBACH P M, IMBODEN D M. Environmental Organic Chemistry[M]. 2nd ed. Journal of Contaminant Hydrology, 2005: 1197-1208.
(  0) 0) |
| [15] |
Interstate Technology & Regulatory Council. Integrated DNAPL Site Characterization and Tools Selection[R]. Washington DC, USA: Interstate Technology & Regulatory Council, DNAPL Site Characterization Team, 2015.
(  0) 0) |
| [16] |
丁贞玉. 重质非水相液体(DNAPL)污染场地调查评估技术[M]. 北京: 化学工业出版社, 2016. DING Zhen-yu. DNAPL Contaminated Site Survey Assessment Techniques[M]. Beijing: Chemical Industry Press, 2016. (  0) 0) |
| [17] |
张雪, 刘维涛, 梁丽琛, 等. 多氯联苯(PCBs)污染土壤的生物修复[J]. 农业环境科学学报, 2016, 35(1): 1-11. ZHANG Xue, LIU Wei-tao, LIANG Li-chen, et al. Bioremediation of Soil Polluted by Polychlorinated Biphenyls (PCBs)[J]. Journal of Agro-Environment Science, 2016, 35(1): 1-11. DOI:10.11654/jaes.2016.01.001 (  0) 0) |
| [18] |
RAJENDRAN R B, IMAGAWA T, TAO H, et al. Distribution of PCBs, HCHs and DDTs, and Their Ecotoxicological Implications in Bay of Bengal, India[J]. Environment International, 2005, 31(4): 503-512. DOI:10.1016/j.envint.2004.10.009 (  0) 0) |
| [19] |
ZHOU W, ANITESCU G, RICE P A, et al. Supercritical Fluid Extraction-xidation Technology to Remediate PCB-Contaminated Soils/Sediments:An Economic Analysis[J]. Environmental Progress, 2004, 23(3): 222-231. DOI:10.1002/(ISSN)1547-5921 (  0) 0) |
| [20] | |
| [21] |
QUE Ming-xue. Pollution Distribution and Source Analysis of PCBs in Chinese Surface Soil[J]. Harbin:Harbin Engineering University, 2007. (  0) 0) |
| [22] |
徐春霞. 煤焦油的性质与加工利用[J]. 洁净煤技术, 2013, 19(5): 63-67. XU Chun-xia. Characteristics and Processing Utilization of Coal Tar[J]. Clean Coal Technology, 2013, 19(5): 63-67. (  0) 0) |
| [23] |
苗强. 生物质油与重油共减黏裂化的可行性研究[J]. 洁净煤技术, 2015(3): 75-78. MIAO Qiang. Feasibility Study of Co-Vis Breaking to Coal Tar or Biomass-Oil and Heavy Oil[J]. Clean Coal Technology, 2015(3): 75-78. (  0) 0) |
| [24] |
杨金鑫. 废轮胎与煤焦油共热解制备燃料油和炭黑工艺研究[D]. 南昌: 江西理工大学, 2014. YANG Jin-xin. The Copyrolysis Process Study of Waste Tire With Coal Tar for Fuel Oil and Carbon Black[D]. Nanchang: Jiangxi University of Science and Technology, 2014. (  0) 0) |
| [25] |
International Agency for Research on Cancer. List of Classifications[EB/OL]. 2017-07-01]. http://monographs.iarc.fr/ENG/Classification/List_of_Classifications.pdf.
(  0) 0) |
| [26] |
周萍. 煤焦油净化制备泡沫碳[D]. 贵阳: 贵州大学, 2016. ZHOU Ping. Coal Tar Purification to Prepare Carbon Foam[D]. Guiyang: Guizhou University, 2016. (  0) 0) |
| [27] |
BLANCO C G, CANGA J S, DOMÍNGUEZ A, et al. Flame Ionization Detection Relative Response Factors of Some Polycyclic Aromatic Compounds:Determination of the Main Components of the Coal Tar Pitch Volatile Fraction[J]. Journal of Chromatography A, 1992, 607(2): 295-302. DOI:10.1016/0021-9673(92)87088-P (  0) 0) |
| [28] |
许友卿, 梅婕, 丁兆坤. 多氯联苯对水生动物抗氧化酶的影响及机理[J]. 水产科学, 2014, 33(4): 258-262. XU You-qing, MEI Jie, DING Zhao-kun. Effects and Mechanisms of Polychlorinated Biphenyls(PCBs) on Antioxidases in Aquatic Animals[J]. Fisheries Science, 2014, 33(4): 258-262. (  0) 0) |
| [29] |
TEAM I I. Technical/Regulatory Guidance:Integrated DNAPL Site Strategy[J]. Washington DC, USA:ITRC, 2011, 1-209. (  0) 0) |
| [30] |
U. S. Environmental Protection Agency. Site Characterization Technologies for DNAPL Investigations[Z]. EPA 542-R-04-017, 2004.
(  0) 0) |
| [31] |
程洲, 吴吉春, 徐红霞, 等. DNAPL在透镜体及表面活性剂作用下的迁移研究[J]. 中国环境科学, 2014, 34(11): 2888-2896. CHENG Zhou, WU Ji-chun, XU Hong-xia, et al. Investigation of the Migration Characteristic of DNAPL in Aquifer With Lenses and Under the Action of Surfactant Flushing[J]. China Environmental Science, 2014, 34(11): 2888-2896. (  0) 0) |
| [32] |
SCHWILLE F. Dense Chlorinated Solvents in Porous and Fractured Media:Model Experiments[M]. Chelsea, USA: Lewis Publishers, 1988: 23-65.
(  0) 0) |
| [33] |
KAMALJIT S, ROBERT K N. Non-Aqueous Phase Liquid Spills in Freezing and Thawing Soils:Critical Analysis of Pore-Scale Processes[J]. Critical Reviews in Environmental Science and Technology, 2013, 43(6): 551-597. DOI:10.1080/10643389.2011.604264 (  0) 0) |
| [34] |
FETTER C W. Contaminant Hydrogeology[M]. Upper Saddle River, USA: Prentice Hall, 1999: 711-738.
(  0) 0) |
| [35] |
刘雪松, 蔡五田, 李胜涛. 石油类污染场地土壤与地下水污染调查实例分析[J]. 水文地质工程地质, 2010, 37(4): 121-125. LIU Xue-song, CAI Wu-tian, LI Sheng-tao. Survey of Soil and Groundwater Contamination in Oil Pollution Site[J]. Hydrogeology & Engineering Geology, 2010, 37(4): 121-125. (  0) 0) |
| [36] |
PARKER B L, CHERRY J A, CHAPMAN S W, et al. Review and Analysis of Chlorinated Solvent Dense Nonaqueous Phase Liquid Distributions in Five Sandy Aquifers[J]. Vadose Zone Journal, 2003, 2(2): 116-137. DOI:10.2136/vzj2003.1160 (  0) 0) |
| [37] |
KUEPER B H, MCWHORTER D B. The Behavior of Dense, Nonaqueous Phase Liquids in Fractured Clay and Rock[J]. Groundwater, 1991, 29(5): 716-728. DOI:10.1111/gwat.1991.29.issue-5 (  0) 0) |
| [38] |
REYNOLDS D A, KUEPER B H. Numerical Examination of the Factors Controlling DNAPL Migration Through a Single Fracture[J]. Groundwater, 2002, 40(4): 368-377. DOI:10.1111/gwat.2002.40.issue-4 (  0) 0) |
| [39] |
DEARDEN R A, NOY D J, LELLIOTT M R, et al. Release of Contaminants From a Heterogeneously Fractured Low Permeability Unit Underlying a DNAPL Source Zone[J]. Journal of Contaminant Hydrology, 2013, 153: 141-155. DOI:10.1016/j.jconhyd.2011.05.006 (  0) 0) |
| [40] |
LUCIANO, VIOTTI P, PAPINI M P. Laboratory Investigation of DNAPL Migration in Porous Media[J]. Journal of Hazardous Materials, 2010, 176(1/2/3): 1006-1017. (  0) 0) |
| [41] |
STEPHENS D B, KELSEY J A, PRIEKSAT M A, et al. DNAPL Migration Through a Fractured Perching Layer[J]. Groundwater, 1998, 36(4): 605-610. DOI:10.1111/gwat.1998.36.issue-4 (  0) 0) |
| [42] |
LONGINO B L, KUEPER B H. The Use of Upward Gradients to Arrest Downward DNAPL Migration in the Presence of Solubilizing Surfactants[J]. Canadian Geotechnical Journal, 2011, 32(2): 296-308. (  0) 0) |
| [43] |
ALAZAIZA M Y D, SU K N, BOB M M, et al. Influence of Macro-Pores on DNAPL Migration in Double-Porosity Soil Using Light Transmission Visualization Method[J]. Transport in Porous Media, 2017, 117(1): 103-123. DOI:10.1007/s11242-017-0822-3 (  0) 0) |
| [44] |
EWING R P, BERKOWITZ B. Stochastic Pore-Scale Growth Models of DNAPL Migration in Porous Media[J]. Advances in Water Resources, 2001, 24(3/4): 309-323. (  0) 0) |
| [45] |
MING W, CHENG Z, WU J F, et al. Precise Simulation of Long-Term DNAPL Migration in Heterogeneous Porous Media Based on Light Transmission Micro-Tomography[J]. Journal of Environmental Chemical Engineering, 2017, 5(1): 725-734. DOI:10.1016/j.jece.2016.12.039 (  0) 0) |
| [46] |
CHENG Z, GAO B, XU H X, et al. Effects of Surface Active Agents on DNAPL Migration and Distribution in Saturated Porous Media[J]. Science of the Total Environment, 2016, 571: 1147-1154. DOI:10.1016/j.scitotenv.2016.07.109 (  0) 0) |
| [47] |
GERHARD J I, PANG T, KUEPER B H. Time Scales of DNAPL Migration in Sandy Aquifers Examined via Numerical Simulation[J]. Groundwater, 2007, 45(2): 147-157. DOI:10.1111/gwat.2007.45.issue-2 (  0) 0) |
| [48] |
SWEIJEN T, HARTOG N, MARSMAN A, et al. The Transport Behaviour of Elemental Mercury DNAPL in Saturated Porous Media:Analysis of Field Observations and Two-Phase Flow Modelling[J]. Journal of Contaminant Hydrology, 2014, 161: 24-34. DOI:10.1016/j.jconhyd.2014.03.001 (  0) 0) |
| [49] |
ZHENG F, GAO Y, SUN Y, et al. Influence of Flow Velocity and Spatial Heterogeneity on DNAPL Migration in Porous Media:Insights From Laboratory Experiments and Numerical Modelling[J]. Hydrogeology Journal, 2015, 23(8): 1703-1718. DOI:10.1007/s10040-015-1314-6 (  0) 0) |
| [50] |
PASSATORE L, ROSSETTI S, JUWARKAR A A, et al. Phytoremediation and Bioremediation of Polychlorinated Biphenyls (PCBs):State of Knowledge and Research Perspectives[J]. Journal of Hazardous Materials, 2014, 278: 189-202. DOI:10.1016/j.jhazmat.2014.05.051 (  0) 0) |
| [51] |
LIPSON D S, KUEPER B H, GEFELL M J. Matrix Diffusion-Derived Plume Attenuation in Fractured Bedrock[J]. Ground Water, 2005, 43(1): 30-39. DOI:10.1111/gwat.2005.43.issue-1 (  0) 0) |
| [52] |
YANG Z B, NIEMI A, FAGERLUND F, et al. Effects of Single-Fracture Aperture Statistics on Entrapment, Dissolution and Source Depletion Behavior of Dense Non-Aqueous Phase Liquids[J]. Journal of Contaminant Hydrology, 2012, 133: 1-16. DOI:10.1016/j.jconhyd.2012.03.002 (  0) 0) |
| [53] |
邓亚平, 张烨, 施小清, 等. 非均质裂隙介质中重非水相流体迁移[J]. 水科学进展, 2015, 26(5): 722-730. DENG Ya-ping, ZHANG Ye, SHI Xiao-qing, et al. Study on the Migration of Dense Non-Aqueous Phase Liquids in Heterogeneous Fractured Media[J]. Advances in Water Science, 2015, 26(5): 722-730. (  0) 0) |
| [54] |
DEMENICO P A, SCHWARTZ F W. Physical and Chemical Hydrogeology[M]. New York, USA: John Wiley Sons, 1990: 334-414.
(  0) 0) |
| [55] |
MENDOZA C A, FRIND E O. Advective-Dispersive Transport of Dense Organic Vapors in the Unsaturated Zone:2.Sensitivity Analysis[J]. Water Resources Research, 1990, 26(3): 388-398. DOI:10.1029/WR026i003p00388 (  0) 0) |
| [56] |
MENDOZA C A, MCALARY T A. Modeling of Groundwater Contamination Caused by Organic Solvent Vapors[J]. Groundwater, 1990, 28(2): 199-206. DOI:10.1111/gwat.1990.28.issue-2 (  0) 0) |
| [57] |
U. S. Army Corps of Engineers. Engineering and Design: Soil Vapor Extraction and Bioventing[Z]. EM1110-1-4001, 2002.
(  0) 0) |
| [58] |
STROO H F, LEESON A, MARQUSEE J A, et al. Chlorinated Ethene Source Remediation:Lessons Learned[J]. Environmental Science & Technology, 2012, 46(12): 6438-6447. (  0) 0) |
| [59] |
CHAPMAN S W, PARKER B L. Plume Persistence Due to Aquitard Back Diffusion Following Dense Nonaqueous Phase Liquid Source Removal or Isolation[J]. Water Resources Research, 2005, 41(12): 2179-2187. (  0) 0) |
| [60] |
PARKER B L, CHAPMAN S W, GUILBEAULT M A. Plume Persistence Caused by Back Diffusion From Thin Clay Layers in a Sand Aquifer Following TCE Source-Zone Hydraulic Isolation[J]. Journal of Contaminant Hydrology, 2008, 102(1/2): 86-104. (  0) 0) |
| [61] |
刘雪松, 蔡五田, 李胜涛. 土壤与地下水中DNAPL的污染机理与调查技术[J]. 油气田环境保护, 2011, 21(6): 37-39. LIU Xue-song, CAI Wu-tian, LI Sheng-tao. Survey of Soil and Groundwater Contamination in Oil Pollution Site[J]. Environmental Protection of Oil & Gas Fields, 2011, 21(6): 37-39. (  0) 0) |
| [62] |
车明道. DNAPLs调查技术简介[J]. 台湾土壤及地下水环境保护协会, 2002(4): 19-22. CHE Ming-dao. DNAPL Survey Technology Overview[J]. TASGEP Newsletter, 2002(4): 19-22. (  0) 0) |




