河流和湖泊等湿地生态系统中的大型水生植物可用于水体生态修复, 在富营养化和污染水体治理中得到了广泛应用。水生植物具有一定的季节性, 冬季低温导致大量水生植物枯死, 若不及时收割, 其腐烂后氮、磷、有机物等释放进入水体将造成水体二次污染, 为此, 将大型水生植物收割制备成生物炭, 既能解决水生植物枯死腐烂造成二次污染的问题, 又能吸附水体中氮、磷等污染物[1-2]。
生物炭指由生物残体在缺氧情况下经高温慢热解(通常<700 ℃)产生的一类难溶、稳定、高度芳香化、富含碳素的固态物质[3]。生物炭可溶性低, 且拥有较大的孔隙度和比表面积, 具有大量表面负电荷以及较高的电荷密度, 稳定性强, 是一种优良的吸附材料[4]。国内外已有许多利用植物废弃物制备生物炭吸附水体污染物的研究[4-6]。李丽等[4]研究了铁改性花生壳炭和小麦秸秆炭对硝态氮的吸附, 但吸附能力有待提高; 王博等[6]利用HCl改性的香蒲(Typha angustifolia)和芦苇(Phragmites communis)生物炭来吸附硝态氮。
香蒲和芦苇是湿地生态修复中常用的大型水生植物。香蒲秸秆以叶片为主, 细胞间隙大, 海绵状; 芦苇秸秆以茎秆为主, 单个植株生物量较大。选择香蒲和芦苇为原料制备生物炭, 以硝酸钾溶液为吸附质, 分析2种生物炭对硝态氮的吸附特性, 并结合红外光谱分析、扫描电镜分析和元素分析, 探究2种改性生物炭对硝态氮的吸附特性, 探索低耗、高效的水体硝态氮去除方法, 开发性能优异的吸附剂, 为水体富营养化治理及水生植物废弃物资源化利用提供理论依据。
1 材料与方法 1.1 主要试剂与仪器主要试剂:硝酸钾、三氯化铁、盐酸, 以上试剂均为分析纯。
主要仪器:TU-1901紫外-可见分光光度计(北京普析通用仪器有限责任公司)、XMT-8000箱式电阻炉(绍兴市上虞道墟科析仪器厂)、SHZ-82旋转恒温气浴振荡器(金坛市城东西瑞仪器厂)、Tenson 27傅里叶变换红外光谱仪(德国布鲁克公司)、SEM-S4800扫描电子显微镜(日本日立高新技术公司)、Vario Micro元素分析仪(德国ELEMENTAR公司)。
1.2 生物炭的制备及改性选用香蒲(Typha angustifolia)和芦苇(Phragmites communis)2种大型水生植物为原料, 于2016年10月将采自南京工程学院校内湖泊的香蒲和芦苇秸秆用自来水冲洗4~5次, 再用去离子水洗净并风干, 剪碎后放入高速多功能粉碎机中粉碎。
生物炭的制备采用缺氧热解法[5], 制备方法参考李丽等[4]的研究:将一定质量的粉碎原料放入马弗炉中, 在500 ℃条件下恒温缺氧热解1 h, 产物用1 mol·L-1 HCl浸泡1 h, 再用去离子水冲洗至中性, 然后在80 ℃条件下烘干, 研磨过0.15 mm孔径筛备用。取部分备用炭用1 mol·L-1 FeCl3浸泡1 h进行生物炭表面改性, 再用去离子水通过玻璃砂芯过滤器多次洗涤至滤液pH值为中性, 于80 ℃条件下烘干后装入密封袋中置于干燥器保存备用。未改性与FeCl3改性香蒲生物炭分别标记为XP、XP-Fe; 未改性与FeCl3改性芦苇生物炭分别标记为LW、LW-Fe。
1.3 指标测定改性前后生物炭的傅里叶变换红外光谱图采用Tenson 27傅里叶变换红外光谱仪测定, 扫描范围为250~4 000 cm-1, 分辨率为6 cm-1。改性前后生物炭的表面形貌特征采用SEM-S4800扫描电子显微镜测定, 扫描电压为15 kV。采用德国Vario Micro元素分析仪测定生物炭中C、H、N、S含量, 扣除灰分对元素含量的影响, 通过差减法计算O含量。产率(W)计算公式为
| $ W = {m_2}/{m_1} \times 100\% 。$ | (1) |
式(1)中, W为产率, %; m1为原料的原始质量, g; m2为原料经马弗炉高温热解后的质量, g。
1.4 生物炭对硝态氮的吸附实验 1.4.1 生物炭对硝态氮的吸附准确量取100 mL 20 mg·L-1 KNO3溶液置于250 mL锥形瓶中, 分别加入0.1 g改性和未改性生物炭, 在25 ℃、150 r·min-1条件下置于恒温振荡箱中振荡2 h, 将吸附液经0.45 μm孔径滤膜过滤后倒入25 mL比色管中, 用紫外分光光度法测定滤液中硝态氮质量浓度[4]。
1.4.2 炭添加量和pH值对硝态氮吸附的影响准确量取100 mL 20 mg·L-1 KNO3溶液置于250 mL锥形瓶中, 分别加入0.05、0.10、0.15、0.20、0.30、0.40、0.50、0.60 g FeCl3改性生物炭。此外, 在250 mL锥形瓶中, 加入0.1 g改性生物炭和20 mg·L-1 KNO3溶液100 mL, 用1 mol·L-1 NaOH和HCl溶液调节pH值为1、3、5、7、9、11, 于25 ℃、150 r·min-1条件下, 在恒温振荡箱内振荡2 h, 用紫外分光光度法测定滤液中硝态氮质量浓度[4]。
1.4.3 改性生物炭对硝态氮吸附动力学在250 mL锥形瓶中, 分别加入0.1 g改性生物炭和100 mL 20 mg·L-1 KNO3溶液, 在25 ℃、150 r·min-1条件下置于恒温振荡箱中分别振荡10、30、40、60、120、240、600 min, 将吸附液经0.45 μm孔径滤膜过滤后, 用紫外分光光度法测定滤液中硝态氮质量浓度[7]。
1.4.4 改性生物炭对硝态氮吸附等温线在250 mL锥形瓶中, 分别加入0.1 g改性生物炭和一系列不同质量浓度(5、10、20、30、40、50、60 mg·L-1)的KNO3溶液100 mL, 在25 ℃、150 r·min-1条件下, 分别在恒温振荡箱内振荡2 h, 用紫外分光光度法测定滤液中硝态氮质量浓度[7]。
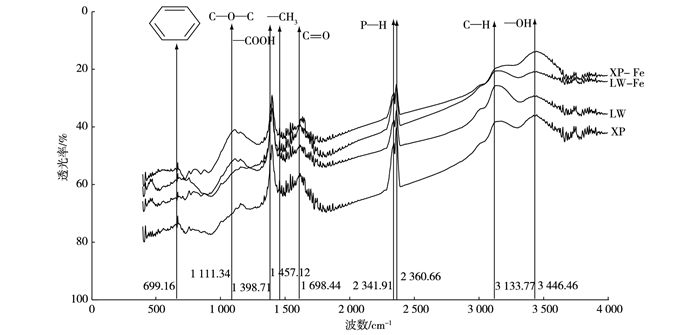
2 结果与讨论 2.1 红外光谱和扫描电镜分析XP、XP-Fe、LW和LW-Fe的红外光谱图具有一定的相似性, 在699.16、1 111.34、1 398.71、1 457.12、1 698.44、2 341.91、2 360.66、3 133.77、3 446.46 cm-1附近都出现吸收峰(图 1)。699.16 cm-1附近出现吸收峰, 代表有苯环存在; 1 111.34 cm-1附近吸收峰为C—O—C的振动[8-9]; 1 398.71 cm-1附近吸收峰为—COOH的对称伸缩振动[10-11]; 1 698.44 cm-1附近为C=O的振动吸收峰[12-13]; 3 133.77和3 446.46 cm-1出现吸收峰, 表示C—H和—OH的存在; 另外, 2 360.66和2 341.91 cm-1出现的吸收峰为P—H的振动吸收, 表明由香蒲和芦苇制备的生物炭表面含磷, 这与杨柳燕等[14]研究结果相似。经FeCl3改性的炭吸收峰强度明显要小于未改性炭的吸收峰强度, 这是由于Fe3+与生物炭表面的—OH、—COOH、C=O等含氧官能团发生了络合作用, 形成络合物[15]。另外, 经水解生成的Fe(OH)3胶体会覆盖生物炭表面的官能团, 这也可能导致经FeCl3改性的生物炭吸收峰强度减弱。
|
图 1 不同生物炭的红外光谱图 Figure 1 Infrared spectra of the biochars XP和XP-Fe分别表示未改性和FeCl3改性香蒲生物炭, LW和LW-Fe分别表示未改性和FeCl3改性芦苇生物炭。 |
从图 2看出, 改性香蒲生物炭的表面因被铁的化合物覆盖变得更加粗糙, 增大了生物炭表面的反应活性位点, 有利于其对硝态氮的吸附。此外, 改性香蒲生物炭表面空隙更加密集, 孔隙率更大, 增加了硝态氮被吸附的空间。芦苇生物炭改性前后的SEM图与香蒲生物炭相似, 故未列出。

|
图 2 未改性和改性香蒲生物炭的SEM图 Figure 2 SEM images of modified and unmodified Typha angustifolia biochars |
芦苇在500 ℃温度下热解的生物炭产率小于香蒲(表 1), 这可能是因为香蒲中木质素含量高于芦苇。已有研究表明, 生物质热解是纤维素、半纤维素和木质素3种主要组分热解的综合表现, 且纤维素和半纤维素主要产生挥发性物质, 木质素主要分解为炭[16]。
|
|
表 1 2种生物炭的产率、元素含量和原子比 Table 1 Yield, elemental contents and atomic ratio of the two kinds of biochars |
2种生物炭均含有C、H、O、N、S等元素, 其中香蒲生物炭的C含量较高, 为73.21%;芦苇生物炭C含量较低, 仅为56.60%;2种生物炭的H含量均较低, 都在1%以下; N、S含量差异不大, 分别在1%~7%和5%~7%范围内; O含量差异较大, 香蒲生物炭为19.03%, 芦苇生物炭为30.24%。
2种生物炭的O/C、H/C和(O+H)/C原子比均为LW>XP, 已有研究结果显示, O/C、H/C和(O+H)/C越小, 表明生物炭的疏水性越强, 芳香官能团更多, 极性越低, 因此有较强的吸附性能[17], 由此可以推测, 香蒲生物炭的吸附性能大于芦苇。
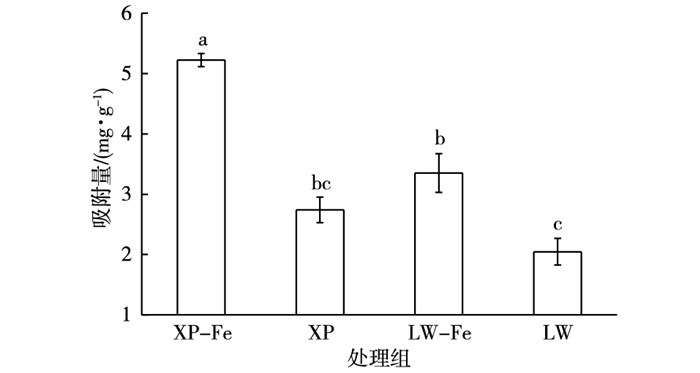
2.3 改性与未改性生物炭对硝态氮的吸附效果2种FeCl3改性生物炭对硝态氮的吸附量均高于未经改性的生物炭, FeCl3改性香蒲炭和芦苇炭对硝态氮的吸附量均为未改性香蒲炭和芦苇炭的2倍左右(图 3)。这是因为生物炭表面带负电荷, 对阴离子NO3-的吸附效果较差[18], 而经FeCl3改性后, Fe3+会与其表面含氧官能团发生络合反应, 降低生物炭表面的负电荷, 增加其正电荷, 从而增强生物炭对带负电荷的NO3-的吸附效果[19]。
|
图 3 改性与未改性生物炭对硝态氮的吸附量 Figure 3 Nitrate-N adsorptions of modified and non-modified biochars XP和XP-Fe分别表示未改性和FeCl3改性香蒲生物炭,LW和LW-Fe分别表示未改性和FeCl3改性芦苇生物炭。直方柱上方英文小写字母不同表示各处理间差异显著(P<0.05)。 |
随着改性生物炭添加量的增大, XP-Fe、LW-Fe 2种生物炭对硝态氮的去除率也随之增加, 增加到一定程度后趋向平衡; XP-Fe添加量为4 g·L-1时, 去除率可达73%;随炭添加量的增加LW-Fe去除率上升比较缓慢, 当添加量为6 g·L-1时, 去除率仅为43%;相同条件下, LW-Fe对硝态氮的去除率明显低于XP-Fe(图 4)。

|
图 4 改性生物炭添加量对硝态氮去除率的影响 Figure 4 Effect of application rate of modified biochars on nitrate-N removal rate XP-Fe和LW-Fe分别表示FeCl3改性香蒲生物炭和芦苇生物炭。 |
Langergren和Svenska给出了求解吸附速率的伪一级吸附动力学反应方程, 如式(2)。除了伪一级吸附动力学反应方程外, 还可以考虑伪二级吸附动力学反应方程, 如式(3)。
| $ \lg \left( {{q_{\rm{e}}} - {q_t}} \right) = \lg {q_{\rm{e}}} - \frac{{{k_1}t}}{{2.303}}, $ | (2) |
| $ \frac{t}{{{q_t}}} = \frac{1}{{q_{\rm{e}}^2{k_2}}} + \frac{t}{{{q_{\rm{e}}}}}。$ | (3) |
式(2)~(3)中, qt为单位质量FeCl3改性生物炭在t时刻所能吸附硝态氮质量, mg·g-1; k1为伪一级吸附动力学方程常数, min-1; k2为伪二级吸附动力学方程常数, g·mg-1·min-1; qe为平衡吸附量, mg·g-1; t为吸附时间, min。
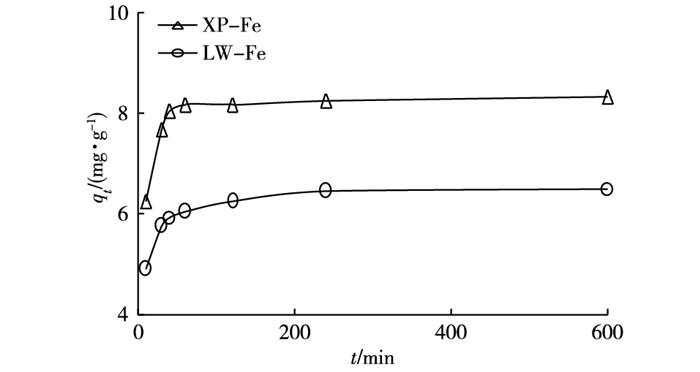
从吸附量与时间关系图可以看出, XP-Fe吸附硝态氮的过程相对较快, 120 min左右达到吸附平衡; LW-Fe对硝态氮的吸附相对较慢, 240 min左右达到吸附平衡; 且相同条件下, XP-Fe的平衡吸附量大于LW-Fe(图 5)。这2种炭的伪二级吸附动力学曲线拟合均较好, 而其伪一级吸附动力学曲线拟合均较差(表 2)。
|
图 5 改性生物炭对硝态氮的吸附量与时间关系 Figure 5 Relationship between nitrate-N adsorption of the modified biochars and duration of the adsorption XP-Fe和LW-Fe分别表示FeCl3改性香蒲生物炭和芦苇生物炭。 |
|
|
表 2 改性生物炭吸附硝态氮的动力学方程参数 Table 2 Parameters of the kinetic equation for nitrate-N adsorption of modified biochars |
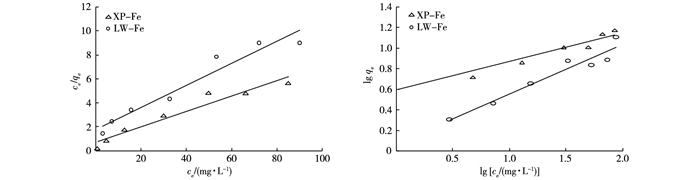
吸附等温线是描述体系中吸附剂表面和溶液中吸附质数量关系的曲线。利用吸附实验数据分别拟合出25 ℃条件下XP-Fe和LW-Fe对硝态氮的Langmuir和Freundlich吸附等温线[20]。Langmuir和Freundlich吸附等温线方程见式(4)~(5), 拟合曲线如图 6所示, 拟合曲线参数见表 3。
| $ {\rm{Langmuir方程:}}\frac{{{c_{\rm{e}}}}}{{{q_{\rm{e}}}}} = \frac{{{c_{\rm{e}}}}}{{{q_{\rm{m}}}}} + \frac{1}{{K{q_{\rm{m}}}}}, $ | (4) |
| $ {\rm{Freundlich}}方程:\lg {q_{\rm{e}}} = \lg {K_{\rm{F}}} + \frac{1}{n}\lg {c_{\rm{e}}}。$ | (5) |
|
图 6 改性生物炭对硝态氮的Langmuir和Freundlich吸附等温线 Figure 6 Langmuir and Freundlich nitrate-N adsorption isotherms of the modified biochars XP-Fe和LW-Fe分别表示FeCl3改性香蒲生物炭和芦苇生物炭。 |
|
|
表 3 25 ℃条件下改性生物炭吸附硝态氮的等温线方程参数 Table 3 Parameters of the nitrate-N isotherm equation for the modified biochars |
式(4)~(5)中, qe为硝态氮在生物炭上的平衡吸附量, mg·g-1; ce为溶液中硝态氮平衡浓度, mg·L-1; qm为最大吸附容量, mg·g-1; K为与吸附能量相关的Langmuir常数; KF为非均相吸附剂的Freundlich常数;n与吸附推动力大小及吸附位的能量分布有关。
XP-Fe对硝态氮的Freundlich吸附等温线方程的线性决定系数R2大于Langmuir吸附等温线方程(表 3), 表明XP-Fe更符合Freundlich吸附等温线模型, 为双分子层吸附。LW-Fe与之相反, 更符合Langmuir吸附等温线模型, 为单分子层吸附。
XP-Fe和LW-Fe的1/n分别为0.276 0、0.484 6, 均介于0.1~0.5之间, 表明2种改性生物炭易于吸附硝态氮[21]。Freundlich吸附等温线参数显示, XP-Fe和LW-Fe的最大吸附量(qm)分别为15.55和10.63 mg·g-1。王博等[6]利用HCl改性的香蒲和芦苇生物炭对硝态氮最大吸附量分别为5.56和14.67 mg·g-1。李丽等[4]利用铁改性花生壳炭和小麦秸秆炭对硝态氮最大吸附潜力分别仅为2.67和1.29 mg·g-1。
2.7 pH值对改性生物炭吸附硝态氮的影响XP-Fe、LW-Fe对硝态氮的吸附量随pH值的升高而下降, pH值从9升高到11时, XP-Fe和LW-Fe的吸附量均明显降低, 分别降低86.43%和67.51%(图 7)。
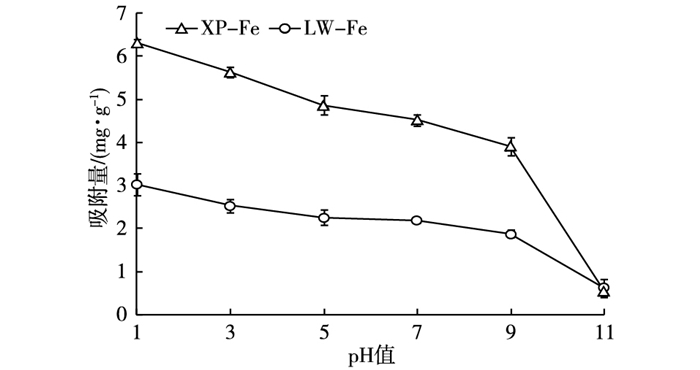
|
图 7 pH值对改性生物炭吸附硝态氮的影响 Figure 7 Effect of pH on adsorption of nitrate-N by modified biochars XP-Fe和LW-Fe分别表示FeCl3改性香蒲生物炭和芦苇生物炭。 |
上述结果表明酸性条件有利于FeCl3改性生物炭对硝态氮的吸附, 而FeCl3改性生物炭对硝态氮的吸附在碱性条件下受到抑制[22], 这是由于pH值越低, 溶液中H+浓度越高, 大量H+使得炭表面的负电荷基团减少, 正电荷基团增加, 而NO3-带负电, H+带正电, 正负电荷相吸, 更有利于FeCl3改性生物炭对硝态氮的吸附。反之, pH值升高, 改性生物炭表面负电荷增加, 使得静电排斥力增大, 吸附量减小[23]。此外, pH值升高, OH-与NO3-形成了吸附竞争, 从而减少改性生物炭表面硝酸盐氮的吸附活性位点, 使得吸附量减小。这与李丽等[4]和王博等[6]的研究结果一致。
3 结论(1) FeCl3改性使得香蒲和芦苇生物炭表面正电荷增加, 负电荷减少, 同时增大2种生物炭表面粗糙度和孔隙率, 改性香蒲和芦苇生物炭对硝态氮的吸附量显著增大, 且FeCl3成本较低, 会对环境造成二次污染。
(2) 2种改性生物炭对硝态氮的吸附均符合伪二级吸附动力学方程。XP-Fe符合Freundlich吸附等温线模型, 为双分子层吸附; 而LW-Fe符合Langmuir吸附等温线模型, 为单分子层吸附。
(3) 铁改性能显著提高生物炭吸附硝态氮的能力, XP-Fe和LW-Fe的最大吸附量分别为15.55和10.63 mg·g-1。
(4) 随着硝态氮溶液pH值的增大, 改性生物炭表面的负电荷增加, 正电荷减少, 2种FeCl3改性生物炭对硝态氮的吸附量均逐渐降低, 表明酸性环境有利于FeCl3改性生物炭对硝态氮的去除。
(5) XP-Fe对硝态氮的吸附能力大于LW-Fe。
| [1] |
JING S R, LIN Y F, LEE D Y, et al. Nutrient Removal From Polluted River Water by Using Constructed Wetlands[J]. Bioresource Technology, 2001, 76(2): 131-135. DOI:10.1016/S0960-8524(00)00100-0 (  0) 0) |
| [2] |
VERHOEVEN J T, ARHEIMER B, YIN C, et al. Regional and Global Concerns Over Wetlands and Water Quality[J]. Trends in Ecology & Evolution, 2005, 21(2): 96-103. (  0) 0) |
| [3] |
王月瑛, 吕贻忠. 酸洗处理对生物炭表面吸附特性及光谱特性的影响[J]. 光谱学与光普分析, 2016, 36(10): 3292-3296. WANG Yue-ying, LÜ Yi-zhong. Effect of Acid Elution on the Surface Structure Characteristics and Spectral Characteristics of Biochars[J]. Spectroscopy and Spectral Analysis, 2016, 36(10): 3292-3296. (  0) 0) |
| [4] |
李丽, 陈旭, 吴丹, 等. 固定化改性生物炭模拟吸附水体硝态氮潜力研究[J]. 农业环境科学学报, 2015, 34(1): 137-143. LI Li, CHEN Xu, WU Dan, et al. Adorption of Aqueous Nitrate-N by Immobilized Modified Biochar[J]. Journal of Agro-Environment Science, 2015, 34(1): 137-143. DOI:10.11654/jaes.2015.01.020 (  0) 0) |
| [5] |
SUN K, KANG M, ZHANG Z, et al. Impact of Deashing Treatment on Biochar Structural Properties and Potential Sorption Mechanisms of Phenanthrene[J]. Environmental Science & Technology, 2013, 47(20): 11473-11481. (  0) 0) |
| [6] |
王博, 叶春, 李法云, 等. 水生植物制生物炭对硝态氮的吸附规律研究[J]. 中国环境科学, 2017, 37(1): 116-122. WANG Bo, YE Chun, LI Fa-yun, et al. Studies on Adsorption of Nitrate From Modified Hydrophyte Biochars[J]. China Environmental Science, 2017, 37(1): 116-122. (  0) 0) |
| [7] |
马锋锋, 赵保卫, 刁静茹, 等. 牛粪生物炭对水中氨氮的吸附特性[J]. 环境科学, 2015, 36(5): 1678-1685. MA Feng-feng, ZHAO Bao-wei, DIAO Jing-ru, et al. Ammonium Adsorption Characteristics in Aqueous Solution by Dairy Manure Biochar[J]. Environmental Science, 2015, 36(5): 1678-1685. (  0) 0) |
| [8] |
王惟萍, 柴阿丽, 石延霞, 等. 基于傅里叶变换红外光谱的大白菜根肿病定量检测[J]. 光普学与光谱分析, 2015, 35(5): 1243-1247. WANG Wei-ping, CHAI A-li, SHI Yan-xia, et al. Quantitative Detection of Chinese Cabbage Ciubroot Based on FTIR Spectroscopy[J]. Spectroscopy and Spectral Analysis, 2015, 35(5): 1243-1247. (  0) 0) |
| [9] |
CHEN Z M, XIAO X, CHEN B L, et al. Quantification of Chemical States, Dissociation Constants and Contents of Oxygen-Containing Groups on the Surface of Biochars Produced at Different Temperatures[J]. Environmental Science & Technology, 2015, 49(1): 309-317. (  0) 0) |
| [10] |
JIANG T Y, JIANG J, XU R K, et al. Adsorption of Pb(Ⅱ) on Variable Charge Soils Amended With Rice-Straw Derived Biochar[J]. Chemosphere, 2012, 89(3): 249-256. DOI:10.1016/j.chemosphere.2012.04.028 (  0) 0) |
| [11] |
潘经健, 姜军, 徐仁扣, 等. Fe(Ⅲ)改性生物质炭对水相Cr(Ⅵ)的吸附试验[J]. 生态与农村环境学报, 2014, 30(4): 500-504. PAN Jing-jian, JIANG Jun, XU Ren-kou, et al. Adsorption of Aqueous Cr(Ⅵ) by Fe(Ⅲ)-Modified Biochar[J]. Journal of Ecology and Rural Environment, 2014, 30(4): 500-504. (  0) 0) |
| [12] |
XU X Y, CAO X D, ZHAO L, et al. Removal of Cu, Zn, and Cd From Aqueous Solutions by the Dairy Manure-Derived Biochar[J]. Environment Science and Pollution Research International, 2012, 20(1): 358-368. (  0) 0) |
| [13] |
KEILUWEIT M, NICO P S, JOHNSON M G, et al. Dynamic Molecular Structure of Plant Biomass-Derived Black Carbon(Biochar)[J]. Environmental Science & Technology, 2010, 44(4): 1247-1253. (  0) 0) |
| [14] |
杨柳燕, 张文, 陈乾坤, 等. 大型水生植物的资源化利用[J]. 水资源保护, 2016, 32(5): 5-10. YANG Liu-yan, ZHANG Wen, CHEN Qian-kun, et al. Resources Utilization of Macrophytes[J]. Water Resources Protection, 2016, 32(5): 5-10. DOI:10.3880/j.issn.1004-6933.2016.05.002 (  0) 0) |
| [15] |
PAN J J, JIANG J, XU R K. Adsorption of Cr(Ⅲ) From Acidic Solutions by Crop Straw Derived Biochars[J]. Journal of Environmental Science, 2013, 25(10): 1957-1965. DOI:10.1016/S1001-0742(12)60305-2 (  0) 0) |
| [16] |
WILLIAMS P T, BESLER S. The Pyrolysis of Rice Husks in a Thermogravimetric Analyser and Static Batch Reactor[J]. Fuel, 1993, 72(2): 151-159. DOI:10.1016/0016-2361(93)90391-E (  0) 0) |
| [17] |
LIAO P, YUAN S H, ZHANG W B, et al. Adsorption of N-Hetrocyclic Organic Compounds on Bamboo Charcoal:Kinetics, Thermodynamic and Microwave Regeneration[J]. Journal of Colloid and Interface Science, 2013, 390(1): 189-195. DOI:10.1016/j.jcis.2012.09.037 (  0) 0) |
| [18] |
HALE S E, ALLING V, MARTINESEN M, et al. The Sorption and Desorption of Phosphate-P, Ammonium-N and Nitrate-N in Cacao Shell and Corn Cob Biochars[J]. Chemosphere, 2013, 91(11): 1612-1619. DOI:10.1016/j.chemosphere.2012.12.057 (  0) 0) |
| [19] |
INYANG M, GAO B, PULLAMMANAPPALLIL P, et al. Biochar Form Anaerobically Digested Sugarcane Bagasse[J]. Bioresource Technology, 2010, 101(22): 8868-8872. DOI:10.1016/j.biortech.2010.06.088 (  0) 0) |
| [20] |
马锋锋, 赵保卫, 钟金魁, 等. 牛粪生物炭对磷的吸附特性及其影响因素研究[J]. 中国环境科学, 2015, 35(4): 1156-1163. MA Feng-feng, ZHAO Bao-wei, ZHONG Jin-kui, et al. Characteristics Phosphate Adsorption Onto Biochars Derived From Dairy Manure and Its Influencing Factors[J]. China Environmental Science, 2015, 35(4): 1156-1163. (  0) 0) |
| [21] |
李勤, 黄亚继, 金保昇, 等. 生物质活性炭对亚甲基蓝的吸附平衡和动力学研究[J]. 热能动力工程, 2010, 25(4): 450-454. LI Qin, HUANG Ya-ji, JIN Bao-sheng, et al. Adsorption Equilibrium and Kinetics of Methylene Blue by Biomass Activated Carbon[J]. Journal of Engineering for Thermal Energy and Power, 2010, 25(4): 450-454. (  0) 0) |
| [22] |
BOCK E, SMITH N, ROGERS M, et al. Enhanced Nitrate and Phosphate Removal in a Denitrifying Bioreactor With Biochar[J]. Journal of Environmental Quality, 2015, 44(2): 605-613. DOI:10.2134/jeq2014.03.0111 (  0) 0) |
| [23] |
CHINTALA R, MOLLINEDO J, SCHUMACHER T E, et al. Nitrate Sorption and Desorption in Biochars From Fast Pyrolysis[J]. Microporous and Mesoporous Materials, 2013, 179: 250-257. DOI:10.1016/j.micromeso.2013.05.023 (  0) 0) |




