2. 云南大学生态学与地植物学研究所, 云南 昆明 650091
2. Institute of Ecology and Geobotany, Yunnan University, Kunming 650091, China
近年来, 持久性有机污染物(persistent organic pollutants, POPs)六氯苯(hexachlorobenzene, HCB)对人体和环境的潜在危害已成为世界各国关注的焦点[1-2]。自然环境和生物体都不同程度地受到HCB污染, 且HCB广泛分布于水体、土壤和沉积物等环境介质中, 可滞留数年甚至数十年或更长时间[3-6]。由于HCB具有强亲脂性, 使得土壤和沉积物成为HCB聚集的主要场所。目前, 生物吸附与生物降解成为解决HCB污染问题最有潜力的方法之一[7]。
人工湿地技术已广泛应用于POPs或农药环境污染物的去除[8-9]。植物作为人工湿地系统的重要组成部分, 其根系输氧作用和根系分泌物直接影响根际微生物及土壤酶(脲酶、脱氢酶和过氧化氢酶等)活性。ZHOU等[10-11]研究指出, 人工湿地植物根际效应对HCB降解的影响是修复HCB污染环境的主要切入点。土壤酶和土壤微生物是衡量土壤生态效应的重要指标, 两者共同推动土壤的新陈代谢过程, 进而影响湿地污染物的降解和转化[12]。根际微生物作为湿地污染物净化及降解的主要执行者[13], 其种类和数量直接影响污染土壤的生物化学活性与转化[14]。土壤酶是土壤生物化学反应的催化剂[15], 参与湿地土壤中许多重要的代谢过程, 其活性大小能直接反映污染物降解的强度和方向, 是评价土壤自净能力的一个重要指标。因此, 探讨湿地植物根际土壤微生物数量和酶活性对HCB降解的影响, 对于研究POPs生物降解机理及根际效应具有重大意义。目前, 关于土壤酶和土壤微生物的研究较多, 但人工湿地的根际生物学研究还相对薄弱, 尤其是针对人工湿地POPs生物降解的根际生态研究亟待开展。
以芦苇(Phragmites australis)和香蒲(Typha angustifolia)为人工湿地典型植物, 构建湿地微宇宙系统, 研究HCB胁迫下根际和非根际土壤的微生物数量、酶活性和HCB变化特征, 以期初步探明芦苇和香蒲2种挺水植物根际与非根际土壤微生物数量和酶活性差异对HCB生物降解的影响, 旨在阐明HCB胁迫下湿地土壤微生物数量和酶活性的变化规律, 同时为阐明HCB生物降解机制提供基础数据和理论依据。
1 材料与方法 1.1 试验材料 1.1.1 试验装置参照ZHOU等[10]的方法, 选择芦苇和香蒲为人工湿地典型植物, 构建人工湿地微宇宙根箱(图 1)。根箱大小为40 cm×30 cm×50 cm(长×宽×高), 自上而下依次是10 cm厚水层〔用自来水补充其蒸发量, 使水层保持在(10±1) cm〕、30 cm厚土壤层和10 cm厚砾石层。如图 1所示, 用48 μm孔径尼龙网将系统横向分成湿地植物根际生长区和2个非根际区, 植物根系被限制于中室内生长。

|
图 1 芦苇和香蒲人工湿地微宇宙系统 Figure 1 Constructed wetland mesocosms vegetated with P. australis or T. angustifolia |
芦苇、香蒲及底泥均取自抚仙湖流域内的牛摩湿地。选择20~40 cm高的芦苇和香蒲均一苗植株。供试底泥理化指标如下:pH值为8.13, w(有机质)为21.16 g·kg-1, w(TN)为9.27 g·kg-1, w(TP)为2.15 g·kg-1, 质量含水率为17.6%。将2 000 mg HCB(分析纯, 纯度w为99.50%)溶于4 000 mL正己烷中, 将溶液添加到1 500 g石英砂中, 充分混匀至溶剂完全挥发, 将石英砂加入到1 000 kg底泥中, 每个箱子装入65 kg底泥, 获得2.0 mg·kg-1 HCB污染底泥[10, 16], 充分混合后高压蒸汽灭菌, 将污染底泥转移到湿地微宇宙系统中。在初始w(HCB)为1.21 mg·kg-1条件下, 设置未灭菌芦苇、灭菌芦苇、未灭菌香蒲、灭菌香蒲和无植物种植的对照(CK)共5个处理, 每个处理组设3个重复。其中, 灭菌植株用表面消毒方法(经w=70%的酒精清洗1 min后, 用w=5%的NaClO消毒5 min, 再用无菌水清洗3次)获取。试验处理组均经历第1~4周7 d淹水(water flooding, WF)和7 d排水(water draining, WD)的交替培养、第5~12周淹水(WF)和第13周排水(WD)的过程。试验期间所有处理组在整个生长期均放置于室外遮雨棚下。
1.2 样品采集与分析方法HCB胁迫下湿地植物缓培4 d后, 于第1(WF)、2(WD)、3(WF)、4(WD)、12(WF)、13(WD)周的第6天采集底泥(5—12周为淹水状态)。采用ZHAO等[14]自制的底泥采样器, 对湿地微宇宙系统中的根际与非根际区域土壤进行多点梅花采样, 分别获得根际土与非根际土, 每个土样至少获取150 g混合土样装入密封袋中待测。采用气相色谱仪定量测定土壤中HCB含量[17], 同时称取20.0 g土壤样品,加入0.1 mL质量浓度为1.0 mg·L-1的HCB标液,进行加标回收实验,3次加标回收率分别为86.4%、91.7%和90.3%。HCB降解率(R, %)计算公式为R=(Ci-Cn)/Ci×100%。其中, Ci为HCB初始含量平均值, mg·kg-1; Cn为第n天HCB含量, mg·kg-1。
土壤pH值、全氮含量、全磷含量、有机质含量和含水率均按土壤农化常规分析方法[18]测定。参照文献[19], 细菌选用LB固体培养基培养(35 ℃), 真菌采用虎红培养基培养(28 ℃), 放线菌采用高氏一号培养基培养(28 ℃), 菌种分离和计数采用平板稀释法。将涂好平板的培养皿放入培养箱中培养。土壤脱氢酶(DEH)活性采用氯化三苯基四氮唑(TTC)还原法测定; 过氧化氢酶(CAT)活性采用高锰酸钾滴定法测定, 以单位质量土壤消耗的0.002 mol·L-1 KMnO4体积表示; 多酚氧化酶(PPO)活性采用紫外光谱比色法(乙醚溶解红紫棓精)测定。
1.3 统计分析采用Excel 2013软件对试验数据进行统计, 不同处理结果用平均数±标准偏差(mean±SD)表示, 采用SPSS 16.0软件进行方差分析(ANOVA), 采用Origin 8.0软件作图。所有数据均为3次重复的平均值。
2 结果与分析 2.1 微生物数量变化特征细菌在污水净化过程中起重要作用, 可使复杂有机化合物转化为可供植物和微生物利用的无机化合物。HCB胁迫下芦苇和香蒲组湿地土壤3类微生物数量由多到少依次为细菌、放线菌和真菌(表 1), 细菌数量在3类微生物中占绝对优势, 约占3类微生物总量的98%。根际土与非根际土中微生物数量均表现为未灭菌植物>灭菌植物(P < 0.05)。芦苇根际土和非根际土中微生物数量分别为95.24×105和16.33×105 g-1, 香蒲根际土和非根际土中微生物数量分别为35.13×106和15.25×106 g-1, 芦苇和香蒲组均表现出明显的根际效应(根际土与非根际土细菌、真菌和放线菌数量之比均大于1, 即R/S>1), 根际土中细菌、真菌和放线菌数量均明显大于非根际土(P < 0.05), 且香蒲组湿地土壤中细菌、真菌、放线菌数量基本上多于芦苇组, 表明不同植物的根际效应有差异。
|
|
表 1 芦苇和香蒲根际土壤微生物数量 Table 1 Microbial population in P. australis and T. angustifolia rhizosphere soil |
不同污染环境下不同植物间土壤酶活性存在一定差异。由图 2可知, 芦苇和香蒲组土壤PPO、DEH、CAT活性均显著高于CK组, 植物根际土壤DEH、CAT和PPO活性均显著高于非根际土(P < 0.05), 芦苇和香蒲表现出明显的根际效应, 说明芦苇和香蒲能通过改变根际酶活性来适应HCB污染环境。香蒲组土壤酶活性平均值均高于芦苇组, 但差异不显著。在整个试验周期内, 未灭菌植物与灭菌植物3种酶活性变化趋势一致, 芦苇和香蒲组根际土与非根际土壤中3种酶活性均表现为未灭菌>灭菌, 表明微生物数量与酶活性变化密切相关。
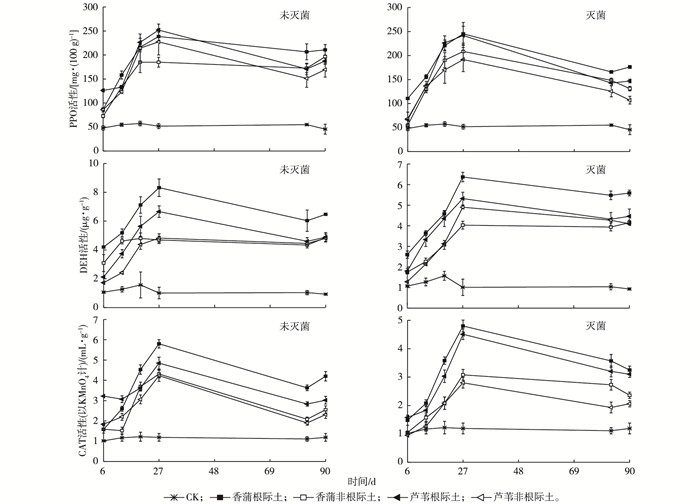
|
图 2 芦苇和香蒲根际与非根际土壤酶活性变化 Figure 2 Variations of enzyme activities in rhizosphere and non-rhizosphere soils |
表 2显示,在整个试验周期内, 人工湿地芦苇和香蒲组土壤中HCB降解率均明显高于CK组, 说明芦苇和香蒲均促进HCB的降解, 且香蒲对HCB的降解效能比芦苇强。由于植物生长缓慢, 试验3~4周时植物处理组降解率大多高于CK组, 仅部分香蒲和芦苇非根际土对HCB的降解率低于CK组。在整个试验周期内, 香蒲和芦苇组根际土壤中HCB含量显著低于非根际土(P < 0.05), 说明芦苇和香蒲的根际效应明显。1~13周时芦苇和香蒲组根际土与非根际土中HCB降解率均表现为未灭菌>灭菌, 说明微生物可能参与了HCB的生物降解。
|
|
表 2 芦苇和香蒲湿地土壤中HCB含量变化 Table 2 Variations of HCB concentrations in P. australis and T. angustifolia wetland soil |
表 3~4显示, 芦苇和香蒲组湿地土壤细菌数量、真菌数量和放线菌数量间呈正相关关系, 且放线菌数量与细菌数量、真菌数量间达显著水平(P < 0.05), 表明3类土壤微生物间存在密切联系, 就3种土壤酶活性而言, PPO活性与DEH活性呈显著正相关(P < 0.05), 与CAT活性呈极显著正相关(P < 0.01), DEH活性与CAT活性间相关不显著, 说明在HCB胁迫下, 土壤CAT活性和PPO活性与土壤生化过程联系更密切。HCB含量与芦苇、香蒲组土壤酶活性和微生物数量之间总体呈负相关趋势, 且香蒲组HCB含量分别与DEH活性(r=-0.418)和PPO活性(r=-0.443)之间相关显著(P < 0.05), 说明土壤DEH活性和PPO活性可能改善了根际环境, 促进湿地土壤中HCB的生物降解, 同时, HCB胁迫可能抑制土壤酶活性和微生物数量。
|
|
表 3 芦苇组土壤中酶活性、微生物数量和HCB含量的相关系数 Table 3 Correlation coefficient of enzyme activities and microbial population quantities with HCB concentration in the soil planted with P. australis |
|
|
表 4 香蒲组土壤中酶活性、微生物数量和HCB含量的相关系数 Table 4 Correlation coefficients of enzyme activities and microbial population with HCB concentration in the soil planted with T. angustifolia |
根际环境和根际微生物是植物降解毒性有机污染物的基础, 根系分泌物主动营造的根际微域环境是有机污染物得以快速降解的重要因素[20]。笔者研究了HCB胁迫下芦苇和香蒲湿地土壤微生物数量与酶活性特征。结果表明, 芦苇和香蒲根际微生物数量显著高于非根际土。这主要是由于植物根系分泌物富含各种无机离子、低分子量糖、多种氨基酸和有机酸, 为植物根际土壤微生物提供了丰富的碳源和能源。笔者研究结果也显示, 在HCB胁迫下, 芦苇和香蒲湿地根际土中DEH、CAT和PPO活性均高于非根际土, 表现出显著的根际效应(R/S>1)。一方面,这是因为植物根系分泌各种酶类释放到根际区, 另一方面, 则是植物根际相对较高的微生物数量及生理代谢作用的结果。笔者研究中, 在HCB胁迫下, CAT具有解毒和抗逆功能, 其活性升高能有效防止土壤新陈代谢过程中过氧化氢对生物体的毒害[21]。
植物对环境中污染物质的吸收具有广泛性, 不同植物对不同污染物质的吸收能力不同[22]。笔者试验中香蒲湿地土壤中细菌、真菌、放线菌数量及土壤DEH、CAT、PPO活性均显著高于芦苇(P < 0.05), 这是因为香蒲根系一般比芦苇根系更发达密集, 根系环境更稳定[23]。此外, 不同微生物类群利用植物根系分泌物的种类不同, 则不同植物对根际微生物类群的生长刺激也不同。因此, 对于不同生态型和基因型植物, 根际土壤微生物数量和酶活性差异很大, 对污染物的去除效果也不同。这主要是因为土壤微生物的生物多样性决定了其功能的多样性, 而土壤微生物作为媒介, 由其生成和释放的酶催化的诸多生物化学过程是土壤功能多样性的前提和基础。笔者研究中, 芦苇和香蒲根际土壤微生物数量和酶活性显著高于CK(P < 0.01), 此与苏嘉欣等[24]的研究结果一致。
3.2 芦苇和香蒲根际土壤微生物数量和酶活性对HCB降解的响应微生物是人工湿地中污染物去除的主要执行者。大量研究表明, 人工湿地中微生物主要包括细菌、真菌和放线菌[25], 这些不同特性的微生物能对污染环境的变化做出直接而快速的反应[26-28]。ZHANG等[29]研究发现, 细菌是湿地土壤中HCB降解的“主力菌”, 笔者研究中, 芦苇和香蒲组土壤中HCB降解率在33%~56%之间, 细菌数量占湿地土壤3类微生物总量的98%, 湿地植物土壤微生物数量和酶活性与HCB含量呈负相关, 说明芦苇和香蒲湿地土壤微生物数量和酶活性的增加有利于促进HCB的降解。土壤酶是影响土壤微生态环境的重要因素, 参与生物化学过程和养分循环, 土壤微生物数量与酶活性间存在密切联系。笔者研究中土壤微生物数量和酶活性之间相关性不显著, 可能与土壤酶活性的影响因素非常复杂, 土壤中微生物种类、水气热状况、酸碱度、结构组成、养分丰缺、污染程度及培肥方式等都显著影响土壤酶活性有关; 此外, 还可能与微生物的测定方法有关, 目前可分离培养的微生物数量仅占微生物总数的1%~5%。芦苇和香蒲处理组HCB含量与土壤酶活性和微生物数量大致呈负相关, 其中, 香蒲组HCB含量分别与DEH活性和PPO活性之间相关显著(P < 0.05), 表明土壤DEH和PPO在HCB降解过程中起促进作用。人工湿地主要通过植被截流、过滤以及微生物新陈代谢等活动净化水质[30-31], 湿地污染物的降解和转化主要由微生物活动完成[32], 土壤酶活性和微生物数量对植被-土壤生态系统中有机质的分解、养分的转化和循环等过程发挥着重要作用[33]。
4 结论(1) 在HCB胁迫下, 人工湿地中不同植物根际微生物数量及DEH、CAT、PPO活性存在显著差异, 香蒲组土壤微生物数量约是芦苇组的6倍, 香蒲组土壤酶活性显著高于芦苇组(P < 0.05)。
(2) 芦苇和香蒲具有明显的根际效应(R/S>1), 土壤微生物数量和酶活性均表现为根际土大于非根际土。
(3) HCB含量与芦苇、香蒲根际微生物数量和酶活性呈负相关关系, 香蒲组HCB含量分别与DEH活性和PPO活性呈显著负相关(P < 0.05), 说明土壤DEH和PPO可能促进了湿地土壤中HCB的生物降解, 同时, HCB胁迫对土壤酶活性和微生物数量起抑制作用。
| [1] |
ZHOU X, ZHANG C F, ZHANG D D, et al. Polyphasic Characterization of an Anaerobic Hexachlorobenzene Dechlorinating Microbial Consortium With a Wide Dechlorination Spectrum for Chlorobenzenes[J]. Journal of Bioscience and Bioengineering, 2015, 120(1): 62-68. DOI:10.1016/j.jbiosc.2014.11.023 (  0) 0) |
| [2] |
SPECHT I O, BONDE J P E, TOFT G, et al. Environmental Hexachlorobenzene Exposure and Human Male Reproductive Function[J]. Reproductive Toxicology, 2015, 58: 8-14. DOI:10.1016/j.reprotox.2015.07.074 (  0) 0) |
| [3] |
刘辉, 姜林, 王琪, 等. 六氯苯微生物降解研究进展[J]. 环境污染与防治, 2013, 35(1): 86-92. LIU Hui, JIANG Lin, WANG Qi, et al. Progress on Microbial Degradation of Hexachlorobenzene[J]. Environmental Pollution and Control, 2013, 35(1): 86-92. (  0) 0) |
| [4] |
GUO W, ZHANG H Y, HUO S L. Organochlorine Pesticides in Aquatic Hydrophyte Tissues and Surrounding Sediments in Baiyangdian Wetland, China[J]. Ecological Engineering, 2014, 67: 150-155. DOI:10.1016/j.ecoleng.2014.03.047 (  0) 0) |
| [5] |
PERELLÓ G, GÓMEZ-CATALÁN J, CASTELL V, et al. Estimation of the Daily Intake of Hexachlorobenzene From Food Consumption by the Population of Catalonia, Spain:Health Risks[J]. Food Control, 2012, 23(1): 198-202. DOI:10.1016/j.foodcont.2011.07.010 (  0) 0) |
| [6] |
BASTERRECHEA M, LERTXUNDI A, IÑIGUEZ C, et al. Prenatal Exposure to Hexachlorobenzene (HCB) and Reproductive Effects in a Multicentre Birth Cohort in Spain[J]. Science of the Total Environment, 2014, 466/467: 770-776. DOI:10.1016/j.scitotenv.2013.07.053 (  0) 0) |
| [7] |
YAN D Z, MAO L Q, LI C Z, et al. Biodegradation of Hexachlorobenzene by a Constructed Microbial Consortium[J]. World Journal of Microbiology and Biotechnology, 2015, 31(2): 371-377. DOI:10.1007/s11274-014-1789-7 (  0) 0) |
| [8] |
UPADHYAY A K, BANKOTI N S, RAI U N. Studies on Sustainability of Simulated Constructed Wetland System for Treatment of Urban Waste:Design and Operation[J]. Journal of Environmental Management, 2016, 169: 285-292. (  0) 0) |
| [9] |
WU J, FENG Y Q, DAI Y R, et al. Biological Mechanisms Associated With Triazophos (TAP) Removal by Horizontal Subsurface Flow Constructed Wetlands (HSFCW)[J]. Science of the Total Environment, 2016, 553: 13-19. DOI:10.1016/j.scitotenv.2016.02.067 (  0) 0) |
| [10] |
ZHOU Y Q, TIGANE T, LI X Z, et al. Hexachlorobenzene Dechlorination in Constructed Wetland Mesocosms[J]. Water Research, 2013, 47(1): 102-110. DOI:10.1016/j.watres.2012.09.030 (  0) 0) |
| [11] |
ZHOU Y Q, TRESTIP S, LI X Z, et al. Dechlorination of Hexachlorobenzene in Treatment Microcosm Wetlands[J]. Ecological Engineering, 2012, 42: 249-255. DOI:10.1016/j.ecoleng.2012.02.017 (  0) 0) |
| [12] |
TORO-VÉLEZ A F, MADERA-PARRA C A, PEÑA-VARÓN M R, et al. BPA and NP Removal From Municipal Wastewater by Tropical Horizontal Subsurface Constructed Wetlands[J]. The Science of the Total Environment, 2016, 542(Pt A): 93-101. (  0) 0) |
| [13] |
STANISLAW B, BIELINSKA E J, PATRYK O. Enzymatic Activity in an Airfield Soil Polluted With Polycyclie Aromatic Hydrocarbons[J]. Geoderma, 2004, 118(3/4): 221-232. (  0) 0) |
| [14] |
ZHAO X Y, YANG J X, BAI S W, et al. Microbial Population Dynamics in Response to Bioaugmentation in a Constructed Wetland System Under 10℃[J]. Bioresource Technology, 2016, 205: 166-173. DOI:10.1016/j.biortech.2016.01.043 (  0) 0) |
| [15] |
WANG M C, LIU Y H, WANG Q, et al. Impacts of Methamidophos on the Biochemical, Catabolic, and Genetic Characteristics of Soil Microbial Communities[J]. Soil Biology and Biochemistry, 2008, 40(3): 778-788. DOI:10.1016/j.soilbio.2007.10.012 (  0) 0) |
| [16] |
LIU C Y, JIANG X, WANG F, et al. Hexachlorobenzene Dechlorination as Affected by Nitrogen Application in Acidic Paddy Soil[J]. Journal of Hazardous Materials, 2010, 179(1/2/3): 709-714. (  0) 0) |
| [17] |
郭强, 田慧, 吴有方, 等. 甘肃省及其周边地区土壤六氯苯污染特征[J]. 中国环境科学, 2013, 33(3): 455-460. GUO Qiang, TAIN Hui, WU You-fang, et al. Soil Pollution Characteristics of Hexachlorobenzene in Gansu Province and Its Neighboring Regions[J]. China Environmental Science, 2013, 33(3): 455-460. (  0) 0) |
| [18] |
鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2002: 25-151. BAO Shi-dan. Soil and Agricultural Chemical Analysis[M]. 3rd ed. Beijing: China Agriculture Press, 2002: 25-151. (  0) 0) |
| [19] |
李振高, 骆永明, 腾应. 土壤与环境微生物研究法[M]. 北京: 科学出版社, 2008: 395-399. LI Zhen-gao, LUO Yong-ming, TENG Ying. Research Methods of Soil Environmental Microorganism[M]. Beijing: Science Press, 2008: 395-399. (  0) 0) |
| [20] |
TOYAMA T, FURUKAWA T, MAEDA N, et al. Accelerated Biodegradation of Pyrene and Benzo[a]Pyrene in the Phragmites australis Rhizosphere by Bacteria-Root Exudate Interactions[J]. Water Research, 2011, 45(4): 1629-1638. DOI:10.1016/j.watres.2010.11.044 (  0) 0) |
| [21] |
孙约兵, 王润珑, 徐应明, 等. 除草剂硝磺草酮对土壤微生物生态效应研究[J]. 中国环境科学, 2016, 36(1): 190-196. SUN Yue-bing, WANG Run-long, XU Ying-ming, et al. Ecological Effects of Herbicide Mesotrione on Soil Microbial Communities[J]. China Environmental Science, 2016, 36(1): 190-196. (  0) 0) |
| [22] |
刘亚云, 陈桂珠. 植物修复多氯联苯研究进展[J]. 应用生态学报, 2006, 17(2): 325-330. LIU Ya-yun, CHEN Gui-zhu. Research Advances in Phytoremediation of Polychlorinated Biphenyls (PCBs)[J]. Journal of Applied Ecology, 2006, 17(2): 325-330. (  0) 0) |
| [23] |
MA X M, HAVELKA M M. Phytotoxicity of Chlorinated Benzenes to Typha angustifolia and Phragmites communis[J]. Environmental Toxicology, 2009, 24(1): 43-48. DOI:10.1002/tox.v24:1 (  0) 0) |
| [24] |
苏嘉欣, 卓胜, 黎华寿, 等. 植物间作下根际微生物和土壤酶与土壤多氯联苯(PCB)降解的关系[J]. 农业环境科学学报, 2010, 29(11): 2114-2120. SU Jia-xin, ZHUO Sheng, LI Hua-shou, et al. Effects of Rhizospheric Microbes and Soil Enzymes on the Biodegradation of PCB in the Soil Within Intercropping Systems[J]. Journal of Agro-Environment Science, 2010, 29(11): 2114-2120. (  0) 0) |
| [25] |
钱鸣飞, 李勇, 黄勇. 芦苇和香蒲人工湿地系统净化微污染河水效果比较[J]. 工业用水与废水, 2008, 39(6): 55-58. QIAN Ming-fei, LI Yong, HUANG Yong. Comparison of Treatment Effects of Micro-Pulluted River Water by Constructed Wetlands Planted With Phragmites communis and Typha latifolia[J]. Industrial Water & Wastewater, 2008, 39(6): 55-58. (  0) 0) |
| [26] |
BENDING G D, TURNER M K, RAYNS F, et al. Microbial and Biochemical Soil Quality Indicators and Their Potential for Differentiating Areas Under Contrasting Agricultural Management Regimes[J]. Soil Biology & Biochemistry, 2004, 36(11): 1785-1792. (  0) 0) |
| [27] |
ZORNOZA R, GUERRERO C, MATAIX-SOLERA J, et al. Assessing Air Drying and Rewetting Pre-Treatment Effect on Some Soil Enzyme Activities Under Mediterranean Conditions[J]. Soil Biology & Biochemistry, 2006, 38(8): 2125-2134. (  0) 0) |
| [28] |
IYYEMPERUMAL K, SHI W. Soil Enzyme Activities in Two Forage Systems Following Application of Different Rates of Swine Lagoon Effluent or Ammonium Nitrate[J]. Applied Soil Ecology, 2008, 38(2): 128-136. DOI:10.1016/j.apsoil.2007.10.001 (  0) 0) |
| [29] |
ZHANG C P, WANG B, DAI X Y, et al. Structure and Function of the Bacterial Communities During Rhizoremediation of Hexachlorobenzene in Constructed Wetlands[J]. Environmental Science and Pollution Research, 2017, 24(12): 11483-11492. DOI:10.1007/s11356-017-8463-1 (  0) 0) |
| [30] |
FAULWETTER J L, BURR M D, PARKER A E, et al. Influence of Season and Plant Species on the Abundance and Diversity of Sulfate Reducing Bacteria and Ammonia Oxidizing Bacteria in Constructed Wetland Microcosms[J]. Microbial Ecology, 2013, 65(1): 111-127. DOI:10.1007/s00248-012-0114-y (  0) 0) |
| [31] |
ZHANG T, XU D, HE F, et al. Application of Constructed Wetland for Water Pollution Control in China During 1990-2010[J]. Ecological Engineering, 2012, 47: 189-197. DOI:10.1016/j.ecoleng.2012.06.022 (  0) 0) |
| [32] |
何起利, 梁威, 贺锋, 等. 人工湿地氧化还原特征及其与微生物活性相关性[J]. 华中农业大学学报, 2007, 26(6): 844-849. HE Qi-li, LIANG Wei, HE Feng, et al. Correlations Between the Redox Potential Characteristics and Microorganisms Activities in the Integrated Vertical Flow Constructed Wetland[J]. Journal of Huazhong Agricultural University, 2007, 26(6): 844-849. (  0) 0) |
| [33] |
GERMAN D P, WEINTRAUB M N, GRANDY A S, et al. Optimization of Hydrolytic and Oxidative Enzyme Methods for Ecosystem Studies[J]. Soil Biology & Biochemistry, 2011, 43(7): 1387-1397. (  0) 0) |




