作为自然界“三致”高毒元素之一, 砷一直是安全与环境领域广泛关注的热点。含砷农药、化肥的大量使用以及高浓度含砷化物工业废水的排放, 进一步加剧了土壤的砷污染, 砷在土壤-水环境中的吸附解吸和迁移转化逐渐成为重要的研究方向[1]。土壤的淋洗修复技术是通过淋洗剂固定、解吸、络合、迁移等作用,使污染物从土壤中分离出来, 具有操作简单、周期较短、效果显著的特点, 是目前国内外污染场地土壤修复中应用较广的技术方法之一[2]。常见的土壤淋洗剂种类众多, 各具利弊。强酸强碱类的淋洗效果显著, 但对土壤本身的基质结构破坏力较大[3]; 表面活性剂等则存在价格昂贵、降解性能差等缺点[4]。中性盐类淋洗剂由于自身化学性质温和逐渐成为淋洗剂的发展方向之一。国外诸多学者如BRIAN等[5]、MAKINO等[6-7]均尝试用CaCl2溶液修复Cd污染土壤, 取得了良好的效果。
土壤中砷含量较高时会抑制植物的生长, 甚至导致农作物死亡, 造成减产减收。当有铁铝等氧化物存在时, As则以AsO3-、H2AsO4-等形态与金属表面形成专性吸附, 实现从固相向液相界面的转移。铁盐作为高效的砷解毒剂, 以其价廉、源广、安全高效的特点在含砷废水处理中应用广泛。KASTO等[8]研究发现三氯化铁的絮凝过程可以处理含砷废水中的砷。MANNING等[9]运用傅里叶红外光谱证明了在共同沉淀和吸附过程中, As3+可在Fe(OH)3表面反应生成内外双核型复合物。带正电荷的胶体可以吸附以砷酸根和亚砷酸根形式存在的砷, 比如磷酸根离子和砷酸根离子以及亚砷酸根离子容易与Fe3+、Al3+、Ca2+生成难溶物。
土壤中由于植物根系分泌物的形成和天然溶解性有机质的分解而存在大量柠檬酸[10]。它通过自身含有的羟基和羧基基团与土壤中的金属阳离子形成性质稳定的螯合物或者与以阴离子形式存在的类金属化合物如砷氧酸根产生竞争吸附点位而在一定程度上影响重金属在土壤中的吸附解吸, 因而也被用于污染土壤的萃取或淋洗。唐敏等[11]研究发现柠檬酸是一种高效且环境友好的砷淋洗剂, 在一定的柠檬酸萃取剂浓度(0.25 mol·L-1)、固液比(20:1)、萃取时间(21 h)下, 对高浓度砷污染土壤的萃取效果最佳。目前, 单一淋洗剂在砷污染土壤修复中的应用多集中在对淋洗剂的筛选和对优化淋洗条件的探索, 而对复合淋洗剂的复合类型及淋洗机理研究相对欠缺。FeCl3价格低廉, 柠檬酸作为绿色环保型淋洗剂具有来源广泛的特点, 目前已有相关研究将两者联合用于促进土壤中重金属的释放, 但集中于土壤阳离子重金属如Pb、Cd等, 而对阴离子形式存在的As淋洗效果和作用机理研究较少。笔者以FeCl3-柠檬酸作为复合淋洗剂, 通过室内批量振荡淋洗实验, 探索不同的淋洗剂配比、淋洗时间、pH值、温度等影响因素对模拟砷污染土壤的淋洗效果, 并对其机理进行初步探讨, 为开发低浓度砷污染土壤的化学淋洗修复技术提供参考。
1 材料与方法 1.1 供试土壤与复合淋洗剂的制备供试土壤取自于华北平原某地区的0~20 cm表层土, 土壤取回后放置在玻璃板上, 铺成薄层。风干后经过磨碎、过筛置于干燥处备用。将Na3AsO3溶液加入原始土壤中配制模拟污染土壤, 搅拌均匀后静置12 h[12], 原始土壤与模拟土壤的性质如表 1所示。
|
|
表 1 土壤的基本理化性质 Table 1 Basic physical and chemical properties of the soil |
复合淋洗剂的制备:以质量比1 :1为例, 准确称取2.695 g FeCl3和1.921 4 g柠檬酸于烧杯中, 加入适量的超纯水, 超声至其完全溶解后倒入100 mL容量瓶进行定容。此复合淋洗剂中FeCl3与柠檬酸浓度均为0.1 mol·L-1。不同配比实验依据其设定比例定量称取配制, 基准浓度均为0.1 mol·L-1。
1.2 实验方法 1.2.1 不同配比复合淋洗剂对土壤中砷的淋洗效果影响分别称取2.00 g砷污染土样, 置于50 mL聚四氟乙烯塑料瓶中, 按序依次加入m(FeCl3) :m(柠檬酸)分别为1 :0、1 :1、1 :2、1 :3、0 :1、2 :1、3 :1的20 mL淋洗液, 充分摇匀后置于恒温水浴振荡器振荡4 h(t=25 ℃, 转速为150 r·min-1), 取上清液过滤, 避光保存, 待测。
1.2.2 不同pH值条件下复合淋洗剂对土壤中砷的淋洗效果分别称取2.00 g砷污染土样, 置于50 mL聚四氟乙烯塑料瓶中, 加入m(FeCl3) :m(柠檬酸)=3 :1的20 mL淋洗液, 用体积分数为10%的HCl和0.1 mol·L-1的NaOH将溶液pH值分别调为3、4、5、6、7、8、9和10。充分摇匀后置于恒温水浴振荡器振荡4 h(t=25 ℃, 转速为150 r·min-1), 取上清液过滤, 避光保存, 待测。
1.2.3 碱性条件下复合淋洗剂对砷污染土壤的淋洗动力学实验条件同1.2.2节, pH值设置梯度为7、8、9、10。充分摇匀后置于恒温水浴振荡器振荡(t=25 ℃, 转速为150 r·min-1)。分别在振荡1、5、10、20、40、90、120、240、480和720 min时取上清液过滤, 避光保存, 待测。
1.2.4 不同温度、共存离子条件下复合淋洗剂对土壤中砷的淋洗效果土液比、动力学取样时间等条件同1.2.3节, 保持原溶液pH值, 温度梯度为25、35、45 ℃。共存离子浓度(Ca2+、Al3+、SO42-、PO43-)设置梯度为0.01、0.02、0.05、0.1和0.2 mol·L-1。
所有试验均设置3次平行, 结果取平均值。
1.3 测试及分析方法土壤中As含量依照HJ 680—2013《土壤和沉积物汞、砷、硒、铋、锑的测定》进行测定, 水样中As浓度采用普析PF-60原子荧光分光光度计测定。淋洗量的计算及动力学方程如下。
(1) 淋洗量方程:
| $ S = CV/M。$ | (1) |
式(1)中, S为不同时间溶液中砷的淋洗量, mg·g-1; C为上清液中As质量浓度, μg·L-1; V为淋洗液体积, mL; M为土样质量, g。
(2) Elovich方程:
| $ S = a + b\ln t。$ | (2) |
式(2)中, a为初始淋洗速率, mg·g-1·min-1; b为Elovich方程中的参数; t为反应时间, min。此模型可用于描述界面化学吸附过程动力学。
(3) 双常数方程:
| $ \ln S = A + B\ln t。$ | (3) |
式(3)中, A、B均为双常数方程中的参数。适用于相对复杂的含氧酸根和重金属的吸附解吸动力学过程。
(4) 一级动力学方程:
| $ \ln S = \ln {S_{\max }} + kt。$ | (4) |
式(4)中, Smax为平衡淋洗量, mg·g-1; k为一级反应速率常数, min-1。该方程用于描述反应速率与某种反应物浓度呈线性关系。
2 结果与讨论 2.1 不同配比复合淋洗剂对土壤中砷的淋洗效果从图 1可知, 不同配比的复合淋洗剂都能在一定程度上将砷从污染土壤中淋洗出来, 淋洗能力依次为配比3 :1>2 :1>1 :3>1 :2>1 :1>1 :0>0 :1。淋洗量分别为0.062 3、0.059 4、0.057 2、0.412 0、0.038 6、0.029 8和0.025 6 mg·g-1。这种配比造成的淋洗修复能力的差异主要与复合淋洗剂2种组成成分在淋洗过程中的反应原理和自身性质有关。陈春乐等[13]研究发现, 以FeCl3作为中性盐淋洗剂, 单一存在或与HCl复合淋洗Cd污染土壤时, 淋洗效果均明显优于其他2种中性盐(CaCl2、NaCl)淋洗剂, 主要原因是FeCl3在水解形成大量Fe(OH)3的同时释放H+, 使土壤pH值降低, 重金属更容易被淋洗出来。
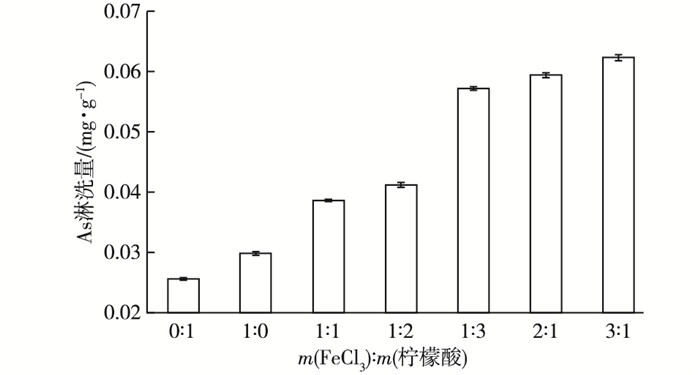
|
图 1 不同配比复合淋洗剂对土壤中As的淋洗量 Figure 1 Leaching of As from the soil with the leachate relative to its ratio |
KUNDU等[14]认为, 砷的吸附解吸行为主要是由于含砷离子与矿物表面Fe原子四周的OH-等配位体发生交换的结果。酸性或弱酸性条件下, H3AsO3的中性分子态形式比较难被沉积物吸附, 土壤中的As被解吸释放到水溶液中, 与Fe(OH)3产生并不稳定的物理吸附过程。此外水解产生的正电荷可以对H2AsO3-产生静电吸附, 使得解吸过程进一步向右发生, 而后3价砷由Fe(OH)3表面向内部扩散, 向结合作用更加紧密的吸附位迁移, 发生共价键结合的化学吸附, 即AsO33-代替铁氢氧化物表面的—OH基团, 形成稳定内圈型表面络合物[15]。而柠檬酸属于土壤中天然形成有机酸, 其酸化土壤的能力弱于FeCl3, 但其自身也具有促进金属氧化物溶解的能力[16]。杨凯光等[17]在研究小分子有机酸对铁(氢)氧化物表面吸附的砷酸盐的解吸作用时发现, 柠檬酸对铁(氢)氧化物解吸溶液中砷存在明显的诱导效应, 它一方面通过—OH、—COOH与铁(氢)氧化物表面位点上的砷发生配位交换, 另一方面使有机配体溶解吸附在铁(氢)氧化物表面Fe结合位点上, 造成矿物表面缓慢溶解, 溶解的Fe可与有机酸络合提高解吸量。SIFFERT等[18]和FAUST等[19]在前期的研究中发现, 这种Fe-柠檬酸的络合物会发生光解作用进一步促进Fe的溶解, 对解吸也有一定影响。柠檬酸具备更多的配位基团能够与土壤中的砷产生吸附点位的竞争效应, 复合淋洗效果更佳。等投加量条件下, 溶液中Fe浓度越高, 与土壤中As起络合作用的功能性基团越多, 解吸效果也就越好[20]。目前市售的工业级FeCl3+柠檬酸的综合价格为7元·kg-1, 根据淋洗效果可以推算, 对于100 mg·kg-1的砷污染土壤, 处理成本约为1.12元·t-1, 源广价廉, 应用前景广阔。
2.2 不同pH值对土壤中As的淋洗效果前期实验结果表明, m(FeCl3) :m(柠檬酸)=3 :1时对砷污染土壤的淋洗效果最佳。选择此复合淋洗剂进行不同pH值的淋洗效果影响实验, 结果如图 2所示。图 2表明, 在相同条件下, pH值对淋洗效果的影响十分显著。复合淋洗剂的初始pH值为2.26, 为强酸溶液, pH值升高时有助于增加土壤中砷的淋洗量, pH=8时的淋洗效果最佳。为此, 进一步开展弱酸到弱碱条件下砷的淋洗动力学实验, 并采用Elovich方程、双常数方程和一级动力学方程对不同pH值条件下As的淋洗动力学数据进行拟合, 结果见图 3。
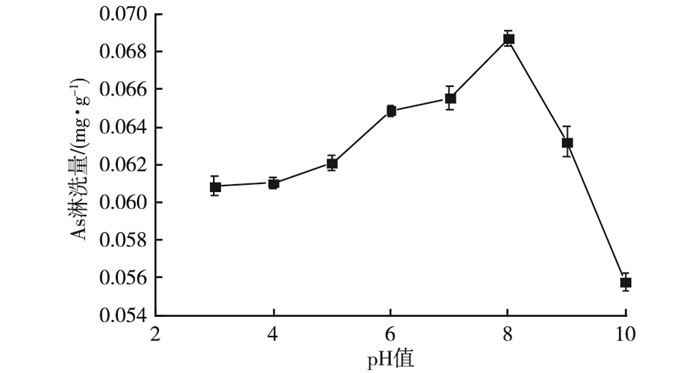
|
图 2 不同pH值条件下土壤中As的淋洗量 Figure 2 Leaching of As from the soil with the leachate relative to pH |
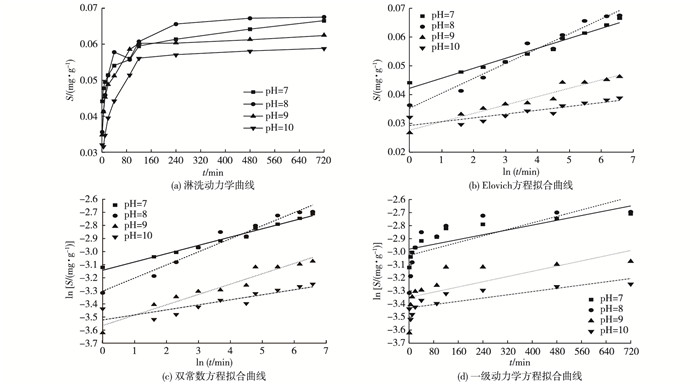
|
图 3 不同pH值条件下As的淋洗动力学及方程拟合曲线 Figure 3 Kinetics and equation fitting curves for As leaching from the soil relative to pH S为As淋洗量。 |
由淋洗动力学曲线可以看出, 在pH值分别为7、8、9、10条件下, As的淋洗过程和趋势呈现出一致性, 可分为前期0~120 min快速增加淋洗量阶段和120~480 min慢速淋洗平衡阶段。pH值对As的淋洗量影响比较明显。在pH=8时, 淋洗效果最佳。FeCl3-柠檬酸进入土壤后, pH值的升高造成分子态H3AsO3的解离度增加, 进一步使得H2AsO3-浓度升高, 它与FeCl3的水解反应, 产生的大量Cl-和H+结合, 故解吸量增加。尽管碱性环境下柠檬酸对As吸附解吸行为影响不大[21], 但却能促进铁氧化物的进一步溶解, 提高As化合物的可溶性, 造成淋洗量增加。随着溶液中pH值的继续升高, H2AsO3-与溶液中OH-开始竞争Fe(OH)3胶体表面的正电荷, As3+淋洗量呈现下降趋势。大量文献表明, 土壤对As3+吸附解吸最大值出现在pH值为7.0~8.0条件下, 这主要是因为砷通过配位交换发生专性吸附反应, H+、OH-参与土壤中砷的吸附或解吸过程主要体现在对土壤表面配位含砷根离子缔合或解离的影响[22]。当加入的淋洗剂体积一定时, 影响整个淋洗效果的主要是溶液中的OH-浓度, 随着pH值的升高, OH-量逐渐增多, 对土壤中As的活化能力也随之提高[23]。此外, 土壤中的黏土矿物如伊利石、绿泥石等都是带负电荷的, 当pH值大于8时, 矿物质会降低黏土矿物对砷的吸附量, 有利于砷的解吸。
采用3种方程对不同pH值条件下As的淋洗动力学数据进行拟合, 结果见表 3。根据拟合结果, 在pH值为7、8、9和10时, Elovich方程和双常数方程的R2和a值的规律相对一致, 但是双常数方程的标准误差(SE值)比Elovich方程的SE值大得多, 所以Elovich方程优于双常数方程。而一级动力学方程均不符合该实验条件下的淋洗动力学过程。
|
|
表 3 不同pH值条件下As淋洗动力学方程的相关参数 Table 3 Relevant parameters of the equation of As leaching kinetics relative to pH |
Elovich方程在描述重金属吸附解吸的动力学过程中适用于活化能变化较大的反应过程, 对于单一反应机理的过程不适合[24]。该方程的基本特点是吸附速率随固体表面吸附量的增加而呈指数下降。该实验中Elovich方程的拟合数值除pH=10时R2较低外, 其余均较高, 拟合度良好。因此可以说明此动力学过程是以非均相扩散为主的过程, 且pH值为8左右时淋洗量最大。
2.3 不同温度条件下As淋洗动力学特征如图 4所示, 不同温度条件下, As3+的淋洗过程经历了与pH值条件下类似的先快后慢双阶段反应过程。当温度为25、35和45 ℃时, 480 min后As3+淋洗增加量分别为0.060 35~0.073 31、0.062 57~0.074 08和0.065 61~0.077 66 mg·g-1。温度的升高有利于淋洗量的增加。这主要是因为在固液相传质过程中, 温度的升高有助于加快柠檬酸的酸解和络合能力, 并对土壤颗粒表面的质子化作用和As3+的扩散溶解都有一定的促进作用。这与TOKUNAGA等[25]的研究结果相似。吸附理论认为, 低温条件下被吸附物质的分子平均动能、活化能都比较小, 分子在吸附点位上的各种平动、转动、振动的空间位置也相对较小。随着温度升高, 分子运动更为活跃, 所需空间也随之增大, 因而单位面积上排列的分子数下降, 解吸量随之增加。
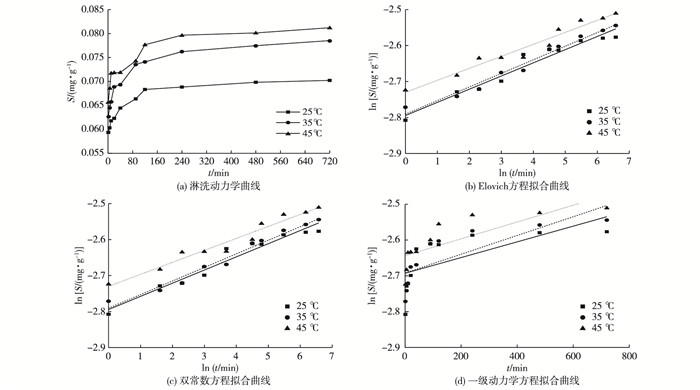
|
图 4 不同温度条件下As的淋洗一级动力学方程拟合曲线 Figure 4 Fitting curves of As leaching kinetics relative to temperature S为As淋洗量。 |
采用3种方程对不同温度条件下As的淋洗动力学数据进行拟合, 有关参数见表 4。由表 4可以看出, 在各个温度条件下, As的R2值由大到小依次为Elovich方程、双常数方程和一级动力学方程, 说明对于此淋洗动力学过程, Elovich方程为最优模型。这也同样验证了该复合淋洗剂对土壤As的淋洗过程主要受到2项之间扩散、表面活化反应速率的影响。
|
|
表 4 不同温度条件下As淋洗动力学相关参数 Table 4 Relevant parameters of As leaching kinetics relative to temperature |
将3种温度下的反应动力学数据通过准二级反应动力学方程进行拟合, 不难得出, 随着反应温度的升高, 反应速率常数也逐渐增大, 据此推断, 复合淋洗剂对土壤中As的解吸属于吸热反应。阿仑尼乌斯公式主要用于对反应活化能的求解[25], 其表达式和线性表达式分别为
| $ k = A\exp \left( {-{E_{\rm{a}}}/RT} \right), $ | (5) |
| $ \ln k = \ln A-{E_{\rm{a}}}/RT。$ | (6) |
式(5)~(6)中, k为反应速率常数,mol·L-1·s-1; A为指前因子; Ea为反应活化能,mol;R为理想气体常数8.314 J·mol-1·K-1;T为绝对温度, K。根据不同温度下As解吸动力学的相关实验数据, 以ln k对1 000/T做一条直线, 则所得直线的斜率为淋洗剂对As的解吸活化能Ea。由于该反应并不属于基元反应, 所求出的Ea只是表观活化能, 因而解吸反应对温度具有一定的敏感性, 这与实验数据分析结果一致。
2.4 常见共存离子对淋洗效果影响实验土壤与水体环境都是多样复杂化的, 各种共存离子及微生物等的存在均可能对淋洗过程和效果产生一定影响。水体中常见的阴阳离子(Ca2+、Al3+、SO42-、PO43-)对FeCl3-柠檬酸淋洗砷污染土壤效果的影响见图 5。
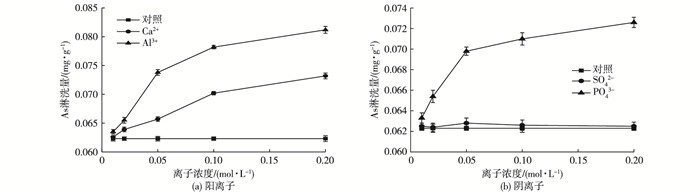
|
图 5 不同浓度离子对As淋洗量的影响 Figure 5 Effects of concentrations of coexisting ions on As leaching |
图 5显示不同强度的阳离子和阴离子存在条件下复合淋洗剂对砷污染土壤淋洗量的影响。其中Ca2+、Al3+、PO43-的加入均能够显著促进淋洗量的增加。在分别加入0.01、0.02、0.05、0.1和0.2 mol·L-1阳离子Ca2+和Al3+的情况下, As淋洗量由初始0.062 3 mg·g-1分别增加至0.062 6、0.063 9、0.065 7、0.070 2、0.073 0 mg·g-1和0.063 5、0.065 5、0.073 8、0.078 2、0.081 2 mg·g-1, 0.02 mol·L-1 Al3+对淋洗效果的提高率达到30.3%。阳离子的加入引起的淋洗率增加可能有以下几点原因:(1)阳离子能和土壤中的其他矿物质产生配位体交换等作用从而占据一定的吸附点位, 促使As从土壤中解吸出来[26]; (2)土壤中As通常以交换态砷、铝型态砷、铁型态砷等形式存在, 加入的阳离子会与砷酸根结合生成络合物, 即新的钙型态砷Ca-As和铝型态砷Al-As, 其中Al-As的结合速率和程度更优于Ca-As; (3)加入的阳离子会在水中发生水解作用, 而水解后产生的物质会改变土壤的酸碱性, 从而提高淋洗效率。
此外, PO43-的存在也对As的淋洗效果影响较大。当PO43-浓度从0.01增加到0.2 mol·L-1时, 土壤中砷的淋洗量分别增加至0.063 3、0.065 4、0.069 8、0.071 0、0.072 6 mg·g-1。当溶液中PO43-浓度较高时, 土壤对砷的吸附能力减弱, 解吸能力增强。GOH等[27]在对热带地区土壤进行研究时也得出了类似结论, 当增加的磷酸盐浓度超过3 mmol·L-1时, 几乎看不出其对土壤砷的吸附能力。实际上, 矿物组分中的Fe、Al等成分对于磷酸根的吸附能远大于As, P与As属于同族元素, 性质相似, PO43-与As在沉积物中的竞争吸附机理相当复杂, 一些专性吸附点位对于AsO43-和PO43-的吸附具有相对选择性, 在这些点位上不会发生两者的竞争吸附[28]。两者之间的竞争主要集中发生在非专性吸附点位上。复合淋洗剂中的Fe3+和柠檬酸对As的吸附均包括专性和非专性吸附, 由于土壤中PO43-浓度较低, 根据传质机理, PO43-会自发地向固相的转移以实现平衡, 因此就会促使原本在土壤界面上的As从固相转移到液相, 增大解吸量。
3 结论(1) 相同的土液比条件(1 :10)下, FeCl3与柠檬酸的质量比为3 :1作为复合淋洗剂时淋洗效果最好; FeCl3-柠檬酸对低浓度As3+污染土壤的淋洗效果符合Elovich方程, 达到平衡时的淋洗量S为0.063 5 mg·g-1, 与实验结果0.062 3 mg·g-1相接近。
(2) pH值和温度条件对淋洗速率和淋洗量有较大影响。弱碱性环境和高温条件均有利于淋洗量的增加。
(3) Ca2+、Al3+、PO43-对淋洗效果都有一定影响。Al3+存在时比Ca2+存在时的淋洗效果好。PO43-由于与AsO33-具有同族的性质相似性能够显著增加淋洗量。这些共存离子浓度越大, 淋洗效果越好, 对淋洗过程起到了促进作用。
| [1] |
廖国权, 李华. 土壤砷污染的淋洗修复研究进展[J]. 科技情报开发与经济, 2011, 21(34): 172-174. LIAO Guo-quan, LI Hua. Advances in Research on the Washing in the Remediation of the Soil With Arsenic Pollution[J]. Sci-Tech Information Development & Economy, 2011, 21(34): 172-174. DOI:10.3969/j.issn.1005-6033.2011.34.077 (  0) 0) |
| [2] |
DERMONT G, BERGERON M, MERCIER G, et al. Soil Washing for Metal Removal:A Review of Physics/Chemical Technologies and Field Applications[J]. Journal of Hazardous Materials, 2008, 152(1): 1-31. DOI:10.1016/j.jhazmat.2007.10.043 (  0) 0) |
| [3] |
邓红侠, 李珍, 杨亚莉, 等. 皂苷EDTA复合淋洗污染土壤中Cu、Pb的效果研究[J]. 农业环境科学学报, 2015, 34(3): 461-470. DENG Hong-xia, LI Zhen, YANG Ya-li, et al. Leaching of Copper and Lead Contaminated Lou Soil With Combined Saponin and EDTA[J]. Journal of Agro-Environment Science, 2015, 34(3): 461-470. DOI:10.11654/jaes.2015.03.007 (  0) 0) |
| [4] |
KUO S, LAI M S, LIN C W. Influence of Solution Acidity and CaCl2 Concentration on the Removal of Heavy Metals From Meta1-Contaminated Rice Soils[J]. Environmental Pollution, 2006, 144(3): 918-925. DOI:10.1016/j.envpol.2006.02.001 (  0) 0) |
| [5] |
BRIAN E, CARRIERE P C, MOORE R. Flushing of Pb(Ⅱ) Contaminated Soil Using HCl, EDTA, and CaCl2[J]. Journal of Environmental Engineering, 1996, 122(1): 48-50. DOI:10.1061/(ASCE)0733-9372(1996)122:1(48) (  0) 0) |
| [6] |
MAKINO T, SUGAHARA K, SAKURAI Y, et al. Remediation of Cadmium Contamination in Paddy Soils by Washing With Chemicals:Selection of Washing Chemicals[J]. Environmental Pollution, 2006, 144(1): 2-10. DOI:10.1016/j.envpol.2006.01.017 (  0) 0) |
| [7] |
MAKINO T, KAMIYA T, TAKANO H, et al. Remediation of Cadmium-Contaminated Paddy Soils by Washing With Calcium Chloride:Verification of On-Site Washing[J]. Environmental Pollution, 2007, 147(1): 112-119. DOI:10.1016/j.envpol.2006.08.037 (  0) 0) |
| [8] |
KASTO A I, ZOUBOULIS A I. Application of Biological Process for the Removal of Arsenic From Groundwater[J]. Water Research, 2004, 38(1): 17-26. DOI:10.1016/j.watres.2003.09.011 (  0) 0) |
| [9] |
MANNING B A, GOLDBER S. Modeling Competitive Adsorption of Arsenate With Phosphate and Molybdate on Oxide Minerals[J]. Soil Science Society of America Journal, 1996, 60(1): 121-131. DOI:10.2136/sssaj1996.03615995006000010020x (  0) 0) |
| [10] |
易龙生, 陶冶, 刘阳, 等. 重金属污染土壤修复淋洗剂研究进展[J]. 安全与环境学报, 2012, 12(4): 42-46. YI Long-sheng, TAO Ye, LIU Yang, et al. Research Advances of Rinsing Reagents Favorable for Remediating Heavy Metal Soil-Contaminants[J]. Journal of Safety and Environment, 2012, 12(4): 42-46. (  0) 0) |
| [11] |
唐敏, 张焕祯, 李亮. 砷污染土壤柠檬酸萃取修复技术研究[J]. 环境污染与防治, 2010, 32(12): 31-34, 58. TANG Min, ZHANG Huan-zhen, LI Liang. Extraction Remediation Technologies of Arsenic Contaminated Soils Using Citric Acid[J]. Environmental Pollution & Control, 2010, 32(12): 31-34, 58. DOI:10.3969/j.issn.1001-3865.2010.12.007 (  0) 0) |
| [12] |
李亚林, 刘蕾, 段万超, 等. 电动修复技术对土壤中镉迁移的影响[J]. 环境工程学报, 2016, 10(10): 6022-6027. LI Ya-lin, LIU Lei, DUAN Wan-chao, et al. Effect of Cadmium Migration in Contaminated Soil by Electrokinetics Remediation[J]. Chinese Journal of Environmental Engineering, 2016, 10(10): 6022-6027. (  0) 0) |
| [13] |
陈春乐, 王果, 王珺玮. 3种中性盐与HCl复合淋洗剂对Cd污染土壤淋洗效果研究[J]. 安全与环境学报, 2014, 14(5): 205-210. CHEN Chun-le, WANG Guo, WANG Jun-wei. Leaching Solutions Cd From Effect of Three Composite With Hydrochloride Acid a Cd-Contaminated Soil Neutral Salt on Removing[J]. Journal of Safety and Environment, 2014, 14(5): 205-210. (  0) 0) |
| [14] |
KUNDU S, GUPTA A K. Adsorptive Removal of As (Ⅲ) From Aqueous Solution Using Iron Oxide Coated Cement (IOCC):Evaluation of Kinetic, Equilibrium and Thermodynamic Models[J]. Separation and Purification Technology, 2002, 51(2): 165-172. (  0) 0) |
| [15] |
LAKSHMIPATHIRAJ P, NARASIMHAN B R V, PRABHAKAR S, et al. Adsorption of Arsenate on Synthetic Goethite From Aqueous Solutions[J]. Journal of Hazardous Material, 2006, 136(2): 281-287. DOI:10.1016/j.jhazmat.2005.12.015 (  0) 0) |
| [16] |
王代长, 蒋新, 贺纪正, 等. 有机酸解吸土壤及矿物表面Cd的动力学特征[J]. 环境化学, 2007, 26(6): 762-767. WANG Dai-zhang, JIANG Xin, HE Ji-zheng, et al. Kinetic Characteristics of Cd Desorption by Organic Acids in Minerals and Soils[J]. Environmental Chemistry, 2007, 26(6): 762-767. (  0) 0) |
| [17] |
杨凯光, 邓芊, 毛丹, 等. 小分子有机酸对铁(氢)氧化物表面吸附的砷酸盐的解吸作用研究[J]. 科学技术与工程, 2014, 14(20): 12-15. YANG Kai-guang, DENG Qian, MAO Dan, et al. The Desorption Characteristics of Arsenate From Iron (Hydr.) Oxides by Low-Molecular-Weight Organic Acid[J]. Science Technology and Engineering, 2014, 14(20): 12-15. DOI:10.3969/j.issn.1671-1815.2014.20.003 (  0) 0) |
| [18] |
SIFFERT C, SULZBERGER B. Light-Induced Dissolution of Hematite in the Presence of Oxalate:A Case Study[J]. Langmuir, 1991, 7(8): 1627-1634. DOI:10.1021/la00056a014 (  0) 0) |
| [19] |
FAUST B C, ZEPP R G. Photochemistry of Aqueous Iron (Ⅲ)-Polycarboxylate Complexes:Roles in the Chemistry of Atmospheric and Surface Waters[J]. Environmental Science & Technology, 1993, 27(12): 2517-2522. (  0) 0) |
| [20] |
ZENG M, LIAO B, LEI M, et al. Arsenic Removal From Contaminated Soil Using Phosphoric Acid and Phosphate[J]. Journal of Environmental Sciences(China), 2008, 20(1): 75-79. DOI:10.1016/S1001-0742(08)60011-X (  0) 0) |
| [21] |
石荣, 贾永锋, 王承智, 等. 溶解性有机酸对砷在土壤矿物质表面吸附、解吸行为的影响[J]. 土壤通报, 2009, 40(4): 762-765. SHI Rong, JIA Yong-feng, WANG Cheng-zhi, et al. Effect of Dissolved Organic Acids on Arsenate Adsorption-Desorption Onto Soil Mineral[J]. Chinese Journal of Soil Science, 2009, 40(4): 762-765. (  0) 0) |
| [22] |
GUO H M, REN Y, LIU Q, et al. Enhancement of Arsenic Adsorption During Mineral Transformation From Siderite to Goethite:Mechanism and Application[J]. Environmental Science & Technology, 2013, 47(2): 1009-1016. (  0) 0) |
| [23] |
JIA Y F, XU L Y, WANG X, et al. Infrared Spectroscopic and X-ray Diffraction Characterization of the Nature of Adsorbed Arsenate on Ferrihydrite[J]. Geochimica Et Cosmochimica Acta, 2007, 71(7): 1643-1654. DOI:10.1016/j.gca.2006.12.021 (  0) 0) |
| [24] |
BACIOCCHI R, CHIAVOLA A, GAVASCI R. Ion Exchange Equilibria of Arsenic in the Presence of High Sulphate and Nitrate Concentrations[J]. Water Science & Technology, 2005, 5(5): 67-74. (  0) 0) |
| [25] |
TOKUNAGA S, HAKUTA T. Acid Washing and Stabilization of an Artificial Arsenic-Contaminated Soil[J]. Chemosphere, 2002, 46(1): 31-38. DOI:10.1016/S0045-6535(01)00094-7 (  0) 0) |
| [26] |
MAKINO T, SUGAHARA K, SAKURAI Y, et al. Remediation of Cadmium Contamination in Paddy Soils by Washing With Chemicals:Selection of Washing Chemicals[J]. Environmental Pollution, 2006, 144(1): 2-10. DOI:10.1016/j.envpol.2006.01.017 (  0) 0) |
| [27] |
GOH K H, LIM T T. Geochemistry of Inorganic Arsenic and Selenium in a Tropical Soil:Effect of Reaction Time, pH, and Competitive Anions on Arsenic and Selenium Adsorption[J]. Chemosphere, 2004, 55(6): 849-859. DOI:10.1016/j.chemosphere.2003.11.041 (  0) 0) |
| [28] |
陈灿, 陈寻峰, 李小明, 等. 砷污染土壤磷酸盐淋洗修复技术研究[J]. 环境科学学报, 2015, 35(8): 2582-2588. CHEN Can, CHEN Xun-feng, LI Xiao-ming, et al. Study on Washing Remediation Technology of Arsenic Contaminated Soil Using Phosphate[J]. Acta Scientiae Circumstantiae, 2015, 35(8): 2582-2588. (  0) 0) |



