2. 同济大学环境科学与工程学院, 上海 200092
2. College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China
沉积物是水生态系统中污染物的关键受体和最终沉积库[1], 因此, 受污染沉积物是潜在的二次污染源。采用合适的方法对污染沉积物进行修复是维持水生态系统健康的重要手段。传统的沉积物修复措施如疏浚和封盖不能有效实现降低污染沉积物对水生生物和人类健康不利影响和保护水生态系统的目标, 有时甚至可能对水生态系统具有破坏作用[2]。因此, 发展低能耗、低成本、高效率和对环境干扰小的沉积物原位修复技术非常必要。一般来说, 底栖生物对污染物的吸收很大程度上取决于沉积物中污染物的生物有效性, 而生物有效性主要与污染物和沉积物颗粒结合的强弱程度有关[3]。因此, 行之有效的沉积物原位修复方法就是最大程度地降低污染物的生物有效性。有研究证实, 黑炭颗粒可以强烈地吸附与沉积物结合的污染物, 其吸附亲和常数比无定形有机质高1~2个数量级, 因此可以有效降低污染物的生物有效性和减少生物积累[4-5], 从而有可能降低这些与沉积物结合的污染物对底栖生物的生态毒性[6-7]。
生物炭(BC)是在限氧条件下将生物质材料通过热化学转化即热裂解(200~900 ℃)而得到的一种固态材料[8]。目前, 生物炭被认为是一种重要的绿色环境吸附剂[9], 对污染沉积物的原位修复具有很大潜力。然而, 目前关于生物炭的长期野外应用研究还十分缺乏, 因此在将生物炭应用于野外沉积物修复之前, 应该明确不同类型生物炭对沉积物中污染物吸附阻控的效力以及生物炭和污染物相互作用的潜在环境生物学效应的变化, 这对于将来应用生物炭修复污染沉积物的工程实践具有重要的指导意义。目前关于生物炭对水土环境中污染物阻控的研究主要关注污染物的生物有效性[10-14], 而对生物炭与污染物相互作用后的潜在生态毒性风险改变的评价研究则较少, 而且已有的报道大多关注生物炭与污染物相互作用对植物的影响[11-12], 仅BIELSKÁ等[15]报道了在土壤中生物炭与芘相互作用对秀丽隐杆线虫(Caenorhabditis elegans)毒性的影响。此外, 评判生物炭与沉积物中污染物相互作用后生态毒性风险的变化必须考虑底栖生物种类的相关性[16], 采用沉积物栖居型底栖动物将更有利于评价生物炭修复污染沉积物的效力和潜在生态毒性风险。铜锈环棱螺(Bellamya aeruginosa)是属于腹足纲田螺科的淡水软体动物, 在我国淡水环境中分布广泛, 是一种典型的沉积物栖居型底栖动物, 该物种对一些典型重金属和持久性有机污染物表现出较好的敏感性, 是进行沉积物毒性测试的理想生物[17-19]。
笔者以城市污水处理厂活性污泥制备的生物炭为研究对象, 以重金属镉(Cd)为目标污染物, 以铜锈环棱螺为测试生物, 采用沉积物14-d亚慢性生物测试, 研究不同添加水平的生物炭与不同浓度Cd联合作用对Cd的生物积累、肝胰脏氧化胁迫、氧化损伤和DNA损伤的影响, 评价活性污泥生物炭降低沉积物中镉生态毒性风险的潜力。
1 材料与方法 1.1 仪器与试剂主要仪器:多功能酶标仪(DTX-880, Beckman Coulter); 台式高速冷冻离心机(长沙平凡TGL-16M); 电感耦合等离子体发射光谱仪(ICP-OES, iCAP6300 Radial, Thermo Fisher Scientific, USA); 全自动雪花制冰机(IMS-30, 雪科); 荧光显微镜(日本尼康ECLIPSE 80i); 水平电泳仪(北京六一仪器厂DYY-12型); 分体式自控电热消化器(CN61M/AED-Ⅳ, 北京中西远大科技有限公司); 玻璃匀浆器; 电动食物搅拌机(酒思JS-601)。
主要试剂:活性污泥生物炭来自密西西比国际水务(中国)有限公司; 超氧化物歧化酶(SOD)、丙二醛(MDA)和蛋白测定试剂盒、低熔点琼脂糖、正常熔点琼脂糖、碘化丙啶、考马斯亮蓝-G250、1-氯-2, 4-二硝基苯(CDNB)以及硫代巴比妥酸, 均来自南京建成生物工程研究所; 蛋白酶抑制剂苯甲基磺酰氟(PMSF)来自Genview公司; Cd标准溶液来自国家钢铁材料测试中心钢铁研究总院; Cd(CH3COO)2·2H2O、蔗糖、Tris、EDTA-Na2、2, 4-二硝基苯肼(DNPH)、盐酸胍及其它辅助试剂均为国产分析纯。
1.2 测试生物实验室人工培养的铜锈环棱螺用作毒性测试生物。按照MA等[17]的方法对铜锈环棱螺进行实验室培养, 并进行多代繁殖。挑选大小均匀的健康个体〔壳长为(20.34±1.28) mm, 体重为(1.94±0.32) g〕用于暴露实验。
1.3 生物炭预处理与理化表征预处理:活性污泥生物炭是将城市污水处理厂剩余污泥在密封、无氧、非燃烧和高温(600 ℃)状态下进行干馏和热分解而制成, 原始粒径为0.1~4.0 mm。由于制备的生物炭偏碱性, 因此在实验前根据李扬等[20]的方法, 按1 g生物炭对应10 mL盐酸(1 mol·L-1)浸泡24 h, 再用去离子水反复冲洗至中性, 然后在80 ℃烘箱中烘48 h, 取出研磨, 过150 μm孔径尼龙筛, 去除粗颗粒, 保存备用。
生物炭表征:在实验前对处理过的生物炭样品进行理化特性表征:pH值为7.8, 阳离子交换容量(CEC)为12.6 cmol·kg-1, 比表面积为16.68 m2·g-1; 在生物炭中, 灰分和挥发性物质w分别占54.15%和23.58%;非金属元素C、H、O、N、S和P分别占28.98%、1.32%、16.18%、3.8%、0.28%和6.89%;常量金属元素Al、K、Fe和Ca的w分别为37.91、12.63、264.28和4.6 mg·g-1; 重金属元素As、Zn、Pb、Ni、Cd、Cr和Cu的w分别为0.010、1.563、0.089、0.046、0.002、0.043和0.365 mg·g-1, 远低于国际生物炭联盟(International Biochar Initiative, IBI)建议的生物炭中重金属含量安全阈值[8]。As、Zn、Pb和Cu的水浸出率分别为4.31%、0.31%、0.64%和0.08%, Ni、Cd、Cr则未检出。
1.4 沉积物加标实验所用沉积物是以采自湖南吉首市德夯自然保护区内的无污染土壤制作的人工沉积物, 采集与处理见MA等[17]的方法。该人工沉积物在使用前过150 μm孔径尼龙筛以去除粗颗粒(与生物炭的处理相同)。经分析测定, 该人工沉积物的w(TOC)为4.8%, pH值为8.01, w(TN)为987 μg·g-1, w(TP)为1 145 μg·g-1, 重金属Cr、Ni、Cu、Zn、Cd和Pb的w分别为58.62、32.14、16.22、111.36、0.35和25.26 μg·g-1, 均低于淡水沉积物质量指南中的生物毒性阈值效应浓度[21]。根据我国淡水沉积物中Cd的环境相关水平设置Cd的实验加标浓度[22-23], 实验共设9个处理组, 包括2个Cd单独处理组(10和50 μg·g-1)、2个生物炭单独处理组(添加比例w分别为1%和5%)、4个Cd和生物炭的联合处理组以及1个空白对照组, 每个处理组设3个重复。参照王萌等[19]的方法对沉积物加标, 为每个处理组称取干的人工沉积物样品600 g, 先加入所需数量的生物炭, 放入搅拌机中连续搅拌1 h, 然后转入预先准备好的洁净带盖小塑料桶中, 按V(沉积物) :V(去离子水)=1 :1的比例搅拌混合均匀。以Cd(CH3COO)2·2H2O配置Cd储备液(2 mg·mL-1), 在不同处理中加入所需数量的Cd储备液, 用小木铲搅拌至少24 h, 每隔3 h搅拌1次, 每次持续1 h。空白对照组除不添加Cd和生物炭外, 按相同方式处理。实验沉积物处理完成后于室温下静置14 d, 在储存期间, 每隔3 d对加标沉积物充分搅拌1次以使加标沉积物达到理化平衡[24]。
1.5 14-d亚慢性生物测试按王萌等[19]的方法进行14-d亚慢性生物测试。先将处理好的加标沉积物加到体积为4 L的玻璃测试缸中, 按V(沉积物) :V(去离子水)=1 :1的比例加入上覆水, 然后将测试缸置于一个恒温水浴槽中, 静置3 d。将所选实验螺随机分组, 以12只·缸-1放入测试缸中, 以静水充氧的方式暴露, 光照周期为t(白昼) :t(黑暗)=12 h :12 h, 水温为(24±1) ℃, 对每个测试缸加盖尼龙网, 中间留1个直径为5 cm的圆孔, 以供喂食。每隔2 d按每只螺每天5 mg的量投喂观赏鱼饵料(三友创美)[17]。在整个暴露实验期间, 每个测试缸中实验螺的存在率都在90%以上, 符合国际通行的沉积物毒性测试标准要求[25]。暴露结束后, 取出实验螺, 用去离子水清洗干净。从每个处理组随机取9只螺, 从内脏团中分离出肝胰脏, 立即进行DNA损伤测定; 再从每个处理组随机取9只螺, 分离肝胰脏放入液氮中速冻保存用于后续生化测定(对每个样品进行单独测定); 最后将每个处理组剩余螺放入去离子水中清肠24 h, 分离全部内脏团并保存于-20 ℃条件下用于Cd含量测定。此外, 在暴露实验开始和结束时, 从每个测试缸中取约50 g沉积物样品, 用于测定沉积物和间隙水中Cd含量。
1.6 DNA损伤测定肝胰脏细胞DNA损伤程度采用彗星实验(Comet assay)[26]进行测定, 按照王萌等[19]的方法用荧光显微镜进行彗星图像采集, 以彗星图像分析软件CASP进行图像数据分析, 获取Olive尾距(Olive tail moment, OTM, 指彗星头部重心与尾部重心间距离与彗尾DNA含量的乘积), 对每个处理组检测9个平行个体, 每个平行观察1张载玻片, 取50个细胞数据的中位数作为DNA损伤测定值。
1.7 生化分析取冷冻的肝胰脏样品, 按质量比1 :4的比例加入含0.000 1 mol·L-1EDTA-2Na、0.01 mol·L-1蔗糖和w=0.8% NaCl的Tris-HCl匀浆介质(0.01 mol·L-1, pH值为7.4), 同时加入苯甲基磺酰氟(PMSF, 1 mmol·L-1), 冰浴条件下用玻璃匀浆器制成匀浆, 然后于4 ℃条件下按所测指标要求离心并取上清液, 置于-20 ℃条件下保存备测。SOD活性采用氯化硝基四氮唑蓝(NBT)光化还原法测定, 以活力单位表示SOD活性值, 在550 nm处测吸光度, 以50%抑制率的酶量为1个活力单位(U·mg-1蛋白); MDA含量采用硫代苯巴比妥酸(TBA)比色法测定, 在532 nm处测定吸光度, 活力单位以nmol·mg-1蛋白表示; 采用考马斯亮蓝染色法在595 nm处测定蛋白含量[27]。
1.8 沉积物、间隙水和组织样品中Cd的测定将新鲜沉积物样品在转速为2 500 r·min-1(离心半径为2.5 cm)条件下离心20 min获得间隙水, 然后加入1 mL 1 mol·L-1HNO3, 静置24 h。所得间隙水经0.45 μm孔径微孔滤膜过滤, 保存备测。沉积物样品和肝胰脏样品分别采用HCl-HNO3-HClO4-HF法和HNO3-HClO4法[27]进行消解, 用w=1%的HNO3洗至容量瓶定容到10 mL, 保存备测。采用ICP-OES测定Cd含量。
1.9 统计分析采用SPSS 20.0软件对实验数据进行统计分析。实验结果以平均值±标准差表示。利用单因素方差分析法(ANOVA)和多重比较检验法(LSD)进行组间差异显著性检验, 差异显著性水平为0.05。
2 结果与分析 2.1 沉积物与间隙水中Cd含量暴露实验前后沉积物及相应间隙水中Cd含量见表 1。
|
|
表 1 暴露实验前后沉积物及其间隙水中Cd含量 Table 1 Cd contents in the sediments and porewaters before and after the 14 d of exposure experiments |
各处理组沉积物中Cd含量在暴露实验前后均没有显著变化, 添加生物炭也并没有显著增加沉积物Cd含量。在间隙水中, 暴露实验前后对照组和生物炭单独处理组均未检测到Cd; 在其他处理组暴露后的Cd含量略低于暴露前, 但差异不显著, 说明在亚慢性暴露实验过程中生物扰动对沉积物化学特性的影响可以忽略不计。与Cd单独处理组相比, Cd与生物炭联合处理组间隙水Cd含量均显著下降, 当生物炭添加量为1%时, 低Cd联合处理组和高Cd联合处理组间隙水中Cd含量分别下降33%和31%。当生物炭添加量为5%时, 则分别下降70%和56%。
2.2 Cd的生物积累生物炭和Cd单一或复合加标沉积物14 d暴露后, 铜锈环棱螺内脏团Cd的累积情况如图 1所示。生物炭单独处理组内脏团Cd含量与对照组〔(0.98±0.09) μg·g-1〕相比无显著差异, 其他处理组Cd含量均显著高于对照组。
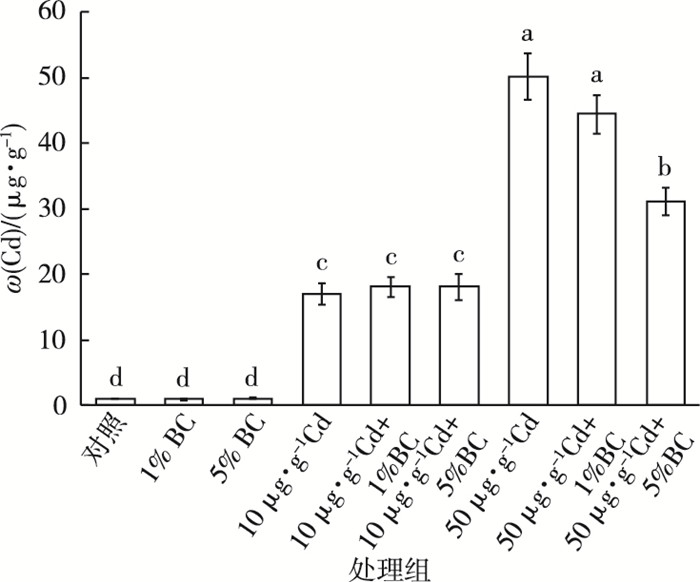
|
图 1 活性污泥生物炭和Cd单一或复合加标沉积物14 d暴露后铜锈环棱螺内脏团Cd含量 Figure 1 Cd content in the visceral mass of Bellamya aeruginosa following 14-day exposure to sediments spiked with Cd and / or activated-sludge-derived biochar BC为生物炭; 直方柱上方英文小写字母不同表示各处理组间Cd含量差异显著(P < 0.05)。 |
当沉积物w(Cd)为10 μg·g-1时, Cd单独处理组与联合处理组的内脏团Cd含量之间没有显著差异, 平均约为17.71 μg·g-1, 为对照组的18倍。当w(Cd)为50 μg·g-1时, Cd单独处理组与联合处理组内脏团Cd含量均显著高于相应低浓度处理组, 分别增加约195%、145%和73%, Cd与5%生物炭联合处理组内脏团Cd含量比Cd单独处理组降低38%。
2.3 肝胰脏DNA损伤生物炭和Cd单一或复合加标沉积物对铜锈环棱螺肝胰脏细胞DNA的损伤程度如图 2~3所示。由图 3可知, 生物炭单独处理组OTM与对照组相比无显著差异, 其他处理组OTM均显著升高。当沉积物w(Cd)为10 μg·g-1时, Cd单独处理组与联合处理组OTM之间无显著差异, 分别约为对照组的27.6倍和29.5倍。当沉积物w(Cd)为50 μg·g-1时, Cd单独处理组与联合处理组OTM均显著高于相应低Cd浓度处理组, Cd与5%生物炭联合处理组OTM与Cd单独处理组相比均显著降低, 分别下降约32.8%和48.3%。
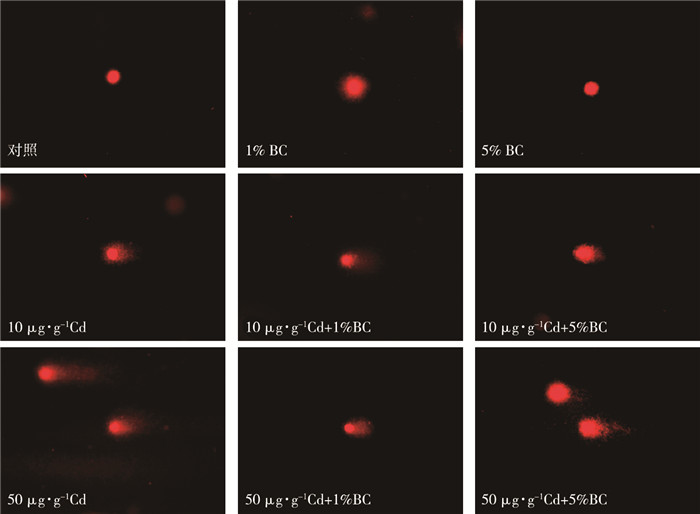
|
图 2 活性污泥生物炭和Cd单一或复合加标沉积物14 d暴露后铜锈环棱螺肝胰脏细胞DNA损伤的代表性彗星实验照片 Figure 2 Representative comet assay photographs of hepatopancreas of Bellamya aeruginosa following 14-day exposure to sediments spiked with Cd and / or activated-sludge-derived biochar BC为生物炭。 |
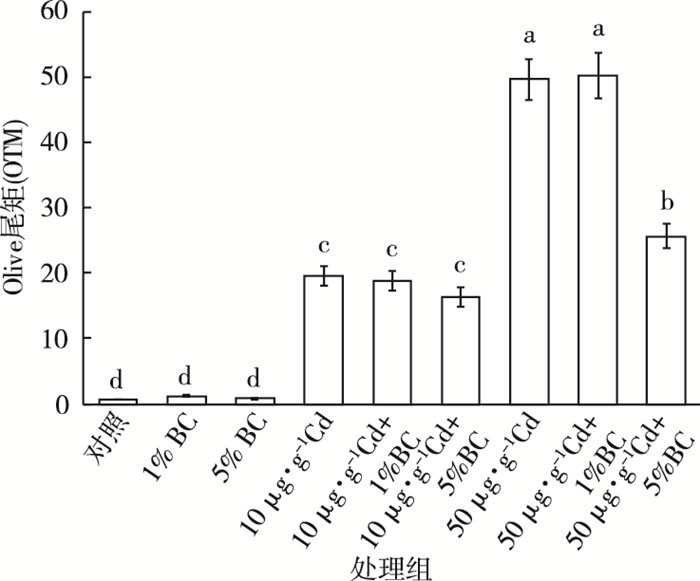
|
图 3 活性污泥生物炭和Cd单一或复合加标沉积物14 d暴露后铜锈环棱螺肝胰脏细胞的DNA损伤 Figure 3 DNA damage of hepatopancreas of Bellamya aeruginosa following 14-day exposure to sediments spiked with Cd and / or activated-sludge-derived biochar BC为生物炭; 直方柱上方英文小写字母不同表示各处理组间OTM差异显著(P < 0.05)。 |
生物炭和Cd单一或复合加标沉积物对铜锈环棱螺肝胰脏SOD活性的影响如图 4所示。生物炭单独处理组SOD活性与对照组〔(21.80±1.37) U·mg-1蛋白〕相比没有显著差异。当沉积物Cd浓度为10 μg·g-1时, Cd单独处理组与联合处理组之间没有显著差异, 但SOD活性显著高于对照组, 约为对照组的1.28倍。当沉积物w(Cd)为50 μg·g-1时, Cd单独处理组与联合处理组SOD活性均显著低于对照组, 与对照组相比分别下降38%、35%和21%;与相应低Cd浓度处理组相比分别下降48%、51%和38%;Cd与5%生物炭联合处理组SOD活性显著高于Cd单独处理组和Cd+1% BC联合处理组。
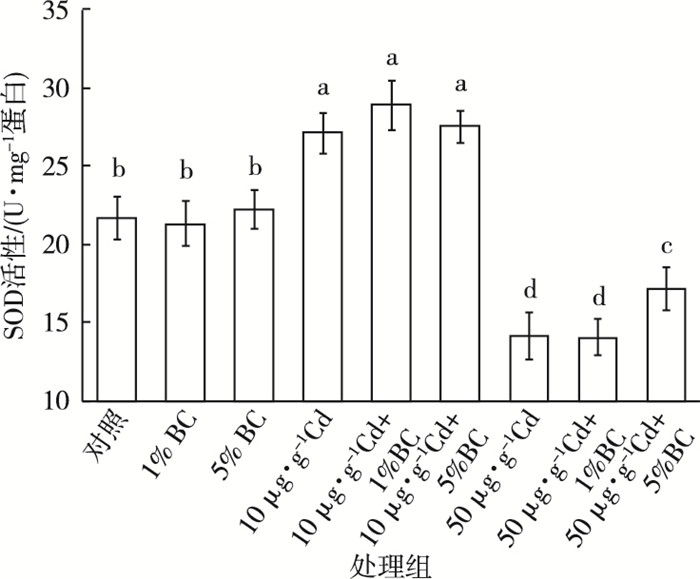
|
图 4 活性污泥生物炭和Cd单一或复合加标沉积物14 d暴露后铜锈环棱螺肝胰脏SOD活性 Figure 4 SOD activity in hepatopancreas of Bellamya aeruginosa following 14-day exposure to sediments spiked with Cd and / or activated-sludge-derived biochar BC为生物炭; 直方柱上方英文小写字母不同表示各处理组间SOD活性差异显著(P < 0.05)。 |
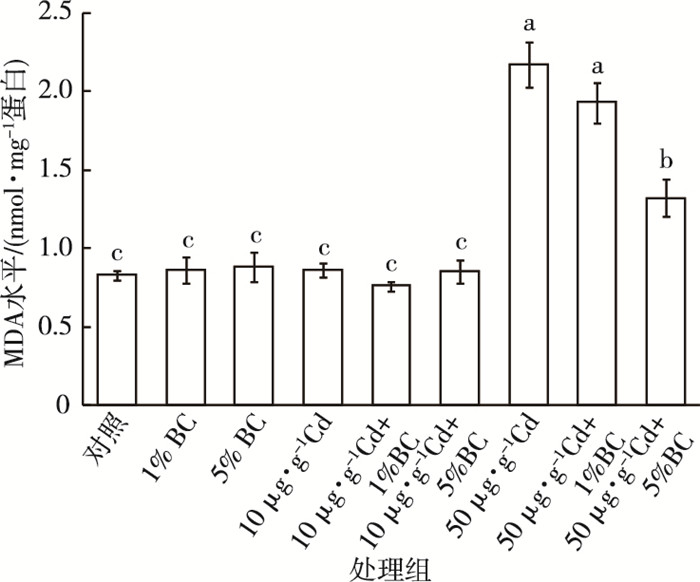
生物炭和Cd单一或复合加标沉积物对铜锈环棱螺肝胰脏MDA含量的影响如图 5所示。生物炭单独处理组、低Cd浓度单独处理组及低Cd浓度与生物炭联合处理组MDA含量与对照组〔(0.83±0.03) nmol· mg-1蛋白〕相比均没有显著差异。高Cd浓度单独处理组及与生物炭联合处理组MDA含量显著高于对照组, 高Cd浓度单独处理组MDA含量最高〔(2.17±0.14) nmol·mg-1蛋白〕, 但随着BC添加量的增加, MDA含量下降, Cd与5%生物炭联合处理组MDA含量则显著下降, 与Cd单独处理组相比下降39%。
|
图 5 活性污泥生物炭和Cd单一或复合加标沉积物14 d暴露后铜锈环棱螺肝胰脏MDA水平 Figure 5 MDA levels of hepatopancreas of Bellamya aeruginosa following 14-day exposure to sediments spiked with Cd and / or activated-sludge-derived biochar BC为生物炭; 直方柱上方英文小写字母不同表示各处理组间MDA水平差异显著(P < 0.05)。 |
污染物的生物积累通常用来指示污染物的初级生物学效应, 可以作为判断其潜在生态毒性风险的初步依据。
目前关于在沉积物中添加生物炭后对污染物生物积累影响的研究仅有少量报道。SHEN等[28]的研究指出, 当沉积物中生物炭添加量在1.5%以下时, 多环芳烃(PAHs)在摇蚊幼虫体内的生物积累显著降低, 当生物炭添加量大于1.5%时, 对PAHs生物积累的影响不大; XIA等[29]发现生物炭可以显著降低沉积物中全氟化合物(PFOS)在摇蚊幼虫体内的生物积累, 并且PFOS生物积累的降低与生物炭用量增加直接相关。笔者研究结果表明, 当沉积物w(Cd)较低(10 μg·g-1)时, 添加1%和5%的生物炭并不显著降低Cd的生物积累, 当w(Cd)较高(50 μg·g-1)时, 只有5%的生物炭才能显著降低Cd的生物积累。这与SHEN等[28]的研究结果基本相反, 而与XIA等[29]的研究结果类似。WANG等[16]研究了在土壤中添加生物炭后对污染物生物积累的影响, 结果显示, 松木源生物炭虽然能显著降低阿特拉津在2种蚯蚓体内的生物积累, 但当生物炭添加量w为0.5%时, 阿特拉津在威廉腔环蚓(Metaphire guillelmi)体内的生物积累低于赤子爱胜蚓(Eisenia foetida),而当生物炭用量w为2%时, 阿特拉津在2种蚯蚓体内的生物积累没有差异。由以上结果可以看出, 生物炭对沉积物或土壤中共存污染物生物积累影响的差异应该与污染物种类(有机物和重金属)和浓度、生物炭种类和添加水平以及测试生物的种类有关。在针对特定测试生物的研究中尤其要考察污染物的浓度效应。
沉积物间隙水中Cd浓度与生物积累之间的相关性不高。特别是在沉积物低Cd浓度下, 随着生物炭添加水平的增加, 间隙水Cd浓度显著下降(表 1), 而Cd的生物积累没有显著改变(图 1), 间隙水Cd浓度与Cd生物积累基本不相关。而XIA等[29]研究发现沉积物中全氟化合物(PFOS)在摇蚊(Chironomus plumosus)s幼虫体内生物积累的降低与沉积物孔隙水中全氟化合物浓度的降低直接相关。因此, 沉积物中污染物在不同底栖动物体内生物积累的差异不仅与污染物种类和浓度有关, 而且还可能与摄食方式不同有关。铜锈环棱螺是一种沉积物栖居型以鳃呼吸的底栖动物, 主要通过摄取沉积物颗粒获得食物[17], 铜锈环棱螺吸收Cd主要有2种途径, 一种来自沉积物的间隙水, 另一种来自沉积物颗粒[18]。MCLEOD等[30]曾指出间隙水中污染物浓度的降低并不足以有效减少沉积物栖居型生物对污染物的摄取。BIELSKÁ等[15]的研究同样指出土壤间隙水中芘浓度与其在秀丽隐杆线虫(Caenorhabditis elegans)体内的生物积累并没有明显的相关性, 因而不能有效地指示其毒性。因此沉积物中污染物生物有效性的降低并不必然导致污染物在底栖生物体内生物积累的减少, 应该考虑不同生物种类的差异。
与对照组相比, 在沉积物中单独添加生物炭没有引起肝胰脏DNA损伤指数以及SOD活性和MDA水平的改变, 说明该实验所采用的活性污泥生物炭对铜锈环棱螺不具有毒性。就Cd单独处理组而言, 实验所采用的Cd浓度都对铜锈环棱螺肝胰脏造成显著的DNA损伤, 这与王萌等[19]的研究结果是一致的; 同时, 低Cd浓度导致SOD活性显著升高, 但MDA含量没有变化, 高Cd浓度导致SOD活性显著降低, 而MDA含量则显著增加, 这说明低Cd浓度时激活的SOD可以有效清除活性氧自由基, 未引起氧化损伤; 高Cd浓度时肝胰脏细胞已经受到氧化损伤(细胞内MDA含量增加指示细胞受到氧化损伤), SOD活性被抑制, 因而不能有效地清除活性氧自由基[18, 27]。就低Cd浓度处理组而言, 添加生物炭后, DNA损伤指数、SOD活性和MDA含量均没有显著改变, 这说明在低Cd浓度沉积物中添加生物炭不影响Cd毒性。就高Cd浓度处理组而言, 添加1%生物炭也未明显降低Cd毒性, 只有当添加5%生物炭时, DNA损伤指数显著降低,SOD活性明显升高,MDA含量显著下降, 提示5%生物炭显著降低了Cd对铜锈环棱螺的毒性, 降幅大约为60%。添加生物炭后, Cd毒性的变化与其生物积累的变化基本一致, 这说明沉积物中较高比例的生物炭通过对Cd的吸附阻控在一定程度上减少了生物积累, 从而降低了对铜锈环棱螺的毒性。
综上所述, 在沉积物中添加生物炭可以降低间隙水中游离Cd含量, 但沉积物间隙水中Cd浓度与Cd在铜锈环棱螺体内的生物积累之间没有明显的相关性。在亚慢性测试中, 活性污泥生物炭对铜锈环棱螺不具有毒性。当沉积物中Cd浓度较低时, 添加生物炭不影响Cd对铜锈环棱螺的生态毒性。当沉积物中Cd浓度较高时, 只有较高比例的生物炭才能降低Cd的生物积累, 并因此降低了Cd对铜锈环棱螺的毒性。因此, 综合前人的研究, 笔者认为在考察生物炭对沉积物中污染物生态毒性的影响时应当考虑污染物种类与浓度、生物炭用量以及测试生物种类等关键因素。
| [1] |
LARSSON P. Contaminated Sediments of Lakes and Oceans Act as Sources of Chlorinated Hydrocarbons for Release to Water and Atmosphere[J]. Nature, 1985, 317(6035): 347-349. DOI:10.1038/317347a0 (  0) 0) |
| [2] |
WENNING R J, SORENSEN M, MAGAR V S. Importance of Implementation and Residual Risk Analyses in Sediment Remediation[J]. Integrated Environmental Assessment and Management, 2006, 2(1): 59-65. DOI:10.1002/ieam.v2:1 (  0) 0) |
| [3] |
LUTHY R G, AIKEN G R, BRUSSEAU M L, et al. Sequestration of Hydrophobic Organic Contaminants by Geosorbents[J]. Environmental Science & Technology, 1997, 31(12): 3341-3347. (  0) 0) |
| [4] |
JONKER M T, HOENDERBOOM A M, KOELMANS A A. Effects of Sedimentary Sootlike Materials on Bioaccumulation and Sorption of Polychlorinated Biphenyls[J]. Environmental Toxicology and Chemistry, 2004, 23(11): 2563-2570. DOI:10.1897/03-351 (  0) 0) |
| [5] |
SUN X L, GHOSH U. The Effect of Activated Carbon on Partitioning, Desorption, and Biouptake of Native Polychlorinated Biphenyls in Four Freshwater Sediments[J]. Environmental Toxicology and Chemistry, 2008, 27(11): 2287-2295. DOI:10.1897/08-020.1 (  0) 0) |
| [6] |
HO K T, BURGESS R M, PELLETIER M C, et al. Use of Powdered Coconut Charcoal as a Toxicity Identification and Evaluation Manipulation for Organic Toxicants in Marine Sediments[J]. Environmental Toxicology and Chemistry, 2004, 23(9): 2124-2131. DOI:10.1897/03-407 (  0) 0) |
| [7] |
BURGESS R M, PERRON M M, FRIEDMAN C L, et al. Evaluation of the Effects of Coal Fly Ash Amendments on the Toxicity of a Contaminated Marine Sediment[J]. Environmental Toxicology and Chemistry, 2009, 28(1): 26-35. DOI:10.1897/08-050.1 (  0) 0) |
| [8] |
International Biochar Initiative (IBI). Standardized Product Definition and Product Testing Guidelines for Biochar That Is Used in Soil[EB/OL]. [2017-08-01]. http://www.biochar-international.org/characterizationstandard
(  0) 0) |
| [9] |
AHMAD M, RAJAPAKSHA A U, LIM J E, et al. Biochar as a Sorbent for Contaminant Management in Soil and Water:A Review[J]. Chemosphere, 2014, 99: 19-33. DOI:10.1016/j.chemosphere.2013.10.071 (  0) 0) |
| [10] |
CAO X D, MA L N, GAO B, et al. Dairy-Manure Derived Biochar Effectively Sorbs Lead and Atrazine[J]. Environmental Science & Technology, 2009, 43(9): 3285-3291. (  0) 0) |
| [11] |
BEESLEY L, MORENO-JIMÉNEZ E, GOMEZ-EYLES J L. Effects of Biochar and Greenwaste Compost Amendments on Mobility, Bioavailability and Toxicity of Inorganic and Organic Contaminants in a Multi-Element Polluted Soil[J]. Environmental Pollution, 2010, 158(6): 2282-2287. DOI:10.1016/j.envpol.2010.02.003 (  0) 0) |
| [12] |
ZHANG Z H, SOLAIMAN Z M, MENEY K, et al. Biochars Immobilize Soil Cadmium, but Do Not Improve Growth of Emergent Wetland Species Juncus subsecundus in Cadmium-Contaminated Soil[J]. Journal of Soils and Sediments, 2012, 13(1): 140-151. (  0) 0) |
| [13] |
HOUBEN D, EVRARD L, SONNET P. Mobility, Bioavailability and pH-Dependent Leaching of Cadmium, Zinc and Lead in a Contaminated Soil Amended With Biochar[J]. Chemosphere, 2013, 92(11): 1450-1457. DOI:10.1016/j.chemosphere.2013.03.055 (  0) 0) |
| [14] |
WANG Y, WANG L, FANG G D, et al. Enhanced PCBs Sorption on Biochars as Affected by Environmental Factors:Humic Acid and Metal Cations[J]. Environmental Pollution, 2013, 172: 86-93. DOI:10.1016/j.envpol.2012.08.007 (  0) 0) |
| [15] |
BIELSKÁ L, KAH M, SIGMUND G, et al. Bioavailability and Toxicity of Pyrene in Soils Upon Biochar and Compost Addition[J]. Science of the Total Environment, 2017, 595: 132-140. DOI:10.1016/j.scitotenv.2017.03.230 (  0) 0) |
| [16] |
WANG F, JI R, JIANG Z W, et al. Species-Dependent Effects of Biochar Amendment on Bioaccumulation of Atrazine in Earthworms[J]. Environmental Pollution, 2014, 186: 241-247. DOI:10.1016/j.envpol.2013.12.012 (  0) 0) |
| [17] |
MA T W, GONG S J, ZHOU K, et al. Laboratory Culture of the Freshwater Benthic Gastropod Bellamya aeruginosa (Reeve) and Its Utility as a Test Species for Sediment Toxicity[J]. Journal of Environmental Sciences, 2010, 22(2): 304-313. DOI:10.1016/S1001-0742(09)60109-1 (  0) 0) |
| [18] |
刘珊珊, 龙奕, 王萌, 等. 沉积物-底栖动物体系中多壁碳纳米管对镉生态毒性的影响[J]. 生态与农村环境学报, 2015, 31(3): 414-419. LIU Shan-shan, LONG Yi, WANG Meng, et al. Effects of Multiwalled Carbon Nanotubes on Ecotoxicity of Cd in the Sediment-Zoobenthos System[J]. Journal of Ecology and Rural Environment, 2015, 31(3): 414-419. DOI:10.11934/j.issn.1673-4831.2015.03.022 (  0) 0) |
| [19] |
王萌, 龚双姣, 刘珊珊, 等. 表面活性剂对沉积物中纳米TiO2与Cd单一及复合污染生态毒理学效应的影响[J]. 应用与环境生物学报, 2015, 21(5): 791-797. WANG Meng, GONG Shuang-jiao, LIU Shan-shan, et al. Impacts of Surfactants on Ecotoxicological Effects of TiO2-NP and/or Cd Contamination in Sediments[J]. Chinese Journal of Applied and Environmental Biology, 2015, 21(5): 791-797. (  0) 0) |
| [20] |
李扬, 李锋民, 张修稳, 等. 生物炭覆盖对底泥污染物释放的影响[J]. 环境科学, 2013, 34(8): 3071-3078. LI Yang, LI Feng-min, ZHANG Xiu-wen, et al. Effects of Biochar Covering on the Release of Pollutants From Sediment[J]. Environmental Science, 2013, 34(8): 3071-3078. (  0) 0) |
| [21] |
MACDONALD D D, INGERSOLL C G, BERGER T A. Development and Evaluation of Consensus-Based Sediment Quality Guidelines for Freshwater Ecosystems[J]. Archives of Environmental Contamination and Toxicology, 2000, 39(1): 20-31. DOI:10.1007/s002440010075 (  0) 0) |
| [22] |
朱程, 马陶武, 周科, 等. 湘西河流表层沉积物重金属污染特征及其潜在生态毒性风险[J]. 生态学报, 2010, 30(15): 3982-3993. ZHU Cheng, MA Tao-wu, ZHOU Ke, et al. Pollution Characteristics and Potential Ecotoxicity Risk of Heavy Metals in Surface River Sediments of Western Hunan[J]. Acta Ecologica Sinica, 2010, 30(15): 3982-3993. (  0) 0) |
| [23] |
陈社军, 麦碧娴, 曾永平, 等. 珠江三角洲及南海北部海域表层沉积物中多溴联苯醚的分布特征[J]. 环境科学学报, 2005, 25(9): 1265-1271. CHEN She-jun, MAI Bi-xian, ZENG Yong-ping, et al. Polybrominated Diphenyl Ethers (PBDEs) in Surficial Sediments of the Pearl River Delta and Adjacent South China Sea[J]. Acta Scientiae Circumstantiae, 2005, 25(9): 1265-1271. (  0) 0) |
| [24] |
SIMPSON S L, ANGEL B M, JOLLEY D F. Metal Equilibration in Laboratory-Contaminated (Spiked) Sediments Used for the Development of Whole-Sediment Toxicity Tests[J]. Chemosphere, 2004, 54(5): 597-609. DOI:10.1016/j.chemosphere.2003.08.007 (  0) 0) |
| [25] |
U. S. Environmental Protection Agency. Methods for Measuring the Toxicity and Bioaccumulation of Sediment-Associated Contaminants With Freshwater Invertebrates, 2nd[R]. Washington D C, USA: Office of Research and Development, Duluth, MN and Office of Science and Technology, 2000.
(  0) 0) |
| [26] |
TICE R R, AGURELL E, ANDERSON D, et al. Single Cell Gel/Comet Assay:Guidelines for in Vitro and in Vivo Genetic Toxicology Testing[J]. Environmental and Molecular Mutagenesis, 2000, 35(3): 206-221. DOI:10.1002/(SICI)1098-2280(2000)35:3<>1.0.CO;2-I (  0) 0) |
| [27] |
龙奕, 刘珊珊, 王萌, 等. 纳米Al2O3和Cd联合暴露对铜锈环棱螺体内Cd的生物积累和抗氧化酶活性的影响[J]. 生态毒理学报, 2015, 10(2): 23-30. LONG Yi, LIU Shan-shan, WANG Meng, et al. Effects of Cd and Al2O3-NPs Co-Exposure on Bioaccumulation of Cd and Antioxidase Enzyme Activities in Bellamya aeroginosa[J]. Asian Journal of Ecotoxicology, 2015, 10(2): 23-30. DOI:10.7524/AJE.1673-5897.20131214001 (  0) 0) |
| [28] |
SHEN M, XIA X, WANG F, et al. Influences of Multiwalled Carbon Nanotubes and Plant Residue Chars on Bioaccumulation of Polycyclic Aromatic Hydrocarbons by Chironomus plumosus Larvae in Sediment[J]. Environmental Toxicology and Chemistry, 2012, 31(1): 202-209. DOI:10.1002/etc.722 (  0) 0) |
| [29] |
XIA X, CHEN X, ZHAO X, et al. Effects of Carbon Nanotubes, Chars, and Ash on Bioaccumulation of Perfluorochemicals by Chironomus plumosus Larvae in Sediment[J]. Environmental Science & Technology, 2012, 46(22): 12467-12475. (  0) 0) |
| [30] |
MCLEOD P B, VAN DEN HEUVEL-GREVE M J, LUOMA S N, et al. Biological Uptake of Polychlorinated Biphenyls by Macoma balthica From Sediment Amended With Activated Carbon[J]. Environmental Toxicology and Chemistry, 2007, 26(5): 980-987. DOI:10.1897/06-278R1.1 (  0) 0) |




