2. 南京信息工程大学农业资源与环境系, 江苏 南京 210044;
3. 中国农业科学研究院作物科学研究所, 北京 100081
2. Institute of Agricultural Resources and Environment, Nanjing University of Information Science and Technology, Nanjing 210044, China;
3. Institute of Crop Sciences of Chinese Academy of Agricultural Sciences, Beijing 100081, China
小麦黄花叶病是危害我国小麦生产的主要土传病毒病之一, 主要由小麦黄花叶病毒(wheat yellow mosaic virus, WYMV)所引起, 以禾谷多黏菌(polymyxa graminis)为传播媒介。小麦感病后, 一般可造成减产10%~30%, 病害严重的田块可减产50%[1-3]。转基因技术为提高小麦抗病性、增加产量开辟了新途径[4]。随着抗病转基因小麦的快速发展, 其环境释放可能产生的生物安全问题受到了广泛关注, 特别是其外源基因漂移的潜在生态风险[5-7]。
小麦是以自花授粉为主的风媒作物, 花粉是小麦转基因漂移的主要媒介。在前期研究中发现抗病转基因小麦的基因漂移频率与花粉密度之间存在明显的相关性[8]。而且花粉流的规模效应即花粉源大小可以在一定范围内影响小麦花粉密度的衰变速率[9]。花粉源大小的变化也可能会导致小麦转基因漂移产生类似的效应, 即基因漂移的频率和最远距离随花粉源面积的增大而增加。HUCL等[10]和MATUS-CÁDIZ等[11-12]以蓝色胚乳小麦作为花粉供体, 将花粉源面积设置为5 m×5 m时检测到的平均最大基因漂移频率为1.75%, 最远漂移距离为27 m; 当花粉源面积增加到50 m×50 m时, 基因漂移的最远距离达300 m, 漂移频率为0.005%;再将花粉源面积增加到33 hm2时, 在距花粉源2.75 km处仍能检测到0.01%的基因漂移频率。但这些研究是在不同年份和不同地点进行的, 试验的气候条件、地理位置、试验方法以及材料品种都会对小麦的基因漂移频率产生一定影响[13-14]。因此, 有必要在相同气候条件下研究花粉源面积大小对小麦基因漂移距离以及变化规律的影响。另外, 在小麦花粉介导的基因漂移研究中, 受体材料的异交率也是影响基因漂移频率的重要因素。LOUREIRO等[15]以去雄小麦为花粉受体, 通过连续3 a的田间试验调查了2种栽培小麦(Triticum aestivum)以及栽培小麦与硬粒小麦(Triticum turgidum var. durum)之间的最大异交率, 结果显示, 距花粉源0 m处栽培小麦之间的基因漂移频率为37%~56%, 栽培小麦到硬粒小麦的基因漂移频率为5%~30%。在以未去雄的常规栽培小麦作为花粉受体时, 距花粉源0 m处检测到的平均漂移频率仅为0.183%[16]。由以上研究可知, 去雄小麦由于缺少自身花粉的竞争只能接受外来花粉, 其近距离处供体材料的花粉密度直接决定了异交率, 自花授粉竞争可能是导致栽培小麦品种间极低的异交率以及基因漂移频率的主要原因之一。
以我国自主研发培育的抗小麦黄花叶病毒(WYMV)转基因小麦品种N12-1为花粉供体, 以扬麦158和矮杆败育小麦为花粉受体, 通过可控的田间栽培试验, 调查不同花粉源面积以及花粉受体材料中转基因小麦的基因漂移频率, 分析花粉源大小及花粉竞争对转基因小麦基因漂移的影响。
1 材料与方法 1.1 试验材料以无选择标记抗WYMV转基因小麦N12-1为花粉供体。该材料采用基因枪共转化法获得:首先从小麦黄花叶病毒扬州株系RNA1中获得复制酶基因WYMV-Nib8, 该基因长度为1 212 bp, 位置在RNA1序列的5 284~6 495 bp之间; 然后采用基因枪共转化法将该基因连同筛选标记bar基因导入扬麦158, 获得4个高抗WYMV的小麦转基因株系N12、N13、N14和N15;最后利用PCR技术和Basta涂抹法, 在转基因株系N12的T3代中筛选到只含有Nib8基因而无选择标记bar基因的转基因小麦株系N12-1[17]。该供体材料由中国农业科学院作物研究所提供。
为比较分析花粉竞争对小麦转基因漂移频率的影响, 采用2种花粉受体材料:一种是转基因小麦N12-1的非转基因近等基因系扬麦158(YM), 该材料是常规小麦栽培品种, 自交可育, 由江苏里下河地区农业科学研究所提供; 另一种为矮杆败育小麦(DW), 是具有矮秆基因标记的太谷核雄性不育小麦。在矮败小麦的后代群体中, 有一半矮秆不育株和一半非矮秆可育株, 该材料由徐州市农业科学院提供[18]。
1.2 试验设计于2014年11月—2015年6月在江苏省南京市江宁区横溪镇南京蔬菜花卉科学研究所(31°43′ N, 118°46′ E)采取2×2的析因试验设计, 共4个试验处理(图 1)。设置2种不同面积的花粉源:面积100和400 m2(图 1)。种植2种花粉受体材料:扬麦158和矮败小麦。4个处理(100-YM、100-DW、400-YM和400-DW)小区平行排列, 小区之间间隔20 m以上的空地, 小麦盛花期前在小区间设置长100 m、高1.5 m的隔离栏, 上附塑料布以防止试验处理间相互影响。
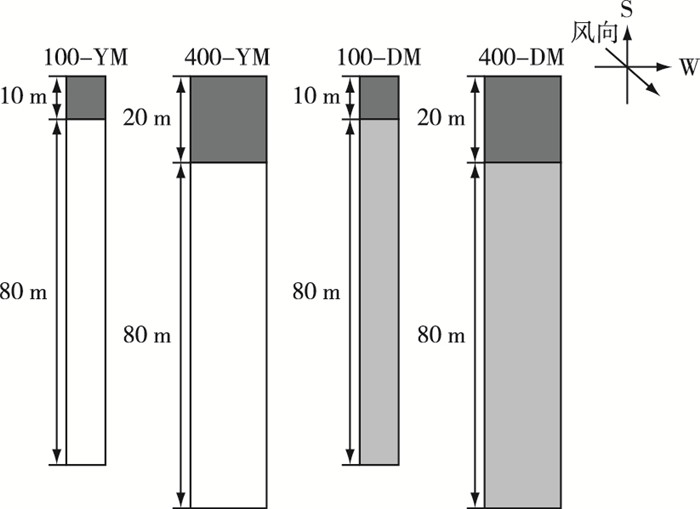
|
图 1 花粉源大小及花粉竞争对转基因小麦基因漂移影响的田间试验设计 Figure 1 Designing of the experiment on effects of size of pollen source and pollen competition on transgenic wheat gene flow 深灰色正方形区域代表种植花粉供体转基因小麦N12-1;白色矩形区域代表种植花粉受体扬麦158;浅灰色矩形区域代表种植花粉受体矮败小麦。100-YM:花粉源面积100 m2, 花粉受体扬麦158; 400-YM:花粉源面积400 m2, 花粉受体扬麦158; 100-DW:花粉源面积100 m2, 花粉受体矮败小麦; 400-DW:花粉源面积400 m2, 花粉受体矮败小麦。箭头方向为转基因小麦盛花期间主导风向。 |
小麦采取直播方式, 播种行距为20 cm。为了保证花粉供体与受体花期相遇, 供体材料N12-1和受体扬麦158于2014年11月1日播种, 矮败小麦于2014年11月20日播种。试验过程中按照当地农田管理措施进行田间管理, 严格按照《农业转基因生物安全管理条例》、《农业转基因生物安全评价管理办法》等法规、规章要求开展试验, 且试验基地已获得农业部农业转基因生物安全管理办公室的批复(农基安办报告字2014-447号)。
1.3 试验方法 1.3.1 取样方法于种子成熟期在每个非转基小麦田块中平行设置10个取样行, 分别距花粉源0、1、2、3、5、10、20、30、50和80 m, 每行随机收获约60个麦穗, 再将收获的麦穗随机分成3份, 即设置3个重复, 每个重复的小麦种子烘干脱粒后萌发, 用于转基因漂移频率的检测。
1.3.2 检测方法小麦种子置于28 ℃光照培养箱中萌发, 大约15 d后取10 cm左右高的小麦嫩叶, 采用GMO作物提取试剂盒〔KG202, 天根生化科技(北京)有限公司〕提取小麦基因组总DNA。共提取扬麦158基因组DNA 10 000份, 矮败小麦基因组DNA 6 000份。利用分光光度计(Nano Drop 2000, Thermo Scientific)测定所提取DNA的浓度和纯度, 根据检测的浓度将DNA样品稀释到50~100 ng·μL-1, 然后置于-20 ℃冰箱中保存备用。选用特异性引物对插入的目的基因Nib8进行PCR定性检测, 该引物上下游分别为5′-GCGACAAACCTGAAAGCCCCA-CAC-3′和5-AACGCCGCCCTTCTTAGCCCACT-3′[8]。20 μL的PCR反应体系中含有缓冲液10 μL, 上下游引物(10 μmol·L-1)各0.6 μL, DNA模板0.6 μL, DNA聚合酶0.4 μL, 无菌水7.8 μL。PCR反应程序如下:预变性94 ℃ 5 min, 变性94 ℃ 30 s,退火65 ℃ 30 s,延伸72 ℃ 30 s, 共35个循环, 循环结束后总延伸72 ℃ 10 min, 16 ℃条件下保存。PCR产物采用w为1.2%的琼脂糖凝胶电泳检测, 目的基因Nib8的扩增片段长度为593 bp。出现目的条带的样本记为阳性结果, 其余样本记为阴性结果(图 2)。
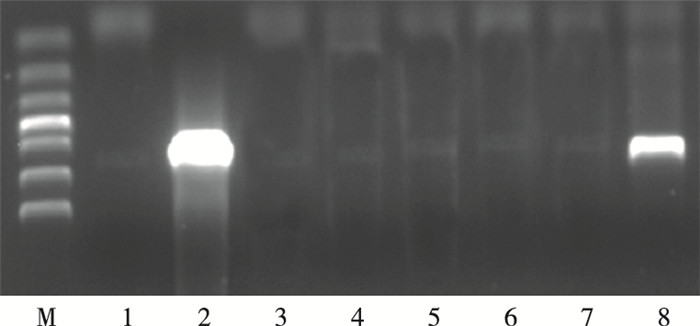
|
图 2 扬麦158和矮杆败育小麦中Nib8基因的PCR检测 Figure 2 PCR detection of Nib8 genes in Yangmai 158 and male-sterile dwarf wheat 图中M代表DL1000 marker; 第1泳道为阴性对照; 第2泳道为阳性对照; 第3~7泳道为阴性样本; 第8泳道为阳性样本。 |
根据检测到的阳性样本数, 小麦的转基因漂移频率的计算公式:小麦的转基因漂移频率=(阳性样本个数/总检测样本数)×100%。采用一般线性模型中的单因变量多因素方差(General Linear Model-Univariate)分析花粉源面积、受体材料、花粉源距离以及交互作用对转基因小麦基因漂移频率的影响, 显著性检测水平为0.05。采用独立样本t检验比较不同花粉源面积和不同受体材料中的转基因小麦基因漂移频率。
通过非线性回归分析拟合指数衰减模型调查转基因小麦基因漂移与花粉源距离的关系:
| $ y = a\cdot{\exp ^{-b \cdot x}}。$ | (1) |
式(1)中, y为转基因漂移频率, %; x为与花粉源的距离, m; a为截距; b为决定曲线斜率的曲线参数, 即衰减速率。通过指数衰减模型中估计的a和b值, 根据式(2)~(3)估测转基因小麦基因漂移频率下降50%(O50)和95%(O95)时的漂移距离:
| $ {O_{50}} = [\ln \left( {0.5 \cdot a} \right)-\ln a]/ -b, $ | (2) |
| $ {O_{95}} = [\ln \left( {0.01 \cdot a} \right)-\ln a]/ -b。$ | (3) |
采用SPSS 19.0软件进行统计分析, Sigma Plot软件进行图形绘制。
2 结果与分析 2.1 不同花粉源面积下转基因小麦基因漂移频率多因素方差分析结果显示, 花粉源面积和受体材料间的交互作用对转基因小麦基因漂移频率有显著影响(表 1)。在扬麦158和矮败小麦2种花粉受体中花粉源大小对小麦基因漂移距离的影响表现一致, 400 m2花粉源小麦转基因在2种受体材料中漂移的最远距离均为5 m, 100 m2花粉源均为3 m(表 2)。但在花粉源相同距离处不同花粉源面积下, 小麦基因漂移频率在2种受体中的表现有明显差异。t检验结果显示, 在扬麦158田块中, 400 m2花粉源小麦基因漂移频率略高于100 m2, 但两者间无显著差异(表 2)。在矮败小麦田块中, 100 m2花粉源0、1、2和3 m处小麦基因漂移频率均略高于400 m2, 但两者间无显著差异(表 2)。
|
|
表 1 花粉源面积、受体材料、与花粉源距离以及交互作用对转基因小麦基因漂移影响的多因素方差分析 Table 1 Multi-factor variance analysis of the effects of pollen source size, pollen receptor, distance from pollen source and their interactions on gene flow of transgenic wheat |
|
|
表 2 不同花粉源面积以及不同花粉受体中转基因小麦的基因漂移频率 Table 2 Gene flow frequency of transgenic wheat relative to pollen receptor and size of pollen source |
多因素方差分析结果显示, 受体材料与花粉源面积间有显著的交互作用, 且受体材料的主效应显著(表 1)。t检验结果显示, 就花粉源面积为100 m2处理而言, 距花粉源0和2 m处转基因小麦向矮败小麦的基因漂移频率显著高于扬麦158(P < 0.05), 在其他距离处2种受体材料间无显著差异, 检测到发生转基因漂移的最远距离均为3 m(表 2)。就花粉源面积为400 m2的处理而言, 距花粉源相同距离处2种受体的基因漂移频率无显著差异, 发生基因漂移的最远距离均为5 m(表 2)。
2.3 不同距离处转基因小麦基因漂移频率距离对转基因小麦基因漂移频率有显著影响(表 1)。在4个处理中, 小麦转基因漂移频率均随着距花粉源距离的增加迅速衰减, 邻近花粉源处的转基因漂移频率显著偏高(P < 0.05), 5 m以后2种受体的基因漂移频率均降为0。转基因小麦的基因漂移频率与距离呈指数衰减关系, 回归分析结果显示R2的取值范围为0.981~0.993, 说明指数回归模型的拟合度很好(表 3, 图 3)。同时根据4个处理拟合得到的指数衰减模型可以看出, 不同处理条件下小麦转基因漂移频率随距离增加的衰减速率有一定差异, 在400 m2花粉源条件下矮败小麦的衰减速率较慢(表 3)。
|
|
表 3 不同处理条件下转基因小麦基因漂移的指数衰减模型及判定系数 Table 3 Exponential decay model and determination coefficient (R2) of the gene flow of transgenic wheat relative to treatment |
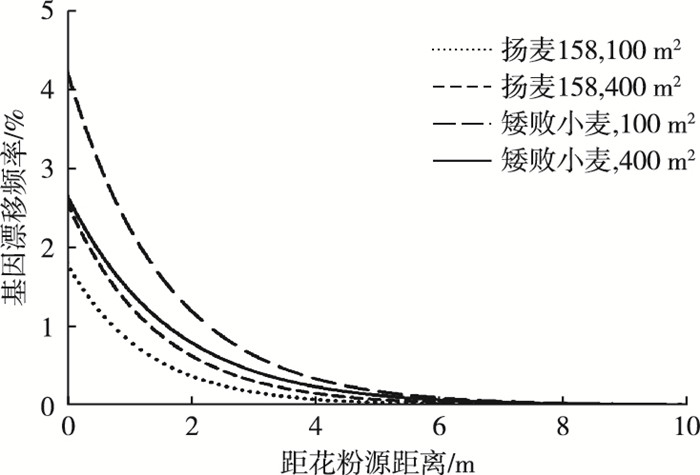
|
图 3 不同处理条件下转基因小麦基因漂移的回归曲线 Figure 3 Regression curves of transgenic wheat gene flow relative to treatment |
根据式(2)和(3)估测, 当转基因小麦在扬麦158中的基因漂移频率下降50%时, 在100和400 m2花粉源条件下的漂移距离分别为0.89和0.99 m; 下降95%时的漂移距离分别为5.90和6.58 m; 当矮败小麦中的漂移频率下降50%时, 在100和400 m2花粉源条件下的漂移距离分别为1.10和1.16 m, 下降95%时的漂移距离分别为7.31和7.68 m。
3 讨论与结论 3.1 花粉源大小对转基因小麦基因漂移的影响该研究中花粉源大小对小麦转基因漂移频率无显著影响, 这在以往的研究中也有类似结果。GUASTAFSON等[19]根据已有试验数据, 通过回归分析构建小麦基因漂移的经验模型, 预测小麦田间基因漂移频率非常低, 而且花粉源大小对基因漂移频率无明显影响。根据该经验模型, 应用线性叠加的假设可以解释笔者研究结果:面积400 m2花粉源的边长比100 m2的增加1倍(图 1), 增加的花粉源与非转基因小麦受体田块间隔10 m。由于小麦花粉基本上集中在花粉源周围5 m以内, 随着距离增加供体的花粉密度迅速下降[9], 花粉介导的转基因漂移频率在5 m以后就降为0, 因此, 尽管花粉源面积增加4倍, 但非转基因小麦接受到的花粉主要还是来自于紧邻的(5 m内)转基因小麦田块, 花粉源面积的增加不会必然导致转基因漂移频率的增加。此外, 该研究中检测到的最大转基因漂移频率发生在矮败小麦中, 为4.33%, 这种较低的漂移频率也有可能导致花粉源规模效应没有明显表现出来[20-21]。值得注意的是, 400 m2花粉源处理下检测到小麦转基因漂移的最远距离为5 m, 而100 m2处理下为3 m, 说明花粉源面积的增加可能会在一定程度上减缓小麦转基因漂移的衰减速率, 这跟笔者之前对于转基因小麦花粉漂移的研究结果一致[9]。
3.2 花粉竞争对转基因小麦基因漂移的影响该研究显示花粉受体材料对小麦转基因漂移频率有显著影响, 在0和2 m处矮败小麦的基因漂移频率显著高于扬麦158。已有研究表明, 矮败小麦异交率远高于普通的栽培小麦[22]。这主要是因为矮败小麦自交不结实, 没有自花授粉的竞争, 只能接受外来花粉, 而一般的小麦栽培品种都存在着强烈的自花授粉竞争, 这也是造成小麦具有极低的异交率的主要原因之一[23-24], 极低的异交结实率限制了基因的漂移频率。值得关注的是, 如果没有非转基因小麦的花粉竞争, 矮败小麦中基因漂移频率应为100%[25], 而该研究中矮败小麦中的基因最大漂移频率仅为4.33%。这可能是因为矮败小麦群体中一半是矮杆败育植株, 一半是高杆可育植株, 虽然在小麦开花前期人工去除了高杆植株, 但仍有部分可能留存, 其提供的花粉与来自于转基因小麦的花粉形成了强烈竞争。而且这部分高杆可育植株混杂在矮败小麦周围, 其花粉密度相对转基因小麦的比例会随着距花粉源距离的增加而增加, 使得矮败小麦更容易接受其周围的非转基因小麦花粉。WILLENBORG等[26]以抗除草剂(HR)转基因春小麦为花粉供体, 以4种不同基因型的非转基因春小麦为花粉受体, 调查了转基因小麦向不同种群密度的栽培小麦田块中的转基因漂移频率。结果显示, 当非转基因小麦种群密度不超过300株·m-2时, 随着受体种群植株密度的增加, 4种春小麦中转基因漂移频率均呈指数下降趋势。这可能是受体植株密度增加导致其花粉密度的相对比例增加, 相当于稀释了来自于转基因小麦的花粉, 在花粉竞争情况下受体植株接受到了更高比例的非转基因花粉。
3.3 转基因小麦基因漂移与距花粉源距离的关系在2种花粉受体中, 小麦的基因漂移频率均随着距花粉源距离的增加而迅速降低。前期研究发现, 转基因小麦的花粉密度随着距离的增加迅速衰减, 小麦的基因漂移频率与供体的花粉密度呈正相关, 且随着花粉密度的下降而显著降低。同时, 基因漂移频率的降低在一定程度上可能与供体花粉活力的下降有关系。LOUREIRO等[16]研究显示在小麦盛花期, 气温在20~25 ℃时, 栽培小麦在散粉1 h后花粉活力就丧失了80%, 花粉颗粒经过长距离的传播可能很难保持原有的活力, 这也进一步说明距离隔离是降低小麦品种间花粉介导的基因漂移的有效措施。这一结果与之前对于小麦基因漂移的研究结果一致, 小麦的基因漂移频率或者异交率都有明显的距离效应[27-28], 距离隔离是控制自花授粉作物中花粉介导的基因漂移的最有效措施之一。
| [1] |
孙炳剑, 羊健, 孙丽英, 等. 禾谷多黏菌传小麦病毒病的分布及变化动态[J]. 麦类作物学报, 2011, 31(5): 969-973. SUN Bing-jian, YANG Jian, SUN Li-ying, et al. Distribution and Dynamics of Polymyxa graminis Transmitted Wheat Viruses in China[J]. Journal of Triticeae Crops, 2011, 31(5): 969-973. DOI:10.7606/j.issn.1009-1041.2011.05.029 (  0) 0) |
| [2] |
李鹏, 崔正勇, 高国强, 等. 小麦黄花叶病研究进展[J]. 山东农业科学, 2017, 49(8): 168-172. LI Peng, CUI Zheng-yong, GAO Guo-qiang, et al. Research Progress of Wheat Yellow Mosaic[J]. Shandong Agricultural Sciences, 2017, 49(8): 168-172. (  0) 0) |
| [3] |
曹晶晶, 杨海艳, 谢咸升, 等. 解淀粉芽胞杆菌对小麦黄花叶病的生物防治[J]. 植物保护学报, 2016, 43(4): 588-593. CAO Jing-jing, YANG Hai-yan, XIE Xian-sheng, et al. Control Effect of Bacillus amyloliquefaciens on Wheat Yellow Mosaic Disease[J]. Journal of Plant Protection, 2016, 43(4): 588-593. (  0) 0) |
| [4] |
叶兴国, 徐惠君, 杜丽璞, 等. 小麦规模化转基因技术体系构建及其应用[J]. 中国农业科学, 2014, 47(21): 4155-4171. YE Xing-guo, XU Hui-jun, DU Li-pu, et al. Establishment and Application of Large-Scale Transformation Systems in Wheat[J]. Scientia Agricultura Sinica, 2014, 47(21): 4155-4171. DOI:10.3864/j.issn.0578-1752.2014.21.003 (  0) 0) |
| [5] |
SUN A Q, ZHANG C Q, WU C L, et al. Pollen Flow of Wheat Under Natural Conditions in the Huanghuai River Wheat Region, China[J]. GM Crops & Food, 2015, 6(3): 135-149. (  0) 0) |
| [6] |
MIROSHNICHENKO D, PUSHIN A, DOLGOV S. Assessment of the Pollen-Mediated Transgene Flow From the Plants of Herbicide Resistant Wheat to Conventional Wheat (Triticum aestivum L.)[J]. Euphytica, 2016, 209(1): 71-84. DOI:10.1007/s10681-016-1637-y (  0) 0) |
| [7] |
MILLWOOD R, NAGESWARA-RAO M, YE R, et al. Pollen-Mediated Gene Flow From Transgenic to Non-Transgenic Switchgrass (Panicum virgatum L.) in the Field[J]. BMC Biotechnology, 2017, 17(1): 40. DOI:10.1186/s12896-017-0363-4 (  0) 0) |
| [8] |
DONG S S, LIU Y, YU C G, et al. Investigating Pollen and Gene Flow of WYMV-Resistant Transgenic Wheat N12-1 Using a Dwarf Male-Sterile Line as the Pollen Receptor[J]. PLoS One, 2016, 11(3): e0151373. DOI:10.1371/journal.pone.0151373 (  0) 0) |
| [9] |
石雪, 董姗姗, 于赐刚, 等. 转WYMV-Nib8基因抗黄花叶病小麦花粉漂移研究[J]. 生态与农村环境学报, 2015, 31(4): 522-527. SHI Xue, DONG Shan-shan, YU Ci-gang, et al. Pollen Flow of Transgenic WYMV-Nib8 Wheat Resistant of Yellow Mosaic Virus[J]. Journal of Ecology and Rural Environment, 2015, 31(4): 522-527. DOI:10.11934/j.issn.1673-4831.2015.04.012 (  0) 0) |
| [10] |
HUCL P, MATUS-CÁDIZ M. Isolation Distances for Minimizing Out-Crossing in Spring Wheat[J]. Crop Science, 2001, 41(4): 1348-1351. DOI:10.2135/cropsci2001.4141348x (  0) 0) |
| [11] |
MATUS-CÁDIZ M A, HUCL P, HORAK M J, et al. Gene Flow in Wheat at the Field Scale[J]. Crop Science, 2004, 44(3): 718-727. DOI:10.2135/cropsci2004.7180 (  0) 0) |
| [12] |
MATUS-CÁDIZ M A, HUCL P, DUPUIS B. Pollen-Mediated Gene Flow in Wheat at the Commercial Scale[J]. Crop Science, 2007, 47(2): 573-579. DOI:10.2135/cropsci06.07.0441 (  0) 0) |
| [13] |
WILKINSON M J, ELLIOTT L J, ALLAINGUILLAUME J, et al. Hybridization Between Brassica napus and B.rapa on a National Scale in the United Kingdom[J]. Science, 2003, 302(5644): 457-459. DOI:10.1126/science.1088200 (  0) 0) |
| [14] |
ZAHARIEVA M, MONNEVEUX P. Spontaneous Hybridization Between Bread Wheat (Triticum aestivum L.) and Its Wild Relatives in Europe[J]. Crop Science, 2006, 46(2): 512-527. DOI:10.2135/cropsci2005.0023 (  0) 0) |
| [15] |
LOUREIRO I, ESCORIAL M C, GONZÁLEZ-ANDUJAR J L, et al. Wheat Pollen Dispersal Under Semiarid Field Conditions:Potential Outcrossing With Triticum aestivum and Triticum turgidum[J]. Euphytica:Netherlands Journal of Plant Breeding, 2007, 156(1/2): 25-37. (  0) 0) |
| [16] |
LOUREIRO I, ESCORIAL M C, GONZÁLEZ Á, et al. Pollen-Mediated Gene Flow in Wheat (Triticum aestivum L.) in a Semiarid Field Environment in Spain[J]. Transgenic Research, 2012, 21(6): 1329-1339. DOI:10.1007/s11248-012-9619-x (  0) 0) |
| [17] |
CHEN M, SUN L, WU H, et al. Durable Field Resistance to Wheat Yellow Mosaic Virus in Transgenic Wheat Containing the Antisense Virus Polymerase Gene[J]. Plant Biotechnology Journal, 2014, 12(4): 447-456. DOI:10.1111/pbi.2014.12.issue-4 (  0) 0) |
| [18] |
LIU B H, YANG L. Breeding of Dwarfing-Sterile Wheat and Its Potential Values in Wheat Breeding[J]. Chinese Science Bulletin, 1991, 36(18): 1562-1564. (  0) 0) |
| [19] |
GUSTAFSON D I, HORAK M J, REMPEL C B, et al. An Empirical Model for Pollen-Mediated Gene Flow in Wheat[J]. Crop Science, 2005, 45(4): 1286-1294. DOI:10.2135/cropsci2004.0137 (  0) 0) |
| [20] |
RONG J, LU B R, SONG Z P, et al. Dramatic Reduction of Crop-to-Crop Gene Flow Within a Short Distance From Transgenic Rice Fields[J]. New Phytologist, 2007, 173(2): 346-353. DOI:10.1111/j.1469-8137.2006.01906.x (  0) 0) |
| [21] |
RONG J, WANG F, SONG Z P, et al. Scale Effect on Rice Pollen-Mediated Gene Flow:Implications in Assessing Transgene Flow From Genetically Engineered Plants[J]. Annals of Applied Biology, 2012, 161(1): 3-11. DOI:10.1111/aab.2012.161.issue-1 (  0) 0) |
| [22] |
ZHANG W, WANG K, LIN Z S, et al. Production and Identification of Haploid Dwarf Male Sterile Wheat Plants Induced by Corn Inducer[J]. Botanical Studies, 2014, 55: 26. DOI:10.1186/1999-3110-55-26 (  0) 0) |
| [23] |
MIROSHNICHENKO D, PUSHIN A, DOLGOV S. Assessment of the Pollen-Mediated Transgene Flow From the Plants of Herbicide Resistant Wheat to Conventional Wheat (Triticum aestivum L.)[J]. Euphytica, 2016, 209(1): 71-84. DOI:10.1007/s10681-016-1637-y (  0) 0) |
| [24] |
CHANDLER S F, STEVENSON T W. Gene Flow and Risk Assessment in Genetically Modified Crops[M]. New York, USA: Springer, 2014: 247-265.
(  0) 0) |
| [25] |
YUAN Q H, SHI L, WANG F, et al. Investigation of Rice Transgene Flow in Compass Sectors by Using Male Sterile Line as a Pollen Detector[J]. Theoretical and Applied Genetics, 2007, 115(4): 549-560. DOI:10.1007/s00122-007-0588-z (  0) 0) |
| [26] |
WILLENBORG C J, BRÛLÉ-BABEL A L, VAN ACKER R C. Low Crop Plant Population Densities Promote Pollen-Mediated Gene Flow in Spring Wheat (Triticum aestivum L.)[J]. Transgenic Research, 2009, 18(6): 841-854. DOI:10.1007/s11248-009-9267-y (  0) 0) |
| [27] |
BECKIE H J, WARWICK S I, SAUDER C A, et al. Pollen-Mediated Gene Flow in Commercial Fields of Spring Wheat in Western Canada[J]. Crop Science, 2011, 51(1): 306-313. DOI:10.2135/cropsci2010.03.0176 (  0) 0) |
| [28] |
FOETZKI A, QUIJANO C D, MOULLET O, et al. Surveying of Pollen-Mediated Crop-to-Crop Gene Flow From a Wheat Field Trial as a Biosafety Measure[J]. GM Crops & Food, 2012, 3(2): 115-122. (  0) 0) |




