2. 辽宁双台河口湿地生态系统国家定位观测研究站, 辽宁 盘锦 124112;
3. 沈阳农业大学生物技术学院, 辽宁 沈阳 110866
2. Liaoning Shuangtai Estuary Wetland Ecosystem Research Station, Panjin 124112, China;
3. College of Biology, Shenyang Agricultural University, Shenyang 110866, China
重金属镉是环境中的持久性污染物,具有隐蔽性、滞后性、微量致毒性以及强移动性等污染特点[1],在植物根、茎、叶及果实中的大量累积不仅会影响植物的生长和发育,而且还会随着食物链进入人体,危害人类健康[2-3]。而芦苇作为重金属镉的超富集植物,通过独特的生理代谢过程,经过溶解、沉淀、凝聚、络合、吸附等反应,可以将镉以不同离子形态赋存积累[4-5],从而减少镉对植物毒害作用并提高植物耐受性。当镉与蛋白质结合形成螯合物时,可限制镉在植物体内的移动性,使镉不能再移动和释放,因此镉在植物体内被限制运输到茎叶,绝大部分保留在根部。芦苇(Phragmites australis)对镉的吸收与镉在芦苇体内各部位分配以及镉与芦苇体内物质的结合形态等因素有关[6]。在芦苇对镉的富集过程中,谷胱甘肽起到十分重要的作用[7],谷胱甘肽不仅能直接结合重金属离子,而且还是植物络合素的合成前体。植株体内γ-谷氨酰半胱氨酸合成酶(γ-GCS)是谷胱甘肽生物合成中的关键酶[2],决定了谷胱甘肽生物合成的速率和数量,对芦苇富集积累重金属镉的能力具有巨大影响。
作为镉的超富集植物,芦苇是辽河湿地的优势物种,对于湿地水质净化,保障辽河口湿地濒危物种栖息地水质质量具有重要的生态作用,芦苇通过吸收镉等重金属,并其保留在芦苇根中,使湿地的重金属得到固定,减小对周边动植物及环境的威胁。为探究镉胁迫下芦苇对氯化钠提取态镉(SCd)的富集规律及螯合吸附镉过程中γ-GCS对重金属镉胁迫的反应,通过不同浓度镉溶液对芦苇进行胁迫培养,分析芦苇根茎叶中SCd的含量特征和γ-GCS活性变化,揭示芦苇对镉的富集规律,为辽河口湿地有效净化重金属污染选育优良的芦苇品种,提高河口区重金属污染的净化效率提供理论依据,为保护辽河口湿地生态系统稳定及濒危物质栖息地安全提供保障。
1 材料与方法 1.1 试验设计试验于2016年4—11月在沈阳农业大学水利综合试验场内进行。将芦苇种植于白塑料桶(直径40 cm,高40 cm)中,每个生长期选择生长状况基本一致的植株进行取样。试验共设置6组,第1~5组分别灌溉不同浓度CdCl2溶液(0.5、1.0、2.0、3.0和50 mmol·L-1)进行培养,每个浓度设计5桶芦苇同时灌溉,分别用于芦苇5个生长时期的样品采集,第6组为全生长期清水灌溉培养。每个处理3个重复,以清水灌溉和CdCl2溶液灌溉做对照,共布设90桶。
按照《主要作物生育时期划分及观测标准》中划分作物生育阶段的标准,将芦苇整个生长期划分为发芽期、展叶期、拔节期、抽穗期和成熟期5个阶段。其中,发芽期为4月末—5月中旬;展叶期为5月中旬—6月下旬;快速生长期为7月上旬—8月中旬;抽穗期为8月中旬—9月上中旬;成熟期为9月中旬—10月上中旬。
1.2 试验材料及装置供试植物芦苇于2015年4月采自辽宁辽河口国家级自然保护区试验区。挖取带有健康芽眼且未萌发的芦苇根状茎,每段截成约20 cm,将根外部包适量土壤,装入麻袋,洒适量清水以保证根系湿润,运回试验地,立即移栽试验池的土壤中,定时浇水以保证成活。经1 a无污染培养后移栽到沙基培养塑料桶(直径40 cm、高40 cm)中。
1.3 镉溶液配置及灌溉在每个生长期取样前一周,将分析纯氯化镉配置的浓度为0.5、1.0、2.0、3.0和5.0 mmol·L-1的CdCl2溶液分别灌入芦苇桶内,每桶均灌入10 L溶液,剩余由清水灌溉补充保持土面以上5 m水层以保障芦苇正常生长。以全生长期灌溉清水的芦苇和5个生长期均灌入镉溶液的芦苇作为对照。镉溶液灌入7 d后,于当天13:00—16:00取样并做好试验前的样品处理。
1.4 样品采集及处理方法(1) 取样方法:选择长势相近的3株植株,小心截取芦苇茎叶并挖出地下根部,用蒸馏水冲洗干净,吸水纸吸干表面水分,放入自封袋中保存备用。
(2) Cd含量的测定:芦苇总镉含量测定采用电感耦合等离子体发射光谱仪(iCAP-7000)测定;芦苇镉形态及含量测定采取分级萃取法,分别称取2.00 g芦苇根、茎和叶片新鲜样品,剪成1~2 mm2的碎片,置于烧杯中,加入37.5 mL提取剂,在30 ℃恒温箱中放置过夜(17~18 h),次日回收提取液,再加入同样体积该提取液,浸取2 h后再回收提取液,重复2次,即在24 h内提取4次,集4次提取液(共150 mL)于烧杯中,消煮测定。样品消煮后用φ=10%硝酸定容,采用原子吸收分光光度计测定。
(3)γ-GCS活性的测定:选取芦苇健康植株,没有变色,没有虫咬、没有水渍变坏的新生根茎叶部位,准确称取0.1 g放入研钵中,液氮快速研磨至粉碎,加入磷酸缓冲液,充分振荡后,离心提取上清液,使用ELISA试剂盒测定酶活性。酶活性单位定义为:在特定的条件下,1 min能转化1 μmoL底物的酶量。
1.5 数据分析对芦苇根茎叶中的氯化钠提取态镉的含量采用Excel 2013和SPSS 19.0软件对每个生长期的芦苇根部的镉含量进行单因素方差分析和多重比较,并对镉溶液浓度与芦苇根茎叶中γ-GCS活性间的关系进行回归分析。
对芦苇γ-GCS活性基于逻辑斯特曲线进行分析,即:
| $ Y = \frac{k}{{1 + A{{\rm{e}}^{ - rt}}}}。$ | (1) |
式(1)中, Y为γ-GCS活性,U·mL-1;r为芦苇γ-GCS活性的内禀增长率,即γ-GCS活性最大增长速率,%;k为环境容纳量,即环境条件所能容许的γ-GCS最大活性,U·mL-1;t为生长时间,d;A为与初始条件有关的常数。
2 结果与分析 2.1 芦苇根茎叶中氯化钠提取态镉(SCd)含量如图 1所示,镉溶液灌溉条件下芦苇根内SCd的单位积累量变化明显,各浓度间差异显著,且均与对照存在极显著差异(P < 0.01)。在同一生长期内,不同浓度镉溶液灌溉下芦苇根内SCd的单位积累量会随着镉浓度的变大而增加,除5.0 mmol·L-1条件下之外,各生长期均表现为3.0 mmol·L-1镉溶液灌溉条件下SCd单位积累量最大,是2.0 mmol·L-1条件下的1.3~1.8倍,是1.0 mmol·L-1条件下的2~4倍,是0.5 mmol·L-1条件下的3~8倍。而随着芦苇生长,同一浓度灌溉条件下芦苇根内SCd的单位积累量也会逐渐增加。其中5.0 mmol·L-1镉溶液灌溉条件下根内SCd的单位积累量在展叶期增加迅速,是发芽期镉单位积累量的6.1倍,从展叶期到成熟期SCd的单位积累量增加缓慢且在快速生长期之后略低于3.0 mmol·L-1条件下SCd的单位积累量;0~3.0 mmol·L-1镉浓度灌溉时,SCd的单位积累量在快速生长期之前均呈上升趋势,浓度越大增长越快,快速生长期之后根中SCd的单位积累量增加缓慢,到成熟期时SCd的单位积累量达到最大,成熟期时3.0 mmol·L-1条件下根中SCd的单位积累量为3 984.16 mg·kg-1。
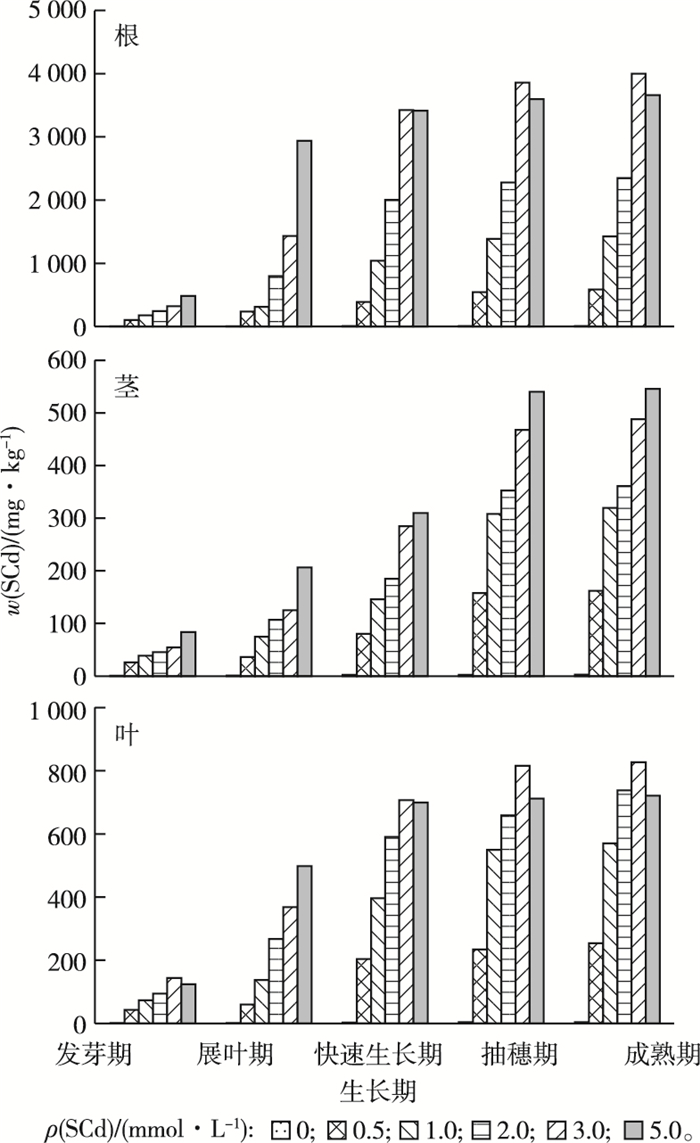
|
图 1 芦苇根茎叶中氯化钠提取态镉(SCd)含量 Figure 1 The content of sodiumchloride-extraction cadmium (SCd) in Phragmites australis |
镉溶液灌溉条件下芦苇茎内SCd的单位积累量变化明显,各浓度间差异显著,且均与对照存在极显著差异(P < 0.01)。镉溶液灌溉下芦苇茎内SCd的单位积累量会随着镉浓度的提高和芦苇生长时间的延长而增加。同一生长期内,各浓度灌溉条件下芦苇茎内SCd的单位积累量均表现为高浓度大于低浓度,各生长期表现为5.0 mmol·L-1镉溶液灌溉条件下SCd的单位积累量最大,是3.0 mmol·L-1条件下的1~1.5倍,是2.0 mmol·L-1条件下的1.3~2.0倍,是1.0 mmol·L-1条件下的1.5~3.0倍,是0.5 mmol·L-1条件下的3~5倍。同一浓度灌溉条件下,芦苇茎内SCd的单位积累量从大到小均表现为成熟期>抽穗期>快速生长期>展叶期>发芽期;不同浓度条件下芦苇茎内SCd的单位积累量的增长速度也随浓度的提高而增加,即灌溉浓度越大SCd的单位积累量增加越快;在芦苇生长到快速生长期之后,茎内SCd的单位积累量增长速度开始变缓,成熟期时芦苇茎内SCd的单位积累量与快速生长期相比增加极少。
镉溶液灌溉条件下芦苇叶内SCd的单位积累量变化明显,各浓度间差异显著,且均与对照存在极显著差异(P < 0.01)。在同一生长期内,不同浓度镉溶液灌溉下芦苇叶内SCd的单位积累量会随着镉浓度的变大而增加,除5.0 mmol·L-1条件下之外,各生长期均表现为3.0 mmol·L-1镉溶液灌溉条件下SCd的单位积累量最大,是2.0 mmol·L-1条件下的1~1.5倍,是1.0 mmol·L-1条件下的1.5~2.5倍,是0.5 mmol·L-1条件下的3~6倍。而随着芦苇生长,同一浓度灌溉条件下芦苇叶内SCd的单位积累量也会逐渐增加。其中5.0 mmol·L-1镉溶液灌溉条件下叶内镉SCd的单位积累量在快速生长期前增加迅速,从快速生长期到成熟期SCd的单位积累量则增加缓慢,而且在快速生长期之后就低于3.0 mmol·L-1条件下SCd的单位积累量,在成熟期甚至低于2.0 mmol·L-1条件下SCd的单位积累量。0~3.0 mmol·L-1镉浓度灌溉时,SCd的单位积累量在抽穗期之前均呈上升趋势,浓度越大增长越快,快速生长期之后叶中SCd的单位积累量增加缓慢,到成熟期时达最大,成熟期时3.0 mmol·L-1条件下叶中SCd的单位积累量为824.19 mg·kg-1。
2.2 芦苇根茎叶中氯化钠形态镉积累量所占比例由图 2可知,在不同浓度镉溶液灌溉条件下,各生长期芦苇根部SCd的积累量均大于茎部和叶部。成熟期时,根部最大积累量为3 984.16 mg·kg-1,是茎部的7.33倍、叶部的4.83倍。
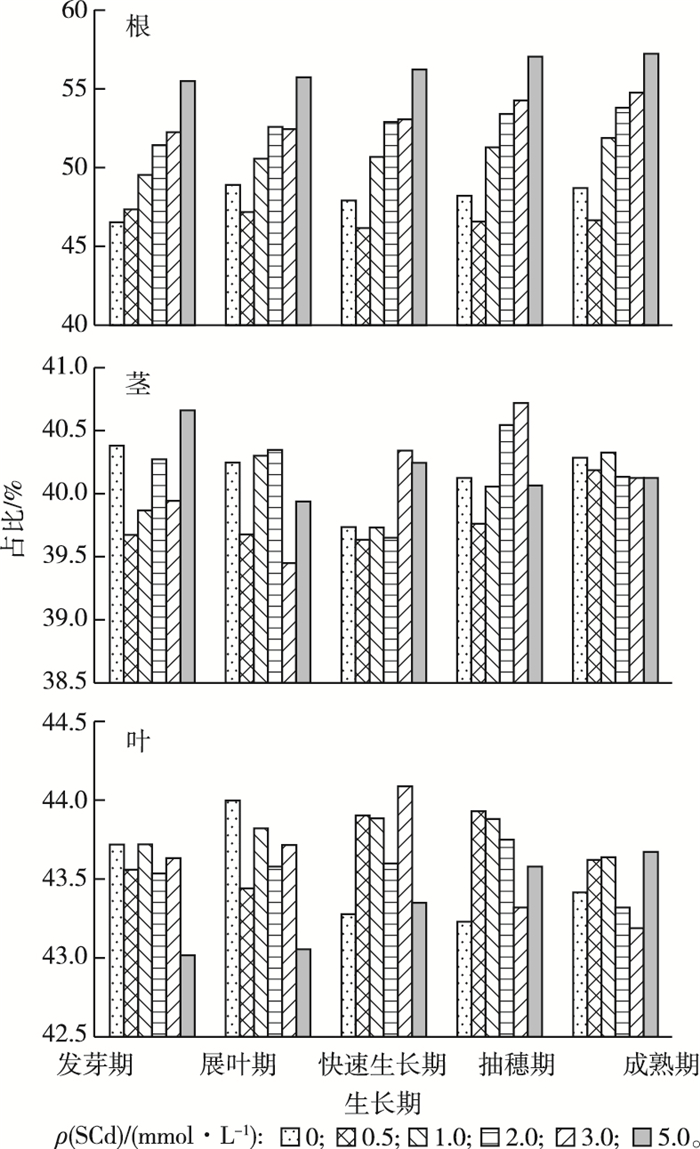
|
图 2 芦苇各部位氯化钠提取态镉(SCd)所占比例 Figure 2 The content of cadmium (SCd) in Phragmites australis |
芦苇根部SCd积累量的共同特征是:SCd的积累量占各种形态镉总积累量的比例随着生长期的变化微小,随浓度升高的变化明显。各浓度灌溉条件下,5.0 mmol·L-1灌溉组中SCd的积累量所占总镉的比例最高,成熟期时达57.15%,其次为3.0 mmol·L-1灌溉组,成熟期时所占比例为54.69%;0.5 mmol·L-1灌溉组中SCd的积累量所占总镉的比例最低,成熟期时为46.64%。芦苇茎部SCd积累量所占总镉的比例随灌溉浓度和生长期的变化无明显特征,均在40%浮动;芦苇叶部SCd积累量所占总镉的比例随灌溉浓度和生长期的变化亦无明显特征,均在43%上下浮动。
2.3 芦苇根茎叶中γ-GCS活性的变化特征芦苇根茎叶中γ-GCS活性的变化特征如图 3所示。
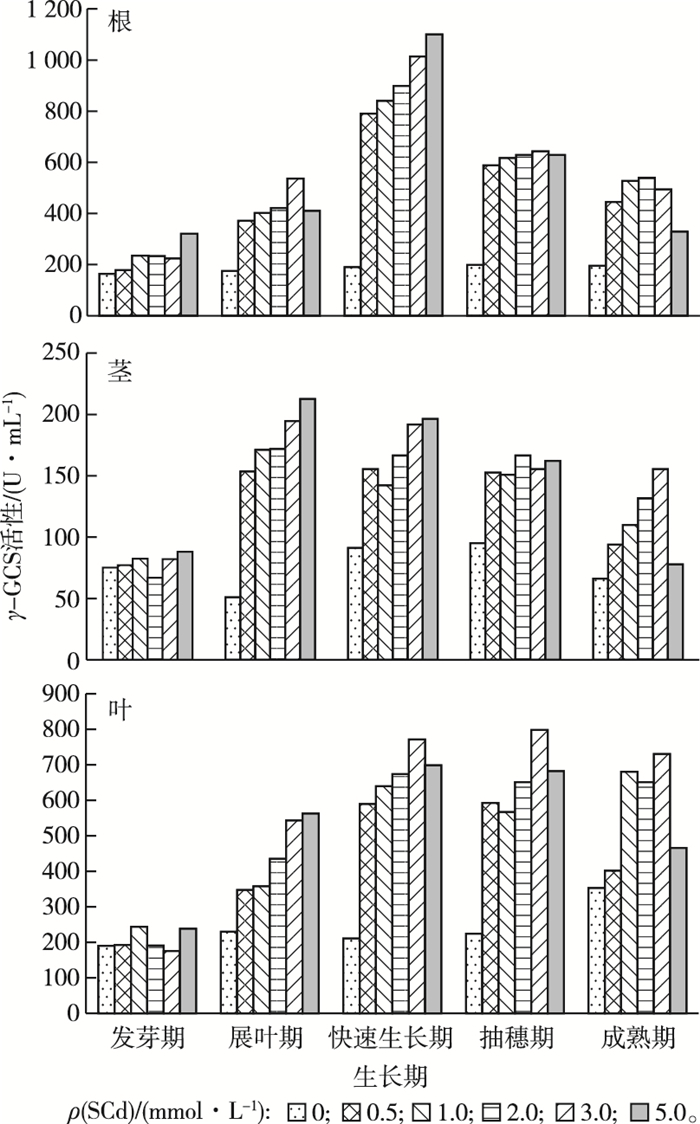
|
图 3 芦苇根茎叶中γ-GCS活性 Figure 3 The γ-GCS Activities in Phragmites australis |
在不同浓度镉溶液灌溉条件下,芦苇根茎叶中γ-GCS活性均有明显增加。除成熟期外,在各个生长期中,芦苇根茎叶中γ-GCS活性均会随着灌溉浓度升高而增加,且均在5.0 mmol·L-1灌溉条件出现活性最大值;同一浓度灌溉条件下,芦苇根茎叶中γ-GCS活性则会随着芦苇生长而呈先增高后降低的趋势,其中根中γ-GCS活性在快速生长期出现最大值,5.0 mmol·L-1灌溉条件下根中γ-GCS活性为对照组的5.8倍;茎中γ-GCS活性在展叶期出现最大值,5.0 mmol·L-1灌溉条件下茎中γ-GCS活性为对照组的4.2倍;叶中γ-GCS活性在抽穗期出现最大值,γ-GCS活性为对照组的3.5倍。
2.4 芦苇对γ-GCS活性的动力学分析因清水灌溉下芦苇γ-GCS活性差异不显著,故仅对镉溶液灌溉下芦苇γ-GCS活性基于逻辑斯特曲线做回归分析,结果见表 1。
|
|
表 1 不同镉浓度下γ-GCS活性的回归方程及变化参数 Table 1 Regression equation and variation parameters of γ-GCS activity under different cadmium concentrations |
从表 1可知,不同浓度镉溶液灌溉条件下芦苇γ-GCS活性的内禀增长率(r值)变化不大,因此可将r值看作是一个不受镉浓度影响的常数,而不同浓度镉溶液灌溉对于芦苇γ-GCS活性的环境容纳量影响则较大,镉浓度越高,芦苇γ-GCS活性的容纳量越高。
3 讨论植物遭受重金属胁迫时会通过自身调节来减少金属对自身生长的影响[8-10]。进入芦苇体内的镉对蛋白质或其他有机化合物中的巯基有很强的亲合力,在作物体内镉常与蛋白质结合[11-12],这种结合形态既会减少以自由态存在的镉离子,使其有效性和移动性降低;但其与体内功能蛋白相结合,对蛋白功能发生干扰,造成植物生理、生化代谢过程紊乱[13]。ANTONOVICS等[14]研究发现,与植物中蛋白质结合态的镉常以SCd形式存在。杨居荣等[11]通过对冬小麦、旱稻等8种作物的筛选研究发现,8种作物体内以SCd形式结合的镉含量均占很大比例;在香菇和大豆中亦是SCd形式为主[15]。笔者研究结果表明芦苇在受到Cd胁迫时,进入芦苇体内的绝大部分Cd被富集在根部,而迁移至其他部位的较少,而在芦苇不同部位内均以NaCl提取态占绝对优势,这一结果与YE等[16]和江行玉等[17]的结论一致。灌溉镉浓度增加时,芦苇植株根、茎、叶的SCd积累量呈先增加后减少的趋势,同时芦苇γ-GCS活性也呈现先升高后降低的趋势,表明一定浓度镉胁迫会促进芦苇对镉吸收富集,但过量的镉将会对芦苇的正常生长代谢造成影响[18]。同时,根据根茎叶部位之间SCd的积累量变化及芦苇吸收总镉比例的分析发现,在Cd胁迫下芦苇体内不同形态镉的积累量均有增加,其中SCd的增加最显著,正是由于这种增加,使得芦苇富集镉的总量增加。因此在以芦苇为主的湿地中,芦苇富集镉后主要集中在根部,减少了湿地生产生活中镉的危害,以保证湿地生态系中动植物的正常生长。对芦苇体内镉结合蛋白的产生及去向以及多年灌溉镉溶液对芦苇遗传物质的影响及优良芦苇品种的筛选,仍需进一步研究。
4 结论通过对不同镉溶液灌溉胁迫下各个时期芦苇根茎叶不同部位中各种形态镉的总积累量进行对比可知,成熟期时根部的总镉积累量最大,为3 984.16 mg·kg-1,是茎部的7.33倍,叶部的4.83倍。同时,芦苇根部SCd占总镉的比例随灌溉浓度增加小幅度升高,成熟期时5.0 mmol·L-1灌溉下达到最大,为57.15%;而SCd在芦苇茎部和叶部中占总镉的比例随灌溉浓度和生长期的变化无明显变化,生长周期内茎部SCd约占茎中总镉含量的40%左右,叶部SCd约占叶中总镉的43%左右。同时芦苇各部位γ-GCS活性随镉浓度升高呈先升高后降低的趋势。
| [1] |
金彪, 黄维南. 镉对植物生理和生态效应的研究进展影响[J]. 生态学报, 2000, 20(3): 514-523. [ ZHANG Jin-biao, HUANG Wei-nan. Advances on Physiological and Ecological Effects of Cadmium on Plants[J]. Acta Ecologica Sinica, 2000, 20(3): 514-523. DOI:10.3321/j.issn:1000-0933.2000.03.030] (  0) 0) |
| [2] |
赵翠珠.芦苇抗重金属基因的克隆和功能鉴定[D].济南: 山东大学, 2011. ZHAO Cui-zhu.The Cloning and Functional Analysis of Heavy Metal Resistance Genes of Phragmites Australis[D].Ji'nan: Shandong University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10422-1011170562.htm (  0) 0) |
| [3] |
张玉秀, 柴团耀, GÉRARDBURKARD. 植物耐重金属机理研究进展[J]. 植物学报, 1999, 41(5): 453-457. [ ZHANG Yu-xiu, CHAI Tuan-yao, GÉRARD B. Research Advances on the Mechanisms of Heavy Metal Tolerance in Plants[J]. Acta Botanica Sinica, 1999, 41(5): 453-457. DOI:10.3321/j.issn:1672-9072.1999.05.001] (  0) 0) |
| [4] |
PIERZYNSKI G M, SCHWAB A P. Bioavailability of Zinc, Cadmium and Lead in a Metal-Contaminated Alluvial Soil[J]. Journal of Environmental Quality, 1993, 22(2): 247-254. (  0) 0) |
| [5] |
王昌全, 代天飞, 李冰, 等. 稻麦轮作下水稻土重金属形态特征及其生物有效性[J]. 生态学报, 2007, 27(03): 889-897. [ WANG Chang-quan, DAI Tian-fei, LI Bing, et al. The Speciation and Bioavailability of Heavy Metals in Paddy Soils Under the Rice-Wheat Cultivation Rotation[J]. Acta Ecologica Sinica, 2007, 27(3): 889-897. DOI:10.3321/j.issn:1000-0933.2007.03.008] (  0) 0) |
| [6] |
程磷令. γ-谷氨酰半胱氨酸合成酶基因及其调控[J]. 国外医学(生理、病理科学与临床分册), 2002, 22(6): 543-545. (  0) 0) |
| [7] |
陆海燕, 刘志辉, 吕光辉. 镉污染下芦苇叶片丙二醛、脯氨酸及SOD保护酶反应研究[J]. 干旱区资源与环境, 2013, 27(8): 171-175. [ LU Hai-yan, LIU Zhi-hui, LÜ Guang-hui. Reaction of MDA, Proline, and SOD Under Cd Stress in Mixture of Phragmites australis's Stems and Leaves[J]. Journal of Arid Land Resources and Environment, 2013, 27(8): 171-175.] (  0) 0) |
| [8] |
MA J F, HIRADATE S, MASTSUMOTO H. High Aluminum Resistance in Buckwheat.Li.Oxalic Acid Detoxifies Aluminum Internally[J]. Plant Physiology, 1998, 117(3): 753-759. DOI:10.1104/pp.117.3.753 (  0) 0) |
| [9] |
TOMSETT A B, THURMAN D A. Molecular Biology of Metal Tolerance of Plants[J]. Plant Cell & Environment, 1988, 11(5): 383-394. (  0) 0) |
| [10] |
江行玉, 赵可夫. 植物重金属伤害及其抗性机理[J]. 应用与环境生物学报, 2001, 7(1): 92-99. [ JIANG Xing-yu, ZHAO Ke-fu. Mechanism of Heavy Metal Injury and Resistance of Plants[J]. Chinese Journal of Applied and Environmental Biology, 2001, 7(1): 92-99. DOI:10.3321/j.issn:1006-687X.2001.01.022] (  0) 0) |
| [11] |
杨居荣, 贺建群, 张国祥, 等. 农作物对镉毒害的耐性机理探讨[J]. 应用生态学报, 1995, 6(1): 87-91. [ YANG Ju-rong, HE Jian-qun, ZHANG Guo-xiang, et al. Tolerance Mechanism of Crops to Cd Pollution[J]. Chinese Journal of Applied Ecology, 1995, 6(1): 87-91. DOI:10.3321/j.issn:1001-9332.1995.01.018] (  0) 0) |
| [12] |
BRAUDE G L, NASH A M, WOLF W J, et al. Cadmium and Lead Content of Soybean Products[J]. Journal of Food Science, 1980, 45(5): 1187-1189. DOI:10.1111/jfds.1980.45.issue-5 (  0) 0) |
| [13] |
许嘉琳, 鲍子平, 杨居荣, 等. 农作物体内铅镉铜的化学形态研究[J]. 应用生态学报, 1991, 2(3): 244-248. [ XU Jia-lin, BAO Zi-ping, YANG Ju-rong, et al. Chemical Forms of Pb, Cd and Cu in Crops[J]. Chinese Journal of Applied Ecology, 1991, 2(3): 244-248. DOI:10.3321/j.issn:1001-9332.1991.03.010] (  0) 0) |
| [14] |
ANTONOVICS J, BRADSHAW A D, TURNER R G. Heavy Metal Tolerance in Plants[J]. Advances in Ecological Research, 1971, 7: 1-85. DOI:10.1016/S0065-2504(08)60202-0 (  0) 0) |
| [15] |
王学锋, 杨艳琴. 土壤-植物系统重金属形态分析和生物有效性研究进展[J]. 化工环保, 2004, 24(1): 24-28. [ WANG Xue-feng, YANG Yan-qin. Progresses in Research on Speciation and Bioavailability of Heavy Metals in Soil-Plant System[J]. Environmental Protection of Chemical Industry, 2004, 24(1): 24-28. DOI:10.3969/j.issn.1006-1878.2004.01.008] (  0) 0) |
| [16] |
YE Z H, BAKER A J M, WONG M H, et al. Regular Article Zinc, Lead and Cadmium Tolerance, Uptake and Accumulation by the Common Reed, Phragmites australis (Cav.) Trin. Ex Steudel[J]. Annals of Botany, 1997, 80(3): 363-370. DOI:10.1006/anbo.1997.0456 (  0) 0) |
| [17] |
江行玉, 王长海, 赵可夫, 等. 芦苇抗镉污染机理研究[J]. 生态学报, 2003, 23(5): 856-862. [ JIANG Xing-yu, WANG Chang-hai, ZHAO Ke-fu, et al. Study on the Mechanism of Cadmium Resistance in Phragmites australis[J]. Acta Ecologica Sinica, 2003, 23(5): 856-862. DOI:10.3321/j.issn:1000-0933.2003.05.003] (  0) 0) |
| [18] |
李洋, 于丽杰, 金晓霞. 植物重金属胁迫耐受机制[J]. 中国生物工程杂志, 2015, 35(9): 94-104. [ LI Yang, YU Li-jie, JIN Xiao-xia. Mechanism of Heavy Metal Tolerance Stress of Plants[J]. China Biotechnology, 2015, 35(9): 94-104.] (  0) 0) |




