有机磷阻燃剂(OFRs)具有良好的阻燃性能,被广泛应用于建筑材料、电子产品、塑料制品、家装饰品和纺织品等产品中。氯代烷基有机磷阻燃剂(OFRs-Cl)是其中较常见、浓度较高的一类,包括磷酸三(1,3-二氯-2-丙基)酯(TDCPP)、磷酸三(2-氯-丙基)酯(TCPP)和磷酸三(2-氯乙基)酯(TCEP)[1]。近年来,随着OFRs-Cl生产量和使用量的大幅增加,其在大气、水体、沉积物和土壤等环境介质中均有检出[2]。KAWAGOSHI等[3]发现日本废弃物处理站内原水中ρ(TCPP)和ρ(TCEP)为1.0~9 065 μg·L-1,ρ(TDCPP)为0.6~6.265 μg·L-1。OFRs-Cl在鱼类、鼠类、鸟类和蚯蚓等生物体内及人体头发、乳汁、精液、血液和尿液中也有检出[1]。OFRs-Cl具有神经、生殖、基因、致癌和内分泌干扰等生物毒性,在环境中很难通过常规工艺降解或去除[4],其中TCPP和TCEP在底栖生物食物链暴露中有生物放大现象。欧盟和美国已将OFRs-Cl列入潜在致癌物名单。
摇蚊幼虫广泛存在于各种水体,种类多,分布广,密度和生物量大(占底栖生物量的70%~80%),且有易繁殖、生长周期短、对毒物敏感性强等优点,是美国国家环境保护局(USEPA)和经济合作与发展组织(OECD)推荐的水生态毒理学测试物种。目前,国内关于摇蚊研究主要集中在重金属、多环芳烃、农药等污染物对其急性和慢性毒性(完整生命周期)的影响,包括死亡率、半致死浓度(LC50)、羽化率、生长速率、羽化时间、雌雄比、卵筏产量及孵化率观测指标[5-8],国内外关于OFRs-Cl对摇蚊幼虫的毒理学研究鲜见报道。
参照GB/T 27858—2011《化学品沉积物-水系统中摇蚊毒性试验加标于水法》,选取我国常见的摇蚊种类——伸展摇蚊(Chironomus riparius)为研究对象。基于急性毒性预试验数据,采用不同浓度TDCPP、TCPP和TCEP开展试验,以存活率、羽化率为表观指标;选择伸展摇蚊幼虫体内抗氧化酶,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量、功能基因〔热休克蛋白同源物(HSC70)和细胞色素P450家族(CYP4G)〕表达量[9-10],探讨摇蚊幼虫对水体污染的生态响应机制,为水体沉积物系统健康评估提供基础数据。
1 材料与方法 1.1 供试材料(1) 受试生物:伸展摇蚊四龄幼虫,其卵块来自环境保护部南京环境科学研究所,在实验室人工气候箱〔温度:(22±0.2) ℃,t(光照):t(黑暗)=16 h:8 h,湿度:75%〕中繁殖多代。试验前,为选择龄期一致的幼虫,将同期(产卵在同一日)卵块分装至同一培养箱,待其生长至四龄期(卵孵化后16 d,体长约为1 cm),挑选大小一致的幼虫进行急性毒性试验。生长期间将德彩鱼饲料磨碎后用培养液稀释成溶液饲喂,投放量以每只幼虫0.25~0.40 mg·d-1计,每隔2 d对幼虫进行一次食物补充。
(2) 主要试剂:TCPP、TCEP和TDCPP均为色谱纯,购自Sigma-Aldrich公司。SOD、CAT和MDA试剂盒均购自于南京建成生物研究所。助溶剂二甲基亚砜(DMSO)为分析纯,由南京晚晴试剂公司提供。RNA提取试剂、目的基因电泳试剂、RNA反转录和RT-qPCR试剂盒均由南京诺唯赞生物科技有限公司提供。
1.2 试验方法参照GB/T 27858—2011,开展TDCPP、TCPP和TCEP对伸展摇蚊的急性毒性试验。采用40 μL的DMSO(φ为0.1‰)作为助溶剂加入含有400 mL蒸馏水〔曝气48 h,ρ(DO)> 50 mg·L-1〕的烧杯中,根据预试验结果分别配制0.1、1.0和5.0 mg·L-13个浓度梯度的TDCPP、TCPP和TCEP,同时设置只含助溶剂的对照组。每个烧杯放入20条四龄摇蚊幼虫,并用医用纱布封口,暴露期间不喂食,每个浓度设置6个平行。将烧杯置于人工气候箱中〔温度:(22±0.2) ℃,t(光照):t(黑暗)=16 h:8 h,湿度:75%〕。24 h暴露结束后,观察幼虫死亡和羽化情况,3种OFRs-Cl每个浓度选3个样品分别进行酶活性测定和功能基因表达分析。
1.3 样品的制备与分析测定(1) 摇蚊幼虫组织匀浆液的制备。取16~20条(20条为0.1 g)摇蚊幼虫,用生理盐水洗净后放入1.5 mL离心管中,加入9倍体质量的匀浆液,在冰浴中快速捣碎,制成10%的组织匀浆液,并在4 ℃、3 000 r·min-1(相对离心力RCF为5 720)条件下离心10 min,吸取上清液,编号分装于离心管,存放于-20 ℃冰箱,供不同酶检测时使用。
(2) 蛋白质和酶活性测定。蛋白质含量、SOD活性、CAT活性和MDA质量的测定均依照试剂盒说明书进行。
(3) 蛋白基因mRNA的RT-qPCR检测。按Trizol试剂说明书提取摇蚊幼虫(挑选15条)组织总RNA,提取后用焦碳酸二乙酯(DEPC)溶解分装于-80 ℃条件下保存。RNA浓度吸光度采用微量紫外分光光度计测定,数值均在1.8~2.0之间,说明RNA纯度高,之后样品进行反转录。取2 μg总RNA,按照反转录试剂盒的操作要求进行,产物cDNA于-20 ℃条件下保存。两种功能基因的RT-qPCR检测采用20 μL体系,包括ChamQ SYBR qPCR Master Mix 10 μL,上下游引物各0.4 μL,模板DNA 2 μL,ddH2O 7.2 μL。仪器选用StepOnePlus Real-Time PCR System(ABI,美国),RT-qPCR反应程序如下:95 ℃预变性10 min;95 ℃变性5 s;60 ℃退火10 s;72 ℃延伸采集荧光信号15 s,45个循环。熔解曲线条件:95 ℃,15 s;60 ℃,60 s;95 ℃,15 s。内参基因(GAPDH)和2个功能基因(HSC70和CYP4G)检测引物序列见表 1[9-10]。
1.4 数据统计与分析采用Origin 8.6软件进行数理统计及作图。不同处理组与对照组的比较采用单因素方差分析,显著性差异水平为α=0.05。
2 结果与分析 2.1 3种OFRs-Cl对摇蚊存活和羽化的影响表 2显示,暴露24 h后,随着浓度增加,摇蚊幼虫存活量呈降低趋势,各处理组均低于对照组。对照组幼虫存活率高达96%,处理组存活率为85%~91%,明显低于对照组。羽化结果显示,摇蚊幼虫在5.0 mg·L-1的TDCPP和TCEP中暴露24 h后,羽化率分别达到10%和2.5%,对照组和其他处理组均未见羽化现象。
|
|
表 2 3种OFRs-Cl对摇蚊存活和羽化的影响 Table 2 Effects of three OFRs-Cl on survival and emergence of Chironomus riparius |
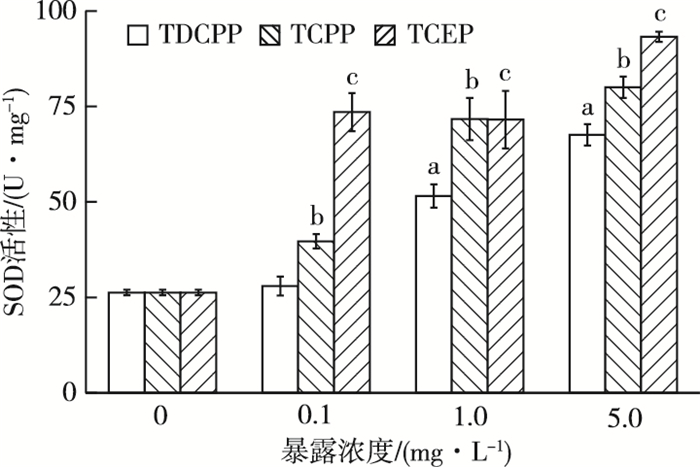
由图 1可知,在3种添加OFRs-Cl的水体中,相对于对照组,各处理组摇蚊幼虫体内SOD活性均被激活,且TDCPP胁迫下SOD活性与污染物浓度具有明显的剂量-效应关系。SOD活性随TDCPP、TCPP和TCEP浓度的增加而逐渐升高,与对照相比,最高浓度处理组受诱导作用最强烈且达显著水平(P<0.05),分别为对照组的2.57、3.05和3.55倍。比较相同浓度TDCPP、TCPP和TCEP发现,TCEP暴露下摇蚊幼虫SOD活性均高于其他两组,在低浓度(0.1 mg·L-1)条件下受诱导差异最明显,分别为TDCPP和TCPP的2.42和1.31倍,SOD对TCEP的指示效果最敏感。
|
图 1 3种OFRs-Cl对摇蚊SOD活性的影响 Figure 1 Effects of three OFRs-Cl on SOD activity in Chironomus riparius 直方柱上方a、b和c分别表示在TDCPP、TCPP和TCEP暴露下,处理组与对照组SOD活性差异显著(P<0.05)。 |
由图 2可知,与对照组相比,TCPP各处理组CAT活性表现为先诱导后抑制,TDCPP和TCEP各处理组均表现为随浓度增大诱导作用逐渐增强,且TCEP胁迫下诱导效应比TDCPP强。

|
图 2 3种OFRs-Cl对摇蚊CAT活性的影响 Figure 2 Effects of three OFRs-Cl on SOD activity in Chironomus riparius 直方柱上方a、b和c分别表示在TDCPP、TCPP和TCEP暴露下,处理组与对照组CAT活性差异显著(P<0.05)。 |
随着TCPP暴露浓度的增加,各处理组CAT活性变化显著,均与对照组表现出显著差异(P<0.05),分别为对照组的2.15、2.61和1.36倍。在不同TDCPP和TCEP暴露浓度下,CAT活性逐渐升高,部分处理组(1.0和5.0 mg·L-1)CAT活性变化显著,5.0 mg·L-1浓度组变化最为显著(P<0.05),分别为对照组的2.28和3.66倍。比较相同浓度TDCPP、TCPP与TCEP发现,就1.0和5.0 mg·L-1处理组而言,TCEP暴露下的摇蚊幼虫CAT活性高于其他两组。与TDCPP和TCEP相比,TCPP暴露下CAT活性最先与对照组之间表现出显著差异(P<0.05),CAT对TCPP的指示效果最明显。
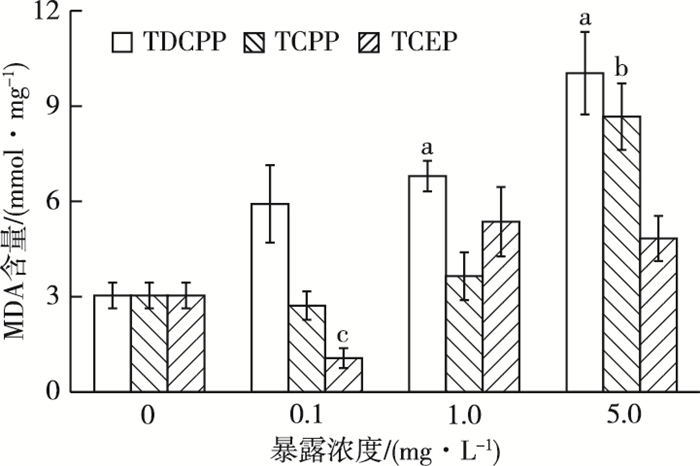
2.4 3种OFRs-Cl对摇蚊MDA含量的影响由图 3可知,各处理组MDA含量表现为低浓度抑制且随着TCEP浓度的增加,活性逐渐得以恢复,在最大浓度时与对照组相比无显著差异。
|
图 3 3种OFRs-Cl对摇蚊MDA含量的影响 Figure 3 Effects of three OFRs-Cl on MDA content in Chironomus riparius 直方柱上方a、b和c分别表示在TDCPP、TCPP和TCEP暴露下,处理组与对照组MDA含量差异显著(P<0.05)。 |
在TDCPP和TCEP暴露下,各处理组MDA含量随浓度升高逐渐升高,在最高浓度时达到最大诱导,显著高于对照组(P<0.05),分别为对照组的3.30和2.85倍。比较相同浓度TDCPP、TCPP、TCEP发现,TDCPP暴露下摇蚊幼虫MDA含量均高于其他两组,在低浓度0.1 mg·L-1条件下差异最明显,分别为TCPP和TCEP的2.18和5.55倍。TCEP暴露下MDA最先与对照组表现出显著差异,MDA对TCEP的指示效果最敏感。TDCPP引起幼虫体内MDA含量增加,呈良好的剂量-效应关系。
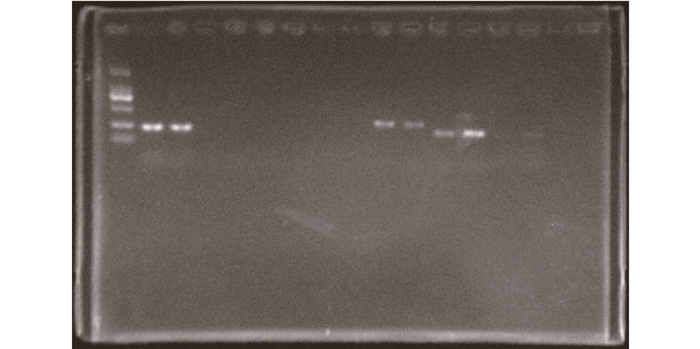
2.5 摇蚊幼虫目的基因的电泳图谱由图 4可知,左侧第一个条带为marker条带,从左往右数第2、3条带均为HSC70基因,第4、5条带均为CYP4G基因,第6、7条带均为GDPAH基因。图 4中可见各引物只有一条条带,亮度明显,图谱清晰,故可做RT-qPCR反应的定量分析。
|
图 4 摇蚊幼虫目的基因的电泳图谱 Figure 4 Electrophoresis image of target gene from Chironomus riparius |
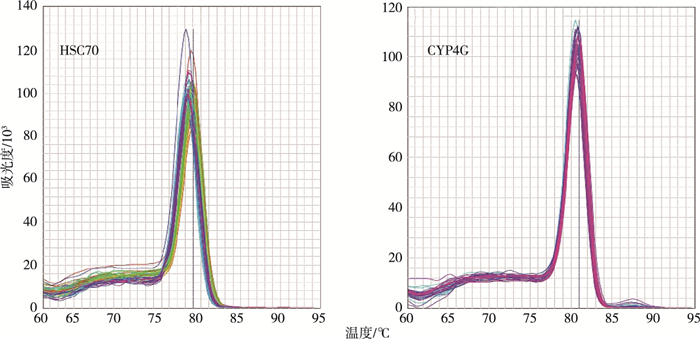
熔解曲线共有9个(3个污染物×3个基因/污染物),选其中两个作为代表(图 5)。
|
图 5 目的基因HSC70和CYP4G的RT-qPCR的熔解曲线分析 Figure 5 Melt curve analysis of the RT-qPCR products of target genes HSC70 and CYP4G |
由图 5可知,摇蚊幼虫暴露于TDCPP后,功能基因HSC70和CYP450的熔解曲线皆为特异的单个峰,没有出现引物二聚体与非特异性扩增,说明引物选择和RT-qPCR反应体系条件的建立适用于供试基因的特异性检测。
2.7 3种OFRs-Cl对摇蚊HSC70基因表达的影响由图 6可知,在TDCPP和TCPP暴露下,各低中浓度处理组HSC70基因表达水平围绕对照组上下波动,而高浓度5.0 mg·L-1处理组HSC70基因表达水平分别上调和下调为对照组的2.40倍和45.0%。随TCEP暴露浓度的增加,各处理组HSC70基因表达水平呈现先下调后上调的趋势,分别在1.0和5.0 mg·L-1条件下与对照组相比表现出显著差异(P<0.05),分别为对照组的73.2%和1.28倍。可见,HSC70基因对TCEP的胁迫尤为敏感。比较同浓度TDCPP、TCPP和TCEP发现,最高浓度5.0 mg·L-1条件下3者的表达水平差异最显著,TDCPP暴露下HSC70表达水平分别为TCPP和TCEP暴露下的5.34和1.87倍。
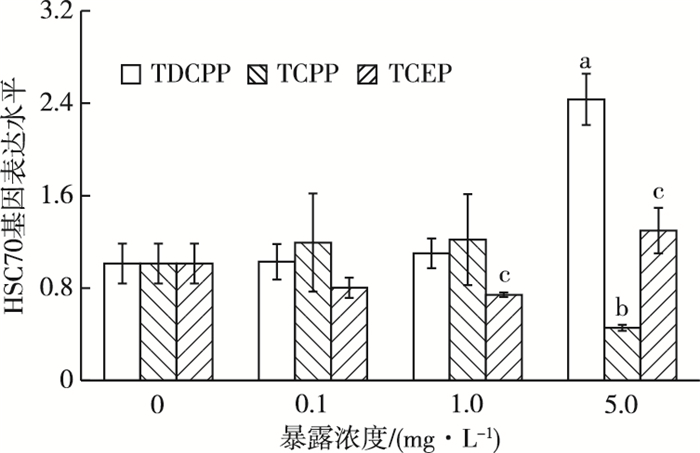
|
图 6 3种OFRs-Cl对摇蚊HSC70基因表达的影响 Figure 6 Effects of three OFRs-Cl on HSC70 gene expression in Chironomus riparius 直方柱上方a、b和c分别表示在TDCPP、TCPP和TCEP暴露下,处理组与对照组HSC70基因表达水平差异显著(P<0.05)。 |
由图 7可知,在TDCPP和TCPP暴露下,各处理组摇蚊幼虫体内CYP4G基因表达水平出现明显波动,均呈现先降低后升高趋势,但在最高浓度5.0 mg·L-1条件下仍低于对照组。TCEP暴露下CYP4G基因波动水平较TDCPP和TCPP缓和,仅在最低浓度0.1 mg·L-1条件下与对照相比呈显著下调(P<0.05),为对照组的62.8%。在TDCPP暴露下,显著下调的处理组随浓度增加,CYP4G基因表达水平依次为对照组的46.1%、14.2%和27.0%。可见CYP4G基因对TDCPP的胁迫最为敏感。比较同浓度TDCPP、TCPP与TCEP发现,在中间浓度1.0 mg·L-1条件下3者表达水平差异最显著,TCEP暴露下CYP4G表达水平为TDCPP和TCPP暴露下的6.02和1.62倍。
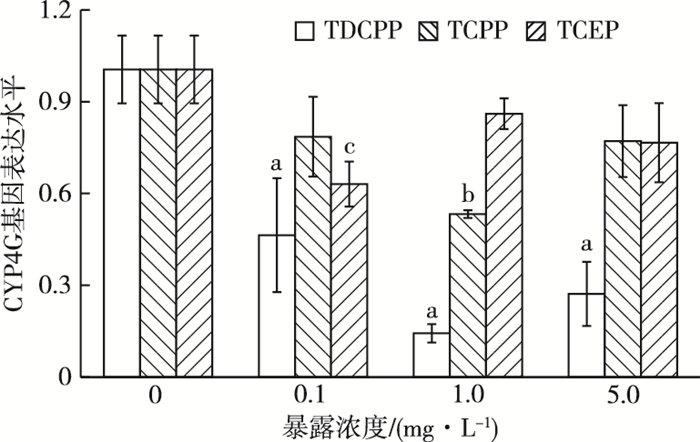
|
图 7 3种OFRs-Cl对摇蚊CYP4G基因表达的影响 Figure 7 Effects of three OFRs-Cl on CYP4G gene expression in Chironomus riparius 直方柱上方a、b和c分别表示在TDCPP、TCPP和TCEP暴露下,处理组与对照组CYP4G基因表达水平差异显著(P<0.05)。 |
保幼激素和蜕皮激素的分泌和内分泌物质的改变是污染物影响昆虫羽化推迟或提前的内在因素[11]。笔者研究中HSC70热激同源蛋白含量在5.0 mg·L-1TDCPP和TCEP刺激下,均显著上调。故推测TDCPP和TCEP可能是诱导HSC70上调和某种内分泌物增加共同导致摇蚊幼虫羽化的提前,这与文献[12]研究结果基本一致。赵小凡[13]和郑薇薇[14]报道昆虫细胞质中的HSC70部分入核与USP结合启动基因转录促进蜕皮激素增多,进而促进昆虫羽化。
SOD和CAT活性显著提高表明OFRs-Cl胁迫下摇蚊幼虫体内活性氧自由基增多,抗氧化防御系统打开,刺激SOD和CAT的合成来清除过多的氧自由基,从而减少细胞膜的氧化损伤,这是摇蚊幼虫对逆境环境的适应性反应,防御污染物对其细胞的氧化损伤、脂质过氧化等[15]。随着TDCPP和TCEP浓度的增加,SOD和CAT活性逐渐增加,说明试验设计的TDCPP和TCEP浓度在摇蚊幼虫的耐受限度内,不会对摇蚊幼虫造成严重的氧化胁迫。当ρ(TCPP)大于1.0 mg·L-1时,SOD活性增强,CAT活性降低,这说明在>1.0 mg·L-1的TCPP胁迫下,摇蚊幼虫体内SOD活性增强有利于清除过量氧自由基,但其仍有积累,对CAT蛋白产生了破坏和消耗。在低浓度TCEP(0.1 mg·L-1)暴露下,摇蚊幼虫体内MDA含量降低,这可能是由于摇蚊幼虫机体的活性氧被抗氧化酶系清除,抑制了脂质过氧化作用。高浓度TDCPP和TCPP处理组(5.0 mg·L-1)MDA含量均显著高于对照组水平,可能是由于在TDCPP和TCPP胁迫下活性氧(ROS)含量增加抑制了抗氧化酶系活性,并且产生过量活性簇引起脂质过氧化作用。相同浓度的3种OFRs-Cl暴露下,摇蚊幼虫体内各种酶活性差异较大,可能与污染物本身的结构、性质和受试生物的种类等有关,但笔者发现指示3种OFRs-Cl最敏感的酶不同。
研究发现Gr 2+、Cu2+、Zn2+、敌百虫等环境污染物会诱导HSP70家族的表达[16-17]。HSC70是热休克蛋白70(HSP70)家族的重要成员,受诱导后表达量变化显著,在生命活动中有重要作用。5.0 mg·L-1的TDCPP和TCEP诱导摇蚊幼虫体内HSC70的显著表达,而且还表现出明显的组织特异性,如促进幼虫羽化。中低浓度TDCPP和TCPP胁迫下,HSC70与对照组相比差异不显著,可能是因为在中低浓度污染物刺激下,摇蚊幼虫体内大量解毒酶发挥作用,快速降低了污染物毒性作用。VALERIA等[18]研究发现伸展摇蚊在安定药中暴露3 h后,其体内HSC70被诱导表达,PLANELLÓ等[19]研究报道相较于重金属Cd、Gr、Ni、Cu浓度较低的河流,浓度较高的河流中伸展摇蚊体内HSC70的表达是受抑制的,这可能与污染物种类或其本身的毒性相关。CYP450是生物体内的一类解毒酶,其中,GYP4家族成员与生物的抗毒害性相关。笔者发现在3种OFRs-Cl胁迫下,摇蚊幼虫体内GYP4G随浓度增加均下调,可能是因为CYP450是个大家族,CYP4G被抑制,家族中其他CYP亚型基因表达上调发挥了作用,亦表明3种OFRs-Cl抑制摇蚊幼虫体内CYP4G的表达。有研究表明在铜污染中暴露3 h,随其浓度的增加,伸展摇蚊CYP4G表达量呈现逐渐下调趋势[20],相似的变化趋势在伸展摇蚊暴露于邻苯二甲酸二(2-乙基已酯)(EHDP)24 h时亦出现[21]。相同浓度TDCPP、TCPP和TCEP胁迫下,摇蚊幼虫HSC70表达水平在5.0 mg·L-1条件下差异最明显,可能与摇蚊幼虫羽化现象的提前相关;在5.0 mg·L-1时,TCPP和TCEP胁迫下摇蚊幼虫CYP4G表达水平高于TDCPP。另有研究表明,TCPP显著提高了鸡的CYP450家族CYP3A37亚型基因的表达水平,而TDCPP诱导了CYP2H1亚型基因的表达水平[22],这可能是CYP450家族中各种亚型基因相互作用造成的。笔者发现解毒酶如SOD、CAT活性与解毒基因亚型CYP4G的变化趋势不一致,类似结果在文献[23]中亦有报道,这可能与基因转录后修饰以及基因和蛋白的降解速率等不同,导致基因与其对应的蛋白无相关性有关。
4 结论(1) 5.0 mg·L-1TDCPP和TCEP促进幼虫的羽化,且TDCPP促进效果更强,这可能是由于TDCPP和TCEP诱导了保幼激素和内分泌激素的增加,TDCPP诱导效果更强。
(2) SOD、CAT活性和MDA含量对TDCPP、TCPP和TCEP的毒性响应各不相同。SOD和MDA对TCEP的指示效果最敏感,CAT对TCPP的指示效果最敏感。
(3) HSC70在最高浓度TDCPP和TCEP胁迫下显著上调,推测与昆虫的羽化相关。CYP4G在3种OFRs-Cl胁迫下均表现出下调趋势。HSC70和CYP4G基因分别对TDCPP和TCEP的胁迫尤为敏感。
(4) 笔者试验仅为24 h的急性毒性试验,未关注更长时间的3种OFRs-Cl对摇蚊幼虫的时间-响应关系,羽化现象与HSC70表达水平相关的机理探讨也有待深入。
| [1] |
WEI G L, LI D Q, ZHUO M N, et al. Organophosphorus Flame Retardants and Plasticizers:Sources, Occurrence, Toxicity and Human Exposure[J]. Environmental Pollution, 2015, 196: 29-46. DOI:10.1016/j.envpol.2014.09.012 (  0) 0) |
| [2] |
周启星, 赵梦阳, 来子阳, 等. 有机磷阻燃剂的环境暴露与动物毒性效应[J]. 生态毒理学报, 2017, 12(5): 1-11. [ ZHOU Qi-xing, ZHAO Meng-yang, LAI Zi-yang, et al. Researching Progress in Toxic Effects of Organophosphorus Flame Retardants Released Into the Environment[J]. Asian Journal of Ecotoxicology, 2017, 12(5): 1-11.] (  0) 0) |
| [3] |
KAWAGOSHI Y, FUKUNAGA I, ITOH H. Distribution of Organophosphoric Acid Triesters Between Water and Sediment at a Sea-Based Solid Waste Disposal Site[J]. Journal of Material Cycles Waste Management, 1999, 1(1): 53-61. (  0) 0) |
| [4] |
LOOS R, CARVALHO R, ANTÓNIO D C, et al. EU-Wide Monitoring Survey on Emerging Polar Organic Contaminants in Wastewater Treatment Plant Effluents[J]. Water Research, 2013, 47(17): 6475-6487. DOI:10.1016/j.watres.2013.08.024 (  0) 0) |
| [5] |
刘丽, 钟文珏, 祝凌燕. 沉积物中六氯苯对摇蚊幼虫慢性毒性效应研究[J]. 生态毒理学报, 2014, 9(2): 261-267. [ LIU Li, ZHONG Wen-jue, ZHU Ling-yan. Chronic Effects of Hexachlorobenzen (HCB) in Sediments to Chironomus kiiensis Larvae[J]. Asian Journal of Ecotoxicology, 2014, 9(2): 261-267.] (  0) 0) |
| [6] |
李浩.铜和镉对羽摇蚊幼虫(Chironomus plumosus)和红裸须摇蚊幼虫(Propsilocerus akamusi)的毒性效应[D].武汉: 华中农业大学, 2012. LI Hao.Toxic Effects of Copper and Cadmium Exposure on Chironomus plumosus and Propsilocerus akamusi[D].Wuhan: Huazhong Agricultural University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10504-1012457711.htm (  0) 0) |
| [7] |
邓万蓉, 刘志红, 孙梨宗, 等. 菲对摇蚊幼虫的急、慢性毒性效应[J]. 生态学杂志, 2017, 36(9): 2556-2563. (  0) 0) |
| [8] |
邓鑫, 刘志红, 李晓军, 等. 沉积物中多杀霉素对摇蚊幼虫的慢性毒性效应[J]. 生态与农村环境学报, 2015, 31(5): 784-788. [ DENG Xin, LIU Zhi-hong, LI Xiao-jun, et al. Chronic Toxic Effects of Spinosad in Sediments to Chironomus tepperi Larvae[J]. Journal of Ecology and Rural Environment, 2015, 31(5): 784-788.] (  0) 0) |
| [9] |
PLANELLÓ R, MARTÍNEZ-GUITARTE J L, MORCILLO G. Effect of Acute Exposure to Cadmium on the Expression of Heat-Shock and Hormone-Nuclear Receptor Genes in the Aquatic Midge Chironomus riparius[J]. Science of the Total Environment, 2010, 408(7): 1598-1603. DOI:10.1016/j.scitotenv.2010.01.004 (  0) 0) |
| [10] |
PARK K, BANG H W, PARK J, et al. Ecotoxicological Multilevel-Evaluation of the Effects of Fenbendazole Exposure to Chironomus riparius Larvae[J]. Chemosphere, 2009, 77(3): 359-367. DOI:10.1016/j.chemosphere.2009.07.019 (  0) 0) |
| [11] |
HARPER M P, PECKARSKY B L. Emergence Cues of a Mayfly in a High-Altitude Stream Ecosystem:Potential Response to Climate Change[J]. Ecological Applications, 2006, 16(2): 612-621. DOI:10.1890/1051-0761(2006)016[0612:ECOAMI]2.0.CO;2 (  0) 0) |
| [12] |
邵世超.有机磷阻燃剂甲状腺干扰效应评价[D].杭州: 浙江工业大学, 2014. DENG Shi-chao.Thyroid Interference Effects of Organophosphorus Flame Retardants[D].Hangzhou: Zhejiang University of Technology, 2014. (  0) 0) |
| [13] |
赵小凡. 昆虫蜕皮激素信号转导途径研究进展[J]. 生命科学, 2010, 22(12): 1208-1214. [ ZHAO Xiao-fan. Progress in Insect Molting Hormone Signaling Transduction Pathways[J]. Chinese Bulletin of Life Sciences, 2010, 22(12): 1208-1214.] (  0) 0) |
| [14] |
郑薇薇.热休克蛋白同源物Hsc70等5种基因在蜕皮激素信号途径中的功能及相互作用研究[D].济南: 山东大学, 2010. ZHENG Wei-wei.Function Analyses of Five Genes Involved in 20E Signal Transduction Pathway and Interaction Among Them[D].Jinan: Shandong University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10422-2010103414.htm (  0) 0) |
| [15] |
赵燕, 汤保华, 蔡磊明, 等. 杀菌剂戊唑醇对花翅摇蚊(Chironomus kiiensis)幼虫的急性毒性和抗氧化酶系统的影响[J]. 农药, 2012, 51(6): 445-448, 460. [ ZHAO Yan, TANG Bao-hua, CAI Lei-ming, et al. The Acute Toxicity of Tebuconazole to Chironomus kiiensis Larvae and Its Responses of Antioxidant Enzyme System[J]. Agrochemicals, 2012, 51(6): 445-448, 460. DOI:10.3969/j.issn.1006-0413.2012.06.018] (  0) 0) |
| [16] |
李春勇.敌百虫诱导近江牡砺(Crassostrea hongkongensis)HSC70基因表达的定量研究[D].广州: 暨南大学, 2007. LI Chun-yong.Quantification of HSC70 Gene mRNA in Crassostrea hongkongensis Treated With Trichlorfon[D].Guangzhou: Jinan University, 2007. (  0) 0) |
| [17] |
马晨曦.重金属对HeLa细胞中热激蛋白70(HSP70)表达的影响[D].合肥: 安徽农业大学, 2013. MA Chen-xi.Effects of Heavy Metal on Expression of Heat Shock Protein 70(HSP70) in HeLa Cell[D].Hefei: Anhui Agricultural University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10364-1014148078.htm (  0) 0) |
| [18] |
VALERIA L, VALENTINA G, BRUNO R, et al. Transcriptional Profiling Induced by Pesticides Employed in Organic Agriculture in a Wild Population of Chironomus riparius Under Laboratory Conditions[J]. Science of the Total Environment, 2016, 557/558: 183-191. DOI:10.1016/j.scitotenv.2016.03.062 (  0) 0) |
| [19] |
PLANELLÓ R, SERVIA M J, GÓMEZ-SANDE P, et al. Transcriptional Responses, Metabolic Activity and Mouthpart Deformities in Natural Populations of Chironomus riparius Larvae Exposed to Environmental Pollutants[J]. Environmental Toxicology, 2013, 30(4): 383-395. (  0) 0) |
| [20] |
PAOLA B, MATTEO G, FRANCESCO B, et al. DNA Damage and Translational Response During Detoxification From Copper Exposure in a Wild Population of Chironomus riparius[J]. Chemosphere, 2017, 173: 235-244. DOI:10.1016/j.chemosphere.2017.01.052 (  0) 0) |
| [21] |
HERRERO Ó, MORCILLO G, PLANELLÓ R. Transcriptional Deregulation of Genetic Biomarkers in Chironomus riparius Larvae Exposed to Ecologically Relevant Concentrations of Di(2-Ethylhexyl) Phthalate(DEHP)[J]. PLoS One, 2017, 12(2): e0171719. DOI:10.1371/journal.pone.0171719 (  0) 0) |
| [22] |
FARHAT A, CRUMP D, CHIU S, et al. In Ovo Effects of Two Organophosphate Flame Retardants TCPP and TDCPP on Pipping Success, Development, mRNA Expression, and Thyroid Hormone Levels in Chicken Embryos[J]. Toxicological Sciences, 2013, 134(1): 92-102. DOI:10.1093/toxsci/kft100 (  0) 0) |
| [23] |
徐湘博, 史雅娟, 吕永龙, 等. 2, 2', 4, 4'-四溴联苯醚对赤子爱胜蚓的抗氧化酶、代谢酶及其基因表达的影响[J]. 环境科学学报, 2014, 34(11): 2948-2955. [ XU Xiang-bo, SHI Ya-juan, Ü Yong-long, et al. Effects of 2, 2', 4, 4'-Tetrabromodiphenyl Ether on Antioxidant and Metabolic Enzymes and Gene Expression Levels of Earthworms(Eisenia fetida)[J]. Acta Scientiae Circumstantiae, 2014, 34(11): 2948-2955.] (  0) 0) |




