全球气候变化和能源安全等原因,近年来促使可再生能源(尤其是生物质能)迅速发展[1]。在众多生物质种类中,规模庞大的木质纤维素材料,特别是作物秸秆,是一个富有吸引力的来源[2]。通过物理化学方法或生物过程,木质纤维素生物质可转化为甲烷、乙醇、丁醇、异丁醇、氢或其他能源产品[3]。在我国农村地区,作物秸秆的禁烧政策面临巨大压力,禁而不止现象突出,也迫切需要寻求潜在的技术解决方案。厌氧消化被广泛认为是生物质能源转化的重要途径,是一种有前景、发展中的作物秸秆综合利用技术[4]。
作物秸秆的细胞壁由纤维素(w为9%~80%)、半纤维素(w为10%~50%)和木质素(w为5%~35%)组成[5]。在分子水平上,纤维素(C6H10O5)n是由D-葡萄糖以β(1→4)共价键链接而成。而纤维素的β(1→4)共价键使得多糖几乎不可以被动物所消化(除反刍动物外)[6]。半纤维素是无定形物质,由各种糖单元相互连接形成,容易被消化[6]。木质素可阻碍微生物(细菌、真菌等)渗透,是细胞壁中最难以降解的部分[6]。此外,木质素和半纤维素以共价键形式结合,将纤维素分子包埋在其中,形成一种天然屏障,使微生物和酶不易与纤维素分子接触,更增加了降解难度[7]。
水解是秸秆等纤维素基质厌氧消化的限制步骤。一种有效提升秸秆厌氧消化性能的方法是预处理,包括增加可接触表面积、纤维素去结晶化、去除半纤维素和去除/改变木质素[8]。目前已开发了各种秸秆预处理技术[8-10],如物理预处理(粉碎、蒸汽爆炸、水热、微波和照射)、化学预处理(酸、碱、氨化、氧化和离子液体)和生物预处理(真菌和酶)等。
反刍动物瘤胃系统的瘤胃液含有厌氧细菌、真菌、原生动物和产甲烷菌等[11],可为作物秸秆的高效厌氧消化提供潜在策略。在反刍动物体内,瘤胃是高负荷纤维素高效分解的原位微生物生态系统,对顽固的木质纤维素生物质表现出很高的降解潜能[12],特别是具有更高的水解和酸化效率。由于具有较高的纤维素降解活性,相较于传统接种物(如厌氧活性污泥),瘤胃微生物可显著提高木质纤维素的降解率。HU等[12]研究显示,在玉米秸秆液相厌氧消化中,相较于传统的污水污泥,以瘤胃微生物作接种物可多产生28%的挥发性脂肪酸(volatile fatty acids,VFAs)。YUE等[3]发现,相对于其他来源的接种物,瘤胃微生物对木质纤维素表现出更快的攻击性。
笔者以水稻、小麦和高粱等谷类秸秆为研究对象,以奶牛瘤胃液为接种物,研究其厌氧消化产酸和产甲烷规律,并探讨消化液溶解性有机物(DOM)的三维荧光光谱变化特征,以期为谷类秸秆的资源化利用提供技术支撑。
1 材料与方法 1.1 试验材料与装置水稻、小麦和高粱秸秆采集自江苏省淮安市某农场,经晾晒后用破碎机粉碎并过0.42 mm孔径筛。谷类秸秆的基本性质见表 1。高粱秸秆挥发性固体(volatile solid,VS)质量含量为93.98%,而水稻秸秆仅为87.30%。秸秆由纤维素、半纤维素和木质素组成,采用全自动纤维分析仪(ANKOM 2000i,ANKOM Technology, USA)测定。水稻、小麦和高粱秸秆的纤维素和半纤维素质量含量之和分别为64.19%、66.19%和65.58%,小麦秸秆具有更高的木质素质量含量(9.01%)。瘤胃液取自屠宰场,奶牛屠宰后,迅速取出其瘤胃内容物,经3层纱布过滤后,快速将过滤后的瘤胃液转运至保温桶,将保温桶置于39 ℃恒温箱(DNP-9052,上海精宏实验设备有限公司,中国)中培养,瘤胃液pH值为6.87。
|
|
表 1 谷类秸秆的基本性质 Table 1 The fundamental characteristics of cereal straw |
厌氧消化采用全自动甲烷潜力测试系统(BMP-RTK,湖北洛克泰克仪器有限公司,中国)。厌氧消化瓶容积为500 mL,置于恒温水浴(±0.1 ℃)中,并配有0~160 r·min-1电动搅拌单元、CO2吸收单元(4 mol·L-1 NaOH溶液)和气体测量单元(精度1 mL)。
1.2 试验流程谷类秸秆进一步粉碎后过0.15 mm孔径筛,用于厌氧消化试验。缓冲液成分[13]:NaHCO3,8 g·L-1;CaCl2·2H2O,0.03 g·L-1;KH2PO4,1 g·L-1;K2HPO4,3 g·L-1;MgCl2·6H2O,0.08 g·L-1;NH4Cl,0.18 g·L-1;缓冲液pH值为8.94。厌氧消化的底物(以VS计)质量浓度为10 g·L-1,发酵温度为39 ℃。每个厌氧消化瓶中瘤胃液接种量为80 mL,缓冲液体积为320 mL,混合液pH值为8.33。为了防止厌氧消化过程发酵液pH < 6.0,在缓冲液中加入过量的CaCO3作为固相缓冲剂。定期采集少量消化液,用于测定pH和产酸性能,以及用于分析三维荧光光谱特征,并实时监测厌氧消化过程的产甲烷规律。
1.3 分析方法三维荧光光谱(three-dimensional excitation emission matrix,3D-EEM)采用三维荧光扫描光谱仪(Aqualog,HORIBA Instruments Inc., USA)分析,配以1 cm×1 cm石英荧光样品池。荧光扫描光谱仪以氙气灯为激发光源,信噪比>20 000:1。激发波长(Ex)范围为211~618 nm,扫描间隔为3 nm。发射波长(Em)范围为240~600 nm,采用电制冷CCD检测器,扫描间隔为3.54 nm。对测得的三维荧光光谱,采用Origin 8.0软件(Origin Lab Inc., USA)进行数据处理,包括利用超纯水去除拉曼散射,消除一、二级瑞丽散射,并同时测量UV-Vis吸光光谱校正内滤效应(inner-filter effect,IFE)。内滤效应的校正公式为Fideal=Fobs×10(AEx+AEm)/2,其中,Fobs和Fideal分别为测量和校正后的荧光强度,以拉曼单位(R. U.)表示;AEx和AEm分别为激发波长和发射波长的吸光度。对处理后的三维荧光光谱,采用SOLO+MIA 8.6.1软件(Eigenvector Research, Inc., USA)进行平行因子分析,并通过核一致性诊断和半劈裂分析(split-half analysis)验证模型。
VFAs检测主要针对乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸。采用岛津GC-2014气相色谱仪(FID,Stabilwax-DA毛细管色谱柱,30 m×φ 0.53 mm×δ 0.25 μm)测定。样品预处理方法:厌氧消化液先用硫酸稀释液酸化,再用高速离心机(转速为10 000 r·min-1,相对离心力为10 278)离心10 min,然后取上清液用0.45 μm孔径亲水性滤膜过滤后装入2 mL样品瓶。
pH值测定采用便携式pH计(LAQN twin, Horiba Scientific, Japan)。VS测定方法:将样品在105 ℃条件下恒重干燥后,在600 ℃马弗炉(MXX1200-30,上海微行炉业有限公司,中国)中灼烧3 h后,计算VS含量。VS含量用于分析秸秆有机物的比例。
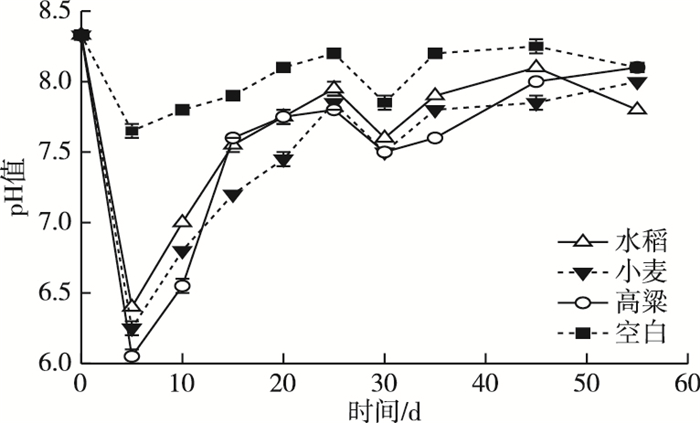
2 结果分析与讨论 2.1 消化液pH变化规律瘤胃液和缓冲液pH值分别为6.87和8.94,接种量φ为20%,混合后初始pH值为8.33。经过5 d厌氧消化后,水稻、小麦和高粱秸秆的消化液pH值分别迅速下降至6.40、6.25和6.05(图 1)。
|
图 1 谷类秸秆厌氧消化过程中pH变化规律 Figure 1 Changes of pH during anaerobic digestion of cereal straw |
消化液pH和总挥发性脂肪酸(total volatile fatty acids,TVFAs)浓度的变化趋势相反(图 2),这表明pH下降主要是由VFAs产生引起的。因此,pH可直接反映产酸性能,并间接反映瘤胃微生物对秸秆的降解能力。有机酸被不断消耗以及消化系统中NH4+的存在,使消化液pH值迅速升高(7.8~8.0)。试验25~30 d时,厌氧消化体系pH再次下降(约为7.5~7.6)。这可能源于部分较难水解酸化的组分(如木质素或被包埋的纤维素)进一步被瘤胃微生物降解。
|
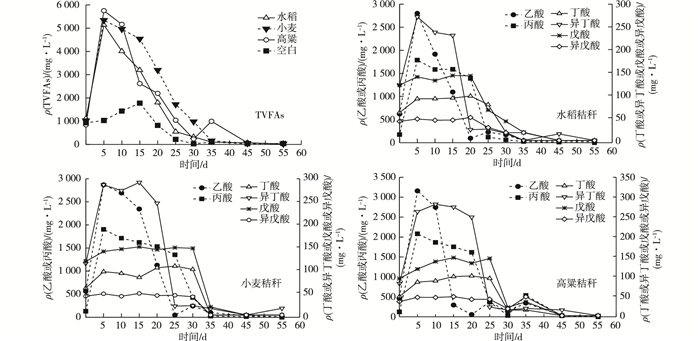
图 2 谷类秸秆厌氧消化过程的总挥发性脂肪酸(TVFAs)和不同挥发性脂肪酸(VFAs)种类变化规律 Figure 2 Changes of TVFAs concentrations and different VFAs species during anaerobic digestion of cereal straw |
谷类秸秆厌氧消化过程的VFAs变化规律见图 2。初始状态下,ρ(TVFAs)为840~1 150 mg·L-1,经过5 d厌氧消化后,水稻、小麦和高粱秸秆的ρ(TVFAs)急剧增加至5 140、5 340和5 751 mg·L-1。这显示出瘤胃微生物可将秸秆有效转化为VFAs,其中,高粱秸秆具有更好的产酸性能。高VFAs浓度并不利于后续的甲烷产生,当ρ(VFAs)超过2 000 mg·L-1时纤维素降解就可能被抑制[14]。空白组TVFAs浓度随厌氧消化的进行,15 d时达到峰值(1 777 mg·L-1),这主要是由于瘤胃中残余物被瘤胃微生物进一步降解导致。随后,产生的TVFAs被产甲烷菌或其他瘤胃微生物迅速降解,30 d后水稻、小麦和高粱秸秆的ρ(TVFAs)分别为325.7、980.7和235.0 mg·L-1。试验结束时,水稻、小麦和高粱秸秆的ρ(TVFAs)分别仅为24.63、26.83和13.88 mg·L-1。
进一步对包括乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸的VFAs种类进行分析。经过5 d厌氧消化后,乙酸和丙酸在VFAs中占据主导作用,水稻、小麦和高粱的ρ(乙酸)分别从621.9、563.0和462.3 mg·L-1上升到2 800、2 868和3 158 mg·L-1,ρ(丙酸)从176.3、131.2和121.3 mg·L-1上升到1 789、1 904和2 081 mg·L-1。异丁酸浓度显著增加,丁酸、戊酸和异戊酸浓度变化很小。不同秸秆的VFAs浓度变化趋势相一致,0~5 d时产生大量乙酸和丙酸,乙酸和丙酸浓度分别在5~25 d和20~30 d内迅速下降。异丁酸主要在0~5 d内产生,而后在15~20 d后被迅速利用。厌氧消化过程的丁酸、戊酸和异戊酸浓度变化规律类似,在20或30 d内小幅波动,而后因上述物质被瘤胃微生物降解而致其浓度逐渐降低。
扣除空白组,水稻、小麦和高粱秸秆(以VS计)在5 d后的TVFAs产率分别达410.9、430.9和472.0 mg·g-1。笔者研究中VFAs产率显著高于水稻秸秆(以VS计)传统厌氧发酵(接种污泥)的0.13~0.29 g·g-1,也明显高于ZHANG等[14]在水稻秸秆(以VS计)接种瘤胃液时测得的0.36 g·g-1。由此可见,笔者采集的奶牛瘤胃微生物对谷类秸秆具有很好的降解性能。这种产酸性能的差异可能源于秸秆组分、矿物元素、颗粒粒度和瘤胃微生物群落结构的差异。其中,水稻秸秆较低的VFAs产率可能在于其具有更低的纤维素和半纤维素组分含量。瘤胃微生物对谷类秸秆的强水解酸化能力,可为秸秆制备工业原料(如有机酸)等资源化利用途径提供潜在方案。
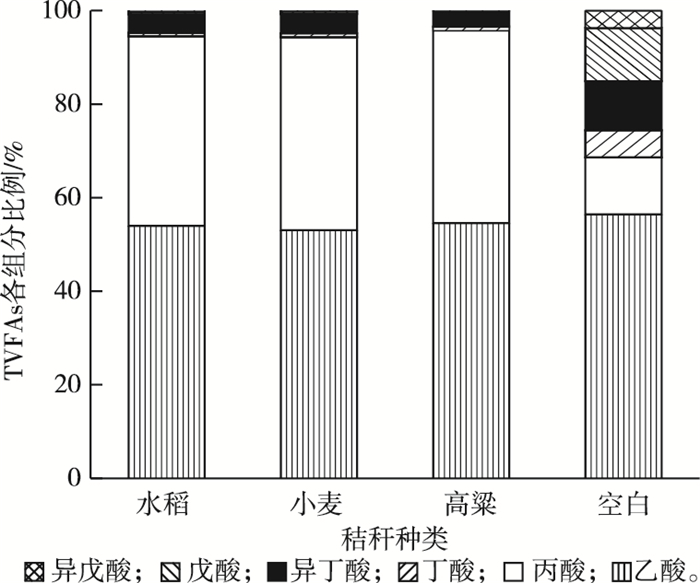
经过5 d厌氧消化后,不同秸秆TVFAs(扣除空白组)的各组分比例见图 3。
|
图 3 谷类秸秆厌氧消化5 d后总挥发性脂肪酸(TVFAs)的组分分布 Figure 3 The components of TVFAs after 5 d anaerobic digestion of cereal straw |
谷类秸秆被瘤胃微生物降解后产生的有机酸质量含量由大到小依次为乙酸(53.1%~54.6%)、丙酸(40.5%~41.4%)和异丁酸(3.3%~4.2%),而丁酸(< 1.0%)、戊酸(< 1.0%)和异戊酸(< 0.5%)所占比例很低。在瘤胃系统中,VFA是反刍动物赖以生存、保持正常代谢和繁殖的主要能量来源,可提供反刍动物70%~80%的总能量,乙酸、丙酸和丁酸质量含量占比可达95%[16]。虽然笔者研究属于体外发酵,环境条件与反刍动物的瘤胃系统存在差异,但乙酸、丙酸和丁酸质量含量与自然瘤胃系统(95.1%~96.5%)一致。而丙酸较难被微生物利用,这是因为利用丙酸的微生物一般具有更慢的生长速度[17]。WANG等[18]发现,当ρ(丙酸)高于900 mg·L-1时将会对产甲烷菌和产酸菌的活性造成不利影响。笔者研究中,厌氧消化初期的ρ(丙酸)高达1 000 ~2 000 mg·L-1,这将严重影响产甲烷菌的正常代谢,与甲烷产量监测结果(图 4)相一致。
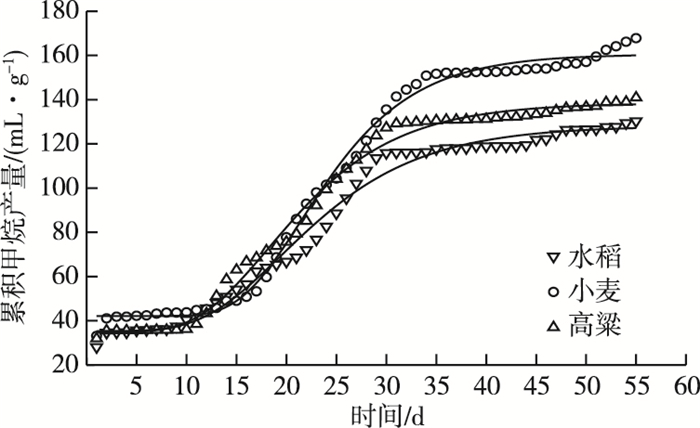
|
图 4 谷类秸秆接种瘤胃液的厌氧消化产甲烷性能 Figure 4 Methane production during anaerobic digestion of cereal straw inoculated with rumen fluid |
各类秸秆(以VS计)厌氧消化过程的甲烷累积产量见图 4。水稻、小麦和高粱秸秆的甲烷产量分别为130.3、167.8和140.9 mL·g-1。扣除空白组,水稻、小麦和高粱的净甲烷产量分别为66.29、103.79和76.89 mL·g -1。水稻秸秆具有更低的甲烷产量,这可能源于更低的TVFAs产率。不同秸秆的甲烷产量差异与纤维物质含量、可发酵的碳水化合物类型和沼气的二氧化碳含量等密切相关。进一步参考LI等[19]的方法,采用改进型Gompertz模型拟合监测到的甲烷产量,如式(1)所示:
| $ B\left( t \right) = {A_0} + {B_0} \times \exp \left\{ {- \exp \left[{\frac{{{\mu _m}e}}{{{B_0}}}\left( {\lambda-t} \right) + 1} \right]} \right\}。$ | (1) |
式(1)中,B(t)为某时刻谷类秸秆(以VS计)厌氧消化过程的累积甲烷产量,mL·g-1;A0为溶解性有机物甲烷累积产量,B0为非溶解性有机物甲烷累积产量,A0和B0之和为总累积甲烷产量,mL·g-1;μm为最大甲烷产率,mL·g-1·d-1;λ为迟缓期,d;e为2.72;t为厌氧消化时间,d。
结果显示,改进型Gompertz模型可较好地描述甲烷的产生规律(表 2),R2为0.989~0.995。
|
|
表 2 谷类秸秆厌氧消化的产甲烷动力学参数 Table 2 Kinetics parameters of methane production for anaerobic digestion of cereal straw |
秸秆粉末(粒径 < 0.15 mm)的可溶解性有机物(如溶解性糖等),可迅速被产甲烷菌利用而消耗,在短时间(2 d)内快速产生大量甲烷,该数值可用A0表示。不同谷类秸秆(以VS计)的A0值相近,为35.36~42.14 mL·g-1。根据改进型Gompertz模型的拟合结果,水稻和高粱的迟缓期λ分别为11.64和11.07 d,而小麦秸秆的λ为15.30 d。小麦秸秆具有更长的迟缓期,这与其更低的乙酸降解速率相一致,可能受高浓度丙酸抑制所致。25 d时,水稻、高粱和小麦ρ(丙酸)分别为121.87、369.24和1 353.2 mg·L-1。水稻、小麦和高粱秸秆的最大甲烷产率μm分别为1.66、2.48和1.79 mL·g-1·d-1。由于小麦秸秆具有更长的迟缓期和更高的甲烷产量,使得其最大甲烷产率μm高于水稻和高粱秸秆。
水稻、小麦和高粱秸秆产甲烷量低的外在原因包括2个方面。一方面,相当部分的碳源被转化为二氧化碳而非甲烷。如水稻、小麦和高粱秸秆在试验5~10 d时的甲烷产量分别仅为4.74、1.56和0.54 mL,而在该过程TVFAs浓度分别降低22%、7%和10%,在55 d厌氧消化期间绝大部分TVFAs均被消耗。另一方面,在厌氧消化系统中,过高的丙酸含量(1 000~2 000 mg·L-1)和VFAs累积抑制了产甲烷菌的活性。内在原因在于以VFAs转化为主要功能的自然瘤胃系统不同于以产甲烷为目的的厌氧消化器。因此,在模拟动物消化机制时,构建可高效降解秸秆并提升厌氧消化性能的人工瘤胃反应器,尤为重要。
MENG等[20]和BÖSKE等[21]提出的上流式厌氧固相(UASS)-厌氧过滤(AF)系统,具有用于构建作物秸秆厌氧消化人工瘤胃反应器的重要潜力。该系统包括一个上流式的固相厌氧反应器(UASS),并耦合一个厌氧过滤器(AF),通过厌氧过滤器的消化液循环,避免VFAs积累。在自然瘤胃的高负荷系统中,瘤胃系统降解的产物通过隔膜被吸收,不会形成产物的累积及抑制,而UASS-AF系统可仿生该行为。仍需进一步探讨人工瘤胃反应器条件下的谷类秸秆厌氧消化产甲烷性能。
2.4 溶解性有机物的荧光光谱-平行因子分析(fluorescence excitation emission matrices-parallel factor analysis,EEM-PARAFAC)笔者利用PARAFAC方法处理采集的40个厌氧消化液样品,包括水稻、小麦和高粱秸秆的30个样品和空白组的10个样品。构建的PARAFAC模型稳健,半劈裂分析显示与整体模型相似度为98.5%,共识别出3个有效组分(图 5)。其中,组分A1为酪氨酸类物质,属于溶解性微生物副产物类物质,激发波长为275 nm,发射波长为300 nm,代表氨基酸或者游离态蛋白质[23]。组分A2为色氨酸类物质,激发波长为280 nm,发射波长为340 nm,属于蛋白类物质。组分A3为低分子量紫外线A波段(ultraviolet A,UVA)腐殖酸类物质[23],激发波长为245 nm,发射波长为430 nm,常见于废水、农田和湿地等环境[23]。
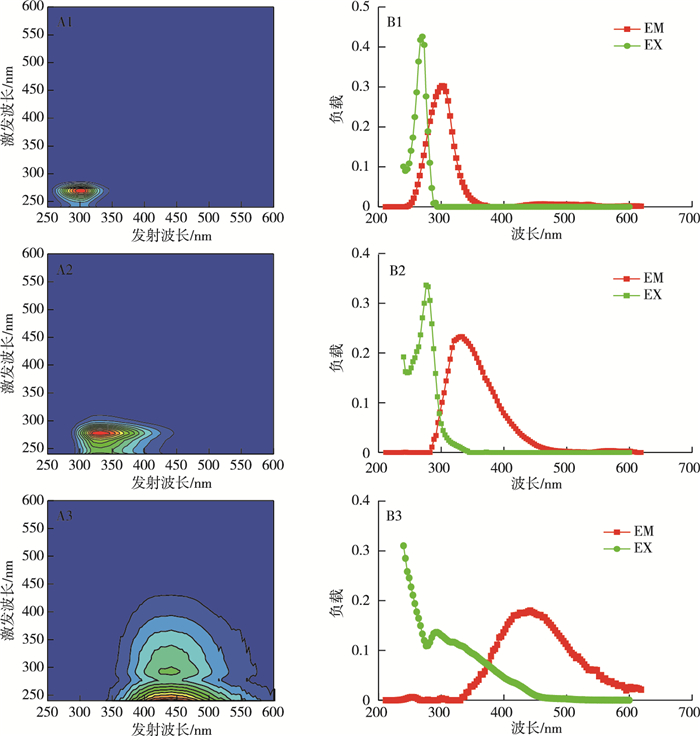
|
图 5 PARAFAC解析出3种组分的代表性荧光光谱(A1、A2和A3)及对应的荧光光谱负载(B1、B2和B3) Figure 5 Representative EEMs (A1, A2 and A3) and florescence spectral loading (B1, B2 and B3)of the three components identified by PARAFAC analysis |
厌氧消化过程的3个组分荧光强度变化规律如图 6所示。对于组分A1酪氨酸类物质,其荧光强度在0~5 d时随着秸秆的水解酸化迅速上升,而后呈逐渐下降趋势,但过程存在波动。组分A2色氨酸类物质,其荧光强度的变化规律与组分A1类似,整体上呈现先上升后下降趋势。同时,发现色氨酸类物质荧光强度和TVFAs浓度可用幂函数拟合,Adj R2为0.813 9(图 7)。这表明色氨酸类物质与谷类秸秆的水解酸化(特别是VFAs的产生和降解)密切相关。对于组分A3腐殖酸类物质,在0~30 d时整体上呈现波动下降趋势,而后进一步上升,趋于稳定。空白组酪氨酸类、色氨酸类和腐殖酸类物质在厌氧消化过程均处于逐渐降低趋势。
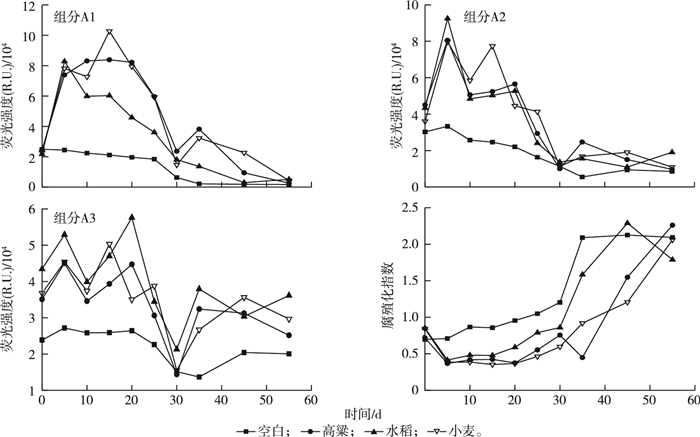
|
图 6 谷类秸秆厌氧消化过程的3个组分荧光强度和腐殖化指数(HIX)的变化规律 Figure 6 Changes of fluorescence intensity of three components and HIX during anaerobic digestion of cereal straw |
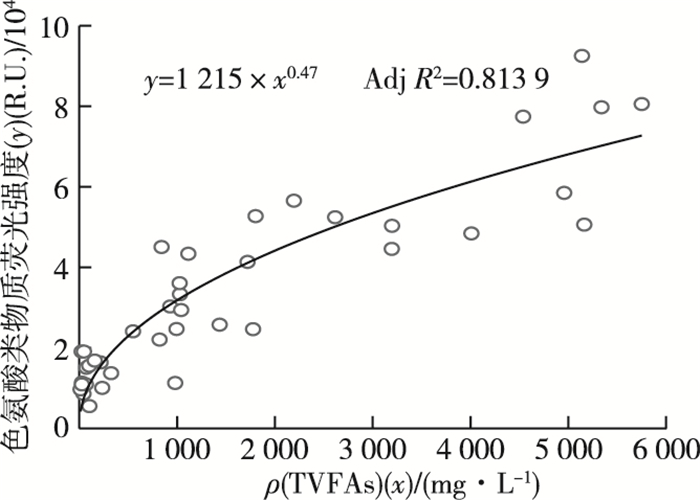
|
图 7 色氨酸类物质荧光强度和总挥发性脂肪酸(TVFAs)浓度的关系 Figure 7 Relation between the fluorescence intensity of tryptophan-like compound and TVFAs concentration |
不同秸秆厌氧消化过程的腐殖化指数(HIX)如图 6所示。HIX可用于评价消化液DOM的芳烃结构聚合程度或者不饱和脂肪族链的共轭程度[24],可表示消化液的腐熟程度[25]。笔者研究中,测得的HIX均小于4,这表明DOM均来源于原生或微生物降解[26]。空白组HIX在0~30 d时随时间变化由0.70逐渐上升至1.20,30~35 d时大幅上升至2.09,而后趋于稳定。在30~35 d时空白组消化液迅速腐殖化,而该阶段消化液VFAs浓度很低,这可能是由于DOM的非有机酸组分被迅速转化为芳烃结构聚合度更高的物质。水稻、小麦和高粱秸秆在厌氧消化初期HIX下降,这归因于秸秆被高效水解酸化为VFAs,而后随着VFAs的逐渐降解,HIX整体上呈现逐渐上升趋势。不同谷类秸秆HIX变化趋势相一致。高粱秸秆在30~35 d时以及水稻秸秆在45~55 d时,HIX的下降可能是由于少量木质素或包埋纤维素被瘤胃微生物分解所致。
总体上,消化液的腐殖化进程与VFAs的产生和降解利用密切相关,HIX和TVFAs浓度的关系可用幂函数拟合(图 8),Adj R2为0.802 1。这显示在一定程度上可采用腐殖化指数来监控谷类秸秆的厌氧消化进程以及VFAs降解规律。
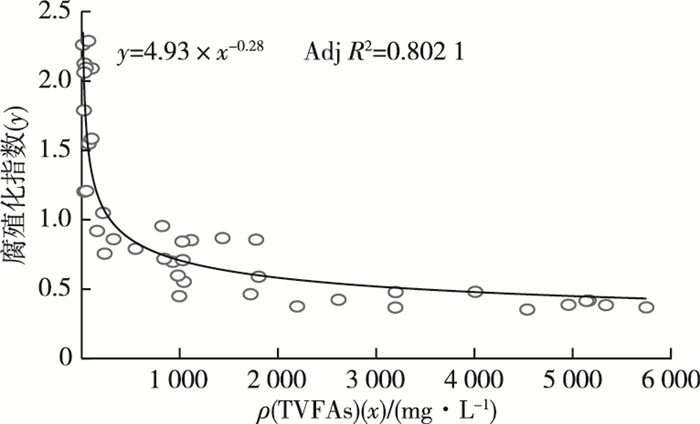
|
图 8 腐殖化指数和TVFAs浓度的关系 Figure 8 Relation between the humification index and TVFAs concentration |
(1) 奶牛瘤胃微生物对谷类秸秆具有很强的水解酸化能力。经过5 d厌氧消化后,水稻、小麦和高粱秸秆(以VS计)的总挥发性脂肪酸产率分别达410.9、430.9和472.0 mg·g-1。谷类秸秆的产甲烷规律符合改进型Gompertz模型。经过55 d厌氧消化,水稻、小麦和高粱秸秆(以VS计)的甲烷产量分别为66.29、103.79和76.89 mL·g-1。
(2) 通过三维荧光光谱耦合平行因子分析(PARAFAC)识别溶解性有机物的3个有效荧光组分,这3个组分分别为酪氨酸类、色氨酸类和低分子量腐殖酸类物质。其中,色氨酸类物质的荧光强度与TVFAs浓度呈幂函数关系。经过5 d厌氧消化后谷类秸秆溶解性有机物的腐殖化指数(HIX)降低,而后呈现逐渐上升趋势。
| [1] |
RAGAUSKAS A J, WILLIAMS C K, DAVISON B H, et al. The Path Forward for Biofuels and Biomaterials[J]. Science, 2006, 311(5760): 484-489. DOI:10.1126/science.1114736 (  0) 0) |
| [2] |
HENDRIKS A T W M, ZEEMAN G. Pretreatments to Enhance the Digestibility of Lignocellulosic Biomass[J]. Bioresource Technology, 2009, 100(1): 10-18. DOI:10.1016/j.biortech.2008.05.027 (  0) 0) |
| [3] |
YUE Z B, LI W W, YU H Q. Application of Rumen Microorganisms for Anaerobic Bioconversion of Lignocellulosic Biomass[J]. Bioresource Technology, 2013, 128: 738-744. DOI:10.1016/j.biortech.2012.11.073 (  0) 0) |
| [4] |
FU S F, WANG F, YUAN X Z, et al. The Thermophilic (55℃) Microaerobic Pretreatment of Corn Straw for Anaerobic Digestion[J]. Bioresource Technology, 2015, 175: 203-208. DOI:10.1016/j.biortech.2014.10.072 (  0) 0) |
| [5] |
SURENDRA K C, TAKARA D, HASHIMOTO A G, et al. Biogas as a Sustainable Energy Source for Developing Countries:Opportunities and Challenges[J]. Renewable and Sustainable Energy Reviews, 2014, 31: 58-64. (  0) 0) |
| [6] |
SAWATDEENARUNAT C, SURENDRA K C, TAKARA D, et al. Anaerobic Digestion of Lignocellulosic Biomass:Challenges and Opportunities[J]. Bioresource Technology, 2015, 178: 178-186. DOI:10.1016/j.biortech.2014.09.103 (  0) 0) |
| [7] |
胡真虎.纤维素类废弃物微生物转化技术和机制的研究[D].合肥: 中国科学技术大学, 2005.
(  0) 0) |
| [8] |
YANG L C, XU F Q, GE X M, et al. Challenges and Strategies for Solid-State Anaerobic Digestion of Lignocellulosic Biomass[J]. Renewable and Sustainable Energy Reviews, 2015, 44: 824-834. DOI:10.1016/j.rser.2015.01.002 (  0) 0) |
| [9] |
VIVEKANAND V, RYDEN P, HORN S J, et al. Impact of Steam Explosion on Biogas Production From Rape Straw in Relation to Changes in Chemical Composition[J]. Bioresource Technology, 2012, 123: 608-615. DOI:10.1016/j.biortech.2012.06.088 (  0) 0) |
| [10] |
ZHU S D. Use of Ionic Liquids for the Efficient Utilization of Lignocellulosic Materials[J]. Journal of Chemical Technology and Biotechnology, 2008, 83(6): 777-779. DOI:10.1002/(ISSN)1097-4660 (  0) 0) |
| [11] |
MILLER T L, WOLIN M J. Inhibition of Growth of Methane-Producing Bacteria of the Ruminant Forestomach by Hydroxymethylglutaryl-Scoa Reductase Inhibitors[J]. Journal of Dairy Science, 2001, 84(6): 1445-1448. DOI:10.3168/jds.S0022-0302(01)70177-4 (  0) 0) |
| [12] |
HU Z H, YU H Q. Application of Rumen Microorganisms for Enhanced Anaerobic Fermentation of Corn Stover[J]. Process Biochemistry, 2005, 40(7): 2371-2377. DOI:10.1016/j.procbio.2004.09.021 (  0) 0) |
| [13] |
岳正波, 胡真虎, 俞汉青.玉米秸秆在人工瘤胃反应器中的厌氧转化[C]//循环经济理论和实践: 长三角循环经济论坛暨2006年安徽博士科技论坛论文集.合肥: 安徽大学出版社, 2006: 406-410.
(  0) 0) |
| [14] |
ZHANG H O, ZHANG P Y, YE J, et al. Improvement of Methane Production From Rice Straw With Rumen Fluid Pretreatment:A Feasibility Study[J]. International Biodeterioration & Biodegradation, 2016, 113: 9-16. (  0) 0) |
| [15] |
PARK G W, SEO C, JUNG K, et al. A Comprehensive Study on Volatile Fatty Acids Production From Rice Straw Coupled With Microbial Community Analysis[J]. Bioprocess and Biosystems Engineering, 2015, 38(6): 1157-1166. DOI:10.1007/s00449-015-1357-z (  0) 0) |
| [16] |
巴桑珠扎, 陈亮, 奥斯曼, 等. 西藏地区不同作物秸秆体外发酵特性研究[J]. 动物营养学报, 2017, 29(2): 719-728. [ BASANGZHUZA, CHEN Liang, AOSIMAN, et al. Study on in Vitro Fermentation Characteristics of Different Crop Straws in Tibet Region[J]. Chinese Journal of Animal Nutrition, 2017, 29(2): 719-728. DOI:10.3969/j.issn.1006-267x.2017.02.042] (  0) 0) |
| [17] |
ZHANG Q H, HE J, TIAN M, et al. Enhancement of Methane Production From Cassava Residues by Biological Pretreatment Using a Constructed Microbial Consortium[J]. Bioresource Technology, 2011, 102(19): 8899-8906. DOI:10.1016/j.biortech.2011.06.061 (  0) 0) |
| [18] |
WANG Y Y, ZHANG Y L, WANG J B, et al. Effects of Volatile Fatty Acid Concentrations on Methane Yield and Methanogenic Bacteria[J]. Biomass and Bioenergy, 2009, 33(5): 848-853. DOI:10.1016/j.biombioe.2009.01.007 (  0) 0) |
| [19] |
LI Y Q, FENG L, ZHANG R H, et al. Influence of Inoculum Source and Pre-Incubation on Bio-Methane Potential of Chicken Manure and Corn Stover[J]. Applied Biochemistry and Biotechnology, 2013, 171(1): 117-127. DOI:10.1007/s12010-013-0335-7 (  0) 0) |
| [20] |
MENG Y, JOST C, MUMME J, et al. Oxygen Tolerance Capacity of Upflow Anaerobic Solid-State (UASS) With Anaerobic Filter (AF) System[J]. Journal of Environmental Sciences, 2016, 45: 200-206. DOI:10.1016/j.jes.2016.01.009 (  0) 0) |
| [21] |
BÖSKE J, WIRTH B, GARLIPP F, et al. Anaerobic Digestion of Horse Dung Mixed With Different Bedding Materials in an Upflow Solid-State (UASS) Reactor at Mesophilic Conditions[J]. Bioresource Technology, 2014, 158: 111-118. DOI:10.1016/j.biortech.2014.02.034 (  0) 0) |
| [22] |
MUMME J, LINKE B, TÖLLE R. Novel Upflow Anaerobic Solid-State (UASS) Reactor[J]. Bioresource Technology, 2010, 101(2): 592-599. DOI:10.1016/j.biortech.2009.08.073 (  0) 0) |
| [23] |
GAO J K, LIANG C L, SHEN G Z, et al. Spectral Characteristics of Dissolved Organic Matter in Various Agricultural Soils Throughout China[J]. Chemosphere, 2017, 176: 108-116. DOI:10.1016/j.chemosphere.2017.02.104 (  0) 0) |
| [24] |
HUR J, LEE B M, SHIN H S. Microbial Degradation of Dissolved Organic Matter (DOM) and Its Influence on Phenanthrene-DOM Interactions[J]. Chemosphere, 2011, 85(8): 1360-1367. DOI:10.1016/j.chemosphere.2011.08.001 (  0) 0) |
| [25] |
FU P Q, KAWAMURA K, CHEN J, et al. Fluorescent Water-Soluble Organic Aerosols in the High Arctic Atmosphere[J]. Scientific Reports, 2015, 5: 9845. DOI:10.1038/srep09845 (  0) 0) |
| [26] |
BIRDWELL J E, ENGEL A S. Characterization of Dissolved Organic Matter in Cave and Spring Waters Using UV-Vis Absorbance and Fluorescence Spectroscopy[J]. Organic Geochemistry, 2010, 41(3): 270-280. DOI:10.1016/j.orggeochem.2009.11.002 (  0) 0) |




