2. 环境保护部南京环境科学研究所生态保护与气候变化研究中心, 江苏 南京 210042;
3. 盐城师范学院江苏省盐土生物资源研究重点实验室/江苏滩涂生物农业协同创新中心, 江苏 盐城 224002
2. Research Center for Ecological Protection and Climate Change Response, Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210042, China;
3. Jiangsu Provincial Key Laboratory of Bio-resources for Coastal Saline Soils, Yancheng Teachers'University/Jiangsu Cooperative Innovation Center for Coastal Bio-agriculture, Yancheng 224002, China
生物质炭是生物质在无氧或缺氧条件下的热解产物,其化学组成以芳香烃等结构复杂的稳定有机化合物为主,比表面积大,吸附性强[1-2]。生物质炭中有机碳的难分解性一直受到关注,在土壤中存留期可达数百至千年尺度[3]。因此,一些学者提出可将地球上的一般生物质转化为生物质炭,从而起到固定大气中CO2、缓解全球气候变化[4-5]的作用。将生物质炭施入土壤,可改善土壤理化性质,如提升土壤有机质水平,增强土壤的持水性能和营养固持能力,提高作物产量[6-7]。因此,将生物质热解转化为生物质炭并用作土壤添加剂,可能具有缓解全球气候变化、改良土壤的双重作用。生物质炭施加对土壤系统的影响已成为当前土壤科学研究的热点之一,对此的全面深入了解是未来大规模应用生物质炭的前提。
到目前为止,关于生物质炭对土壤碳稳定关键过程的影响还存在较大的不确定性[5, 8-11],这制约了生物质炭的大规模推广应用。有研究认为,生物质炭施入土壤后,不仅以其自身的难分解性而迅速地提升土壤有机质水平,并可能提升土壤中原有有机碳(native soil organic carbon,nSOC),即有机碳中非生物质炭部分的稳定性,从而抑制nSOC分解[5, 10],提高土壤SOC含量。但也有研究提出,施加生物质炭减少了土壤中稳定有机质或一些活性碳组分的损失[9, 12]。生物质炭对土壤碳过程的影响与生物质炭-土壤矿质的相互作用有关,如生物质炭可能促进土壤团聚体的形成,从而增强团聚体对nSOC或生物质炭本身的包裹[13],即增加土壤对有机碳的物理保护作用[14];生物质炭可能与土壤矿质形成某种形式的有机-无机复合体[15-16];生物质炭表面还可能直接吸附土壤腐殖酸等有机分子[17],进而影响nSOC稳定性。整体而言,生物质炭对土壤碳过程的影响具有较强的不确定性。
欲表征生物质炭对土壤碳稳定的影响,可以通过物理或化学分组方法,将施加生物质炭后的土壤分为不同组分;进一步分析nSOC和生物质炭在各组分中的分布[7, 13-14, 18],还可以研究所获得的土壤碳组分的分解动态[19]。不同的物理或化学分组方法获得的土壤碳组分可能对应于不同的碳稳定机制[20-21],相比之下,物理分组方法由于破坏性小而成为近些年来研究土壤有机碳组分的主流方法。为此,笔者采用土壤物理分组方法,从田间施加生物质炭1 a后的水稻土中分离出不同的碳组分,分析生物质炭对这些不同土壤碳组分及其分解动态的影响,以探讨生物质炭是否促进了土壤碳稳定。
1 材料与方法 1.1 研究地概况研究地位于上海市崇明岛(31°27′~31°5l′ N,121°09′~121°54′ E)东端的前哨农场。崇明岛属北亚热带季风气候区,年均温为15.3 ℃,降水量为1 003.7 mm。前哨农场于20世纪60年代由滩涂围垦形成。选取前哨农场典型稻-麦轮作农田,其种植水稻年限已逾40 a。土壤类型为粉砂质水稻土。
1.2 田间试验设计及土壤采集为了区分生物质炭来源的SOC与nSOC,生物质炭用C4植物玉米秸秆制备;由此,基于生物质炭与土壤nSOC(来源于C3植物)稳定性碳同位素组成的差异,可区分两者对土壤碳组分及其分解的贡献。所施加的生物质炭购自无锡明燕集团有限公司,由玉米(C4植物)芯在350~550 ℃条件下用干馏法烧制而成。生物质炭购回后用脱粒机粉碎并过2 mm孔径筛,用旋耕机使生物质炭均匀分布于深度为15 cm的耕层中。田间试验设置3个处理(每个处理设置4个重复样方):(1)对照(CK),不施加生物质炭;(2)生物质炭施加率为40 t·hm-2(BL);(3)生物质炭施加率为100 t·hm-2(BH)。添加试验在2014年6月25日水稻播种前完成。生物质炭施加于夏季水稻种植前,而稻田灌溉水及夏季暴雨引起的表面径流作用,使得生物质炭颗粒可能存在流失[22]。
土壤样品采集时间为生物质炭施加后1 a,即1个水稻-小麦轮作周期后。用土壤取样器(直径为8 cm,取样深度为15 cm)取样,在每个处理的4个样方中共设置12~18个取样点,但各取样点非均匀分布于各样方中,这是由于土壤翻耕造成生物质炭在田间分布不均,仅在生物质炭露出土表较明显的地方取样。将来自4~6个取样点的土壤(分布于1~2个样方)合并成1个混合样;以上过程重复3次,每个处理形成3个混合样。土样带回实验室后混合均匀,过2 mm孔径筛,剔除肉眼可见的石砾、植物根系和土壤动物等,取少量土壤测定pH、全碳(TC)含量和全氮(TN)含量等理化指标;其余土壤贮存于4 ℃条件下备用。生物质炭处理后的土壤性质见表 1。
|
|
表 1 生物质炭和土壤的基本理化性质及同位素组成 Table 1 Basic physio-chemical properties and isotopic composition of soil and biochar |
所用土壤碳分组程序参考SIX等[23]和STEMMER等[24]的研究。分组流程概述如下:(1)取过2 mm孔径筛土壤(田间湿度)50 g,加入去离子水100 mL,低能量(50 J·s-1)超声振荡2 min;(2)用湿筛法,将超声振荡后的土壤依次过250和50 μm孔径筛,留在筛上的土壤分别为>250~2 000 μm(mAgg)和>50~250 μm(μAgg)粒径团聚体;(3)用筛分仪(Analysette 3,Fritsch,德国)将上述过筛后的土-水悬液过20 μm孔径筛,留在筛上的为20~50 μm粒径粉粒(c_S);(4)将上述通过筛分仪的土-水悬液进行高速离心(7 500 r·min-1,离心半径为5.5 cm),离心所得组分为 < 20 μm粒径土壤颗粒(μ_S+C);(5)取上述各步骤所得土壤组分适量(1~2 g),加入NaI重液(1.85 g·cm-3),轻微摇动混匀,离心(2 000 r·min-1,离心半径为11 cm)5 min;沉淀于管底的为重组分(HF),浮于液面上的为轻组分(游离的颗粒有机物,fPOM)。
收集以上所得土壤组分,取部分烘干、称重,用于土壤碳含量及碳稳定同位素分析;剩余土壤在室温条件下晾至近田间湿度(60%~70%)后,贮存于4 ℃条件下备用。
1.4 土壤组分培养称取上述分组所得土壤组分(田间湿度)适量(除mAgg组分称取2 g以外,其余组分皆称取10 g),置于150 mL(mAgg)和500 mL(μAgg、c_S、μ_S+C)培养瓶中,用去离子水调节至60%最大持水量。用丁基橡胶塞密封培养瓶,瓶塞上插入三通阀,用于在培养过程中抽取气体。所有样品在25 ℃条件下预培养5 d。
土壤呼吸产生的CO2及稳定性碳同位素丰度(δ13C)测定:在正式培养第1~3、4~7、8~14和15~28天,将培养瓶密闭,每次密闭开始和结束时分别从培养瓶中取15 mL顶空气体,取气后立即向培养瓶中注入同样体积的无CO2空气。将所取15 mL气体样品注入同位素碳分析仪PICARRO(G220-1, Istapic CO2/CH4,美国),直接测定其CO2浓度和δ13C。每次密闭后,将瓶塞打开以通入新鲜空气,避免造成土壤厌氧环境。以上培养仅针对CK和BH处理进行。
1.5 土壤有机碳及其同位素组成分析由于所用土壤含有一定量碳酸盐,在对土壤组分的有机碳和碳同位素组成进行分析之前,必须预先去除土壤中的无机碳。为此,参考RAMNARINE等[25]所用的盐酸熏蒸法,取0.2 g土壤置于瓷舟中,与约50 mL盐酸一起放入真空干燥器内;用气泵对真空干燥器抽真空,使盐酸沸腾,然后密闭真空干燥器。熏蒸24 h后取出土壤,将土壤转移至滤纸上,用抽滤法充分洗涤,使土壤pH接近中性。所得土壤烘干并研磨,用同位素质谱仪(MAT 253,Thermo Finnigan,美国)测定稳定性碳同位素组成(δ13C精度:±0.20‰);土壤有机碳含量由与同位素质谱仪偶联的元素分析仪测定得到。
1.6 数据分析土壤稳定性碳同位素丰度(δ13C,‰)计算公式为
| $ {\delta _{^{13}{\text{C}}, {\text{sample}}}} = \left( {{R_{{\text{sample}}}}/{R_{{\text{V}}-{\text{PDB}}}}-1} \right) \times 1\;000。$ | (1) |
式(1)中,Rsample为样品的13C/12C比值;RV-PDB为国际标准品V-PDB(Vienna Pee Dee Belemnite standard)的13C/12C比值[26]。
土壤中生物质炭和nSOC的质量比例计算公式为
| $ {\delta _{^{13}{\text{C, TSOC}}}} = {f_{{\text{BC}}}} \times {\delta _{^{13}{\text{C, BC}}}} + {f_{{\text{nSOC}}}} \times {\delta _{^{13}{\text{C, nSOC}}}}, $ | (2) |
| $ {f_{{\text{BC}}}} + {f_{{\text{nSOC}}}} = 1。$ | (3) |
式(2)~(3)中,δ13C, TSOC、δ13C, BC和δ13C, nSOC分别为土壤总有机碳、生物质炭和nSOC的δ13C,‰;fBC和fnSOC分别为土壤总有机碳中生物质炭和nSOC质量比例,%。
基于土壤全土或某组分的有机碳含量及其中生物质炭的比例,可以计算出其中生物质炭含量。下文中所有生物质炭含量的表示均基于全土而非土壤组分的质量。
在土壤碳组分培养过程中,某时间段内土壤呼吸所产生的CO2量计算方法为
| $ R = \frac{1}{{22.4}} \times \frac{{{T_0}}}{T} \times \frac{{\Delta C \times V}}{M}。$ | (4) |
式(4)中,R为土壤组分CO2产生量,μg·g-1;22.4为标准状态下气体摩尔体积,L·mol-1;T为取气样时培养瓶内绝对温度,298.15 K;T0为标准状态下空气绝对温度,273.15 K;ΔC为培养瓶内CO2质量浓度在某时间段内增加值,mg·m-3;V为培养瓶内空气体积,L;M为培养土样的干重,g。土壤组分的呼吸累积量由CO2产生量随时间累加而得到。
在土壤碳组分培养过程中,某密闭时间段内土壤呼吸的δ13C计算公式为
| $ {\delta _{^{13}{\text{C}}, R}} = \frac{{\left( {{C_1} \times {\delta _{^{13}{\text{C1}}}}-{C_0} \times {\delta _{^{13}{\text{C0}}}}} \right)}}{{{C_1}-{C_0}}}。$ | (5) |
式(5)中,δ13C, R为某密闭时间段内土壤呼吸的δ13C,‰;δ13C1、δ13C0分别为密闭后、密闭前培养瓶内气体的δ13C,‰;C1、C0分别为密闭后、密闭前培养瓶内CO2质量浓度,mg·m-3。
采用单因素方差分析方法分析生物质炭施加对土壤理化性质、不同组分碳含量及同位素组成以及土壤呼吸及同位素组成的影响。所有统计分析均用SPSS 19.0软件完成。
2 结果与分析 2.1 土壤组分分布及碳含量土壤物理分组结果显示,各粒级中 < 20 μm的细粉黏粒组分(μ_S+C)质量含量最高(平均为49%);其后依次为>50~250 μm粒级的微团聚体(μAgg,平均为22%)和20~50 μm粒级的粗粉粒(c_S,平均为23%);>250~2 000 μm粒级的大团聚体(mAgg)质量含量最低,平均仅为6%。生物质炭的施加未显著改变各粒级土壤组分的分布(F=0.25,P=0.78;图 1)。
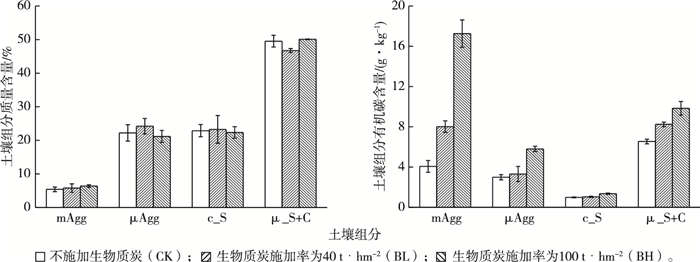
|
图 1 土壤组分分布和各组分有机碳含量 Figure 1 Distribution of soil fractions and organic carbon contents of various fractions mAgg为>250~2 000 μm粒径团聚体,μAgg为>50~250 μm粒径团聚体,c_S为20~50 μm粒径粗粉粒,μ_S+C为 < 20 μm粒径土壤颗粒。 |
然而,生物质炭的施加显著增加了土壤团聚体(mAgg、μAgg)及 < 20 μm粒级(μ_S+C)土壤组分的有机碳含量(图 1)。对于mAgg和μ_S+C,各处理有机碳含量由高到低依次为BH、BL和CK(mAgg:F=50.01,P < 0.01;μ_S+C:F=12.85,P < 0.05);对于μAgg,各处理有机碳含量由高到低依次为BH>BL≈CK(F=17.79,P < 0.01)。
2.2 土壤不同组分中生物质炭含量土壤不同组分的δ13C及生物质炭含量见图 2。
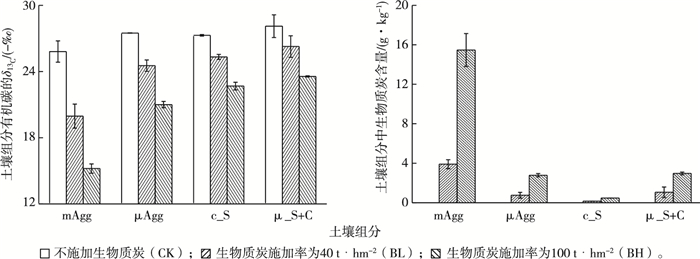
|
图 2 土壤不同组分的δ13C及生物质炭含量 Figure 2 The δ13C values and biochar contents of different soil fractions mAgg为>250~2 000 μm粒径团聚体,μAgg为>50~250 μm粒径团聚体,c_S为20~50 μm粒径粗粉粒,μ_S+C为 < 20 μm粒径土壤颗粒。 |
对土壤各组分的稳定性碳同位素分析表明,生物质炭的施加显著改变了各碳组分的δ13C,且各处理所有组分中δ13C由大到小依次均为BH、BL和CK(F=120.47,P < 0.01;图 2),即生物质炭的施加使所有组分更易于富集13C。
基于同位素及有机碳分析的计算结果(图 2)显示,生物质炭含量以土壤大团聚体(mAgg)为最高,其中BL、BH处理该粒级生物质炭平均含量分别为3.9和15.5 g·kg-1,分别占该粒级总有机碳含量的55%和90%;微团聚体与细粉黏粒组分中生物质炭含量仅次于mAgg;生物质炭含量以c_S组分(20~50 μm)为最低。各粒级土壤组分中,生物质炭含量均随施加率的增加而增加。
2.3 按密度分离对土壤组分中生物质炭含量的影响为了解各粒级中生物质炭与土壤矿质结合的紧密程度,对各粒级土壤组分用NaI重液(密度为1.85 g·cm-3)按密度进行分离,并对分离后的土壤组分的同位素组成和有机碳含量进行分析。结果(图 3)表明,按密度分离后,大团聚体(mAgg)中生物质炭含量降低最明显,其他各粒级生物质炭含量也有不同程度的下降。在mAgg、μAgg和c_S这3个组分中,按密度分离后的生物质炭含量相当于分离前的4%、21%和35%。
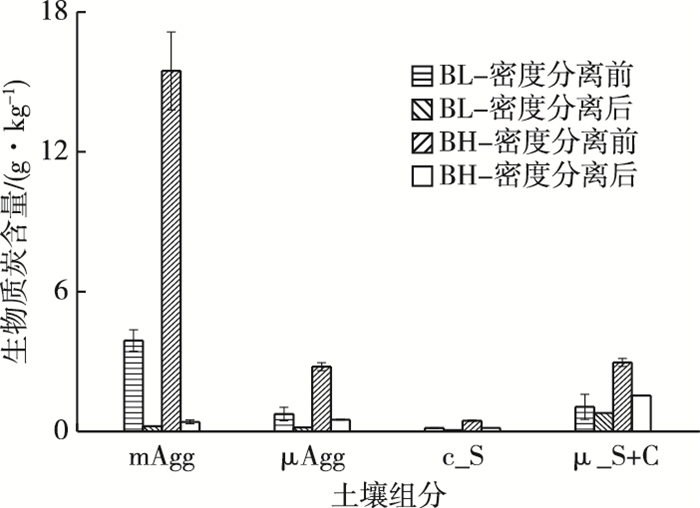
|
图 3 土壤不同组分按密度分离前后的生物质炭含量 Figure 3 Biochar contents in different soil fractions before and following density separation mAgg为>250~2 000 μm粒径团聚体,μAgg为>50~250 μm粒径团聚体,c_S为20~50 μm粒径粗粉粒,μ_S+C为 < 20 μm粒径土壤颗粒;BL和BH分别指生物质炭施加率为40和100 t·hm-2。 |
按密度分离使得细粉黏粒组分(μ_S+C)生物质炭含量降低幅度最小,仅为25%~48%。按密度分离后,mAgg、μAgg和c_S组分中生物质炭的碳含量均低于土壤总有机碳含量的2%;μ_S+C组分中生物质炭的碳含量最高,为土壤总有机碳含量的3.8%~4.6%。
对大团聚体和微团聚体按密度分离后的轻组分(fPOM, 团聚体外游离的颗粒有机物)和重组分(HF,即除去fPOM后的剩余部分)进行分析。δ13C的计算结果(图 4)表明,两种团聚体组分的生物质炭均主要分布于fPOM中(占fPOM碳含量的65%~93%),且fPOM中生物质炭含量随施加率的增加而增加。HF中生物质炭含量极低,仅相当于其总有机碳含量的7%~15%。事实上,就全土而言,生物质炭主要存在于fPOM中(图 2、图 4)。BL处理两个粒级团聚体fPOM中生物质炭含量合计占全土生物质炭总量的82%,BH处理的这一比例为85%。大团聚体中fPOM生物质炭含量远高于微团聚体。
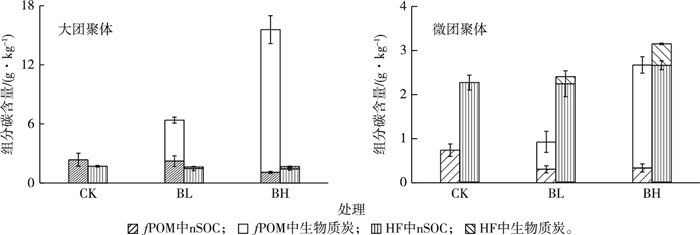
|
图 4 土壤大团聚体和微团聚体中游离颗粒有机物(fPOM)及重组分(HF)中生物质炭与土壤原有有机碳(nSOC)含量 Figure 4 Contents of biochar and nSOC in free particulate organic matter (fPOM) and heavy fraction (HF) of soil macroaggregates and microaggregates CK为不施加生物质炭,BL和BH分别指生物质炭施加率为40和100 t·hm-2。 |
由图 4可知,生物质炭施加有降低大团聚体和微团聚体fPOM中nSOC含量的趋势。这对于大团聚体尤其明显,BH处理该组分fPOM中nSOC含量为0.9~1.1 g·kg-1,明显低于对照土壤nSOC(1.6~3.7 g·kg-1)。然而,对于HF而言,生物质炭施加对nSOC含量的影响趋势不明显。
2.4 土壤不同组分的分解动态图 5显示,土壤呼吸在各组分间有显著差异。培养28 d时,CK处理各碳组分土壤呼吸累积量由大到小依次为μAgg>mAgg≈μ_S+C≈c_S(F=15.89,P < 0.01),BH处理各碳组分土壤呼吸累积量由大到小依次为mAgg>μAgg>μ_S+C≈c_S(F=32.22,P < 0.01)。可见,总体而言,两个粒级团聚体的土壤呼吸高于其他两个组分,20~50 μm碳组分平均呼吸累积量在所有碳组分中为最低。
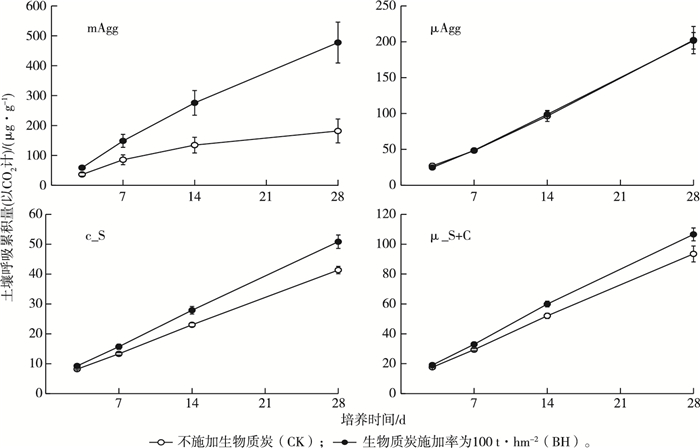
|
图 5 土壤不同碳组分培养过程中CO2累积产生量 Figure 5 Cumulative CO2 production during the incubation of different soil fractions mAgg为>250~2 000 μm粒径团聚体,μAgg为>50~250 μm粒径团聚体,c_S为20~50 μm粒径粗粉粒,μ_S+C为 < 20 μm粒径土壤颗粒。 |
生物质炭的施加显著增加了各碳组分的土壤呼吸累积量(F=22.84,P < 0.01)。尤其对于mAgg组分,生物质炭施加使呼吸累积量增加163%(图 5);对于μ_S+C和c_S组分,土壤呼吸量仅有微弱增加。与其他3个组分不同的是,微团聚体(μAgg)土壤累积呼吸量在不同处理间并无显著差异(F=0.07,P>0.05;图 5)。
对土壤培养产生的CO2碳同位素组成进行分析。方差分析结果(表 2)表明,CO2的δ13C在CK和BH处理间基本无显著差异。根据式(2)~(3),可以认为笔者研究中土壤CO2均主要来自原有有机碳(nSOC)。仅μAgg组分所产生CO2的δ13C呈现CK(-26.85‰)> BH(-27.42‰)的趋势。这可能是由于实验操作或数据处理过程中产生的误差所致,而非生物质炭的真实效应。由于生物质炭本身的δ13C高于nSOC,生物质炭如存在较强的分解,理论上应使施加生物质炭后的土壤更易于富集13C。总之,以上结果表明各处理土壤碳组分所产生的CO2基本来自nSOC,生物质炭本身分解极其微弱,其对CO2释放的贡献可以忽略不计。
|
|
表 2 土壤培养过程中CO2碳同位素组成的双因素方差分析 Table 2 Two-way ANOVA of δ13C of different soil fractions during incubation |
对土壤各组分短期培养后的KMnO4-易氧化碳含量的分析表明,土壤组分间易氧化碳含量差异显著,呈mAgg >μ_S+C≈μAgg>c_S的顺序(表 3)。生物质炭对mAgg、μAgg和c_S组分易氧化碳含量的影响均不显著,但却显著降低μ_S+C组分易氧化碳含量(F=7.73,P < 0.05)。
|
|
表 3 2种处理土壤不同组分易氧化碳含量 Table 3 Contents of KMnO4-oxidizable carbon of soil fractions under CK and BH treatments |
生物质炭与土壤矿质的结合形式决定其对土壤碳稳定的影响状况。生物质炭进入土壤后,可能的存在形式包括:(1)以游离生物质炭颗粒形式存在[18, 27];(2)作为团聚体的黏合剂(binding agent),促进土壤团聚体的形成而被团聚体所包裹[13];(3)生物质炭颗粒与土壤矿质通过静电力、氢键和离子桥等作用力,形成有机-无机复合体[16]。笔者通过土壤颗粒分组,并结合对团聚体组分的按密度分离方法得到的结果表明,生物质炭施入新成土发育的稻田土1 a后,大部分(76%~90%)以游离颗粒碳形式附着于>250~2 000和>50~250 μm这两个粒级团聚体以外(图 2、图 4);仅有3%~7%的生物质炭与团聚体结合较为紧密,可能已进入团聚体内。这与HERATH等[18]的研究结果一致,他们基于同位素分析,同样发现生物质炭施加295 d后,77%~94%的生物质炭以游离颗粒态形式存在于团聚体外。
笔者研究及HERATH等[18]的结果与BRODOWSKI等[14]报道的较多黑炭(>20%)积累于土壤团聚体内的现象不同,这可能是由于BRODOWSKI等[14]观察到的现象发生于数十年的耕作过程中,而当前的生物质炭施加试验大多仅持续数年。
值得注意的是,笔者的研究结果也显示,在细粉黏粒组分(< 20 μm)所含的生物质炭中,有52%~75%不能通过按密度分离的方法与土壤矿质分开,表明在该粒级中生物质炭与土壤矿质的结合较为紧密。生物质炭可能与土壤矿质、有机物发生疏水或亲水性的相互作用,形成有机-无机复合体[16]。如GLASER等[15]用扫描电镜观察发现,黑炭可嵌入铁、铝氧化物形成的结核中。笔者研究中是否形成了生物质炭-矿质复合体,尚需进一步研究。
3.2 生物质炭对新成土发育的稻田土壤碳组分分解的影响13C同位素分析表明,土壤组分培养过程中所产生的CO2基本来自非生物质炭的部分,即土壤原有有机碳(nSOC),生物质炭本身的分解极其微弱(表 2)。这与以往研究所报道的生物质炭在土壤中的分解动态是一致的。如LUO等[28]发现,将C4植物材料制备的生物质炭添加入土壤(C3)后培养,1个月后生物质炭本身的分解速率已经很低。KUZYAKOV等[3]及笔者所在课题组将14C标记的生物质炭与土壤混合培养,同样发现生物质炭的分解最迟在3个月后已经变得极其微弱[29]。笔者所培养的土壤中,生物质炭已经施入水稻土1 a,其自身的分解微弱是可以预料的。
因此,笔者研究中不同处理各碳组分的分解动态主要反映了nSOC的分解对生物质炭施加的响应。笔者发现生物质炭的施加不同程度地促进了土壤大团聚体、粗粉粒和细粉黏粒组分的碳分解,尤其是大团聚体粒级的累积呼吸量增加163%(图 5)。这一结果表明生物质炭促进了nSOC的分解,即引起土壤碳分解的正激发效应[10-11]。大团聚体中nSOC分解的增加应主要来自团聚体外游离的颗粒有机物(fPOM)的分解。这是因为大团聚体重组分的nSOC碳含量并未因生物质炭施加而显著改变;相反,BH处理大团聚体粒级fPOM组分中nSOC含量显著低于未施加生物质炭的土壤(图 4)。SINGH等[9]在瑞士某温带森林土壤中也发现生物质炭施加使土壤中游离颗粒有机碳含量减少约13%。生物质炭促进土壤游离颗粒有机物分解的机制尚不清楚,可能是由于生物质炭为土壤微生物提供了更多适宜空间,增强了土壤微生物活性[9]。生物质炭的施加还减少了土壤细粉黏粒组分中易氧化碳含量(表 3),这与该组分CO2累积产生量的增加是一致的,表明生物质炭可能也促进了该组分中微生物活性及nSOC分解。
3.3 生物质炭施加对新成土发育的稻田土壤碳稳定的短期效应以往研究曾提出,生物质炭或其他形式的黑炭可通过促进土壤团聚体的形成[13-14],从而增强土壤碳的稳定而产生长期的固碳效应[5]。然而,笔者研究表明至少在新成土发育的稻田土中施加1 a后,生物质炭未显著影响土壤团聚体的形成。其他研究也有类似发现[18, 27]。这些研究结果,一方面可能与生物质炭的施加时间较短(一般仅数年)有关,更重要的,可能是由于生物质炭本身并非是形成团聚体的良好黏合剂。一般土壤团聚体的最初形成,是由于有机物分解所释放的黏性有机分子(如多糖或其他次生代谢物)、根系分泌物的黏附作用或菌丝缠绕等,使土壤颗粒包裹于有机物表面[30-31]。然而,生物质炭中97%的有机物极难分解,活性物质含量平均仅为3%左右;这部分活性有机物的分解较难产生大量黏附土壤颗粒的位点。部分研究观测到的生物质炭对团聚体形成的促进效应可能是过渡性的[13, 32]。
虽然生物质炭单独施加可能对土壤团聚体形成的影响有限,生物质炭与其他有机物混施对团聚体形成的促进作用却可能强于有机物单施[27]。未来可通过田间长期定位试验,比较生物质炭单独施加、生物质炭与其他活性有机物(如秸秆、厩肥等)混施对新成土发育的稻田土中团聚体形成与碳稳定的效果。
笔者研究结果还显示,生物质炭的施加短期内不仅未显著促进土壤团聚体的形成,还导致土壤中原有游离颗粒有机物、易氧化碳等活性碳组分的损失。因此,总体而言,笔者研究中生物质炭的施加降低了土壤原有有机碳的稳定性。然而,由于生物质炭的施加时间尚短,这一效应将在多长时间尺度上持续仍值得进一步验证。如ZIMMERMAN等[33]就认为,生物质炭在施加后的短期内会加速土壤原有有机碳的分解,但在此阶段之后,将促进土壤碳的长期稳定。尽管如此,在未来如果生物质炭在农业中的应用常规化,其频繁施加对土壤碳分解的短期正激发效应仍不容忽视。综上所述,笔者研究结果证实,单独施加生物质炭对土壤碳稳定的促进作用不明显,且可能会加速土壤原有有机碳的分解,至少在短期内对其无影响甚至呈负反馈作用。
4 结论通过土壤碳分组的方法,结合稳定性碳同位素示踪技术,揭示了生物质炭在田间施加1 a后,生物质炭颗粒主要以游离态形式松散附着于团聚体表面;少部分被土壤团聚体所包裹,或与土壤细粉黏粒组分形成某种有机-无机复合体。在田间施加1 a后,生物质炭的自身分解已经极其微弱,难以被检测到,证明生物质炭本身具有极强的化学稳定性。然而,生物质炭却在不同程度上促进了土壤各物理组分原有有机碳的分解,导致游离颗粒有机物、易氧化碳等活性碳组分的损失。总之,笔者研究表明在新成土发育的稻田土中施加生物质炭,短期内未显著促进土壤碳稳定,反之可能加速其原有有机碳的分解。
| [1] |
张阿凤, 潘根兴, 李恋卿. 生物黑炭及其增汇减排与改良土壤意义[J]. 农业环境科学学报, 2009, 28(12): 2459-2463. [ ZHANG A-feng, PAN Gen-xing, LI Lian-qing. Biochar and the Effect on C Stock Enhancement, Emission Reduction of Greenhouse Gases and Soil Reclaimation[J]. Journal of Agro-Environment Science, 2009, 28(12): 2459-2463. DOI:10.3321/j.issn:1672-2043.2009.12.004] (  0) 0) |
| [2] |
谢祖彬, 刘琦, 许燕萍, 等. 生物炭研究进展及其研究方向[J]. 土壤, 2011, 43(6): 857-861. [ XIE Zu-bin, LIU Qi, XU Yan-ping, et al. Advances and Perspectives of Biochar Research[J]. Soils, 2011, 43(6): 857-861.] (  0) 0) |
| [3] |
KUZYAKOV Y, SUBBOTINA I, CHEN H Q, et al. Black Carbon Decomposition and Incorporation Into Soil Microbial Biomass Estimated by 14C Labeling[J]. Soil Biology and Biochemistry, 2009, 41(2): 210-219. DOI:10.1016/j.soilbio.2008.10.016 (  0) 0) |
| [4] |
LEHMANN J. A Handful of Carbon[J]. Nature, 2007, 447(7141): 143-144. DOI:10.1038/447143a (  0) 0) |
| [5] |
WOOLF D, LEHMANN J. Modelling the Long-Term Response to Positive and Negative Priming of Soil Organic Carbon by Black Carbon[J]. Biogeochemistry, 2012, 111(1/2/3): 83-95. (  0) 0) |
| [6] |
SPOKAS K A, CANTRELL K B, NOVAK M J, et al. Biochar:A Synthesis of Its Agronomic Impact Beyond Carbon Sequestration[J]. Journal of Environmental Quality, 2012, 41(4): 973-989. DOI:10.2134/jeq2011.0069 (  0) 0) |
| [7] |
SINGH R, BABU N J, KUMAR R, et al. Multifaceted Application of Crop Residue Biochar as a Tool for Sustainable Agriculture:An Ecological Perspective[J]. Ecological Engineering, 2015, 77: 324-347. DOI:10.1016/j.ecoleng.2015.01.011 (  0) 0) |
| [8] |
CROSS A, SOHI S P. The Priming Potential of Biochar Products in Relation to Labile Carbon Contents and Soil Organic Matter Status[J]. Soil Biology and Biochemistry, 2011, 43(10): 2127-2134. DOI:10.1016/j.soilbio.2011.06.016 (  0) 0) |
| [9] |
SINGH N, ABIVEN S, MAESTRINI B, et al. Transformation and Stabilization of Pyrogenic Organic Matter in a Temperate Forest Field Experiment[J]. Global Change Biology, 2014, 20(5): 1629-1642. DOI:10.1111/gcb.2014.20.issue-5 (  0) 0) |
| [10] |
MAESTRINI B, NANNIPIERI P, ABIVEN S. A Meta-Analysis on Pyrogenic Organic Matter Induced Priming Effect[J]. GCB Bioenergy, 2015, 7: 577-590. DOI:10.1111/gcbb.2015.7.issue-4 (  0) 0) |
| [11] |
WANG J Y, XIONG Z Q, KUZYAKOV Y. Biochar Stability in Soil:Meta-Analysis of Decomposition and Priming Effects[J]. GCB Bioenergy, 2016, 8: 512-523. DOI:10.1111/gcbb.2016.8.issue-3 (  0) 0) |
| [12] |
WARDLE D A, NILSSON M C, ZACKRISSON O. Fire-Derived Charcoal Causes Loss of Forest Humus[J]. Science, 2008, 320(5876): 629. DOI:10.1126/science.1154960 (  0) 0) |
| [13] |
YOO G, KIM H, CHOI J Y. Soil Aggregate Dynamics Influenced by Biochar Addition Using the C-13 Natural Abundance Method[J]. Soil Science Society of America Journal, 2017, 81(3): 612-621. DOI:10.2136/sssaj2016.09.0313 (  0) 0) |
| [14] |
BRODOWSKI S, JOHN B, FLESSA H, et al. Aggregate-Occluded Black Carbon in Soil[J]. European Journal of Soil Science, 2006, 57(4): 539-546. (  0) 0) |
| [15] |
GLASER B, BALASHOV E, HAUMAIER L, et al. Black Carbon in Density Fractions of Anthropogenic Soils of the Brazilian Amazon Region[J]. Organic Geochemistry, 2000, 31(7/8): 669-678. (  0) 0) |
| [16] |
JOSEPH S D, ARBESTAIN M C, LIN Y, et al. An Investigation Into the Reactions of Biochar in Soil[J]. Australian Journal of Soil Research, 2010, 48(7): 501-515. DOI:10.1071/SR10009 (  0) 0) |
| [17] |
KASOZI G N, ZIMMERMAN A R, NKEDI-KIZZA P, et al. Catechol and Humic Acid Sorption Onto a Range of Laboratory-Produced Black Carbons (Biochars)[J]. Environmental Science & Technology, 2010, 44(16): 6189-6195. (  0) 0) |
| [18] |
HERATH H M S K, CAMPS-ARBESTAIN M, HEDLEY M, et al. Fate of Biochar in Chemically-and Physically-Defined Soil Organic Carbon Pools[J]. Organic Geochemistry, 2014, 73: 35-46. DOI:10.1016/j.orggeochem.2014.05.001 (  0) 0) |
| [19] |
SWANSTON C W, CALDWELL B A, HOMANN P S, et al. Carbon Dynamics During a Long-Term Incubation of Separate and Recombined Density Fractions From Seven Forest Soils[J]. Soil Biology and Biochemistry, 2002, 34(8): 1121-1130. DOI:10.1016/S0038-0717(02)00048-2 (  0) 0) |
| [20] |
SIX J, CONANT R T, PAU E A, et al. Stabilization Mechanisms of Soil Organic Matter:Implications for C-Saturation of Soils[J]. Plant and Soil, 2002, 241(2): 155-176. DOI:10.1023/A:1016125726789 (  0) 0) |
| [21] |
LÜTZOW V M, KÖGEL-KNABNER I, KLEMENS E, et al. SOM Fractionation Methods:Relevance to Functional Pools and to Stabilization Mechanisms[J]. Soil Biology and Biochemistry, 2007, 39(9): 2183-2207. DOI:10.1016/j.soilbio.2007.03.007 (  0) 0) |
| [22] |
裴俊敏, 李金全, 李兆磊, 等. 生物质炭施加对水-旱轮作农田土壤CO2排放及碳库的影响[J]. 亚热带资源与环境学报, 2016, 11(3): 72-80. [ PEI Jun-min, LI Jin-quan, LI Zhao-lei, et al. Effects of Biochar on Soil CO2 Emissions and Carbon Pool in Rice-Wheat Rotation Croplands[J]. Journal of Subtropical Resources and Environment, 2016, 11(3): 72-80. DOI:10.3969/j.issn.1673-7105.2016.03.009] (  0) 0) |
| [23] |
SIX J, ELLIOTT E T, PAUSTIAN K, et al. Aggregation and Soil Organic Matter Accumulation in Cultivated and Native Grassland Soils[J]. Soil Science Society of America Journal, 1998, 62(5): 1367-1377. DOI:10.2136/sssaj1998.03615995006200050032x (  0) 0) |
| [24] |
STEMMER M, GERZABEK M H, KANDELER E. Organic Matter and Enzyme Activity in Particle-Size Fractions of Soils Obtained After Low-Energy Sonication[J]. Soil Biology and Biochemistry, 1998, 30(1): 9-17. DOI:10.1016/S0038-0717(97)00093-X (  0) 0) |
| [25] |
RAMNARINE R, VORONEY R P, WAGNERRIDDLE C, et al. Carbonate Removal by Acid Fumigation for Measuring the δ13C of Soil Organic Carbon[J]. Canadian Journal of Soil Science, 2011, 91(2): 247-250. DOI:10.4141/cjss10066 (  0) 0) |
| [26] |
DAWSON T E, MAMBELLI S, PLAMBOECK A H, et al. Stable Isotopes in Plant Ecology[J]. Annual Review of Ecology and Systematics, 2002, 33: 507-559. DOI:10.1146/annurev.ecolsys.33.020602.095451 (  0) 0) |
| [27] |
FUNGO B, LEHMANN J, KALBITZ K, et al. Aggregate Size Distribution in a Biochar-Amended Tropical Ultisol Under Conventional Hand-Hoe Tillage[J]. Soil and Tillage Research, 2017, 165: 190-197. DOI:10.1016/j.still.2016.08.012 (  0) 0) |
| [28] |
LUO Y, DURENKAMP M, NOBILI M D, et al. Short Term Soil Priming Effects and the Mineralisation of Biochar Following Its Incorporation to Soils of Different Ph[J]. Soil Biology and Biochemistry, 2011, 43(11): 2304-2314. DOI:10.1016/j.soilbio.2011.07.020 (  0) 0) |
| [29] |
CUI J, GE T, KUZYAKOV Y, et al. Interactions Between Biochar and Litter Priming:A Three-Source 14C and δ13C Partitioning Study[J]. Soil Biology and Biochemistry, 2017, 104: 49-58. DOI:10.1016/j.soilbio.2016.10.014 (  0) 0) |
| [30] |
GOLCHIN A, OADES J M, SKJEMSTAD J O, et al. Soil Structure and Carbon Cycling[J]. Australian Journal of Soil Research, 1994, 32(5): 1043-1068. DOI:10.1071/SR9941043 (  0) 0) |
| [31] |
PUGET P, CHENU C, BALESDENT J. Dynamics of Soil Organic Matter Associated With Particle-Size Fractions of Water-Stable Aggregates[J]. European Journal of Soil Science, 2000, 51(4): 595-605. DOI:10.1111/ejs.2000.51.issue-4 (  0) 0) |
| [32] |
SUN F, LU S. Biochars Improve Aggregate Stability, Water Retention, and Porespace Properties of Clayey Soil[J]. Journal of Plant Nutrition and Soil, 2014, 177(1): 26-33. DOI:10.1002/jpln.v177.1 (  0) 0) |
| [33] |
ZIMMERMAN A R, GAO B, AHN M Y. Positive and Negative Carbon Mineralization Priming Effects Among a Variety of Biochar-Amended Soils[J]. Soil Biology and Biochemistry, 2011, 43(6): 1169-1179. DOI:10.1016/j.soilbio.2011.02.005 (  0) 0) |




