2. 环境保护部南京环境科学研究所, 江苏 南京 210042;
3. 国家环境保护农药环境评价与污染控制重点实验室, 江苏 南京 210042
2. Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210042, China;
3. Key Laboratory of Pesticide Environmental Assessment and Pollution Control, Ministry of Environmental Protection, Nanjing 210042, China
草甘膦(glyphosate)是一种非选择性广谱有机磷除草剂, 在农业中常用于控制多种一年生和多年生杂草[1], 可以破坏杂草的地下组织, 近几年已成为使用最为普遍、销售量最大的除草剂。尽管草甘膦易被土壤成分吸附, 但由于其具有较高的水溶性以及在环境中有较长的半衰期, 使得草甘膦在施药较长时间后或者在远离施药点的地方均能检测到[2-4]。多项研究表明草甘膦具有毒性作用, 对生态环境和人体健康都具有潜在危害[5-8]。
目前, 国内外对用于土壤中的除草剂进行过广泛的研究[9-13], 但对草甘膦检测与土壤理化性质的关系研究较少。草甘膦极易吸附在土壤中, 这是由于草甘膦在土壤溶液中主要以两性离子存在, 结构式中具有羧基、氨基和膦酸基3个极性基团[14-16], 可以与土壤中的二氧化硅、金属离子、金属氧化物以及天然有机化合物反应。草甘膦在土壤中的吸附作用不仅受物理因素如表面积的影响, 也受化学因素, 如腐殖质、土壤pH值、阳离子以及和磷酸盐的竞争作用等的影响[17-20]。笔者分别探究了腐殖酸含量、重金属离子含量以及土壤pH值对草甘膦检测方法的影响, 并对土壤和沉积物中草甘膦的检测方法作出评价。
1 材料与方法 1.1 仪器与试剂仪器:高效液相色谱仪, 配备荧光检测器(Waters, 美国); 高速离心机(Centrifuge C5804, Eppendorf, 德国); 恒温混匀仪(Eppendorf, 德国); WH-3微型旋涡混合仪(上海楚定分析仪器有限公司, 中国); Milli-Q超纯水器(Mimpore, 美国); AG-285电子天平(Mettler, 瑞士); HQ30d便携式多参数pH计(HACH, 美国)。
试剂:乙腈为色谱纯, 购于德国Merck公司; 氯甲酸-9-芴基甲酯(FMOC-Cl)为标准品, 腐殖酸纯度w > 90.0%, 均购于上海安谱科学仪器有限公司; 磷酸钠、四硼酸钠、柠檬酸三钠、正己烷、磷酸、石英砂、盐酸、氢氧化钠、硝酸钴、硫酸铁、硫酸亚铁、硫酸镍、硫酸铜、硫酸锌和硫酸锰均为分析纯, 购于南京化学试剂有限公司。
农药标准品:草甘膦(Sigma, 美国)。
采集土壤样品概况见表 1。
|
|
表 1 土壤样品概况 Table 1 Generalization of the soil samples |
1.0 g·L-1草甘膦标准储备液配置:准确称取50.0 mg草甘膦标准品, 用去离子水溶解, 转移至50.00 mL容量瓶中, 用去离子水定容, 并超声使之充分溶解, 4 ℃条件下保存。
系列标准工作溶液配置:以去离子水梯度洗脱法逐级稀释草甘膦储备液, 根据检测要求配置一系列浓度的标准工作溶液, 在4 ℃条件下保存。
1.3 试验方法 1.3.1 腐殖酸对草甘膦检测的影响称取10.0 g石英砂, 分别加入0、2.0、5.0、10.0、20.0和50.0 g·kg-1腐殖酸标准品, 混匀后, 加入0.1和1.0 mg·kg-1的草甘膦标样, 按照1.4节所述方法进行测定, 探究腐殖酸浓度对草甘膦检测的影响。
1.3.2 土壤pH值对草甘膦检测的影响称取10.0 g石英砂, 加入2.0 g·kg-1腐殖酸标准品, 混匀后用HCl和NaOH溶液调节石英砂pH值, 使pH值范围为3~11, 加入1.0 mg·kg-1草甘膦标样, 按照1.4节所述方法进行测定, 探究土壤pH值对草甘膦检测的影响。
1.3.3 土壤重金属离子对草甘膦检测的影响称取10.0 g石英砂, 分别加入w为0、0.5、2.0、5.0、20.0和100.0 g·kg-1重金属离子, 加入1.0 mg·kg-1草甘膦标样, 按照1.4节所述方法进行测定, 分别探究7种重金属离子对草甘膦检测的影响。
1.3.4 实际样品检测称取10.0 g实际土壤, 分别添加低、中、高3种不同含量(0.1、0.5和1.0 mg·kg-1)草甘膦标样, 按照1.4节所述方法进行测定, 每种含量平行测定6次, 分别计算不同添加含量的加标回收率和相对标准偏差。
1.4 样品前处理及检测方法 1.4.1 样品前处理称取10.0 g样品于50 mL离心管中, 加入50 mL 0.03 mol·L-1磷酸钠和0.01 mol·L-1柠檬酸三钠混合提取液, 超声提取30 min后, 以10 000 r·min-1离心5 min(离心半径为15 cm), 取上清液过滤。滤液先用HCl调节pH值至9, 静置10 min后过滤, 加入50 mL正己烷液液萃取进行净化, 充分振荡后静置, 弃有机相留水相, 再用50 mL正己烷萃取1次。取1 mL萃取液于1.5 mL PE管中, 加入0.12 mL 0.05 mol·L-1四硼酸钠溶液和0.2 mL 1.0 mg·mL-1 FMOC-Cl, 涡旋使之充分混匀, 常温下衍生反应4 h, 过0.22 μm孔径滤膜后, 用液相色谱-荧光检测器分析检测。
1.4.2 仪器条件Waters高效液相色谱仪检测条件:色谱柱, 使用Cosmosil 5C18-AR-Ⅱ(250 mm×4.6 mm×5 μm)液相色谱柱, 或其他等效类型色谱柱; 流动相, A为乙腈, B为φ=0.2%的磷酸水溶液, 梯度洗脱程序如表 2所示; 流速1.0 mL·min-1; 柱温35 ℃; 进样量20 μL; 荧光条件,激发波长254 nm, 发射波长301.5 nm。
|
|
表 2 梯度洗脱程序 Table 2 Gradient elution procedure |
土壤中有机质含量是影响草甘膦吸附量的主要因素[21], 而腐殖质作为土壤中有机质的重要存在形式, 对草甘膦的影响尤为显著。草甘膦分子具有羧基、氨基和膦酸基团这3个极性基团, 这些基团可以通过氢键与腐殖酸结合[22]。草甘膦添加量为0.1和1.0 mg·kg-1时, 在不同腐殖酸含量条件下的回收率如图 1所示。草甘膦回收率随着腐殖酸浓度的增加而减小, 且回收率与腐殖酸含量存在较好的线性关系, 这与YU等[23]的研究结果相一致。由表 1可知, 不同类型土壤和沉积物的有机质含量大不相同, 这是影响草甘膦检测的主要原因。
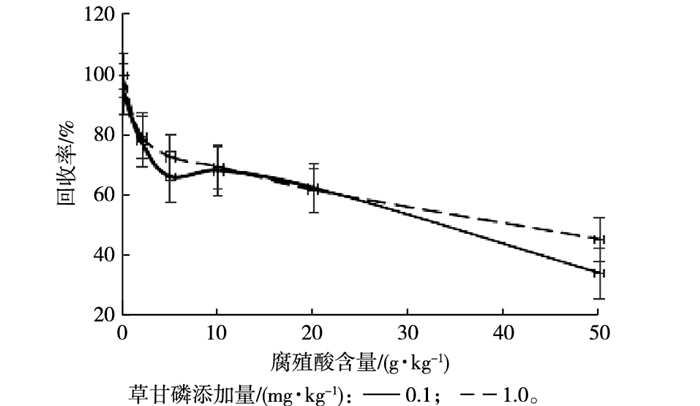
|
图 1 腐殖酸含量对草甘膦回收率的影响 Figure 1 Effect of humic acid content on glyphosate recovery rate |
土壤pH值随着土壤类型和组成不同而发生改变, 对草甘膦的吸附效果有较大影响。对于离子型和有机酸型农药, 当土壤pH值接近农药的酸度系数(pKa)时, 吸附效果最强。草甘膦分子中含有3个可电离的活泼氢, 其pKa值分别为2.53、5.9和10.9[13]。所以在酸性条件下, 草甘膦大多以分子态形式存在, 而在碱性条件下, 大多以阴离子形态存在。在碱性环境中, 土壤带有负电荷, 会与草甘膦发生排斥, 进而减少草甘膦吸附量。在pH值为3~11范围内, 1.0 mg·kg-1草甘膦的回收率如图 2所示。随着pH值增大, 草甘膦的回收率先逐渐增大, 在pH值为8~9处取得最大值, 当pH值 > 9时, 回收率逐渐降低到与pH值为7时相等。草甘膦回收率在不同pH值条件下差别并不大(相对极差为0.17), 这是由于样品提取液(0.03 mol·L-1磷酸钠和0.01 mol·L-1柠檬酸三钠混合溶液)本身就是一种缓冲溶液, 使得土壤pH值对草甘膦的影响大大减小, 说明建立的检测方法适用于各种pH值条件的土壤。
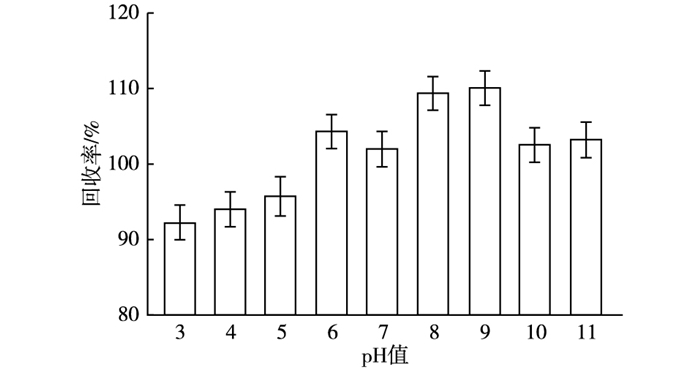
|
图 2 土壤pH值对草甘膦回收率的影响 Figure 2 Effect of soil pH on glyphosate recovery rate |
土壤中的重金属离子对草甘膦的吸附也有影响, 重金属离子可以和草甘膦形成稳定的络合物, 如Cu-Gly复合体[24-25]。在不同含量7种常见重金属离子(Cu2+、Fe2+、Fe3+、Zn2+、Ni2+、Co2+和Mn2+)环境下, 1.0 mg·kg-1草甘膦回收率的变化情况见图 3。
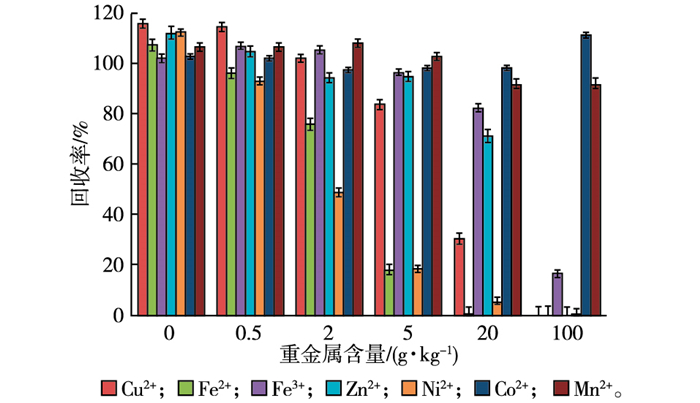
|
图 3 重金属含量对草甘膦回收率的影响 Figure 3 Effect of heavy metal content on glyphosate recovery rate |
当重金属离子含量小于0.5 g·kg-1时, 草甘膦回收率基本不受影响, 这是由于提取液中添加了柠檬酸三钠金属离子络合剂, 消除了金属离子的干扰。当重金属离子含量大于0.5 g·kg-1时, 对于Cu2+、Fe2+、Fe3+、Zn2+和Ni2+离子, 草甘膦回收率随着重金属离子浓度的增加而急剧下降, 说明这些重金属离子能与草甘膦络合形成稳定化合物; 而对于Co2+和Mn2+, 离子浓度增加对草甘膦的回收率基本没有影响, 说明这2种重金属离子不能与草甘膦作用, 对草甘膦的检测没有影响。
2.4 实际样品的检测选取国内具有代表性的3种土壤和2种沉积物, 包括湖南红壤、东北黑土、太湖水稻土以及前湖沉积物、秦淮河沉积物, 按照1.3.4节的方法对实际样品进行检测。水稻土和前湖沉积物样品加标色谱图如图 4所示。由图 4可知, 色谱峰峰型较好, 分离度高, 能很好地满足草甘膦的测定要求。
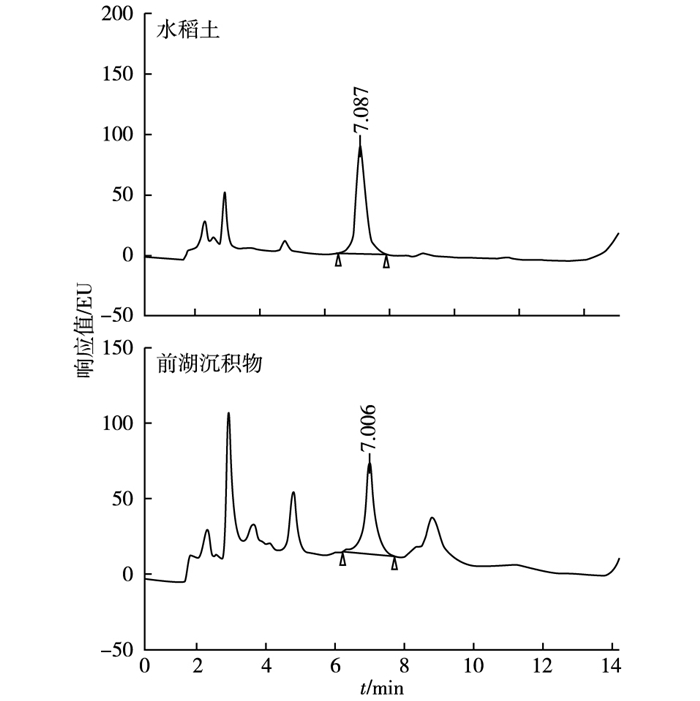
|
图 4 加标样品色谱图 Figure 4 Chromatograms of spiked sample |
由表 3可知, 3种土壤样品中均有草甘膦检出, 且检出浓度低于GB 15618—1995《土壤环境质量标准》限值(0.5 mg·kg-1)。然而, 在湖沉积物和河沉积物中均没有目标物检出, 这是由于草甘膦与土壤的吸附能力较强, 流动性能较差, 并且在水-沉积物体系中更易降解。5种土壤和沉积物的回收率均大于75%, 相对标准偏差均小于12%, 说明该方法对大部分土壤和沉积物均适用, 且方法操作稳定。由于不同土壤的理化性质不同, 回收率也会存在差距。由上述研究发现, 草甘膦回收率主要受土壤有机质含量影响, 红壤中有机质含量较低, 对草甘膦的吸附较弱, 所以回收率较高, 均超过90%;而沉积物中有机质含量较高, 对草甘膦的吸附较强, 回收率相对较低。
|
|
表 3 方法精密度和准确度 Table 3 Precision and accuracy of the determination method |
(1) 土壤中有机质含量对草甘膦回收率起主要影响作用, 有机质含量越高, 对草甘膦的吸附越强, 回收率越低。
(2) 土壤pH值对草甘膦的回收率有较大影响。在酸性土壤中, 草甘膦以分子形态存在; 而在碱性条件下, 草甘膦大多以阴离子形态存在, 与带有负电荷的土壤颗粒相排斥, 减少了草甘膦的吸附量, 导致回收率提高。
(3) 土壤中的重金属离子Cu2+、Fe2+、Fe3+、Zn2+和Ni2+可以与草甘膦形成稳定的络合物, 使草甘膦回收率降低; 而重金属离子Co2+和Mn2+对回收率没有影响。
(4) 笔者建立的土壤和沉积物中草甘膦的标准检测方法能满足各种类型的土壤和沉积物。其中, 磷酸钠和柠檬酸三钠混合提取液具有缓冲溶液的效果, 可以适应各种pH值环境的土壤; 柠檬酸三钠可以去除土壤中大部分重金属离子的干扰, 故该方法对重金属污染土壤依然适用。
| [1] |
WILLIAMS G M, KROES R, MUNRO I C. Safety Evaluation and Risk Assessment of the Herbicide Roundup and Its Active Ingredient, Glyphosate, for Humans[J]. Regulatory Toxicology and Pharmacology, 2000, 31(2): 117-165. DOI:10.1006/rtph.1999.1371 (  0) 0) |
| [2] |
VEREECKEN H. Mobility and Leaching of Glyphosate:A Review[J]. Pest Management Science, 2005, 61(12): 1139-1151. DOI:10.1002/(ISSN)1526-4998 (  0) 0) |
| [3] |
BORGGAARD O K, GIMSING A L. Fate of Glyphosate in Soil and the Possibility of Leaching to Ground and Surface Waters:A Review[J]. Pest Management Science, 2008, 64(4): 441-456. DOI:10.1002/(ISSN)1526-4998 (  0) 0) |
| [4] |
傅定一. 草甘膦的第二次机遇[J]. 农药, 2002, 41(10): 1-5. FU Ding-yi. The Second Revolution of Glyphosat[J]. Pesticides, 2002, 41(10): 1-5. DOI:10.3969/j.issn.1006-0413.2002.10.001 (  0) 0) |
| [5] |
DARUICH J, FANNY Z, GIMENEZ M S. Effect of the Herbicide Glyphosate on Enzymatic Activity in Pregnant Rats and Their Fetuses[J]. Environmental Reaserch, 2001, 85(3): 226-231. DOI:10.1006/enrs.2000.4229 (  0) 0) |
| [6] |
FUJⅡ T. Transgenerational Effects of Maternal Exposure to Chemicals on the Functional Development of the Brain in the Offspring[J]. Cancer Causes & Control, 1997, 8(3): 524-528. (  0) 0) |
| [7] |
DALLEGRAVE E, MANTESE F D, COELHO R S, et al. The Teratogenic Potential of the Herbicide Glyphosate-Roundup® in Wistar Rats[J]. Toxicology Letters, 2003, 142(1/2): 45-52. (  0) 0) |
| [8] |
南旭阳, 陈浩, 张碧双, 等. 除草剂"草甘膦"对蟾蜍外周血红细胞微核及核异常的影响[J]. 温州师范学院学报(自然科学版), 2000, 21(6): 57-58. NAN Xu-yang, CHEN Hao, ZHANG Bi-shuang, et al. Effects of Herbicide (Glyphosate) on Micronuclei and Nuclear Anomalies in Erythrocyte of Bufo bufo Gargarizans[J]. Journal of Wenzhou Teachers College(Natural Science), 2000, 21(6): 57-58. (  0) 0) |
| [9] |
EPA 443265-06, Environmental Chemistry Method[S].
(  0) 0) |
| [10] |
WANG Q Q, YANG W C, LIU W P. Adsorption of Acetanilide Herbicides on Soils and Its Correlation With Soil Properties[J]. Pest Management Science, 1999, 55(11): 1103-1108. DOI:10.1002/(SICI)1096-9063(199911)55:11<>1.0.CO;2-4 (  0) 0) |
| [11] |
SANCHO J V, HERNÁNDEZ F, LÓPEZ F J, et al. Rapid Determination of Glufosinate, Glyphosate and Aminomethylphosphonic Aacid in Environmental Water Samples Using Precolumn Fluorogenic Labeling and Coupled-Column Liquid Chromatography[J]. Journal of Chromatography A, 1996, 737(1): 75-83. DOI:10.1016/0021-9673(96)00071-4 (  0) 0) |
| [12] |
BOTERO-COY A M, IBÁÑEZ M, SANCHO J V, et al. Improvements in the Analytical Methodology for the Residue Determination of the Herbicide Glyphosate in Soils by Liquid Chromatography Coupled to Mass Spectrometry[J]. Journal of Chromatography A, 2013, 1292: 132-141. DOI:10.1016/j.chroma.2012.12.007 (  0) 0) |
| [13] |
叶常明, 雷志芳, 王杏君. 丁草胺在土壤中的吸附及环境物质的影响[J]. 环境化学, 2003, 22(1): 14-18. YE Chang-ming, LEI Zhi-fang, WANG Xing-jun. Adsorption of Butachlor in Soil and Influence of Environmental Substances[J]. Environmental Chemistry, 2003, 22(1): 14-18. (  0) 0) |
| [14] |
MIANO T M, PICCOLO A, CELANO G, et al. Infrared Fluorescence Spectroscopy of Glyphosate-Humic Acid Complexes[J]. Science of the Total Environment, 1992, 123/124: 83-92. DOI:10.1016/0048-9697(92)90135-F (  0) 0) |
| [15] |
UNDABEYTIA T, CHESHIRE M V, MEPHAIL D. Interaction of the Herbicide Glyphosate With Copper in Humic Complexes[J]. Chemosphere, 1996, 32(7): 1245-1250. DOI:10.1016/0045-6535(96)00036-7 (  0) 0) |
| [16] |
PICCOLO A, CELANO G, PIETRAMELLARA G. Adsorption of the Herbicide Glyphosate on a Metal-Humic Acid Complex[J]. Science of the Total Environment, 1992, 123/124: 77-82. DOI:10.1016/0048-9697(92)90134-E (  0) 0) |
| [17] |
VEREECKEN H. Mobility and Leaching of Glyphosate:A Review[J]. Pest Management Science, 2005, 61(12): 1139-1151. DOI:10.1002/(ISSN)1526-4998 (  0) 0) |
| [18] |
BORGGAARD O K, GIMSING A L. Fate of Glyphosate in Soil and the Possibility of Leaching to Ground and Surface Waters:A Review[J]. Pest Management Science, 2008, 64(4): 441-456. DOI:10.1002/(ISSN)1526-4998 (  0) 0) |
| [19] |
SHEALS J, SJÖBERG S, PERSSON P. Adsorption of Glyphosate on Goethite:Molecular Characterization of Surface Complexes[J]. Environmental Science & Technology, 2002, 36(14): 3090-3095. (  0) 0) |
| [20] |
HANCE R J. Adsorption of Glyphosate by Soils[J]. Pest Management Science, 1976, 7(4): 363-366. DOI:10.1002/ps.v7:4 (  0) 0) |
| [21] |
NORTHCOTT G L, JONES K C. Experimental Aapproaches and Analytical Techniques for Determining Organic Compound Bound Residues in Soil and Sediment[J]. Environmental Pollution, 2000, 108(1): 19-43. DOI:10.1016/S0269-7491(99)00199-2 (  0) 0) |
| [22] |
PUSINO A, LIU W, GESSA C. Dimepiperate Adsorption and Hydrolysis on Al3+-, Fe3+-, Ca2+-, and Na+-Montmorillonite[J]. Clays and Clay Minerals, 1993, 41(3): 335-340. DOI:10.1346/CCMN (  0) 0) |
| [23] |
YU Y, ZHOU Q X. Adsorption Characteristic of Pesticides Methamidophos and Glyphosate by Two Soils[J]. Chemosphere, 2005, 58(6): 811-816. DOI:10.1016/j.chemosphere.2004.08.064 (  0) 0) |
| [24] |
SHEALS J, GRANSTRÖM M, SJÖBERG S, et al. Coadsorption of Cu(Ⅱ) and Glyphosate at the Water-Goethite(α-FeOOH) Interface:Molecular Structures From FTIR and EXAFS Measurements[J]. Journal of Colloid and Interface Science, 2003, 262(1): 38-47. DOI:10.1016/S0021-9797(03)00207-8 (  0) 0) |
| [25] |
BARJA B C, AFONSO M D S. Aminomethylphosphonic Acid and Glyphosate Adsorption Onto Goethite:A Comparative Study[J]. Environmental Science & Technology, 2005, 39(2): 585-592. (  0) 0) |




