2. 环境保护部南京环境科学研究所, 江苏 南京 210042
2. Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210042, China
在逐步淘汰或者禁用多溴二苯醚(PBDEs)时, 作为替代品的有机磷阻燃剂(organophosphate flame retardants, OPFRs)的使用量快速上升[1]。在过去几年内, OPFRs已经成为全球性污染物而倍受关注, 在各种非生物介质, 包括室内空气、自然水体、沉积物及野生动物和人体中均有检出[2-3]。
研究发现, 有机磷阻燃剂由于缺少化学键的束缚, 极易从产品中溢出并释放到环境中。数据表明, 水体中有机磷阻燃剂含量远高于PBDEs, 已达μg·L-1级。我国松花江流域、黄海、长江、太湖流域和珠江流域水体中均有有机磷阻燃剂检出[2, 4-7]。检出率较高的有机磷阻燃剂有磷酸三苯酯(TPhP)、磷酸三正丁酯(TnBP)、磷酸(1, 3-二氯-2-丙基)酯(TDCPP)和磷酸三(2-氯丙基)酯(TCPP)等。
毒理学证据显示, 有机磷阻燃剂对生物体具有毒性效应。有研究报道TPhP具有迟发性的神经毒性[8], 可以干扰斑马鱼肝脏碳水化合物和脂质代谢从而导致DNA损伤[9]。在动物长期暴露实验中, 由于TnBP具有与有机磷杀虫剂类似的结构, 可损害脑部发育, 进而导致神经毒性[10]。研究者发现, TDCPP对虹鳟鱼96 h半数致死浓度(LC50)为1.1 mg·L-1[11], 可能具有内分泌干扰效应, 能够降低甲状腺激素水平[12]。TCPP对黑头呆鱼和金鱼的LC50为51 mg·L-1[11]。同样, 若啮齿类动物长期处于三(β-氯乙基)磷酸酯(TCEP)和TDCPP暴露下, TCEP和TDCPP会诱导其肾脏、甲状腺、脑、肝脏和睾丸等器官肿瘤的产生[13]。鉴于氯代有机磷阻燃剂具有较强的毒性和持久性[14], 极易在生物体内蓄积, TCEP、TCPP和TDCPP依次被欧盟列为第2、4批高度关注物质[15], 成为研究者的关注热点。
目前, OPFRs的危害毒性数据虽有些报道, 但不够完整, 难以开展准确的生态风险评价。对TPhP、TnBP、TCPP和TDCPP而言, 现有的文献主要报道了其对鱼类的急性毒性数据, 长期试验数据还鲜有报道。鱼类数据又集中于成鱼, 缺少鱼类胚胎和早期生活期鱼类对污染物最敏感生命阶段的数据。因此, 以斑马鱼(Danio rerio)胚胎为受试对象, 研究4种典型有机磷阻燃剂的急、慢性毒性, 揭示有机磷阻燃剂对鱼类短期和长期暴露效应以及毒性作用机制。在此基础上, 依据文献报道的重点流域水体中OPFRs含量水平, 采用风险熵值法进行评估, 从而了解OPFRs的生态风险, 为我国OPFRs的环境管理提供科学依据。
1 材料与方法 1.1 受试生物野生型TU品系斑马鱼购于国家斑马鱼资源中心, 饲养于实验室内循环养殖系统中。饲养条件如下:试验用水为充分曝气脱氯并经活性炭过滤的自来水; 每天16 h光照, 光强为1 000~1 500 lx; 温度为(25±1) ℃; 溶解氧浓度大于空气饱和浓度的80%;pH值为7.0~8.0;喂食情况为每日定时投喂丰年虫2次, 外加颗粒饵料1次。投饵15 min后, 去除残饵。从养殖群体中选择3个月以上, 健康、体表无损伤、繁殖状况良好的成鱼为亲鱼。雌、雄斑马鱼亲鱼以1:1比例配对, 每日清晨观察雌、雄鱼的行为, 当观察到雄鱼追逐雌鱼时, 将雌、雄鱼捞出, 人工受精获取受精卵。试验开始前在显微镜下随机抽样, 确认此批受精卵处于单细胞期。
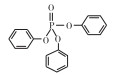
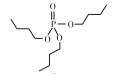
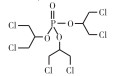
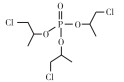
1.2 试剂TPhP、TnBP、TDCPP和TCPP纯度w=99.0%, 由百灵威科技有限公司(上海)提供, 用二甲基亚砜(DMSO, 色谱纯, 德国Merck公司)作溶剂配制质量浓度为1 000 mg·L-1的储备液(置于4 ℃冰箱中避光保存)。4种阻燃剂的主要结构和基本信息见表 1。
|
|
表 1 4种典型有机磷阻燃剂的基本信息 Table 1 Basic information of four typical OPFRs |
试验用水参照ISO 6341的方法统一配制, 温度保持在(27.0±0.5) ℃, 用分析纯试剂和蒸馏水配制而成。取CaCl2、MgSO4、NaHCO3和KCl储备液各1 L混合, 并用去离子水稀释至100 L。配制好的稀释水pH值为7.8±0.2, 稀释水在使用之前曝气24 h以上。
1.3 仪器设备繁殖盒(北京爱生科技发展有限公司); 电子分析天平(0.1 mg/0.01 mg, MU105DU, 梅特勒托利多, 瑞士); 溶氧仪、温度计、pH计(HQ40d, 美国哈希公司); 6孔板玻璃结晶皿配盖(海门市三和镇弘澄实验器材厂); 1 L玻璃鱼缸(配盖, 三合祖平玻璃仪器厂, 江苏); 人工气候箱(MLR-315H, SANYO, 日本); 体视显微镜(莱卡, M205FA); 数显游标卡尺(16EX, 上海沪工)。
1.4 胚胎急性毒性试验胚胎急性毒性试验方法参照OECD化学品测试导则OECD TG 236[16]。采用半静态法(换水频率为每隔24 h更换1次)。在正式试验之前先对4种物质进行较大范围浓度系列(0.1、1、10、100、1 000 mg·L-1)的预试验, 不设平行组。
根据预试验结果, 设置5个浓度梯度, TPhP、TnBP和TDCPPP质量浓度均分别为1.00、2.00、4.00、8.00和10.0 mg·L-1, TCPP质量浓度分别为10.0、20.0、40.0、60.0、80.0和100 mg·L-1。另外, 设置1个空白组和1个溶剂对照组(100 μg·L-1DMSO)。实验容器为6孔板, 将受精后1 h胚胎置于6孔板上, 每孔10粒, 设2个平行, 置于人工培养箱。观察并记录试验开始后24、48、72和96 h的死亡情况和中毒症状, 及时清理死亡胚胎, 以保证染毒液清洁。测定并记录试验温度、pH、溶解氧浓度和水质硬度等水质参数。
试验期间, 各项试验条件控制如下:周期为4 d; 光照为t(光):t(暗)=16:8;温度为(25±1) ℃; 溶解氧浓度大于空气饱和浓度的80%。
1.5 早期生活阶段慢性毒性试验早期生活阶段慢性毒性试验方法参照OECD化学品测试导则OECD TG 210[17]。采用半静态法(换水频率为每隔24 h更换1次), 根据急性毒性试验96 h LC50结果, 确定试验浓度范围。TPhP试验设置5个浓度组(0.01、0.03、0.09、0.30和0.60 mg·L-1), TnBP和TDCPP试验分别设置5个浓度组(0.05、0.10、0.20、0.40和0.80 mg·L-1), TCPP试验设置5个浓度组(1.00、2.00、4.00、6.00和8.00 mg·L-1), 并设溶剂对照组(10 μg·L-1 DMSO)。每组均设置3个平行。选用1 L玻璃鱼缸。将受精后1 h胚胎置于玻璃鱼缸, 每缸放置30枚胚胎, 每个鱼缸加入1 L受试溶液, 并将其置于人工培养箱。
试验期间准确记录胚胎发育所处时期。每天观察胚胎孵出及存活情况, 以卵凝结和心跳停止作为死亡终点, 统计胚胎死亡数、孵化数。用体视显微镜观察和记录胚胎或仔鱼的畸形和异常行为。试验期间对处理组和对照组暴露后72 hpf受试鱼心率进行测量。将仔鱼小心放置于凹槽玻片上, 在体视显微镜下观察, 打开摄像软件(BB FlashBack Pro 5.0) 对斑马鱼心跳录像1 min, 然后用Image J软件对摄像资料进行处理, 统计心率。试验结束时(32 d), 采用数显游标卡尺逐一测定存活鱼体长度(全长)。
试验期间, 除周期为32 d外,其余各项试验条件同胚胎急性毒性试验。
1.6 风险评估方法根据欧盟关于环境风险评价的技术指南[18], 采用风险商值(risk quotient, RQ, QR)法评估TPhP、TnBP、TDCPP和TCPP在环境中的风险。QR为实际测定浓度(measured environmental concentration, MEC, CME)和无效应浓度(predicted no effect concentration, PNEC, CPNE)之间的比值, 计算公式为QR=CME/CPNE。
PNEC值通常由试验所得的急性和慢性毒性数据〔LC50、EC50和无可见效应浓度(NOEC)等〕除以评估因子(AF, FA)得到。毒性数据除采用笔者试验研究结果外, 还参照其他文献报道数据。AF的取值范围为10~1 000。根据QR值的大小, 分为3个环境风险等级:0.01≤QR < 0.1时,为低环境风险;0.1≤QR < 1.0时,为中等环境风险;QR≥1.0时,为高环境风险[19]。
1.7 数据处理采用SPSS 17.0统计软件计算LC50。采用单因素方差分析分析鱼卵的心率、孵化率、存活率和异常率的组间差异。将每个处理组与对照组进行比较, 检验差异显著性, *和**分别表示差异显著(P < 0.05) 和差异极显著(P < 0.01)。
2 结果与讨论 2.1 有机磷阻燃剂对斑马鱼胚胎的急性毒性表 2显示, 斑马鱼胚胎对TPhP最敏感, TnBP和TDCPP毒性次之, TCPP毒性最低。有资料[20]报道TPhP、TnBP、TDCPP和TCPP对斑马鱼胚胎的96 h LC50分别为1.53、7.82、0.418和13.5 mg·L-1; 也有文献报道, TCPP对斑马鱼胚胎和成鱼的96 h LC50值分别为26.01和47.06 mg·L-1[21], TDCPP对稀有鲫的96 h LC50值为2.99 mg·L-1[22]。笔者研究结果与上述文献报道的TPhP、TnBP和TCPP 3种物质的毒性结果基本接近。而关于TDCPP的研究结果存在差异, 这可能是因为品系、胚胎质量、环境条件和水质参数等因素存在差异所致。
|
|
表 2 4种典型有机磷阻燃剂对斑马鱼胚胎的急性毒性结果 Table 2 Acute toxicity of 4 OPFRs to zebrafish embryos |
将斑马鱼胚胎暴露于用标准胚胎培养液配制的不同浓度的4种典型有机磷阻燃剂。结果发现, 胚胎死亡率随着4种物质浓度的升高而升高, 并且早期斑马鱼胚胎在高浓度有机磷阻燃剂暴露下, 胚胎由透明色变成白色半透明死卵, 部分存活胚胎孵化后出现明显的畸形现象(图 1)。斑马鱼胚胎畸形表现为卵凝结、色素减少、心包囊肿、卵黄囊肿、体形变小、脊椎弯曲和发育延缓。部分处理组胚胎出现孵化抑制现象。
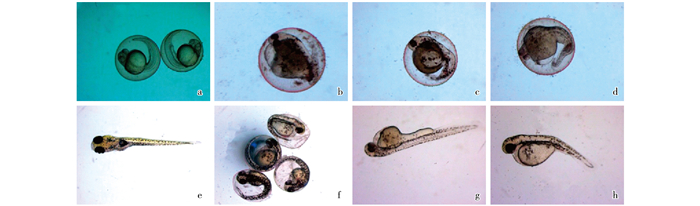
|
图 1 有机磷阻燃剂对斑马鱼胚胎染毒症状 Figure 1 Symptoms of OPFRs toxicity on zabrafish embryo a~d表示试验24 h时斑马鱼胚胎染毒症状; e~h表示120 h时斑马鱼胚胎染毒症状。a—发育正常胚胎; b—心包囊肿、卵黄囊肿胚胎; c—脊椎弯曲胚胎; d—脊椎弯曲、卵黄囊肿胚胎; e—发育正常仔鱼; f—发育延缓胚胎; g—发育延缓、色素减少仔鱼; h—心包囊肿仔鱼。 |
图 2显示, 正常对照组斑马鱼72 hpf心率规则, 平均心率为160次·min-1, 这与DU等[20]报道的斑马鱼72 hpf心率基本相同。当ρ(TPhP)为0.09、0.30、0.60 mg·L-1, ρ(TnBP)、ρ(TDCPP)为0.10、0.20、0.40、0.80 mg·L-1, ρ(TCPP)为6.00、8.00 mg·L-1时, 斑马鱼胚胎心率与对照组相比显著降低(P < 0.05)。由此可知, TPhP、TnBP、TDCPP和TCPP对斑马鱼心率影响的NOEC值分别为0.03、0.05、0.05和4.00 mg·L-1。DU等[20]报道ρ(TPhP)为0.50、1.00 mg·L-1时, 斑马鱼胚胎心率显著降低, 笔者研究结果与其基本一致。
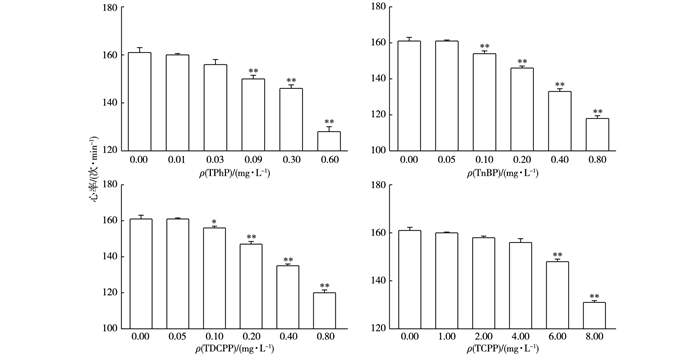
|
图 2 4种有机磷阻燃剂对斑马鱼胚胎72 hpf心率的影响 Figure 2 Heart rate of the zebrafish embryo after 72 hpf exposure to 4 OPFRs 同一幅图中, *和**分别表示处理组斑马鱼胚胎心率与对照组相比差异显著(P < 0.05) 和差异极显著(P < 0.01)。 |
图 3显示, 空白对照组孵化率达100%。当ρ(TPhP)分别为0.09、0.30、0.60 mg·L-1, ρ(TnBP)、ρ(TDCPP)分别为0.10、0.20、0.40、0.80 mg·L-1, ρ(TCPP)分别为2.00、4.00、6.00、8.00 mg·L-1时, 斑马鱼胚胎孵化率与对照组相比显著降低(P < 0.05)。由此可知, TPhP、TnBP、TDCPP和TCPP对斑马鱼胚胎孵化率影响的NOEC值分别为0.03、0.05、0.05和1.00 mg·L-1。
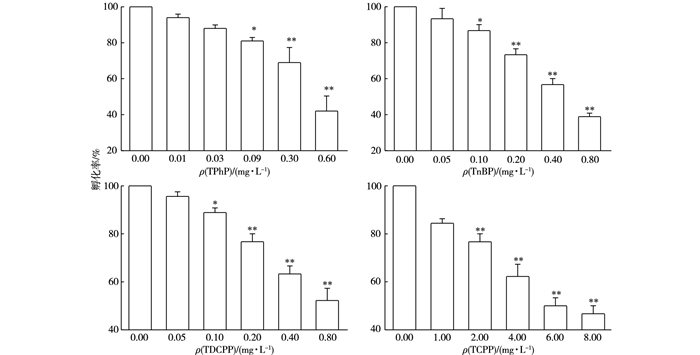
|
图 3 4种有机磷阻燃剂对斑马鱼胚胎120 hpf孵化率的影响 Figure 3 Hatching rate of the zebrafish embryo after 120 hpf exposure to 4 OPFRs 同一幅图中, *和**分别表示处理组斑马鱼胚胎孵化率与对照组相比差异显著(P < 0.05) 和差异极显著(P < 0.01)。 |
笔者观察到TCPP暴露导致斑马鱼胚胎发育延迟现象较明显, 直到第6天有少数孵化个体在体式显微镜下观察仍有心跳, 并未死亡。可见, 4种OPFRs对斑马鱼胚胎孵化均有抑制作用。4种OPFRs对斑马鱼孵化率均有不同程度的抑制作用, 且具有明显的剂量-效应关系。暴露于TPhP的斑马鱼胚胎孵化率由94%(0.01 mg·L-1)降低至42%(0.60 mg·L-1); 暴露于相同浓度梯度TnBP和TDCPP的斑马鱼胚胎孵化率由93%、96%(0.05 mg·L-1)分别下降至39%、52%(0.80 mg·L-1); 暴露于TCPP中的斑马鱼胚胎孵化率由84%(1.00 mg·L-1)下降到47%(8.00 mg·L-1)。
2.2.4 4种OPFRs对斑马鱼幼鱼32 d异常率的影响暴露32 d后, 4种OPFRs对斑马鱼幼鱼发育异常率的影响见图 4, 与对照组相比, OPFRs低浓度组幼鱼异常率均无显著差异(P > 0.05);当各OPFRs浓度升高时异常率升高, ρ(TPhP)为0.60 mg·L-1, ρ(TnBP)、ρ(TDCPP)为0.80 mg·L-1, ρ(TCPP)为8.00 mg·L-1时显著上升(P < 0.05)。由此可知, TPhP、TnBP、TDCPP和TCPP对斑马鱼幼鱼32 d异常率影响的NOEC值分别为0.30、0.40、0.40和6.00 mg·L-1。
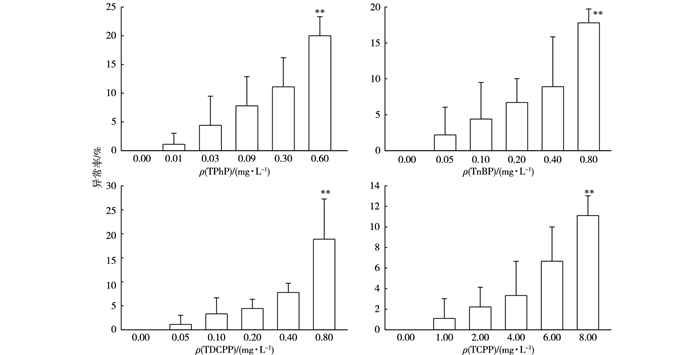
|
图 4 4种有机磷阻燃剂对斑马鱼胚胎32 d异常率的影响 Figure 4 Abnormal rate of the zebrafish embryo after 32 d exposure to 4 OPFRs 同一幅图中, *和**分别表示处理组斑马鱼胚胎32 d异常率与对照组相比差异显著(P < 0.05) 和差异极显著(P < 0.01)。 |
图 4显示, 4种OPFRs对斑马鱼幼鱼32 d异常率随着OPFRs浓度的升高而升高。暴露于TPhP的斑马鱼幼鱼异常率由1%(0.01 mg·L-1)升高到20%(0.60 mg·L-1); 暴露于相同浓度梯度TnBP、TDCPP中的斑马鱼幼鱼异常率分别由2%、1%(0.05 mg·L-1)升高至18%、19%(0.80 mg·L-1); 暴露于TCPP中的斑马鱼幼鱼异常率由1%(1.00 mg·L-1)升高至11%(8.00 mg·L-1)。
2.2.5 4种OPFRs对斑马鱼幼鱼32 d存活率的影响暴露32 d后, 4种OPFRs对斑马鱼幼鱼存活率的影响见图 5, ρ(TPhP)分别为0.09、0.30、0.60 mg·L-1, ρ(TnBP)分别为0.10、0.20、0.40、0.80 mg·L-1, ρ(TDCPP)分别为0.20、0.40、0.80 mg·L-1, ρ(TCPP)分别为2.00、4.00、6.00、8.00 mg·L-1时,斑马鱼幼鱼32 d存活率与对照组相比显著降低。由此可知, TPhP、TnBP、TDCPP和TCPP对斑马鱼幼鱼存活率影响的NOEC值分别为0.03、0.05、0.10和1.00 mg·L-1。
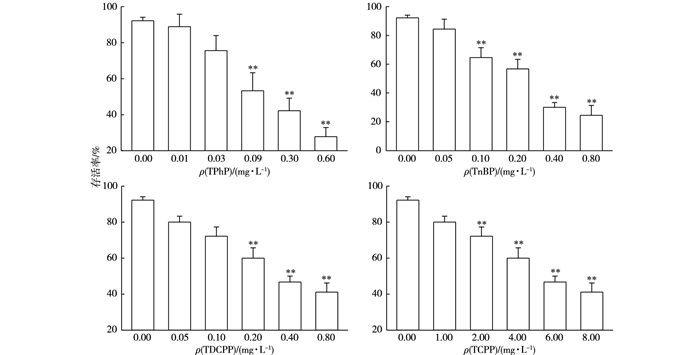
|
图 5 4种有机磷阻燃剂对斑马鱼幼鱼32 d存活率的影响 Figure 5 Survival rate of the zebrafish embryo after 32 d exposure to 4 OPFRs 同一幅图中, *和**分别表示处理组斑马鱼幼鱼32 d存活率与对照组相比差异显著(P < 0.05) 和差异极显著(P < 0.01)。 |
图 5显示, 4种OPFRs各浓度梯度和斑马鱼幼鱼存活率具有负相关关系。暴露于TPhP的斑马鱼幼鱼存活率由89%(0.01 mg·L-1)下降到28%(0.60 mg·L-1); 暴露于相同浓度梯度TnBP和TDCPP中的斑马鱼幼鱼存活率分别由84%、80%(0.05 mg·L-1)下降至24%、36%(0.80 mg·L-1); 暴露于TCPP中的斑马鱼幼鱼存活率由80%(1.00 mg·L-1)下降至41% (8.00 mg·L-1)。
2.2.6 4种OPFRs对斑马鱼幼鱼32 d体长的影响暴露32 d后, 4种OPFRs对斑马鱼幼鱼体长的影响见图 6, ρ(TPhP)所有处理组, ρ(TnBP)分别为0.05、0.10 mg·L-1, ρ(TDCPP)分别为0.05、0.10、0.20、0.40 mg·L-1, ρ(TCPP)所有处理组与对照组相比均无显著差异。由此可知, TPhP、TnBP、TDCPP和TCPP对斑马鱼幼鱼体长影响的NOEC值分别为0.60、0.10、0.40和8.00 mg·L-1。
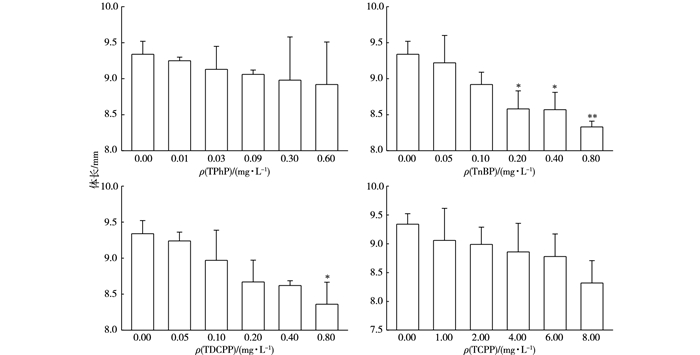
|
图 6 4种有机磷阻燃剂对斑马鱼胚胎32 d体长的影响 Figure 6 Body length of the zebrafish embryo after 32 d exposure to 4 OPFRs 同一幅图中, *和**分别表示处理组斑马鱼胚胎32 d体长与对照组相比差异显著(P < 0.05) 和差异极显著(P < 0.01)。 |
结合CUNNINGHAM等[23]和MARIE-PIERRE等[24]的研究成果, 应用基于生物毒性试验的PNEC简易估算方法。毒性数据除采用笔者试验研究结果外, 还参照ECOTOX数据库。
对TPhP而言, 采集到鱼、大型溞和藻短期试验数据, 最敏感的是月牙藻(Selenastrum bibraianum), 其96 h EC50值为0.50 mg·L-1。笔者研究得到长期试验NOEC值为0.03 mg·L-1(按最敏感指标计)。由于获取了1项长期试验的NOEC(鱼类)数据, 因此, 评估因子取值100。根据鱼类长期试验NOEC计算得到的水体环境中PNEC值为0.30 μg·L-1。
对TnBP而言, 采集到鱼、大型溞和藻短期试验数据, 最敏感的是大型溞(Daphnia magna), 其96 h EC50值为2.10 mg·L-1。笔者研究得到长期试验NOEC值为0.05 mg·L-1(按最敏感指标计)。由于获取了1项长期试验的NOEC(鱼类)数据, 因此, 评估因子取值100。根据鱼类长期试验NOEC计算得到的水体环境中PNEC值为0.50 μg·L-1。
对TDCPP而言, 未采集到相关文献数据。笔者研究得到TDCPP短期试验96 h LC50值为2.32 mg·L-1, 长期试验NOEC值为0.05 mg·L-1(按最敏感指标计)。由于获取了1项长期试验的NOEC(鱼类)数据, 因此, 评估因子取值100。根据鱼类长期试验NOEC计算得到的水体环境中PNEC值为0.50 μg·L-1。
对TCPP而言, 未采集到相关文献数据。笔者研究得到TCPP短期试验96 h LC50值为14.1 mg·L-1。长期试验NOEC值为1.00 mg·L-1(按最敏感指标计)。由于获取了1项长期试验的NOEC(鱼类)数据, 因此, 评估因子取值100。根据鱼类长期试验NOEC计算得到的水体环境中PNEC值为10.0 μg·L-1。
2.4 风险评价如上所述, TPhP、TnBP、TDCPP和TCPP水环境中PNEC值分别为0.30、0.50、0.50和10.0 μg·L-1, 利用我国一些水域中OPFRs的检出浓度[2, 4-7], 计算得出部分地区水域中OPFRs的RQ值及生态风险(表 3)。结果显示, 4种OPFRs在我国一些重要水域中有检出, 具有不同程度的环境风险。其中, TPhP在松花江RQ值介于0.015~0.275之间; TnBP在松花江RQ值介于0.174~1.920之间, 在太湖RQ值介于0.008 2~0.18之间, 在珠江RQ值为0.206;TDCPP在黄海和东海沿岸海水RQ值介于0.166~0.706之间, 在太湖RQ值介于ND~0.116之间; TCPP在太湖RQ值介于0.008 1~0.197之间。上述水域的环境风险为中到高, 需要引起足够重视。
|
|
表 3 我国部分重要水域中有机磷阻燃剂(OPFRs)的RQ值及生态风险 Table 3 RQ values and ecological risk of OPFRs in some important waters |
研究了4种典型OPFRs对斑马鱼胚胎的急性和慢性毒性, 并根据文献报道的我国部分水域OPFRs浓度开展风险评价。结论如下:(1) TPhP、TnBP、TDCPP和TCPP对斑马鱼胚胎急性毒性的96 h LC50分别为1.90、2.27、2.32和14.1 mg·L-1。(2) TPhP、TnBP、TDCPP和TCPP对斑马鱼胚胎32 d慢性毒性NOEC值分别为0.03、0.05、0.05和1.00 mg·L-1。(3) TPhP、TnBP、TDCPP和TCPP在我国一些重要水域中具有不同程度的环境风险, 部分水体风险熵RQ值大于0.1甚至1, 环境风险为中到高, 需要引起足够重视。
基于文献报道的水体OPFRs浓度水平, 结合ECOTOX等数据库, 对4种典型OPFRs急慢性数据进行补充完善, 并采用评估因子法估算PNEC值, 初步评估了我国重要水域中4种典型OPFRs的环境风险。但是OPFRs风险评估还需要进一步研究探索, 下一步研究方向主要包括:(1) 建立2~3条食物链中不同营养级生物共生的水生态暴露模拟系统, 建立多层次生物系统, 从系统水平上研究OPFRs的水生态危害性, 从而进行更为精确的风险评估。(2) 由于实际情况下通常是多种有害物质共存于水体中, 因此开展多种OPFRs的混合暴露毒性研究对于更客观真实评价OPFRs的环境风险十分必要。
| [1] |
BOLLMANN U E, MÖLLER A, XIE Z Y, et al. Occurrence and Fate of Organophosphorus Flame Retardants and Plasticizers in Coastal and Marine Surface Waters[J]. Water Research, 2012, 46(2): 531-538. DOI:10.1016/j.watres.2011.11.028 (  0) 0) |
| [2] |
秦宏兵, 范苓, 顾海东. 固相萃取-气相色谱/质谱法测定水中6种有机磷酸酯类阻燃剂和增塑剂[J]. 分析科学学报, 2014, 30(2): 259-262. QIN Hong-bing, FAN Ling, GU Hai-dong. Determination of Organophosphorus Flame Retardants and Plasticizers in Environmental Water by Solid Phase Extraction Coupled With Gas Chromatography/Mass Spectrometry[J]. Journal of Analytical Science, 2014, 30(2): 259-262. (  0) 0) |
| [3] |
KIM J W, ISOEB T, MUTO M, et al. Organophosphorus Flame Retardants (PFRs) in Human Breast Milk From Several Asian Countries[J]. Chemosphere, 2014, 116: 91-97. DOI:10.1016/j.chemosphere.2014.02.033 (  0) 0) |
| [4] |
WANG X W, LIU J F, YIN Y G. Development of an Ultra-High-Performance Liquid Chromatography-Tandem Mass Spectrometry Method for High Throughput Determination of Organophosphorus Flame Retardants in Environmental Water[J]. Journal of Chromatography A, 2011, 1218(38): 6705-6711. DOI:10.1016/j.chroma.2011.07.067 (  0) 0) |
| [5] |
HU M Y, LI J, ZHANG B B, et al. Regional Distribution of Halogenated Organophosphate Flame Retardants in Seawater Samples From Three Coastal Cities in China[J]. Marine Pollution Bulletin, 2014, 86(1/2): 569-574. (  0) 0) |
| [6] |
严小菊, 典型有机磷酸酯阻燃剂在太湖水体和底泥中存在水平和分布特征[D]. 南京: 南京大学, 2013. YAN Xiao-ju.Occurrence and Distribution of Typical Organophosphorus Ester Flame Retardants in the Surface Water and Sediment in Taihu Lake[D].Nanjing:Nanjing University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10284-1016000698.htm (  0) 0) |
| [7] |
何丽雄, 曹曙霞, 曾祥英, 等. 固相萃取/气相色谱-质谱联用技术快速测定水中有机磷酸酯阻燃剂与增塑剂[J]. 分析测试学报, 2013, 32(4): 437-441. HE Li-xiong, CAO Shu-xia, ZENG Xiang-ying, et al. Determination of Organophosphate Flame Retardants and Plasticizers in Water Using Solid Phase Extraction Coupled With GC-MS[J]. Journal of Instrumental Analysis, 2013, 32(4): 437-441. (  0) 0) |
| [8] |
NI Y, KUMAGAI K, YANAGISAWA Y. Measuring Emissions of Organophosphate Flame Retardants Using a Passive Flux Sampler[J]. Atmospheric Environment, 2007, 41(15): 3235-3240. DOI:10.1016/j.atmosenv.2006.10.080 (  0) 0) |
| [9] |
DU Z, ZHANG Y, WANG G, et al. TPhP Exposure Disturbs Carbohydrate Metabolism, Lipid Metabolism, and the DNA Damage Repair System in Zebrafish Liver[J]. Scientific Reports, 2016, 6(11): 21827. (  0) 0) |
| [10] |
WHO.Enviromental Health Criteria 112:Tri-n-Butyl Phosphate[Z].Geneva, Switzerland:World Health Organization, 1991. http://www.inchem.org/documents/ehc/ehc/ehc112.htm
(  0) 0) |
| [11] |
MARKLUND A, ANDERSSON B, HAGLUND P. Organophosphorus Flame Retardants and Plasticizers in Swedish Sewage Treatment Plants[J]. Environmental Science & Technology, 2005, 39(19): 7423-7429. (  0) 0) |
| [12] |
MEEKER J D, STAPLETON H M. House Dust Concentrations of Organophosphate Flame Retardants in Relation to Hormone Levels and Semen Quality Parameters[J]. Environmental Health Perspectives, 2010, 118(3): 318-323. (  0) 0) |
| [13] |
WHO.Environmental Health Criteria 209:Flame Retardants:Tris(Chloropropyl) Phosphate and Tris(2-Chloroethyl) Phosphate[Z].Geneva, Switzerland:World Health Organization, 1998. http://www.inchem.org/documents/ehc/ehc/ehc209.htm
(  0) 0) |
| [14] |
LAW R J, COVACI A, HARRAD S, et al. Levels and Trends of PBDEs and HBCDs in the Global Environment:Status at the End of 2012[J]. Environment International, 2014, 65: 147-158. DOI:10.1016/j.envint.2014.01.006 (  0) 0) |
| [15] |
EU(European Union).Risk Assessment Report of Tri(2-Chloroethyl) Phosphate, 2008.CAS No:115-96-8 EINECS No:204-118-5[Z].s. l.:[s. n., 2008.
(  0) 0) |
| [16] |
OECD.Guidelines for the Testing of Chemicals, No.236 Fish Embryo Acute Toxicity (FET) Test[Z].Paris:OECD, 2013. http://www.oalib.com/references/5831193
(  0) 0) |
| [17] |
OECD.Guidelines for the Testing of Chemicals, No. 210 Fish, Early-Life Stage Toxicity Test[Z].Paris:OECD, 2013.
(  0) 0) |
| [18] |
European Chemical Bureau.Technical Guidance Document on Risk Assessment in Support of Commission Directive 93/67/EEC on Risk Assessment for New Notified Substances, Commission Regulation (EC)No. 14488/94 on Risk Assessment for Existing Substances, and Directive 98/EC of the European Parliament and of the Council Concerning the Placing of Biocidal Products on the Market[R].Luxembourg:Office for Official Publications of the European Communities, 2003.
(  0) 0) |
| [19] |
HERNANDO M D, MEZCUA M, FERNÁNDEZ-ALBA A R, et al. Environmental Risk Assessment of Pharmaceutical Residues in Wastewater Effluents, Surface Waters and Sediments[J]. Talanta, 2005, 69(2): 334-342. (  0) 0) |
| [20] |
DU Z K, WANG G W, GAO S X, et al. Aryl Organophosphate Flame Retardants Induced Cardiotoxicity During Zebrafish Embryogenesis:By Disturbing Expression of the Transcriptional Regulators[J]. Aquatic Toxicology, 2015, 161: 25-32. DOI:10.1016/j.aquatox.2015.01.027 (  0) 0) |
| [21] |
皮天星, 蔡磊明, 蒋金花, 等. 新型阻燃剂TCPP对斑马鱼的毒性研究[J]. 生态毒理学报, 2016, 11(2): 247-256. PI Tian-xing, CAI Lei-ming, JIANG Jin-hua, et al. Toxicity Effects of a New Flame Retardant Tris(2-Chloroisopropyl) Phosphate to Zebrafish(Danio rerio)[J]. Asian Journal of Ecotoxicology, 2016, 11(2): 247-256. (  0) 0) |
| [22] |
塔娜, 房彦军, 林本成, 等. 磷酸三(2, 3-二氯丙基)酯阻燃剂对稀有鲫的毒性效应[J]. 生态毒理学报, 2013, 8(5): 757-762. TA Na, FANG Yang-jun, LIN Ben-cheng, et al. Toxicity Effect of Tri(2, 3-Dichloroprophyl) Phosphate Flame Retardant on Rare Minnow(Gobiocypris rarus)[J]. Asian Journal of Ecotoxicology, 2013, 8(5): 757-762. DOI:10.7524/AJE.1673-5897.20130116002 (  0) 0) |
| [23] |
CUNNINGHAM V L, CONSTABLE D J, HANNAH R E. Environmental Risk Assessment of Paroxetine[J]. Environmental Science & Technology, 2004, 38(12): 3351-3359. (  0) 0) |
| [24] |
MARIE-PIERRE H, RORTAIS A, ARNOLD G, et al. New Risk Assessment Approach for Systemic Insecticides:The Case of Honey Bees and Imidacloprid (Gaucho)[J]. Environmental Science & Technology, 2006, 40(7): 2448-2454. (  0) 0) |