环境雌激素(environmental estrogens, EEs)指具有雌激素活性或者抗雄激素效应, 能够模拟或者干扰天然雌激素正常生理和生化作用的一类化合物。近年来, 激素类药物被广泛用于人类日常生活和养殖业中, 造成排放到环境中的雌激素种类日益增多[1]。固醇类是环境中常见的雌激素物质, 如雌酮(E1)、雌二醇(E2)、雌三醇(E3) 和17α-乙炔基雌二醇(EE2)。AERNI等[2]研究指出污水厂出水中E1、E2和EE2质量浓度分别为51、6和2 ng·L-1。WANG等[3]在一些地表水中检测到E1和E2质量浓度分别高达7.4和55.8 ng·L-1。由于雌激素物质的难降解性和稳定性, 污水处理厂出水成为水环境中雌激素的重要来源之一[4]。
化学方法检测到的单一雌激素浓度不能揭示其对水环境的实际生态风险, 而生物效应评价弥补了这方面的不足。检测雌激素活性的体外方法包括重组酵母菌法(YES)、细胞增殖法和酶联免疫吸附法(ELISA)等。其中重组酵母菌法是传统的评价水环境雌激素效应的方法[5], 酶联免疫吸附法则是基于抗原-抗体的特异性反应原理, 主要用来检测细胞和血液中雌激素含量。A2/O工艺因其工艺成熟、便于管理、对有机物去除效果好以及出水水质稳定等优点, 被广泛应用于污水处理。笔者分别采用化学分析、重组酵母菌法和酶联免疫法对A2/O工艺处理前后水样的典型固醇类雌激素水平和雌激素活性进行全面研究, 并对3者进行比较, 以期为水环境的生态风险评价提供依据。
1 材料与方法 1.1 化学试剂E1、E2、E3、EE2以及邻硝基酚β-D-半乳糖苷(o-Nitrophenyl β-D-galactopyranoside, ONPG)为超级纯, 购自Sigma-Aldrich公司; 无氨基酵母氮碱、DO和SD溶液所用的氨基酸均为超级纯, 购于Difco公司;HPLC级二甲基亚砜(DMSO)、甲醇和乙酸乙酯购自天津科密欧公司;试验用水均为超纯水。
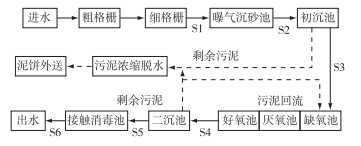
1.2 水样的采集与预处理污水来源于以A2/O为主要处理工艺的西安市某污水厂各处理单元的进出水。选取细格栅出水(S1)、曝气沉砂池出水(S2)、初沉池出水(S3)、好氧池出水(S4)、二沉池出水(S5) 和加氯消毒出水(S6)6个取样点, 污水处理工艺流程及取样点如图 1所示。水样取回后, 立即进行如下预处理:各水样用玻璃纤维膜(0.45 μm, Millipore, GF/B)进行过滤, 1 L滤液用固相萃取小柱(Oasis HLB 6 mL/ 200 mg Cartridge, Waters)进行浓缩富集。具体操作如下:依次经10 mL乙酸乙酯、10 mL甲醇和10 mL超纯水通过固相萃取小柱进行润湿活化, 中间不允许填料抽干。使水样连续通过固相小柱, 调节真空泵的真空度, 使流速保持在5~10 mL·min-1。水样全部过滤完后再用10 mL纯水洗涤, 继续真空抽气干燥15 min, 将固相小柱放在离心机中离心15 min, 转速为3 500 r·min-1, 离心半径为81 mm。最后用10 mL乙酸乙酯洗脱柱子, 收集洗脱液, 用高纯氮气吹干, 得到萃取物。对于化学检测, 萃取物用1 mL甲醇进行溶解; 雌激素活性检测时, 萃取物用500 μL DMSO溶解并进行梯度稀释; 酶联免疫法分析时, 萃取物用φ=1%的DMSO溶解, 最终浓缩倍数为100倍。
|
图 1 污水厂处理工艺流程图及取样点 Figure 1 Technological flowchart of the sewage treatment plant and sampling sites |
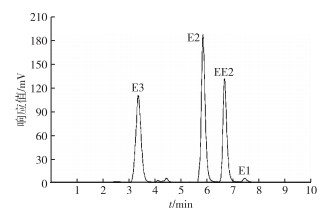
雌激素E1、E2、E3和EE2采用高效液相色谱仪(日本分光LC-2000) 测定。HPLC色谱柱为Agilent 5 TC-C18 (250 mm×4.6 mm); 流动相为乙腈和水, 两者体积比例为60 :40, 流动相流速设为1 mL·min-1, 柱温为30 ℃。检测器为紫外(MD-2010) 和荧光检测器(FP-2020) 联用; 紫外检测器波长为280 nm, 荧光检测器吸收波长和发射波长分别为227和315 nm; 进样体积为100 μL, 每个物质的出峰时间如图 2所示。
|
图 2 高效液相检测方法的出峰时间 Figure 2 Times of peaking in HPLC |
雌激素活性采用中国科学院生态环境中心建立的酵母双杂交雌激素活性评价方法[6]。将酵母菌置于SD培养基中, 在30 ℃、130 r·min-1条件下培养36 h。用SD培养液稀释至600 nm处吸光度为0.75左右, 吸取菌液995 μL于1.5 mL灭菌离心管中, 加入5 μL样品, 混匀。每个样品设6个梯度。将200 μL混合菌液转移到96孔板中, 每个浓度设置3个平行, 在30 ℃、800 r·min-1条件下暴露2 h。测定菌悬液在600 nm处的吸光度值, 随后每孔弃去150 μL, 加入120 μL测试缓冲液和20 μL氯仿, 以1 200 r·min-1振荡破壁15 min, 加入40 μL ONPG, 于30 ℃、800 r·min-1条件下培养显色60 min。显色结束后, 每孔加入100 μL 1 mol·L-1碳酸钠溶液, 终止反应。吸取200 μL上清液至新96孔板中, 测定420 nm处吸光度。同时, 以DMSO作为阴性对照, 以E2作为阳性对照。
β-半乳糖苷酶活性(U)和雌激素当量(EEQ,QEE)计算公式为
| $ U = \frac{{({A_{420}}-{A_{420}}') \times D}}{{t \times V \times {A_{600}}}}, $ | (1) |
| $ {Q_{{\rm{EE}}}} = \frac{{\rho ({\rm{E}}{{\rm{C}}_{50, {\rm{E}}2}})}}{{\rho ({\rm{E}}{{\rm{C}}_{50, 样品}})}}。$ |
式(1)~(2) 中, t为从加入ONPG到溶液显色时的反应时间, 取值60 min; V为菌液体积, 取值0.2 mL; A600和A420分别为菌液在600和420 nm处的光密度值; A420′为空白对照在420 nm处的光密度值; D为稀释因子, 取值6.6。ρ(EC50, E2)为雌二醇的半数有效浓度(EC50), 取值18.33 ng·L-1; ρ(EC50, 样品)为实际样品的EC50值, ng·L-1。
1.3.3 酶联免疫吸附法E2测定根据试剂盒说明书(Estradiol, DRG)进行操作, 简述如下:将标准品和浓缩样品分别用新的取样吸头取25 μL加入到相应的微孔中。在每个微孔中加入200 μL酶联物, 充分混匀10 s, 室温孵育2 h, 快速弃去微孔内反应物, 每孔用400 μL洗涤液洗板3次, 在吸水纸上拍干。在每个微孔中加入100 μL底物液, 室温孵育15 min, 随后加50 μL终止液到每个检测孔中终止酶反应。10 min后, 测450 nm处吸光度。
1.4 数据分析重组酵母菌的雌激素活性采用Origin软件由最小二乘法计算得出。应用GraphPad® Prism 5软件中的单因素方差分析对当量进行差异显著性分析。
2 结果与讨论 2.1 雌激素浓度水平分析由表 1可知,E1、E2、E3和EE2的回收率分别为62%~65%、70%~85%、67%~81%以及69%~94%。GUEDES-ALONSO等[7]曾报道固醇类雌激素的回收率为31%~119%, 笔者的研究结果与其具有一致性, 说明该化学检测方法具有可行性。
|
|
表 1 不同浓度目标雌激素的回收率 Table 1 Recovery rate of target EDCs relative to concentration |
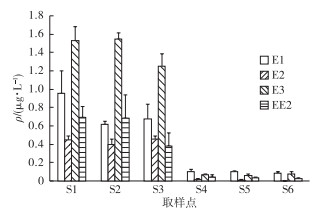
污水经以A2/O处理工艺为主的常规活性污泥处理之后, COD去除率为94%, 总氮去除率为77%, 总磷去除率为80%, 出水达到我国GB 18918—2002《城镇污水处理厂污染物排放标准》中的一级B类标准, 污水处理厂运行良好。由图 3可知, 污水处理前后都存在一定浓度的雌激素。进水中雌激素质量浓度达上百ng·L-1甚至μg·L-1级别。进水中E3质量浓度为1 531.33 ng·L-1, 是浓度最高的雌激素, 其次是E1、EE2和E2, 质量浓度分别为962.24、698.81和447.64 ng·L-1。经过二级生物处理之后, 雌激素得到明显去除, 出水E1、E2、E3和EE2质量浓度分别为87.96、5.50、75.32和30.63 ng·L-1。英国污水处理厂出水E1、E2和EE2质量浓度分别为1~80、1~50和0.2~7.0 ng·L-1[8], 笔者的检测结果与其相当。
|
图 3 各取样点E1、E2、E3和EE2浓度 Figure 3 Concentrations of E1, E2, E3 and EE2 in wastewater sampled at each sampling point 采样次数n=6。 |
雌激素的物理化学特性对其在污水处理过程中的去除和归趋有重要作用。例如, 典型固醇类雌激素具有较低的亨利常数(Hc), 并且与正辛醇/水分配系数(Kow)的比值Hc/Kow低于10-9, 因此挥发作用对雌激素在整个污水处理工艺的去除效果甚为微弱[9], 笔者试验中曝气沉砂池对雌激素的去除率低于10%。在初沉池中, E1、EE2和E3的去除率分别为29.72%、16.37%和18.21%, 而E2几乎没有变化。这些微弱的削减作用可能是由于雌激素被吸附到固体颗粒上, 随着颗粒的沉降而被去除。在厌氧/缺氧/好氧阶段, 好氧池出水中E1、E2、E3和EE2的去除率分别高达88.83%、95.69%、95.21%和93.09%。一些研究表明严格的厌氧/缺氧/好氧环境构建了良好的脱氮除磷菌群结构, 这种特性的污泥更有利于雌激素的吸附, 且硝化过程可促进雌激素的降解[10]。二沉池工艺未能明显去除4种雌激素, 加氯消毒过程使60.30%的E2得到去除, 而其他雌激素的去除效果并不明显。因此, 在污水处理厂中, 生物降解和污泥吸附对雌激素的去除起着至关重要的作用, 而物理处理作用的效果并不显著。
在生物处理过程中, E1的去除率低于其他类固醇雌激素。这可能是由于E2在微生物的降解过程中产生了E1, 影响了E1的去除效果[11]。另一方面, 物质的去除效果和其物化特性有一定的关系。例如, 物质的lg Kow值决定了其与污泥的吸附能力, 在2.5~4.0之间时表现出中度吸附能力; >4.0时, 表现出高吸附能力[13]。E1、E2、E3和EE2的lg Kow范围为2.81~4.15[12]。由此可知, 固醇类雌激素易被好氧污泥吸附, 因而在好氧池中的去除率较高。另一方面, E2在厌氧、缺氧和好氧条件下均可以被微生物降解, 而EE2只有在好氧条件下才能得到有效去除[13], 且由EE2的lg Kow值(4.15) 可知其去除机制主要为污泥吸附[11], 故EE2的去除率要低于E2。尽管典型固醇类雌激素能够得到一定的去除, 但由于水环境中存在一些类雌激素物质(如双酚A), 影响上述4种固醇类物质的综合生物效应, 因此, 有必要进行生物毒性检测以进一步明确污水的毒性效应。
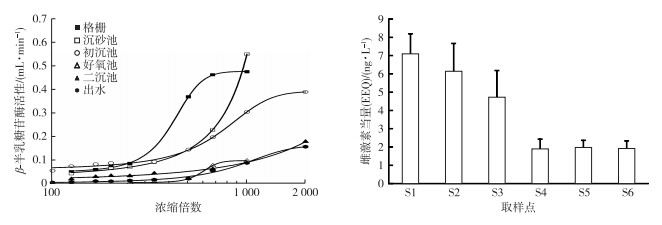
2.2 雌激素活性分析图 4显示了重组酵母菌法检测中各取样点污水β-半乳糖苷酶活性变化, 以及以E2为当量表示的雌激素活性。
|
图 4 各采样点β-半乳糖苷酶活性和雌激素活性 Figure 4 Activity of β-galactosidase and its estrogenic effects in wastewater sampled at each sampling point |
由图 4可知, 当水样浓缩倍数为1 000时, 曝气沉砂池出水β-半乳糖苷酶活性高于格栅出水, 这是由于在曝气沉砂池污水中颗粒物表面附着的雌激素物质被剥离而溶于水所致。进水的雌激素活性EEQ为7.09 ng·L-1, 经曝气沉砂池和初沉池预处理后污水的EEQ分别为6.14和5.72 ng·L-1, 以上样品的雌激素活性并没有显著性差异(F=0.843, P=0.511 2)。经A2/O生物处理之后, 污水的EEQ为1.89 ng·L-1, 经二沉池和加氯消毒之后最终出水的EEQ分别为1.97和1.92 ng·L-1。这与前人研究结果(0.031.6 ng·L-1)[14-15]具有一致性。二级处理之后的水样EEQ与进水相比具有显著性差异(F=35.06, P=0.002 5)。
由图 4可知, 曝气沉砂池和初沉池对雌激素活性的去除率分别为13.41%和33.44%, 雌激素活性未见显著降低, 好氧池中EEQ去除率为73.33%。由于氨氧化菌控制着雌激素的硝化过程[16], 例如E1和E2硝化产物的雌激素活性相对较低[17]。好氧池中氨氮去除率达94%, 这有可能导致雌激素活性的去除。此外, 对好氧池污泥EEQ的测定结果显示, 其EEQ为1.9 ng·g-1, 这说明污泥吸附对雌激素活性具有一定的去除作用。总体而言, 随着雌激素的降解或者吸附, 雌激素活性明显降低。然而经过二沉池之后, 出水EEQ有微弱上升, 这可能是由于沉降过程中污泥上含有的雌激素活性物质重新溶解所致[11]。与之类似, 经过加氯消毒之后, 污水厂出水EEQ并没有降低。该结论和ZENG等[18]的研究结果具有一致性, 即加氯消毒对二级出水雌激素活性没有持续的去除作用。在消毒过程中产生的中间产物含有雌激素活性, 从而导致出水EEQ较稳定。例如E1、E2和EE2的消毒副产物具有相当的雌激素活性[19]。当水环境的EEQ大于1 ng·L-1时, 会对水生生物产生一定的危害[20]。因此, 尽管雌激素去除率较高(>90%), 但是污水厂出水仍会对受纳水体的水生生物产生潜在危害。
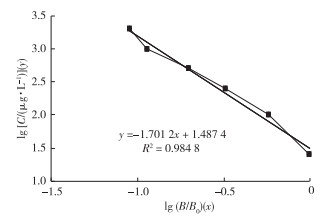
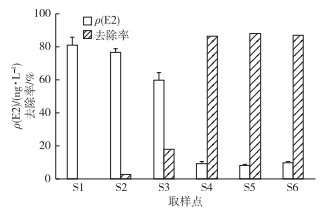
2.3 酶联免疫试验以E2浓度对数lg C和吸光率对数lg (B/B0)作标准曲线图, 所得结果如图 5所示, 该方法对E2的检测限为10.6 pg·mL-1。由图 6可见, 用酶联免疫法检测到进水E2质量浓度为82.82 ng·L-1, 与MANICKUM等[21]报道的E2质量浓度(119 ng·L-1)相近。经过曝气沉砂池和初沉池之后, E2质量浓度分别降低为76.80和69.65 ng·L-1。经过厌氧/缺氧/好氧处理之后, E2质量浓度降低为9.26 ng·L-1。经三级处理二沉池和加氯消毒之后,最终出水E2质量浓度为10.14 ng·L-1, 与好氧池出水相比, 雌激素活性的降低并不显著(F=4.61, P=0.121 7), 这与用重组酵母菌法检测雌激素活性的结果具有一致性。E2经过曝气沉砂池和初沉池后没有得到明显去除(去除率低于14%), 而经过厌氧/缺氧/好氧阶段之后, E2的去除率约为88.83%, 该值与用重组酵母菌法检测雌激素活性的去除率相当。此外, 酶联免疫法检测到污泥中E2质量浓度为12.2 ng·g-1, 这进一步说明污泥对雌激素具有一定的吸附作用。经过二沉池和加氯消毒之后, 污水厂出水E2浓度并没有降低。
|
图 5 ELISA检测的标准曲线 Figure 5 Standard curve of ELISA test C—E2质量浓度;B/B0—吸光率。 |
|
图 6 水样中E2浓度和去除率 Figure 6 Concentration of E2 in the wastewater and its removal rate |
试验初期利用酶联免疫法得出的E2浓度比用化学分析得到的E2浓度低, 但是两者之间差距随着处理工艺流程的进行而减小, 利用酶联免疫法检测得到最终出水中E2质量浓度为10.01 ng·L-1, 高于化学分析出水中E2浓度。CAMILLE等[22]研究也得出利用酶联免疫法检测的水体目标物浓度水平比化学检测值高。环境水样品中存在着和E2结构非常相似的其他雌激素(如E1和EE2)。这些物质可以与微孔板上包被的E2抗体发生交叉反应, 使得酶联免疫法检测结果偏高[23]。另外, 酶联免疫法检测所得E2值与重组酵母菌法所得EEQ相比, 其值偏高1个数量级, 但两者的趋势具有一致性。环境水样中的各种化学物质可能存在拮抗作用[19], 一些具有抗雌激素作用的物质会使重组酵母菌法检测值降低。酶联免疫法与传统的化学分析及重组酵母菌法相比具有一定的优势, 例如操作简单、节约时间和成本以及样品量少等。总之, 酶联免疫法可成为化学检测和重组酵母菌检测的一个重要补充, 为及时采取污染控制措施提供技术保证。
3 结论(1) 曝气沉砂池和初沉池对4种固醇类雌激素具有微弱的去除作用, 而A2/O生物处理对雌激素的去除具有明显效果, 去除率高达90%, 对目标雌激素的去除效果由高到低依次为E2、E3、EE2和E1。
(2) 采用重组酵母菌法研究污水处理厂中雌激素的活性水平发现, 二级生物处理能很好地降低污水厂雌激素活性, 去除率高达73.33%。尽管雌激素浓度得到了一定程度的去除, 但出水仍具有一定的雌激素生物效应。
(3) 酶联免疫法分析发现, A2/O对E2的去除率为88.23%, 与化学分析和重组酵母菌法检测结果一致。
(4) 酶联免疫法具有操作简单、节约时间和成本等优点, 可应用于城市污水雌激素快速筛选和诊断。
| [1] |
谭丽超, 葛峰, 单正军, 等. 超高效液相色谱串联质谱法测定污水处理厂水样中的雌激素[J]. 生态与农村环境学报, 2011, 27(5): 86-92. TAN Li-chao, GE Feng, SHAN Zheng-jun, et al. Determination of Estrogens in Water Samples From Wastewater Treatment Plant Using Ultra-Performance Liquid Chromatography-Electrospray Tandem Mass Spectrometry Method[J]. Journal of Ecology and Rural Environment, 2011, 27(5): 86-92. (  0) 0) |
| [2] |
AERNI H R, KOBLER B, RUTISHAUSER B V, et al. Combined Biological and Chemical Assessment of Estrogenic Activities in Wastewater Treatment Plant Effluents[J]. Analytical and Bioanalytical Chemistry, 2004, 378(3): 688-696. DOI:10.1007/s00216-003-2276-4 (  0) 0) |
| [3] |
WANG L, YING G G, ZHAO J L, et al. Assessing Estrogenic Activity in Surface Water and Sediment of the Liao River System in Northeast China Using Combined Chemical and Biological Tools[J]. Environmental Pollution, 2010, 159(1): 148-156. (  0) 0) |
| [4] |
BOLONG N, ISMAIL A F, SALIM M R. A Review of the Effects of Emerging Contaminants in Wastewater and Options for Their Removal[J]. Desalination, 2009, 239(1/2/3): 229-246. (  0) 0) |
| [5] |
VÄLITALO P, PERKOLA N, SEILER T B, et al. Estrogenic Activity in Finnish Municipal Wastewater Effluents[J]. Water Research, 2016, 88: 740-749. DOI:10.1016/j.watres.2015.10.056 (  0) 0) |
| [6] |
MA M, LI J, WANG Z. Assessing the Detoxication Efficiencies of Wastewater Treatment Processes Using a Battery of Bioassays/Biomarkers[J]. Archives of Environment Contamination and Toxicology, 2005, 49(4): 480-487. DOI:10.1007/s00244-004-0204-z (  0) 0) |
| [7] |
GUEDES-ALONSO R, SANTANA-VIERA S, SOSA-FERRERA Z, et al. Molecularly Imprinted Solid-Phase Extraction Coupled With Ultra High Performance Liquid Chromatography and Fluorescence Detection for the Determination of Estrogens and Their Metabolites in Wastewater[J]. Journal of Separation Science, 2015, 38(22): 3961-3968. DOI:10.1002/jssc.v38.22 (  0) 0) |
| [8] |
DESBROW C, RUTLEDGE E J, BRIGHTY G C, et al. Identification of Estrogenic Chemicals in STW Effluent:1. Chemical Fractionation and in Vitro Biological Screening[J]. Environmental Science Technology, 1998, 32(11): 1549-1558. DOI:10.1021/es9707973 (  0) 0) |
| [9] |
ROGERS H R. Sources, Behaviour and Fate of Organic Contaminants During Sewage Treatment and Sewage Sludges[J]. Science of the Total Environment, 1996, 185(1/2/3): 3-26. (  0) 0) |
| [10] |
FORREZ I, CARBALLA M, NOPPE H, et al. Influence of Manganese and Ammonium Oxidation on the Removal of 17α-Ethinylestradiol (EE2)[J]. Water Research, 2009, 43(1): 77-86. DOI:10.1016/j.watres.2008.10.006 (  0) 0) |
| [11] |
张照韩, 冯玉杰, 苏惠, 等. AO与AAO工艺去除雌激素效能对比及分析[J]. 环境科学学报, 2011, 31(1): 26-32. ZHANG Zhao-han, FENG Yu-jie, SU Hui, et al. Comparison and Analysis of Estrogen Removal Efficiency in AO and AAO Processes[J]. Acta Scientiae Circumstantiae, 2011, 31(1): 26-32. (  0) 0) |
| [12] |
LAI K M, JOHNSON K L, SCRIMSHAW M D, et al. Binding of Waterborne Steroid Estrogens to Solid Phases in River and Estuarine Systems[J]. Environment Science & Technology, 2000, 34(18): 3890-3894. (  0) 0) |
| [13] |
VADER J S, VAN GINKEL C G, SPERLING F M G M, et al. Degradation of Ethinyl Estradiol by Nitrifying Activated Sludge[J]. Chemosphere, 2000, 41(8): 1239-1243. DOI:10.1016/S0045-6535(99)00556-1 (  0) 0) |
| [14] |
MA M, RAO K F, WANG Z J. Occurrence of Estrogenic Effects in Sewage and Industrial Wastewaters in Beijing, China[J]. Environmental Pollution, 2007, 147(2): 331-336. DOI:10.1016/j.envpol.2006.05.032 (  0) 0) |
| [15] |
GAULKE L S, STRAND S E, KALHORN T F, et al. 17α-Ethinylestradiol Transformation via Abiotic Nitration in the Presence of Ammonia Oxidizing Bacteria[J]. Environmental Science & Technology, 2008, 42(20): 7622-7627. (  0) 0) |
| [16] |
ZHU B T, HAN G Z, SHIM J Y, et al. Quantitative Structure-Activity Relationship of Various Endogenous Estrogen Metabolites for Human Estrogen Receptor Alpha and Beta Subtypes:Insights Into the Structural Determinants Favoring a Differential Subtype Binding[J]. Endocrinology, 2006, 147(9): 4132-4150. DOI:10.1210/en.2006-0113 (  0) 0) |
| [17] |
MORIYAMA K, MATSUFUJI H, CHINO M, et al. Identification and Behavior of Reaction Products Formed by Chlorination of Ethynylestradiol[J]. Chemosphere, 2004, 55(6): 839-847. DOI:10.1016/j.chemosphere.2003.11.045 (  0) 0) |
| [18] |
ZENG S Y, HUANG Y Q, SUN F, et al. Probabilistic Ecological Risk Assessment of Effluent Toxicity of a Wastewater Reclamation Plant Based on Process Modeling[J]. Water Research, 2016, 100: 367-376. DOI:10.1016/j.watres.2016.05.039 (  0) 0) |
| [19] |
VETHAAK A D, LAHR J, SCHRAP S M, et al. An Integrated Assessment of Estrogenic Contamination and Biological Effects in the Aquatic Environment of the Netherlands[J]. Chemosphere, 2005, 59(4): 511-524. DOI:10.1016/j.chemosphere.2004.12.053 (  0) 0) |
| [20] |
JAROŠOVÁ B, BLÁHA L, GIESY J P, et al. What Level of Estrogenic Activity Determined by in Vitro Assays in Municipal Waste Waters Can Be Considered as Safe?[J]. Environment International, 2014, 64: 98-109. DOI:10.1016/j.envint.2013.12.009 (  0) 0) |
| [21] |
MANICKUM T, JOHN W.Occurrence, Fate and Environmental Risk Assessment of Endocrine Disrupting Compounds at the Wastewater Treatment Works in Pietermaritzburg (South Africa)[J].Science of the Total Environment, 2014, 468/469:584-597.
(  0) 0) |
| [22] |
CAMILLE P, EMMANUELLE V. Utilisation of an Enzyme-Linked Immunosorbent Assay (ELISA) for Determination of Alkylphenols in Various Environmental Matrices:Comparison With LC-MS/MS Method[J]. Talanta, 2011, 85(5): 2492-2497. DOI:10.1016/j.talanta.2011.07.102 (  0) 0) |
| [23] |
张明辉, 吴曼莉, 杨瑞, 等. 利用酶联免疫测定水中雌二醇[J]. 分析试验室, 2014, 34(1): 27-30. ZHANG Ming-hui, WU Man-li, YANG Rui, et al. Study on Determination of Estradiol in Water Using Enzyme-Linked Immunoassay[J]. Chinese Journal of Analysis Laboratory, 2014, 34(1): 27-30. (  0) 0) |




