2. 中国科学院南京土壤研究所-香港浸会大学土壤与环境联合开放实验室, 江苏 南京 210008;
3. 中国科学院大学, 北京 100049
2. Joint Open Laboratory of Soil and the Environment, Hong Kong Baptist University & Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
人工纳米材料(engineered nanomaterials, ENMs)应用广泛, 易通过生产、储藏、使用及废物处理等环节进入大气、水体和土壤等环境中[1]。目前主要通过模型预测纳米材料在环境中的浓度[2], 如GOTTSCHALK等[3]和SUN等[4]通过模型预测发现ENMs在土壤中的浓度远高于大气和水体。据统计, ENMs主要通过污泥农用、土壤修复剂和工厂泄露等途径进入土壤[5]。此外, 大气沉降和农田灌溉可将ENMs从大气和水体带入土壤[6]。ENMs进入土壤后, 势必会对土壤生态系统产生一定程度的影响[7]。
植物是土壤生态系统的重要组分之一, 可通过吸收、转运、累积和食物链传递将ENMs带入生物体内, 对生物产生潜在风险[8]。因此, ENMs对于植物的生物效应应引起广泛关注。YIN等[9]通过显微技术观察到纳米银(Ag)通过吸附附着在植物根系表面, 经氧化溶解Ag穿过细胞膜进入细胞内, 而后转运至植物其他部位, 影响植物生长。SERVIN等[10]发现纳米二氧化钛(TiO2)可进入黄瓜体内, 改变黄瓜果实中脂质、氨基化合物和碳水化合物等的化学环境, 从而降低黄瓜的营养价值。纳米磁性氧化铁(Fe3O4)也被发现可产生氧化胁迫, 进入植物组织[11-12]。虽然目前针对ENMs的植物效应的研究已有较多报道, 但多基于植物, 缺少微生物的协同作用研究[13]。在自然生态系统中, 植物与微生物之间相互影响相互作用, 构成植物-微生物生态区域[14]。已有研究发现微生物能通过自身或其代谢产物影响ENMs活性, 进而改变ENMs的植物效应[15]。因此, ENMs对植物-微生物的影响更值得重视。
丛枝菌根(arbuscular mycorrhizal, AM)真菌是土壤生态系统中一类广泛存在的共生微生物, 通过侵染植物根系与陆地上约90%的植物形成互惠共生体, 可促进植物吸收氮、磷等营养元素[16]。此外, AM真菌的根内和根外菌丝均具有较高的重金属吸附能力[17], 可影响植物对污染物的吸收、转运和积累, 对农产品的质量安全具有重要意义[18]。目前已有大量文献证实AM真菌可提高植物体内营养元素含量, 改变植物对重金属的吸收和转运, 增强植物对重金属胁迫的抵抗作用[19]。王卫中等[20]发现AM真菌增加了玉米植株对氮、磷、钾等养分的吸收, 并通过将Zn固定在植物根部/根内菌丝, 减少Zn向地上部的转运, 从而缓解纳米氧化锌(ZnO)对植物的毒害作用。FENG等[21]发现纳米Ag处理下AM真菌减少了Ag在植物体内的累积量, 降低了纳米Ag对植物生长的抑制作用。但由于AM真菌的生态功能受污染物种类、宿主植物等多种因素的影响[22], 其他ENMs如纳米Fe3O4与AM真菌之间的关系值得深入研究。
选取典型纳米材料纳米Fe3O4为研究对象, 以玉米(Zea mays)为供试植物, 在盆栽条件下模拟不同水平纳米Fe3O4污染的土壤, 研究接种AM真菌和施加纳米Fe3O4对玉米植株生长、营养状况和Fe吸收和转运的影响, 旨在评价AM真菌和纳米Fe3O4对玉米植株生长和Fe吸收的影响。该研究不仅可为未来纳米Fe3O4的生产使用提供理论指导, 还可为AM真菌的应用和降低作物污染风险提供一定依据。
1 材料与方法 1.1 试验材料供试植物为玉米。供试纳米Fe3O4采用氧化-沉淀法制备[23]。利用透射电子显微镜(TEM, JEOL/JEM-2000E)测定纳米Fe3O4的形态特征(图 1), 结果显示纳米Fe3O4为圆形。利用选区电子衍射(SAED)(ED, JEOL, JEM-200EX)分析400个粒子, 得出其平均粒径为(10.5±2.6) nm。用Zeta电位仪(BECKMAN, Delsa 440SX)测定纳米Fe3O4的Zeta电位约为(-23.90±0.42) mV。微米Fe3O4购自国药集团化学试剂有限公司, 分析纯, 纯度为99%, 平均粒径约为5 μm。
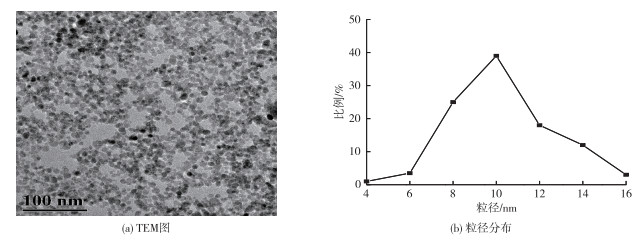
|
图 1 纳米Fe3O4的TEM图和粒径分布 Figure 1 TEM image and relative size distribution of iron oxide magnetic nanoparticles |
供试土壤采自中国科学院封丘农业生态实验站(35°00′ N, 114°24′ E)一小麦田。小麦成熟后, 采集表层0~15 cm土壤, 经自然风干后去除植物残体及石块, 过2 mm孔径筛, 置于4 ℃冷库中备用。土壤类型为华北平原的典型潮土, 土壤基本理化性质:pH值为8.45, w(全氮)为0.59 g·kg-1, w(全磷)为0.55 mg·kg-1, w(全钾)为16.9 mg·kg-1, w(有机碳)为4.62 g·kg-1。所接种的AM真菌为实验室分离保藏的苏格兰球囊霉菌(Glomus caledonium)[24], 以河沙为培养基质, 以白三叶草(Trifolium repens)为宿主植物进行扩大繁殖, 去掉植物地上部, 将根剪碎, 以获得的含有AM真菌孢子、菌丝、侵染根段等繁殖体和根际沙土的菌剂为接种物。
1.2 试验设计试验设置3个在纳米Fe3O4生物效应研究中常用的施加水平(0.1、1.0和10.0 mg·kg-1,代号分别为NL、NM和NH)[25], 并设置相应施加水平的微米Fe3O4(代号分别为WL、WM和WH)为对照, 以不添加Fe3O4材料的处理为空白对照, 每个水平下设置接种AM真菌(+M)和不接种AM真菌(-M)处理, 共14个处理, 每个处理3次重复。
选用250 mL塑料盆(上口直径7.0 cm, 高9.2 cm), 每盆装入180 g风干过筛土。接种AM真菌的处理每盆施加9 g AM菌剂(接种量为土壤总量的5%), 采用混施法将其与土壤混匀; 不接种处理加入等量灭活菌剂, 采用121 ℃高压蒸汽灭菌锅进行间歇式灭菌, 每次0.5 h, 灭4次, 并浇上上述菌剂滤液, 使其他微生物群落尽量与接种处理一致。采用逐级混匀法施加纳米Fe3O4或微米Fe3O4[26]。玉米种子先用w=0.5%的NaClO表面消毒后放于浸水的滤纸上,并将其置于25 ℃培养箱中催芽48 h, 选取已发芽的种子, 移栽至装有土壤和纳米Fe3O4或微米Fe3O4的混合基质中, 每盆播种2颗, 覆土0.5 cm。试验在日光温室进行, 光照时间为每天12 h, 白天和夜间温度分别约为28和20 ℃, 相对湿度为40%~60%。各处理在温室中随机排列, 每3 d重新随机排列各盆的位置, 定期用称重法浇水。每盆每周浇灌20 mL Hoagland营养液, 以保证植物生长。待苗龄20 d时各处理间植物生长呈明显差异, 收获所有玉米植株。
1.3 测定项目与方法分开收获玉米植株地上部和地下部, 依次用自来水和蒸馏水冲洗, 105 ℃杀青30 min后, 70 ℃烘干48 h, 称干重[27]317。地下部烘干前挑取部分细根称鲜重, KOH消煮后用曲利苯蓝进行染色, 利用根段频率标准法检测AM真菌对玉米根系的侵染率[28]。玉米植株地上部和地下部烘干后粉碎分为2份:一份用H2SO4-H2O2消煮, 用凯氏定氮仪测定氮(N)含量, 用钼锑抗比色法测定磷(P)含量, 用火焰光度计测定钾(K)含量[29];另一份用浓HNO3消煮, 用原子吸收分光光度计测定锌(Zn)、镁(Mg)、钙(Ca)和铁(Fe)含量[27]336。从3个方面评估玉米植株Fe的吸收和转运率:(1) 玉米植株地上部和地下部Fe含量; (2) 单个植株Fe吸收总量; (3) Fe转运率。
采用TEM(JEOL/JEM-2000E)观察Fe在玉米根系的分布情况[30]。首先将新鲜玉米根尖放入pH值为7.2的磷酸缓冲液中, 放于洁净的载玻片上,用刀片切成1 mm×1 mm的小块, 然后迅速放入用上述pH值的磷酸缓冲液配制的φ=4%的戊二醛中, 4 ℃条件下固定2 h。然后用缓冲液换洗4次, 置于上述磷酸缓冲液配制的w=1%的锇酸中, 4 ℃冰箱过夜后用酒精脱水, 丙酮过渡, Epon 812包埋, LKB-V型超薄切片机切片, 醋酸双氧铀及柠檬酸铅染色。
1.4 数据统计分析根据植株生物量和Fe含量计算总Fe吸收量和Fe的转运率。单个植株Fe吸收总量=地上部生物量×地上部Fe含量+地下部生物量×地下部Fe含量; Fe转运率=玉米植株地上部Fe含量/玉米植株体内Fe总吸收量。
采用Excel 2007软件计算数据的平均值和标准偏差, SPSS 18.0软件进行单因素和双因素方差分析。单因素方差分析中首先采用Tukey检验对测定指标在各处理间的差异显著性(α=0.05) 进行多重比较, 然后采用双因素方差分析AM真菌与Fe3O4施加水平之间的交互作用, 最后采用Origin 8.6软件绘制数据图。
2 结果与分析 2.1 AM真菌侵染率不同处理下玉米根系AM真菌侵染率见图 2。
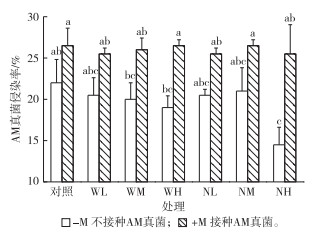
|
图 2 不同处理对玉米根系AM真菌侵染率的影响 Figure 2 Root mycorrhizal colonization rate under different treatments WL、WM和WH以及NL、NM和NH分别表示微米Fe3O4或纳米Fe3O4的施加水平为0.1、1.0和10.0 mg·kg-1。柱子上方英文小写字母不同表示不同处理间AM真菌侵染率差异显著(P < 0.05)。 |
未接种AM真菌下, 玉米根系被土著AM真菌侵染。与对照相比, 3个微米Fe3O4施加水平均未显著影响AM真菌侵染率, 而纳米Fe3O4在10.0 mg·kg-1施加水平下使AM真菌侵染率显著降低(P < 0.05)。与对照相比, 接种AM真菌后微米Fe3O4和纳米Fe3O4均对AM真菌侵染率无显著影响。但与未接种AM真菌处理相比, 接种处理显著提高了10.0 mg·kg-1的纳米Fe3O4施加水平下AM真菌侵染率(P < 0.05)。接菌和施加水平及两者的交互作用均显著影响AM真菌侵染率(P < 0.05)。
2.2 玉米植株生物量由图 3可知, 不同处理下玉米植株地上部和地下部生物量不同。与对照相比, 接种和未接种AM真菌处理下, 3个微米Fe3O4施加水平均未显著影响玉米植株地上部和地下部生物量; 未接种AM真菌处理下, 10.0 mg·kg-1纳米Fe3O4施加水平显著降低了玉米植株地上部和地下部生物量(P < 0.05)。接种AM真菌的玉米植株地上部和地下部生物量在高纳米Fe3O4施加水平下显著高于未接种处理(P < 0.05), 但在较低纳米Fe3O4施加水平下接种AM真菌的效果不明显。接种显著影响了玉米植株地上部和地下部生物量(P < 0.05)。
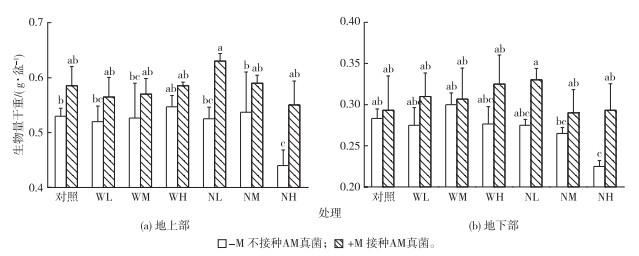
|
图 3 不同处理对玉米植株地上部和地下部生物量的影响 Figure 3 Plant biomass under different treatments WL、WM和WH以及NL、NM和NH分别表示微米Fe3O4或纳米Fe3O4的施加水平为0.1、1.0和10.0 mg·kg-1。柱子上方英文小写字母不同表示不同处理间生物量差异显著(P < 0.05)。 |
由表 1可知, 不同处理下玉米植株地下部和地上部养分含量不同。与对照相比, 接种和未接种AM真菌处理下, 3个微米Fe3O4施加水平均未显著影响玉米植株地上部和地下部养分含量; 而在未接种AM真菌下, 在10.0 mg·kg-1纳米Fe3O4施加水平下显著降低玉米植株地下部N、P、Ca和Zn含量(P < 0.05), 并显著降低地上部Ca、Zn和Mg含量(P < 0.05)。与未接种处理相比, 接种AM真菌的玉米植株地下部P、Ca、Zn和Mg含量在10.0 mg·kg-1纳米Fe3O4施加水平下显著增高(P < 0.05), N和K含量呈增加趋势, 地上部仅Mg含量显著增加(P < 0.05), N、P、K、Ca和Zn含量呈增加趋势, 但在较低纳米Fe3O4施加水平下接种AM真菌的效果不明显。接种、施加水平和两者的交互作用显著影响玉米植株地下部Ca和Zn含量及地上部Mg含量(P < 0.05)。
|
|
表 1 不同处理下玉米植株地下部N、P、K、Ca、Zn、Mg含量 Table 1 Contents of N, P, K, Ca, Zn, Mg elements in maize roots |
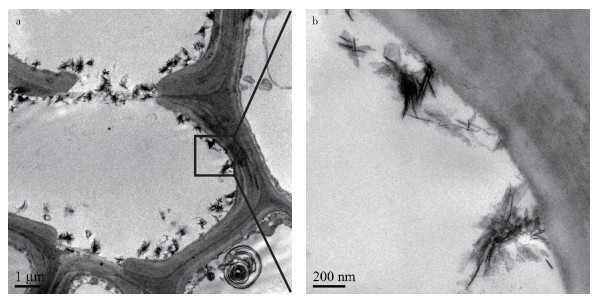
由图 4可知, 未接种AM真菌下, 3个微米Fe3O4施加水平均未显著影响玉米地上部和地下部Fe含量、Fe吸收量和转运率; 而纳米Fe3O4在10.0 mg·kg-1施加水平下显著增加玉米地上部Fe含量(P < 0.05)。接种AM真菌后, 纳米Fe3O4显著增加玉米地下部Fe含量和吸收量, 降低了Fe由玉米地下部转至地上部的转运率(P < 0.05)。双因素方差分析结果显示接种显著影响玉米植株地上部、地下部Fe含量、吸收量和转运率(P < 0.05)。TEM结果显示纳米Fe3O4在玉米根系细胞的分布情况(图 5), Fe以纳米形式存在, 纳米Fe3O4表现出一定程度的团聚。
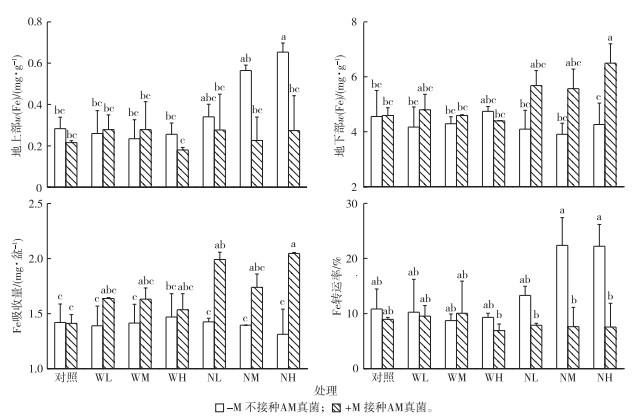
|
图 4 不同处理对玉米植株地上部、地下部Fe含量、Fe吸收量和Fe转运率的影响 Figure 4 Shoot and root Fe concentrations, individual Fe acquisitions and Fe translocation efficiency WL、WM和WH以及NL、NM和NH分别表示微米Fe3O4或纳米Fe3O4的施加水平为0.1、1.0和10.0 mg·kg-1。同一幅图中直方柱上方英文小写字母不同表示不同处理间某指标差异显著(P < 0.05)。植株质量以干重计。 |
|
图 5 施加10.0 mg·kg-1纳米Fe3O4下玉米根系对纳米Fe3O4的吸收 Figure 5 Representative transmission electron microscopy images of roots of maize under 10.0 mg·kg-1 of iron oxide magnetic nanoparticles |
AM真菌侵染率是衡量AM真菌与宿主植物之间互惠共生关系的重要指标[31]。重金属、干旱、土壤磷含量和纳米ZnO等可降低AM真菌对植物根系的侵染率[32-35]。通过盆栽试验, 模拟不同纳米Fe3O4污染水平的土壤, 发现土壤添加不同水平的纳米Fe3O4后, 虽然玉米根系与土著AM真菌成功建立了互惠共生关系, AM真菌侵染率达14.5%±2.1%~22%±2.8%, 但施加10.0 mg·kg-1水平的纳米Fe3O4显著抑制了菌根的生长, 而不同施加水平的微米Fe3O4对菌根侵染率的影响较小, 表明纳米Fe3O4对菌根生长的影响与其粒径有关。纳米Fe3O4因其纳米粒径具有较高的比表面积和较强的比表面活性, 比相同水平的微米Fe3O4更易释放Fe离子, 如HE等[25]通过测定发现施加纳米Fe3O4的土壤中溶解性Fe比相应水平的微米Fe3O4高。Fe2+在被氧化的过程中可产生超氧自由基等对细胞造成氧化胁迫[36]。例如, AUFFAN等[36]研究指出纳米Fe3O4可产生活性氧对大肠杆菌产生毒害作用。接种AM真菌(Glomus caledonium)后, 在10.0 mg·kg-1纳米Fe3O4施加水平下AM真菌侵染率增加, 这可能与Glomus caledonium的特性有关, Glomus caledonium不仅可通过孢子萌发的菌丝侵染植物根系,还可通过菌丝体片段或菌根段侵染植物根系[37]。HU等[38]也指出重金属污染下, 接种AM真菌(Glomus caledonium)增加了AM真菌侵染率。沙培中纳米Fe3O4未对Glomus caledonium侵染三叶草根系产生影响, 而纳米Ag在0.1~1.0 mg·kg-1下增加了Glomus caledonium对三叶草根系的侵染率[21], 表明ENMs对AM真菌的影响与ENMs种类、浓度等有关。这可能是由于ENMs的稳定性、溶解性和生物有效性等环境行为与多种因素有关[39]。
3.2 纳米Fe3O4条件下接种AM真菌对玉米植株生长的影响随着土壤施加纳米Fe3O4水平的增加, 玉米植株的生物量呈下降趋势, 纳米Fe3O4在10.0 mg·kg-1施加水平下显著降低了玉米植株地上部和地下部生物量, 特别是地下部生物量的降幅更大, 与其他ENMs对小麦、玉米等的研究结果一致, 这可能是由于植物地下部与土壤中ENMs直接接触, 导致地下部受到的伤害更大[40]。WANG等[12]研究发现纳米Fe3O4对植物产生氧化胁迫, 地下部受到的胁迫作用比地上部更大, 并推测可能是纳米Fe3O4吸附在根表面, 或者进入根细胞, 破坏了根系的生理功能。根系生理功能的变化将影响其对营养物质的吸收。
纳米Fe3O4在10.0 mg·kg-1施加水平下减少了玉米根系对土壤中营养元素的吸收, 玉米根系N、P、K、Ca、Zn、Mg等元素含量几乎均显著下降。王卫中等[20]也发现纳米ZnO抑制了玉米根系对N、P、K、Fe、Cu等营养元素的吸收。此外, 当纳米Fe3O4为10.0 mg·kg-1施加水平时AM真菌侵染率的下降也将影响植物根系对营养元素的吸收。AM真菌侵染率与植物对营养元素的吸收之间存在密切关系[41]。AM真菌在促进宿主植物对土壤养分吸收, 尤其在P吸收方面有突出作用[31]。除了P, AM真菌对宿主植物N、K、Ca、Mg、Fe、Zn等营养元素吸收方面也具有一定的改善作用[41]。在10.0 mg·kg-1纳米Fe3O4施加水平下, 接种AM真菌显著促进玉米植株生长, 改善N、P、K、Ca、Zn、Mg等矿质营养, 这可能是由于接种AM真菌增加了其对植物根系的侵染率, 菌丝扩大了植物的根系范围和根的吸收面积, 增强了植物对营养的吸收能力[42]。在未施加纳米Fe3O4和施加低水平纳米Fe3O4处理下, 接种AM真菌对玉米植株生长和营养吸收的影响不明显, 这可能是因为在正常土壤条件下植物与土壤中AM真菌已形成比较稳定的互惠共生关系, 而低水平纳米Fe3O4未对玉米产生较明显的胁迫作用, 因而AM真菌未发挥作用, 表明AM真菌发挥作用有一个纳米Fe3O4阈值, 只有高于这个阈值, AM真菌才有助于植物抵抗逆境, 笔者前期研究发现AM真菌需在一定纳米Ag胁迫水平下才能发挥作用[20]。此外, AM真菌只能在一定程度范围内的重金属胁迫下起作用, 因为高浓度重金属可降低AM真菌活性和侵染过程, 进而影响AM真菌功能的正常发挥[33]。不仅胁迫程度可影响AM真菌的功能, 土壤P含量、AM真菌种类等均可影响AM真菌的功能[38-42]。因此, 在利用AM真菌进行生物污染修复时, 需考虑多种因素对AM真菌的影响。
3.3 纳米Fe3O4条件下接种AM真菌对玉米植株吸收和转运Fe的影响在重金属胁迫下, 随着土壤中重金属含量的增加,AM真菌侵染率和植物生长一般会降低, 而植物体内重金属含量则会增加[33]。金属ENMs处理下植物体内金属含量也随着土壤或沙培基质中金属ENMs含量的增加而增加[40, 43]。Fe作为植物生长必需的微量元素[44], 一般认为植物体内Fe含量达0.3 mg·g-1可保证植物正常生长, 若Fe含量过高,植物会出现中毒症状[45]。在施加0.1、1.0和10.0 mg·kg-1纳米Fe3O4处理下, 玉米植株地上部Fe含量分别达0.34、0.56和0.65 mg·g-1。但纳米Fe3O4仅在10.0 mg·kg-1施加水平下降低了玉米植株地上部和地下部生物量, 表明该玉米品种对纳米Fe3O4有一定的抗性。ZHU等[11]研究发现纳米Fe3O4被植物根系吸收, 并转运至植物其他组织。GHAFARIYAN等[45]也在植物体内发现纳米Fe3O4, 并发现纳米Fe3O4可随着叶片的水分蒸发在叶片边缘积累。TEM观察发现纳米Fe3O4分布在植物根系细胞内。有研究[40-42]发现其他金属ENMs, 如纳米ZnO、纳米Ag和纳米氧化铜(CuO)处理下, 植物体内相应的Zn、Ag、Cu等含量增加, 且DIMKPA等[43]通过TEM发现植物体内Ag是以纳米形式存在的, 并发现纳米Ag可能直接被植物吸收, 或者纳米Ag释放的Ag离子被植物吸收转运后, 在植物体内被还原[46]。
AM真菌改变植物体内重金属含量是其提高植物抗逆性的一个重要机制[47]。在重金属污染条件下, CHEN等[48]研究发现接种AM真菌增加了植物地下部Zn含量, 减少了Zn往地上部的转运。刘德良等[49]研究指出接种AM真菌可增加植物对重金属Cd、Zn等的吸收。纳米Fe3O4在10.0 mg·kg-1施加水平下, 接种AM真菌在促进玉米生长的同时增加了玉米地下部Fe含量和总Fe吸收量, 降低了玉米地上部Fe含量和Fe转运率, 该结果与纳米ZnO处理下接种AM真菌增加了Zn在植物地下部的分配比例类似[20]。这可能是由于接种AM真菌改变了植物根系表面, 从而影响了其对重金属的吸附作用。植物根系表面在接种与未接种AM真菌处理之间是不同的。例如, SUBRAMANIAN等[50]指出AM真菌可提高植物根系密度和根系表面积。利用微计算机断层扫描技术(micro computed tomography, micro-CT)也发现AM真菌促进了植物根系的发育[21]。此外, 菌丝密度增多也是AM真菌侵染植物根系的作用结果[51]。AM真菌的菌丝已被发现其表面积是根系表面的100多倍, 且菌丝具有较强的吸收重金属能力[17], 菌丝的重金属含量远远高于根系内含量[47]。因此, 接种AM真菌后, 重金属被固定在菌丝组织中, 减少了其向植物地上部的转运, 是降低重金属对宿主植物毒害的重要机制。DIMKPA等[15]发现固氮微生物(PcO6) 降低了植物地上部和地下部Cu含量, 缓解了纳米CuO对植物的毒性效应。这可能是因为不同微生物对ENMs的植物效应、作用方式等的影响不同。因此, ENMs与植物-微生物之间的关系值得深入探讨。
4 结论通过模拟不同纳米Fe3O4污染水平的土壤, 发现10.0 mg·kg-1的纳米Fe3O4可对玉米植株和AM真菌产生一定的毒性效应, 降低了AM真菌侵染率和玉米植株对养分的吸收, 抑制了玉米植株生物量的累积, 同时Fe在玉米植株地上部累积量随着纳米Fe3O4处理浓度的增加而增加。
接种AM真菌在一定程度上缓解了纳米Fe3O4对玉米植株生物量、养分含量和AM真菌的毒害作用, 增加了Fe在玉米根系的分配比例, 减少了Fe向玉米植株地上部的转运。因此, 在未来纳米Fe3O4污染的土壤中, 接种AM真菌有利于提高玉米植株对纳米Fe3O4的抵抗能力。
| [1] |
NOWACK B. The Behavior and Effects of Nanoparticles in the Environment[J]. Environmental Pollution, 2009, 157(4): 1063-1064. DOI:10.1016/j.envpol.2008.12.019 (  0) 0) |
| [2] |
CORNELIS G, HUND-RINKE K, KUHLBUSCH T, et al. Fate and Bioavailability of Engineered Nanoparticles in Soils:A Review[J]. Critical Reviews in Environmental Science and Technology, 2014, 44(24): 2720-2764. DOI:10.1080/10643389.2013.829767 (  0) 0) |
| [3] |
GOTTSCHALK F, SONDERER T, SCHOLZ R W, et al. Modeled Environmental Concentrations of Engineered Nanomaterials (TiO2, ZnO, Ag, CNT, Fullerenes) for Different Regions[J]. Environmental Science & Technology, 2009, 43(24): 9216-9222. (  0) 0) |
| [4] |
SUN T Y, GOTTSCHALK F, HUNGERBVHLER K, et al. Comprehensive Probabilistic Modelling of Environmental Emissions of Engineered Nanomaterials[J]. Environmental Pollution, 2014, 185(9): 69-76. (  0) 0) |
| [5] |
SIMONIN M, RICHAUME A. Impact of Engineered Nanoparticles on the Activity, Abundance, and Diversity of Soil Microbial Communities:A Review[J]. Environmental Science and Pollution Research International, 2015, 22(18): 13710-13723. DOI:10.1007/s11356-015-4171-x (  0) 0) |
| [6] |
NOWACK B, RANVILLE J F, DIAMOND S, et al. Potential Scenarios for Nanomaterial Release and Subsequent Alteration in the Environment[J]. Environmental Toxicology and Chemistry, 2012, 31(1): 50-59. DOI:10.1002/etc.726 (  0) 0) |
| [7] |
TOURINHO P S, VAN GESTEL C A M, LOFTS S, et al. Metal-Based Nanoparticles in Soil:Fate, Behavior, and Effects on Soil Invertebrates[J]. Environmental Toxicology and Chemistry, 2012, 31(8): 1679-1692. DOI:10.1002/etc.v31.8 (  0) 0) |
| [8] |
RUFFINI C M, CREMONINI R. Nanoparticles and Higher Plants[J]. Caryologia, 2009, 62(2): 161-165. DOI:10.1080/00087114.2004.10589681 (  0) 0) |
| [9] |
YIN L Y, CHENG Y W, ESPINASSE B, et al. More Than the Ions:The Effects of Silver Nanoparticles on Lolium multiflorum[J]. Environmental Science & Technology, 2011, 45(6): 2360-2367. (  0) 0) |
| [10] |
SERVIN A D, CASTILLO-MICHEL H, HERNANDEZ-VIEZCAS J A, et al. Synchrotron Micro-XRF and Micro-XANES Confirmation of the Uptake and Translocation of TiO2 Nanoparticles in Cucumber (Cucumis sativus) Plants[J]. Environmental Science & Technology, 2012, 46(14): 7637-7643. (  0) 0) |
| [11] |
ZHU H, HAN J, XIAO J Q, et al. Uptake, Translocation, and Accumulation of Manufactured Iron Oxide Nanoparticles by Pumpkin Plants[J]. Journal of Environmental Monitoring, 2008, 10(6): 713-717. DOI:10.1039/b805998e (  0) 0) |
| [12] |
WANG H H, KOU X M, PEI Z G, et al. Physiological Effects of Magnetite (Fe3O4) Nanoparticles on Perennial Ryegrass (Lolium perenne L.) and Pumpkin (Cucurbita mixta) Plants[J]. Nanotoxicology, 2011, 5(1): 30-42. DOI:10.3109/17435390.2010.489206 (  0) 0) |
| [13] |
GE Y, PRIESTER J H, MORTIMER M, et al. Long-Term Effects of Multiwalled Carbon Nanotubes and Graphene on Microbial Communities in Dry Soil[J]. Environmental Science & Technology, 2016, 50(7): 3965-3974. (  0) 0) |
| [14] |
WAGG C, JANSA J, SCHMID B, et al. Belowground Biodiversity Effects of Plant Symbionts Support Aboveground Productivity[J]. Ecology Letters, 2011, 14(10): 1001-1009. DOI:10.1111/ele.2011.14.issue-10 (  0) 0) |
| [15] |
DIMKPA C O, MCLEAN J E, BRITT D W, et al. Nano-CuO and Interaction With Nano-ZnO or Soil Bacterium Provide Evidence for the Interference of Nanoparticles in Metal Nutrition of Plants[J]. Ecotoxicology, 2015, 24(1): 119-129. DOI:10.1007/s10646-014-1364-x (  0) 0) |
| [16] |
SMITH S E, READ D J. Mycorrhizal Symbiosis[M]. New York, USA: Academic Press, 2008, 525-535.
(  0) 0) |
| [17] |
陈保冬, 李晓林, 朱永官. 丛枝菌根真菌菌丝体吸附重金属的潜力及特[J]. 菌物学报, 2005, 24(2): 283-291. CHEN Bao-dong, LI Xiao-lin, ZHU Yong-guan. Characters of Metal Adsorption by AM Fungal Mycelium[J]. Mycosystema, 2005, 24(2): 283-291. (  0) 0) |
| [18] |
王发园, 林先贵. 丛枝菌根真菌对污染土壤中农产品质量安全的影响[J]. 土壤学报, 2008, 45(6): 1142-1147. WANG Fa-yuan, LIN Xian-gui. Effect of Arbuscular Mycorrhizal Fungion Quality Safety of Farm Products in Contaminated Soils[J]. Acta Pedologica Sinica, 2008, 45(6): 1142-1147. (  0) 0) |
| [19] |
MIRANSARI M. Contribution of Arbuscular Mycorrhizal Symbiosis to Plant Growth Under Different Types of Soil Stress[J]. Plant Biology, 2010, 12(4): 563-569. (  0) 0) |
| [20] |
王卫中, 王发园, 李帅, 等. 丛枝菌根影响纳米ZnO对玉米的生物效应[J]. 环境科学, 2014, 35(8): 3135-3141. WANG Wei-zhong, WANG Fa-yuan, LI Shuai, et al. Arbuscular Mycorrhizal Symbiosis Influences the Biological Effects of Nano-ZnO on Maize[J]. Environmental Science, 2014, 35(8): 3135-3141. (  0) 0) |
| [21] |
FENG Y Z, CUI X C, HE S Y, et al. The Role of Metal Nanoparticles in Influencing Arbuscular Mycorrhizal Fungi Effects on Plant Growth[J]. Environmental Science & Technology, 2013, 47(16): 9496-9504. (  0) 0) |
| [22] |
ZHU Y G, SMITH F A, SMITH S E. Phosphorus Efficiencies and Responses of Barley (Hordeum vulgare L.) to Arbuscular Mycorrhizal Fungi Grown in Highly Calcareous Soil[J]. Mycorrhiza, 2003, 13(2): 93-100. DOI:10.1007/s00572-002-0205-6 (  0) 0) |
| [23] |
MOLDAY R S.Magnetic Iron-Dextran Microspheres:US, US4452773[P].1984.
(  0) 0) |
| [24] |
LIAO J P, LIN X G, CAO Z H, et al. Interactions Between Arbuscular Mycorrhizae and Heavy Metals Under Sand Culture Experiment[J]. Chemosphere, 2003, 50(6): 847-853. DOI:10.1016/S0045-6535(02)00229-1 (  0) 0) |
| [25] |
HE S Y, FENG Y Z, NI J, et al. Different Responses of Soil Microbial Metabolic Activity to Silver and Iron Oxide Nanoparticles[J]. Chemosphere, 2016, 147: 195-202. DOI:10.1016/j.chemosphere.2015.12.055 (  0) 0) |
| [26] |
PRIESTER J H, GE Y, MIELKE R E, et al. Soybean Susceptibility to Manufactured Nanomaterials With Evidence for Food Quality and Soil Fertility Interruption[J]. Proceedings of the National Academy of Sciences, 2012, 109(37): E2451-E2456. DOI:10.1073/pnas.1205431109 (  0) 0) |
| [27] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU Rui-kun. Soil Argrochemistry Analysis Protocoes[M]. Beijing: China Agriculture Science Press, 2000. (  0) 0) |
| [28] |
GIOVANNETTI M, MOSSE B. An Evaluation of Techniques for Measuring Vesicular-Arbuscular Mycorrhizal Infection in Roots[J]. New Phytologist, 1980, 84(3): 489-500. DOI:10.1111/j.1469-8137.1980.tb04556.x (  0) 0) |
| [29] |
THOMAS R L, SHEARD R W, MOYER J R. Comparison of Conventional and Automated Procedures for Nitrogen Phosphorus and Potassium Analysis of Plant Material Using a Single Digestion[J]. Agronomy Journal, 1967, 59(3): 240-243. DOI:10.2134/agronj1967.00021962005900030010x (  0) 0) |
| [30] |
WANG Z Y, XIE X Y, ZHAO J, et al. Xylem-and Phloem-Based Transport of CuO Nanoparticles in Maize (Zea mays L.)[J]. Environmental Science & Technology, 2012, 46(8): 4434-4441. (  0) 0) |
| [31] |
SMITH S E, READ D J. Mycorrhizal Symbiosis[M]. London, UK: Academic Press, 1997, 13-116.
(  0) 0) |
| [32] |
秦子娴, 朱敏, 郭涛. 干旱胁迫下丛枝菌根真菌对玉米生理生化特性的影响[J]. 植物营养与肥料学报, 2013, 19(2): 510-516. QIN Zi-xian, ZHU Min, GUO Tao. Influence of Mycorrhizal Inoculation on Physiological and Biochemical Characteristics of Maize (Zea mays) Under Water Stress[J]. Plant Nutrition and Fertilizer Science, 2013, 19(2): 510-516. DOI:10.11674/zwyf.2013.0229 (  0) 0) |
| [33] |
张旭红, 林爱军, 张莘, 等. Cu污染土壤接种丛枝菌根真菌对旱稻生长的影响[J]. 环境工程学报, 2012, 6(5): 1677-1681. ZHANG Xu-hong, LIN Ai-jun, ZHANG Xin, et al. Effects of Arbuacular Mycorrhizal Fungi(AMF) on Growth of Upland Rice in Soil Contaminated by Cu[J]. Chinese Journal of Environmental Engineering, 2012, 6(5): 1677-1681. (  0) 0) |
| [34] |
HU J L, LIN X G, WANG J H, et al. Arbuscular Mycorrhizal Fungus Enhances P Acquisition of Wheat (Triticum aestivum L.) in a Sandy Loam Soil With Long-Term Inorganic Fertilization Regime[J]. Applied Microbiologyand Biotechnology, 2010, 88(3): 781-787. DOI:10.1007/s00253-010-2791-0 (  0) 0) |
| [35] |
李帅, 刘雪琴, 王发园, 等. 纳米氧化锌、硫酸锌和AM真菌对玉米生长的影响[J]. 环境科学, 2015, 36(12): 4615-4622. LI Shuai, LIU Xue-qin, WANG Fa-yuan, et al. Effects of ZnO Nanoparticles' ZnSO4 and Arbuscular Mycorrhizal Fungus on the Growth of Maize[J]. Environmental Science, 2015, 36(12): 4615-4622. (  0) 0) |
| [36] |
AUFFAN M, ACHOUAK W, ROSE J, et al. Relation Between the Redox State of Iron-Based Nanoparticles and Their Cytotoxicity Toward Escherichia coli[J]. Environmental Science & Technology, 2008, 42(17): 6730-6735. (  0) 0) |
| [37] |
DANIELL T J, HUSBAND R, FITTER A H, et al. Molecular Diversity of Arbuscular Mycorrhizal Fungi Colonising Arable Crops[J]. FEMS Microbiology Ecology, 2001, 36(2/3): 203-209. (  0) 0) |
| [38] |
HU J L, WANG H S, WU F Y, et al. Arbuscular Mycorrhizal Fungi Influence the Accumulation and Partitioning of Cd and P in Bashfulgrass (Mimosa pudica L.) Grown on a Moderately Cd-Contaminated Soil[J]. Applied Soil Ecology, 2014, 73: 51-57. DOI:10.1016/j.apsoil.2013.08.010 (  0) 0) |
| [39] |
LIN D H, TIAN X L, WU F C, et al. Fate and Transport of Engineered Nanomaterials in the Environment[J]. Journal of Environmental Quality, 2010, 39(6): 1896-1908. DOI:10.2134/jeq2009.0423 (  0) 0) |
| [40] |
DIMKPA C O, MCLEAN J E, LATTA D E, et al. CuO and ZnO Nanoparticles:Phytotoxicity, Metal Speciation, and Induction of Oxidative Stress in Sand-Grown Wheat[J]. Journal of Nanoparticle Research, 2012, 14(9): 1125-1129. DOI:10.1007/s11051-012-1125-9 (  0) 0) |
| [41] |
MIRANSARI M. Arbuscular Mycorrhizal Fungi and Uptake of Nutrients[J]. Symbiotic Endophytes, 2013, 37: 253-270. DOI:10.1007/978-3-642-39317-4 (  0) 0) |
| [42] |
MIRANSARI M. Plant, Mycorrhizal Fungi, and Bacterial Network[J]. Plant Signaling:Understanding the Molecular Crosstalk, 2013, 315-325. (  0) 0) |
| [43] |
DIMKPA C O, MCLEAN J E, MARTINEAU N, et al. Silver Nanoparticles Disrupt Wheat (Triticum aestivum L.) Growth in a Sand Matrix[J]. Environmental Science & Technology, 2013, 47(2): 1082-1090. (  0) 0) |
| [44] |
MARTIN J H, COALE K H, JOHNSON K S, et al. Testing the Iron Hypothesis in Ecosystems of the Equatorial Pacific Ocean[J]. Nature, 1994, 371(6493): 123-129. DOI:10.1038/371123a0 (  0) 0) |
| [45] |
GHAFARIYAN M H, MALAKOUTI M J, DADPOUR M R, et al. Effects of Magnetite Nanoparticles on Soybean Chlorophyll[J]. Enviromental Science & Technology, 2013, 47(18): 10645-10652. (  0) 0) |
| [46] |
HAVERKAMP R G, MARSHALL A T. The Mechanism of Metal Nanoparticle Formation in Plants:Limits on Accumulation[J]. Journal of Nanoparticle Research, 2009, 11(6): 1453-1463. DOI:10.1007/s11051-008-9533-6 (  0) 0) |
| [47] |
TOLER H D, MORTON J B, CUMMING J R. Growth and Metal Accumulation of Mycorrhizal Sorghum Exposed to Elevated Copper and Zinc[J]. Water, Air, and Soil Pollution, 2005, 164(1): 155-172. (  0) 0) |
| [48] |
CHEN B D, LI X L, TAO H Q, et al. The Role of Arbuscular Mycorrhiza in Zinc Uptake by Red Clover Growing in a Calcareous Soil Spiked With Various Quantities of Zinc[J]. Chemosphere, 2003, 50(6): 839-846. DOI:10.1016/S0045-6535(02)00228-X (  0) 0) |
| [49] |
刘德良, 杨期和. 接种丛枝菌根对鬼针草吸收煤矿区土壤重金属的影[J]. 生态与农村环境学报, 2013, 29(3): 342-347. LIU De-liang, YANG Qi-he. Effect of Inoculation of Arbuscular Mycorrhizal Fungi on Bidens bipinnata Absorbing Soil Heavy Metals in Coal Mining Area[J]. Journal of Ecology and Rural Environment, 2013, 29(3): 342-347. (  0) 0) |
| [50] |
SUBRAMANIAN K S, SANTHANAKRISHNAN P, BALASUBRAMANIAN P. Responses of Field Grown Tomato Plants to Arbuscular Mycorrhizal Fungal Colonization Under Varying Intensities of Drought Stress[J]. Scientia Horticulturae, 2006, 107(3): 245-253. DOI:10.1016/j.scienta.2005.07.006 (  0) 0) |
| [51] |
DONG Y, ZHU Y G, SMITH F A, et al. Arbuscular Mycorrhiza Enhanced Arsenic Resistance of Both White Clover (Trifolium repens L.) and Ryegrass (Lolium perenne L.) Plants in an Arsenic-Contaminated Soil[J]. Environmental Pollution, 2008, 155(1): 174-181. DOI:10.1016/j.envpol.2007.10.023 (  0) 0) |




