2. 南京科技职业学院, 江苏 南京 210048;
3. 南京师范大学环境学院, 江苏 南京 210023;
4. 湖南农业大学资源环境学院, 湖南 长沙 410128
2. Nanjing Polytechnic Institute, Nanjing 210048, China;
3. School of Environment, Nanjing Normal University, Nanjing 210023, China;
4. College of Resources & Environment, Hunan Agricultural University, Changsha 410128, China
我国的红壤形成于亚热带湿润气候环境中, 面积达2.03亿hm2, 高度风化和高度淋溶导致红壤pH值较低, 黏度大, 营养贫瘠。红壤地区是水稻主产区, 产量占全国的80%[1]。作物生长通常受土壤高酸度和营养匮乏的限制, 因此, 红壤水稻土质量备受关注[2-3]。微生物群落是用于评估土壤质量、衡量土壤肥力的重要指标[4], 是土壤物质循环的重要执行者[5]; 微生物对其生存微环境变化也较为敏感, 微生物指标是表征土壤生态系统变化的警示指标[6]。
水稻属半水生植物, 大部分生长过程处于淹水的厌氧状态, 在晒田期、收获期和休耕期处于排水的微氧/好氧状态, 这使得水稻土环境变化频繁。施肥和改变地下水位是水稻田最主要的农业管理方式。肥料种类和施肥量会影响土壤碳、氮、磷等营养元素含量, 研究发现长期施化肥或有机肥均能提高微生物磷脂脂肪酸(phospholipid fatty acids, PLFA)总量, 改变微生物群落结构[6-7]。地下水位高低会直接影响土壤氧气含量和氧化还原电位(Eh), 也会间接影响土壤养分含量。易亚男等[8]研究不同地下水位红壤水稻土有机碳组分, 发现高地下水位(地表以下20 cm)比低地下水位(地表以下80 cm)更能促进土壤有机碳的积累。研究发现, 土壤养分含量、氧气含量和Eh会显著影响土壤微生物群落[9-10]。但是, 不同地下水位对土壤微生物群落影响的研究尚鲜见报道, 而施肥和地下水位双因素协同作用对红壤水稻土微生物群落的影响还不清楚。
笔者研究依托湖南农业大学长期定位研究平台, 分析红壤水稻土PLFA指纹特征, 研究施肥和地下水位对红壤水稻土微生物生物量和群落结构的影响, 并筛选驱动群落变化的关键环境因子。
1 材料与方法 1.1 施肥处理与取样供试土壤采自湖南农业大学(28°10′58″ N, 113°4′37″ E)校园内长期定位试验水稻田, 供试土壤为第四纪红色黏土发育的红壤水稻土。从1982年春季开始设置试验田, 延续至今, 稻作制为稻-稻-冬闲。试验地设置高地下水位(地表以下20 cm)和低地下水位(地表以下80 cm)2种地下水位管理模式。水稻栽种期水分按照常规管理, 淹水期长约173 d, 冬闲期(排水期)长约192 d。试验地还设置高量有机肥、常量有机肥和无机肥3种长期施肥模式。因此, 共有6个处理:(1) 高地下水位无机肥(HCF); (2) 低地下水位无机肥(LCF); (3) 高地下水位常量有机肥(HNOM); (4) 低地下水位常量有机肥(LNOM); (5) 高地下水位高量有机肥(HHOM); (6) 低地下水位高量有机肥(LHOM)。每个处理设置3个重复小区(2.5 m×2.5 m)。无机肥处理每季施氮量为150 kg·hm-2, 早稻w(N) :w(P2O5) : w(K2O)=1 :0.5 :1, 晚稻w(N) :w(P2O5) : w(K2O)=1 :0.2 :1, 氮、磷、钾肥分别以尿素、过磷酸钙、氯化钾形态施入。对于高量有机肥处理, 早稻施用鲜黑麦草45 t·hm-2, 晚稻施用鲜稻草25 t·hm-2; 对于常量有机肥处理, 有机肥施用量为高量有机肥处理的1/2。为维持各处理施肥水平一致, 施肥量以无机肥处理为标准, 有机肥处理小区肥料不足部分用化肥补足。在晚稻收获后对耕作层(0~20 cm)土壤进行采样, 每个小区利用土钻多点采集后混合形成1个土壤样品。采集的样本立即置于4 ℃保温箱中保存, 于3 d内运送至实验室。每个土壤样品过2 mm孔径筛后分为2份:一份保存在4 ℃条件下于1周内进行PLFA提取和分析; 一份风干后用于土壤理化性质分析。
1.2 土壤基本理化性质分析土壤基本理化性质分析采用常规方法[11]。土壤pH值采用pH玻璃电极测定, m(土) :V(水)=1 :2.5。土壤有机碳含量采用重铬酸钾氧化法测定, 全氮含量采用凯氏定氮法测定, 速效氮含量采用碱解扩散法测定, 全磷含量采用磷钼蓝法测定, 速效磷含量采用HCl-NH4F萃取-分光光度法测定, 全钾含量采用氢氧化钠熔融-原子吸收光谱法测定, 速效钾含量采用醋酸铵提取-原子吸收光谱法测定。
1.3 PLFA提取及指纹图谱分析采用Bligh Dyer方法进行PLFA提取[7, 12-13], 土样用15 mL Bligh Dyer提取液〔V(0.1 mol·L-1柠檬酸缓冲液) :V(氯仿):V(甲醇)=0.8 :1 :2〕提取, 提取液用硅酸键合固相抽提柱(SPE-SI)层析, 分别用氯仿、丙酮和无水甲醇洗脱, 将含磷脂的洗脱液用氮气吹干, 然后用碱性甲醇水解和皂化(甲基化)得到磷脂脂肪酸甲基酯。采用Sherlock微生物鉴定系统(MIDI, Newark, DE)分析PLFA种类和量, 其中, PLFA定量采用19 :0 FAM内标法测定[14-15]。
1.4 数据分析采用单因素方差分析研究各处理间土壤理化性质和土壤微生物PLFA含量的差异显著性, 采用双因素方差分析研究施肥、地下水位及双因素协同作用对土壤理化性质及土壤微生物PLFA含量影响的差异显著性; 采用逐步回归法筛选影响土壤微生物PLFA含量的主要环境因子。采用SPSS 20.0软件进行统计分析, 显著性水平设为α=0.05。采用Canoco 5.0软件对各处理PLFA含量和环境因子进行主成分分析(principal component analysis, PCA)以获取影响土壤微生物群落结构的环境因子权重。
2 结果与分析 2.1 土壤理化性质单因素方差分析显示, LHOM处理土壤有机碳含量显著高于LCF处理, 其他处理间无显著差异; LNOM处理土壤NO3--N含量显著高于HCF和HNOM处理, 其他处理间无显著差异; 各处理土壤pH值, 以及全磷、全钾、速效氮、速效磷、速效钾和NH4+含量无显著差异。在排水状态下, HCF处理土壤Eh, p(排水状态下的Eh)显著低于其他处理; 而在淹水条件下, 各处理间Eh, y(淹水状态下的Eh)无显著差异(表 1)。双因素方差分析显示, 不同地下水位显著影响土壤pH值、Eh, p和NO3--N含量, 而不同施肥模式显著改变土壤Eh, y, Eh, p, 有机碳、全氮和速效钾含量; 施肥和地下水位管理协同作用仅对Eh, p有显著影响。
|
|
表 1 各处理土壤基本理化性质 Table 1 Basic physicochemical properties of the studied soils |
PLFA指纹分析显示, LHOM处理总PLFA、细菌PLFA含量显著高于HNOM处理, 其余处理间无显著差异; LNOM处理革兰阳性菌(G+)PLFA含量显著高于其他处理(LHOM处理除外); LHOM处理革兰阴性菌(G-)PLFA含量显著高于其他有机肥处理; 各处理真菌、放线菌、厌氧菌、好氧菌PLFA含量均无显著差异; 各处理厌氧菌PLFA/好氧菌PLFA比值、真菌PLFA/细菌PLFA比值也无显著差异, 但LNOM处理G+PLFA/G-PLFA比值显著高于其他处理(表 2)。双因素方差分析显示, 不同地下水位显著影响土壤总PLFA、细菌PLFA、G+PLFA含量以及G+PLFA/G-PLFA比值, 而不同施肥模式显著影响G-PLFA含量和G+PLFA/G-PLFA比值; 施肥和地下水位管理协同作用显著影响真菌PLFA、G-PLFA含量和G+PLFA/G-PLFA比值。
|
|
表 2 不同施肥模式和地下水位条件下稻田土壤微生物PLFA含量 Table 2 Contents of soil microbial PLFAs in paddy soil under long-term fertilization and varying groundwater table |
逐步回归分析表明, 土壤微生物PLFA含量显著受土壤pH值、Eh及养分含量的影响。放线菌PLFA含量显著受土壤pH值(r=0.758) 和全氮含量(r=0.561) 的影响, G+PLFA(r=0.589)、厌氧菌PLFA(r=0.473)、好氧菌PLFA(r=0.569) 含量显著受土壤pH值的影响, 真菌PLFA/细菌PLFA比值显著受土壤Eh, y(r=0.483) 的影响, G+PLFA/G-PLFA比值显著受NO3--N(r=0.751) 和全钾含量(r=0.523) 的影响。
主成分分析显示了环境因子与微生物群落间的关系(图 1)。PC1可代表全钾含量(r=-0.80, P < 0.05)、pH值(r=0.49, P < 0.05) 和Eh, y(r=-0.50, P < 0.05), 能够解释80.2%的环境因子; PC2可代表NO3--N含量(r=-0.70, P < 0.05)、全氮含量(r=0.44, P < 0.05) 和全磷含量(r=-0.80, P < 0.05), 能够解释13.7%的环境因子。结果显示环境因子影响不同施肥模式和地下水位条件下红壤水稻土微生物群落结构, 全钾含量、pH值和Eh, y是导致LNOM处理与其他处理间微生物群落结构不同的主要环境因子, 而NO3--N含量、全氮含量、全磷含量是导致LHOM处理与HNOM、HHOM、LCF、HCF处理间微生物群落结构不同的主要环境因子。
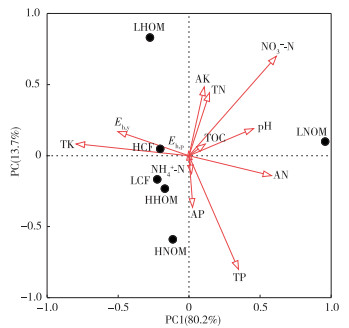
|
图 1 土壤微生物群落和环境因子的PCA分析 Figure 1 PCA biplot analysis between soil microbial community and environmental factors HCF为高地下水位无机肥; LCF为低地下水位无机肥; HNOM为高地下水位常量有机肥; LNOM为低地下水位常量有机肥; HHOM为高地下水位高量有机肥; LHOM为低地下水位高量有机肥。TOC为总有机碳; TN为全氮; AK为速效钾; Eh, y和Eh, p分别为淹水状态和排水状态下的氧化还原电位; TK为全钾; AP为速效磷; TP为全磷; AN为速效氮。不同处理样品间直线距离(欧几里德距离)代表样品间差异性, 距离越短表示样品间差异越小; 不同处理样品在环境变量及其延长线上的投影点位置代表样品在该环境变量的排序, 投影点越接近箭头方向, 表示样品在环境变量上的排序越高。 |
施肥可增加土壤养分含量, 肥料种类和施肥量的不同对土壤性质的影响不同。笔者研究发现不同施肥模式显著改变了红壤水稻土Eh, y、Eh, p、有机碳含量、全氮含量和速效钾含量, 而不同地下水位管理则显著影响土壤pH值、Eh, p和NO3--N含量。已有关于施肥、水分含量对土壤微生物群落影响的报道[16]。然而, 大多数研究仅关注其中一种影响因素的作用。笔者研究发现施化肥和有机肥土壤微生物群落不同, 不同施肥模式显著影响G-PLFA含量和G+PLFA/G-PLFA比值。
近年来, 关于施肥影响红壤微生物群落的研究已较多。颜慧等[7]发现长期施化肥或有机肥均能增加土壤微生物PLFA种类和数量, 平衡施用无机氮、磷、钾肥对土壤中细菌和放线菌的生长最有利, 而施用无机磷肥对土壤中细菌的生长最有利。ZHONG等[13]发现长期施有机肥可显著增加旱地细菌、放线菌、厌氧菌PLFA量, 而长期施化肥则显著增加真菌和好氧菌PLFA量。夏昕等[17]采用PLFA方法分析土壤微生物群落发现, 长期施化肥、有机肥/化肥混施显著增加了红壤水稻土微生物PLFA总量, 改变了微生物群落结构。前人研究也发现施肥能降低土壤真菌/细菌比值, 增加土壤微生物生物量; 有机肥与化肥混施有利于G-、真菌、放线菌的增长, 而单施化肥有利于G+的生长[17]。分析其原因:与有机肥/化肥混施处理相比, 单施化肥土壤易板结, 土壤环境更恶劣, 细胞壁更坚韧的G+的耐受性较G-更强, 更适合在恶劣环境中生存; 而施加有机肥可改善土壤质地, 丰富的有机碳源、氮源促进了对营养需求较高的G-、真菌、放线菌及原生动物的生长[7]。
3.2 地下水位对红壤水稻土PLFA指纹的影响与机理笔者研究结果显示地下水位会影响土壤Eh, 高地下水位土壤Eh多数情况下低于低地下水位土壤。刘若萱等[18]的研究也得到类似结果。施肥过程中添加的有机质、NH4+-N等还原性物质也会影响土壤Eh。而水位管理对于NO3--N含量的影响, 可能还源于水分对土壤中硝态氮的脱附作用, 以及淹水导致的过度还原条件抑制了硝化微生物的活性[18]。稻田土壤pH值与水位管理显著相关, 进而影响土壤微生物群落。通常认为水稻田的pH值除受母质影响外, 还与水位管理关系较大。一般地, 酸性水稻土淹水后, 其pH值趋向中性, 这是因为酸性土灌水后, 在水中形成Fe(OH)2和Mn(OH)2, 使水稻土pH值升高; 灌溉可使碱性水稻土中碱性物质遭到淋失, 从而使pH值降低。而笔者研究表明高水位使酸性土壤pH值升高, 而接近中性的环境更适合微生物生长。逐步回归分析和PCA分析均显示pH值对微生物群落影响较大, 其中, 逐步回归分析显示厌氧菌、好氧菌、G+PLFA含量均显著受土壤pH值的影响。笔者研究结果显示无论水位高低, 好氧菌数量均远大于厌氧菌数量(表 2), 因此, 高水位导致的过度还原条件降低了微生物总量, 造成总PLFA含量及细菌PLFA含量均较低。G+ PLFA/G- PLFA比值变化可以反映土壤微生物群落所受到的胁迫[19], 笔者研究结果表明G+数量与水位相关, 而G-数量与施肥相关, 水位管理与施肥均对G+ PLFA/G- PLFA比值产生影响。
4 结论采用PLFA指纹法研究不同施肥模式和地下水位对红壤水稻土微生物群落的影响, 发现长期施肥和地下水位管理显著影响土壤微生物生物量、微生物群落结构及生存环境。其中, 全钾含量、pH值和Eh, y是导致LNOM处理与其他处理微生物群落结构不同的主要环境因子, 而NO3--N含量、全氮含量、全磷含量是导致LHOM处理与HNOM、HHOM、LCF、HCF处理间微生物群落结构不同的主要环境因子。
| [1] |
LOU Y S, LI Z P, ZHANG T L, et al. Carbon Dioxide Flux in a Subtropical Agricultural Soil of China[J]. Water, Air, and Soil Pollution, 2003, 149(1): 281-293. (  ) ) |
| [2] |
张桃林. 中国红壤退化机制与防治[M]. 北京: 中国农业出版社, 1999, 138. ZHANG Tao-lin. Mechanism and Control of Red Soil Degradation in China[M]. Beijing: China Agriculture Press, 1999, 138. (  ) ) |
| [3] |
孙波, 张桃林, 赵其国. 我国东南丘陵区土壤肥力的综合评价[J]. 土壤学报, 1995, 32(4): 362-369. SUN Bo, ZHANG Tao-lin, ZHAO Qi-guo. Comprehensive Evaluation of Soil Fertility in the Hilly and Mountainous Region of Southeastern China[J]. Acta Pedologica Sinica, 1995, 32(4): 362-369. (  ) ) |
| [4] |
HUSSAIN Q, LIU Y Z, ZHANG A F, et al. Variation of Bacterial and Fungal Community Structures in the Rhizosphere of Hybrid and Standard Rice Cultivars and Linkage to CO2 Flux[J]. FEMS Microbiology Ecology, 2011, 78(1): 116-128. DOI:10.1111/j.1574-6941.2011.01128.x (  ) ) |
| [5] |
STATUS C F Ⅲ, MCFARLAND J, DAVID M A, et al. The Changing Global Crabon Cycle Linking Plant-Soil Carbon Dynamics to Global Consequences[J]. Journal of Ecology, 2009, 97(5): 840-850. DOI:10.1111/jec.2009.97.issue-5 (  ) ) |
| [6] |
滕应, 黄昌勇, 龙健, 等. 复垦红壤牧草根际微生物群落功能多样性[J]. 中国环境科学, 2003, 23(3): 295-299. TENG Ying, HUANG Chang-yong, LONG Jian, et al. Functional Diversity of Microbial Community in Herbage Rhizosphere of Reclaimed Red Soils[J]. China Environmental Science, 2003, 23(3): 295-299. (  ) ) |
| [7] |
颜慧, 钟文辉, 李忠佩, 等. 长期施肥对红壤水稻土磷脂脂肪酸特性和酶活性的影响[J]. 应用生态学报, 2008, 19(1): 71-75. YAN Hui, ZHONG Wen-hui, LI Zhong-pei, et al. Effects of Long-Term Fertilization on Phospholipid Fatty Acids and Enzyme Activities in Paddy Red Soil[J]. Chinese Journal of Applied Ecology, 2008, 19(1): 71-75. (  ) ) |
| [8] |
易亚男, 尹力初, 张蕾, 等. 施肥对不同地下水位水稻土团聚体组成及有机碳分布的影响[J]. 水土保持学报, 2013, 27(5): 144-148. YI Ya-nan, YIN Li-chu, ZHANG Lei, et al. Effects of Fertilization on Aggregate Composition and Organic Carbon Distribution in Paddy Soil Under Different Groundwater Level[J]. Journal of Soil and Water Conservation, 2013, 27(5): 144-148. (  ) ) |
| [9] |
MARSCHNER P, KANDELER E, MARSCHNER B. Structure and Function of the Soil Microbial Community in a Long-Term Fertilizer Experiment[J]. Soil Biology and Biochemistry, 2003, 35(3): 453-461. DOI:10.1016/S0038-0717(02)00297-3 (  ) ) |
| [10] |
FIERER N, JACKSON R B. The Diversity and Biogeography of Soil Bacterial Communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 626-631. DOI:10.1073/pnas.0507535103 (  ) ) |
| [11] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000, 12-195. LU Ru-kun. Soil Agricultural Chemical Analysis Method[M]. Beijing: China Agriculture Scientech Press, 2000, 12-195. (  ) ) |
| [12] |
BLIGH E G, DYER W J. A Rapid Method of Total Lipid Extraction and Purification[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917. DOI:10.1139/o59-099 (  ) ) |
| [13] |
ZHONG W H, GU T, WANG W, et al. The Effects of Mineral Fertilizer and Organic Manure on Soil Microbial Community and Diversity[J]. Plant and Soil, 2010, 326(1): 511-522. (  ) ) |
| [14] |
ZELLES L. Fatty Acid Patterns of Phospholipids and Lipopolysaccharides in the Characterisation of Microbial Communities in Soil:A Review[J]. Biology and Fertility of Soils, 1999, 29(2): 111-129. DOI:10.1007/s003740050533 (  ) ) |
| [15] |
BUYER J S, TEASDALE J R, ROBERTS D P, et al. Factors Affecting Soil Microbial Community Structure in Tomato Cropping Systems[J]. Soil Biology and Biochemistry, 2010, 42(5): 831-841. DOI:10.1016/j.soilbio.2010.01.020 (  ) ) |
| [16] |
钟文辉, 蔡祖聪, 尹力初, 等. 用PCR2DGGE研究长期施用无机肥对种稻红壤微生物群落多样性的影响[J]. 生态学报, 2007, 27(10): 4011-4018. ZHONG Wei-hui, CAI Zu-cong, YIN Li-chu, et al. The Effects of the Long-Term Application of Inorganic Fertilizers on Microbial Community Diversity in Rice-Planting Red Soil as Studied by PCR-DGGE[J]. Acta Ecologica Sinica, 2007, 27(10): 4011-4018. DOI:10.3321/j.issn:1000-0933.2007.10.008 (  ) ) |
| [17] |
夏昕, 石坤, 黄欠如, 等. 长期不同施肥条件下红壤性水稻土微生物群落结构的变化[J]. 土壤学报, 2015, 52(3): 697-705. XIA Xin, SHI Kun, HUANG Qian-ru, et al. The Changes of Microbial Community Structure in Red Paddy Soil Under Long-Term Fertilization[J]. Acta Pedologica Sinica, 2015, 52(3): 697-705. (  ) ) |
| [18] |
刘若萱, 贺纪正, 张丽梅. 稻田土壤不同水分条件下硝化/反硝化作用及其功能微生物的变化特征[J]. 环境科学, 2014, 35(11): 4275-4283. LIU Ruo-xuan, HE Ji-zheng, ZHANG Li-mei. Response of Nitrification/Denitrification and Their Associated Microbes to Soil Moisture Change in Paddy Soil[J]. Environmental Science, 2014, 35(11): 4275-4283. (  ) ) |
| [19] |
DENG H, LI X F, CHENG W D, et al. Resistance and Resilience of Cu-Polluted Soil After Cu Perturbation, Tested by a Wide Range of Soil Microbial Parameters[J]. FEMS Microbiology Ecology, 2009, 70(2): 137-148. (  ) ) |





