2. 农业生物化学与生物转化湖南省高校重点实验室, 湖南 长沙 410128;
3. 畜禽废弃物资源化利用湖南省工程实验室, 湖南 长沙 410128;
4. 西藏自治区农牧科学院农业质量标准与检测研究所, 西藏 拉萨 850032
2. Hunan Province University Key Laboratory for Agricultural Biochemistry and Biotransformation, Changsha 410128, China;
3. Hunan Engineering Laboratory for Resource Utilization of Animal Faeces Wastes, Changsha 410128, China;
4. Institute of Agricultural Product Quality Standard and Testing Research, Tibet Academy of Agricultural and Animal Husbandry Sciences, Lhasa 850032, China
在石油勘探、开采、运输、储存及生产加工等过程中大量泄漏的石油进入生态环境中, 不仅污染土壤, 导致土质恶化, 影响植物的生长发育[1-2], 而且对人类的健康带来巨大威胁, 尤其是石油烃中的多环芳烃(polycyclic aromatic hydrocarbons, PAHs)等有毒物质具有“三致”(致癌、致畸、致突变)作用, 危害极大[3-5]。因此, 如何高效地治理石油在开采、利用等过程中造成的污染问题迫在眉睫。当前, 治理石油污染常用的物理、化学方法均因费用昂贵及二次污染受到极大的限制, 而微生物修复治理技术被公认为是最经济、最有效、最环保的修复技术, 且无二次污染[6-7]。1989年美国在Exxon Vadez泄油事故中利用微生物修复技术首战告捷, 为微生物修复治理石油污染物拉开了序幕[8]。
研究证实, 自然环境中广泛存在能够利用石油烃为唯一碳源和能源生长繁殖的微生物[9-10]。YU等[11]分离出2株原油降解菌Bacillus subtilis SWH-1和Sphingbacterium multivorum SWH-2, 对原油的降解率分别为33.9%和46.3%。BAYAT等[12]从贻贝中分离得到的Shewanella algae BHA1和Pseudoalteromonas sp.BHA8, 对原油的降解率分别为47.24%和27.13%。LIU等[13]从被原油污染的土壤中筛选获得一株原油降解细菌Bacillus licheniformis Y-1, 该细菌在5 d内对原油的去除率高达60.2%。LI等[14]用渤海海水中分离得到的5株细菌(Ochrobactrum TCOB-1, Brevundimonas TCOB-2, Brevundimonas TCOB-3, Bacillus TCOB-4和Castellaniella TCOB-5) 构成的复合系在7 d内对原油的降解率达51.87%。但是, 目前所筛选出来的石油烃降解细菌大多数是假单胞杆菌属(Pseudomonas)、芽孢杆菌属(Bacillus)以及不动杆菌属(Acinetobacter)等[15], 还没有肠杆菌属(Enterobacter)在石油烃降解方面的报道。笔者从被原油污染的土壤中分离得到一株对原油有很好降解效果的肠杆菌ODB01, 对其进行鉴定及降解条件的优化, 并分析了表面活性剂对其降解率的影响, 研究结果将为进一步开发具有高性能的原油降解微生物提供理论基础。
1 材料与方法 1.1 材料与培养基土壤样品采集于长庆油田被原油污染的土壤; 原油购于中国石化。
LB培养基:蛋白胨10 g、酵母提取物5 g、NaCl 10 g、琼脂粉15~20 g、蒸馏水1 000 mL, pH值为7.0~7.2, 121 ℃灭菌20 min。
无机盐培养基:参照文献[16]。
1.2 原油降解菌株的富集、分离与纯化在装有100 mL无机盐培养基的250 mL三角瓶中, 加入5 mL土壤样品浸提液, 添加φ=1%的原油作为唯一的碳源和能源, 置于30 ℃、200 r·min-1恒温摇床培养1周; 取φ=10%的富集培养液转移到已添加φ=1%原油的新鲜无机盐培养液中, 置于30 ℃、200 r·min-1恒温摇床培养1周, 连续重复3次。取最后1次富集培养液连续稀释至10-5, 涂布于φ=0.1%原油的无机盐固体平板培养基上, 置于30 ℃恒温培养箱中培养48 h。挑取平板上的单菌落反复进行划线分离纯化, 得到纯化后的菌株, 保存备用。
1.3 原油降解菌株的复筛目的菌液的制备:将纯化后得到的单菌落分别接种于装有30 mL LB液体培养基的100 mL三角瓶中, 37 ℃、200 r·min-1培养至半对数期, 12 000 r·min-1离心10 min, 收集菌体, 用无菌生理盐水洗涤2次, 再重悬浮至光密度值(D600)为1.0, 备用。
原油降解率的测量方法:先将对照组培养液全部倒入100 mL分液漏斗中, 加入一定量石油醚(30~60 ℃)振荡萃取培养液中残留的原油, 重复萃取2次, 合并萃取液, 60 ℃烘至恒重, 用电子天平称重, 获得对照组原油残留质量并计算原油回收率; 然后用同样的方法获得实验组原油残留质量, 并计算原油降解率。
原油回收率=对照组原油残留质量/原油加入质量×100%,原油降解率=1-实验组原油残留质量/对照组原油残留质量×100%。
复筛:在装有35 mL含0.5 mL原油的无机盐培养基的50 mL带盖的三角瓶中, 分别加入2 mL OD600为1.0的菌悬液, 置于30 ℃、200 r·min-1摇床培养7 d。实验设4个组, 每组以不加菌悬液为对照, 实验组和对照组各设3个平行。用重量法分别测定对照组和实验组在第1、3、5和7天原油的残留量和生物质的变化,并计算各菌株原油降解率, 选取原油降解率最好、稳定性最好的1株菌进行实验并将其命名为ODB01。
1.4 原油降解菌株的鉴定 1.4.1 形态学观察和生理生化特征通过形态学观察及生理生化特征, 对菌株ODB01进行鉴定[17-18]。
1.4.2 16S rDNA序列分析提取对数生长期菌株ODB01的总DNA, 用于16S rDNA序列扩增。引物:27F,5′-AGAGTTTGATCMTGGCTCAG-3′;1492R,5′-GGTTACCTTGTTACGACTT-3′。PCR反应体系:10×缓冲液,5 μL;ExTaq,0.25μL;dNTP,4 μL, 引物各2 μL;模板,2 μL,ddH2O补至50 μL。PCR反应程序,94 ℃预变性5 min, 94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸2 min, 共32个循环, 再72 ℃延伸10 min, PCR扩增产物回收后连接到pMD18-T质粒上, 经鉴定后送华大基因进行测序。测序结果在NCBI(http://blast.ncbi.nlm.nih.govBlast.cgi)中进行在线比对, 并用MEGA 6.0软件选用邻近法构建系统进化树。
1.5 原油降解条件的优化经单因素试验确定影响原油降解细菌ODB01降解原油的环境因素, 并确定最适范围。在此基础上, 以原油降解率为响应值(Y), 单因素为自变量(X), 利用响应曲面法中的Box-Behnken中心组合设计原理设计实验, 对关键因素进行优化, 通过实验数据拟合的响应曲面模型和方差分析, 最终确定细菌ODB01的最佳原油降解条件并进行验证, 每个实验设3个平行, 求其平均值。
1.6 非离子表面活性剂Tween 80和Triton X-100对原油降解率的影响按照1.3节所述方法制备细菌ODB01的菌悬液, 在最佳原油降解条件下, 分别将其置于装有5 mL含不同浓度Tween 80和Triton X-100(w分别为0.01%、0.05%、0.10%、0.15%和0.20%)液体原油无机盐培养基的10 mL带盖离心管中, 置于200 r·min-1摇床上培养7 d, 分别于第1、3、5、7天取样用可见分光光度计测定其D600, 确定最适生长的非离子表面活性剂浓度, 每组实验设3个平行, 以不加菌悬液为对照, 用于测量时作参比溶液。
按照1.3节制备细菌ODB01菌悬液, 在最佳降解条件和最适浓度表面活性剂情况下降解15 d, 测定原油降解率, 每组实验设3个平行。
2 结果与讨论 2.1 原油降解菌株的筛选以原油为唯一碳源和能源初步筛选出14株能利用原油生长的菌株, 通过监测原油降解过程中原油的残留量以及生物质的增长变化进一步复筛出1株降解效率最高、稳定性最好的菌株进行研究, 将其命名为ODB01。菌株ODB01的复筛结果见图 1, 在菌株ODB01降解原油的过程中, 原油残留量随降解时间的延续而不断减少, 生物质含量随着降解时间的延续而不断增加, 从而证实菌株ODB01确实能够利用原油进行生长繁殖, 对原油具有一定的降解效果, 计算得出第7天时原油回收率为94.1%, 菌株ODB01的初始原油降解率为24.1%。
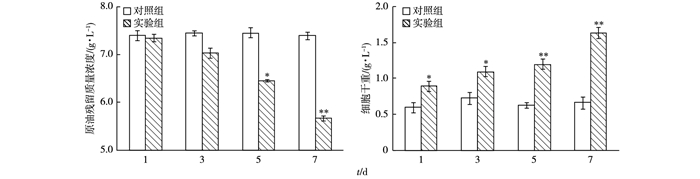
|
图 1 原油降解过程中原油残留量和生物质含量的变化 Figure 1 The changes of crude oil residue weight and cell dry weight during the degradation of crude oil *表示对照组和实验组之间差异显著(P < 0.05);**表示对照组和实验组之间差异极显著(P < 0.01)。 |
菌株ODB01在固体平板上的单菌落形态为较规则圆形, 湿润, 易挑起, 呈淡黄色, 油镜下观察单菌株形态为直杆状, 长1.2~3.0 μm, 宽0.6~1.0 μm, 是革兰阴性菌(图 2)。菌株ODB01的部分生理生化特征见表 1。

|
图 2 原油降解菌株ODB01的形态 Figure 2 Morphological observation of crude oil-degrading strain ODB01 |
|
|
表 1 菌株ODB01的生理生化特征 Table 1 Physiological and biochemical characteristics of strain ODB01 |
菌株ODB01 16S rDNA测序结果最终获得1.5 kb的序列, 经GenBank Blast序列同源性比较, 结果显示与肠杆菌属(Enterobacter sp.)有99%的同源性。采用MEGA 6.0软件构建的系统发育树(图 3) 表明菌株ODB01与路德维希肠杆菌(Enterobacter ludwigii)在同一个分支上。所以, 结果形态学观察、生理生化特征和分子生物学鉴定菌株ODB01隶属于肠杆菌属(Enterobacter sp.)细菌。
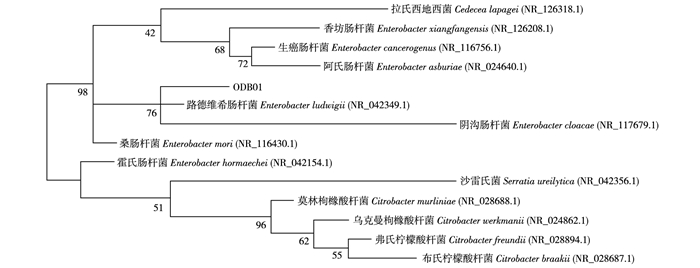
|
图 3 原油降解菌ODB01的系统发育树 Figure 3 Phylogenetic tree of crude oil-degrading strain ODB01 |
为了对细菌ODB01的原油降解条件进行优化, 首先通过单因素试验最终选定pH值、w(NaCl)、油菌比和温度4个关键的单因素进行优化(图 4)。pH值过低或过高都将会造成降解率的重大变化, 当pH值小于5.0时, 细菌ODB01生长受到抑制, 随后pH值不断增加, 降解率不断增大, 直到pH值为9.0时, 降解率达到最大值。当pH值大于12时, 细菌生长受到抑制。因此, 选取9.0为自变量pH值的0水平。当w(NaCl)超过1%时, 随着NaCl浓度的增加,细菌ODB01降解率开始减小, 达到8%左右时细菌不生长, 这说明高浓度NaCl会使溶液中渗透压增大, 造成细菌ODB01脱水, 影响其生化反应, 故选取1%为自变量NaCl浓度的0水平。当油菌比增大时, 原油降解率也随之增加, 当油菌比为1:4时, 原油降解率达到最大值, 故取1:4为自变量油菌比的0水平。当温度低于25 ℃时, 细菌ODB01的生长受到抑制, 随着温度的增加, 降解率呈上升趋势, 在35 ℃时达到最大值。因此, 选取35 ℃为自变量温度的0水平。
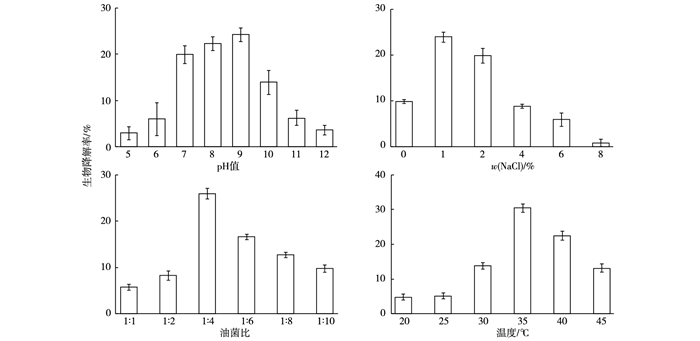
|
图 4 pH值、NaCl浓度、油菌比和温度对细菌ODB01原油降解率的影响 Figure 4 Effect of pH, NaCl concentration, oil-bactera liquid proportion and temperature for biodegradation of crude oil-degrading strain ODB01 |
根据单因素试验结果, 4个自变量(X1:pH值; X2:w(NaCl); X3:油菌比; X4:温度)设计的因素与3水平为:X1为-1(8)、0(9)、1(10);X2为-1(0)、0(1%)、1(2%); X3为-1(1:2)、0(1:4)、1(1:6);X4为-1(30 ℃)、0(35 ℃)、1(40 ℃)。以原油降解率为响应值(Y), 采用响应曲面法中的Box-Behnken中心组合设计原理设计实验, 结果见表 2。
|
|
表 2 响应曲面试验结果 Table 2 The results of response surface analysis |
根据表 2结果, 利用Design Expert 8.0软件对该结果进行响应曲面回归性分析, 分析得到响应值原油降解率(Y)对自变量pH值(X1)、w(NaCl)(X2)、油菌比(X3)、温度(X4)的二次回归方程:
| $ \begin{align} & Y=35.25-1.27{{X}_{1}}+1.66{{X}_{2}}+0.68{{X}_{3}}+3.04{{X}_{4}}+ \\ & 1.40{{X}_{1}}{{X}_{2}}+0.38{{X}_{1}}{{X}_{3}}-0.26{{X}_{1}}{{X}_{4}}+0.57{{X}_{2}}{{X}_{3}}+ \\ & 0.86{{X}_{2}}{{X}_{4}}-0.51{{X}_{3}}{{X}_{4}}-5.70{{X}_{1}}^{2}-4.95{{X}_{2}}^{2}-5.08{{X}_{3}}^{2} \\ & -4.50{{X}_{4}}^{2}。\\ \end{align} $ |
对该回归模型进行方差分析, 结果表明:该模型总回归方程的P < 0.000 1, 达到极显著水平, 失拟项P=0.390 7, 说明失拟性检验结果不显著, 其余因素对试验影响较小, 该模型稳定, 可以作为响应值对各自变量进行预测。再者, 模型决定系数R2=0.969 6, 说明实验所得的真实值与该模型的预测值有很好的相关性, 模型校正决定系数Radj2=0.939 3, 说明该实验结果的重复性很好, 可信度高。另外, 从X12、X22、X32、X42个因素的P值可以看出这4个因素对降解率的影响均极显著, 从F值来判断, 这4个因素对降解率的影响程度为X4 > X2 > X1 > X3。对所得到的回归方程求偏导微积分, 获得结果为X1=8.91, X2=1.19%, X3=1:4.12, X4=36.78, Y=36.03%。即pH值为8.91, w(NaCl)为1.19%, 油菌比为1:4.12, 温度为36.78 ℃, 此时分析预测的最大原油降解率为36.03%。
2.3.3 预测理论值的验证为了验证响应曲面法软件预测实验结果的准确性, 在其预测的最佳原油降解条件和其他前提条件不变的情况下, 试验测试原油的降解情况, 每组实验设3个平行, 求其平均值。实验原油降解率为34.6%, 是优化前的1.44倍, 与用响应曲面法软件预测的最佳降解率36.03%比较接近, 说明该模型能够很好地预测原油降解的实际情况, 预测结果准确可靠。
2.4 非离子表面活性剂Tween 80和Triton X-100对原油降解率的影响 2.4.1 不同浓度非离子表面活性剂Tween 80和Triton X-100对原油降解细菌ODB01生长的影响非离子表面活性剂能降低表面张力, 提高石油烃化合物的溶解度, 从而提高石油烃的生物利用度[19]。选用Tween 80和Triton X-100这2种非离子表面活性剂来研究它们对原油降解细菌ODB01的原油降解效果是否有影响, 实验结果见图 5。
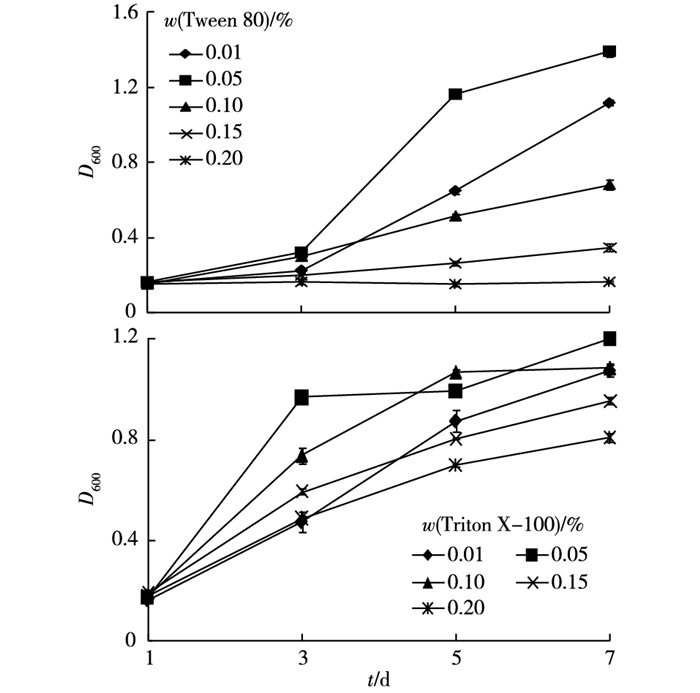
|
图 5 不同浓度非离子表面活性剂Tween 80和Triton X-100对原油降解细菌ODB01生长的影响 Figure 5 Effects of the growth on crude oil-degrading strain ODB01 under different concentrations of non-ionic surfactants Tween 80 and Triton X-100 |
不同浓度非离子表面活性剂Tween 80和Triton X-100对其生长有很大影响。对于非离子表面活性剂Tween 80而言, 原油降解细菌ODB01在w为0.05%时要优于0.01%的生长情况, 随后, 随着浓度的增加, ODB01的生长情况越来越差, 当w为0.20%时, ODB01生长受到抑制。因此, 非离子表面活性剂Tween 80对ODB01的最适生长浓度为0.05%。然而, 对于Triton X-100来说, 当Triton X-100的w为0.01%时, ODB01的生长情况比w为0.05%时差, 之后, 随着浓度的增大, 细菌ODB01的生长情况越来越差。与表面活性剂Tween 80相比, 当Triton X-100 w为0.20%时并没有出现生长受到抑制的现象, 说明ODB01对表面活性剂Triton X-100有很宽的适用浓度。所以, 非离子表面活性剂Triton X-100对ODB01的最适生长浓度也是0.05%。由此可见, 高浓度非离子表面活性剂将抑制细菌的生长, 降低原油降解率。SALEK等[20]用3株细菌(Achromobacter sp. 4, Pseudomonas stutzeri 9,Rahnella sp. EK12) 研究对柴油的生物降解过程中添加ρ为120 mg·L-1的Triton X-100时, 柴油降解率得到很大提高。KACZOREK等[21]研究了不同浓度Triton X-100对细菌Pseudomonas fluorescens P1降解石油烃化合物的影响。结果显示, 当ρ(Triton X-100) 为150 mg·L-1时, 石油烃化合物的降解率大约提高8%。KUMAR等[16]用4株细菌(Pseudoalteromonas sp.、Ruegeria sp.、Exiguobacterium sp.和Acinetobacter sp.)构建复合系统研究对引擎油的降解中, 添加w为0.05%的Tween 80 15 d时引擎油降解率提高将近1倍。
2.4.2 最佳降解条件和最适非离子表面活性剂浓度下原油降解率的测定为了评估原油降解细菌ODB01在最佳降解条件和最适非离子表面活性剂浓度下原油的降解效果, 分最适非离子表面活性剂浓度的Tween 80和Triton X-100以及不加表面活性剂3组进行实验, 每组设3个平行。用重量法分别测量第1、5、10、15天原油残留量的变化, 结果见表 3。
|
|
表 3 在ODB01对原油降解的最佳条件下原油残留量的变化 Table 3 The changes of total residual crude oil weight under optimal condition with crude oil-degrading strain ODB01 |
在最佳降解条件和没有添加表面活性剂情况下, 15 d时ODB01对原油的降解率为37.1%, 在添加w=0.05% Tween 80情况下, 降解率达42.5%, 在添加w=0.05% Triton X-100情况下, 降解率高达46.1%。因此, 非离子表面活性剂w=0.05% Tween 80和w=0.05% Triton X-100均能一定程度增强ODB01对原油的降解能力, 但w=0.05% Triton X-100比w=0.05% Tween 80显著。无添加表面活性剂、添加w=0.05% Tween 80和添加w=0.05% Triton X-100处理间残留的原油质量有显著差异(P < 0.05)。同时, ODB01在初始5 d内对原油的降解效果较高, 随着降解时间的延长, 对原油的降解率反而降低, 特别是15 d后, 原油降解率变化很小。这说明原油降解菌ODB01可能会代谢产生一些中间产物, 这些中间代谢产物会对ODB01产生毒害作用或抑制其生长。YANTO等[22]发现添加w=1.0%的非离子表面活性剂Tween 80后Pestalotiopsis sp. NG007对柏油的降解率提高41%。MOHANTY等[23]则发现添加临界胶团浓度(CMC)的Triton X-100时, Burkholderia multivorans对NAPL-A1降解率由41%提高到90%。然而, TIAN等[24]发现, 非离子表面活性剂Tween 80对原油的降解率没有影响。同时, 近几年也有学者认为化学表面活性剂增加微生物对石油烃的生物利用度是有争议的[25-26]。
3 结论(1) 从长庆油田被原油污染的土壤中分离筛选出1株原油降解菌株ODB01。经鉴定该菌株ODB01为肠杆菌属(Enterobacter sp.)细菌, 在原油初始浓度w=1%情况下, 7 d对原油的降解率为24.1%, 细菌ODB01对原油具有一定的降解作用。
(2) 利用响应曲面法Box-Behnken中心组合设计实验对细菌ODB01的原油降解条件进行优化。优化的最佳原油降解条件为pH值为8.91, w(NaCl)为1.19%, 油菌比为1:4.12, 温度为36.78 ℃, 此条件下原油降解率为34.6%, 是优化前的1.44倍。
(3) 在最佳降解条件和分别添加w=0.05% Tween 80和w=0.05% Triton X-100情况下, 15 d后原油降解率分别为42.5%和46.1%, 比没有添加表面活性剂条件下的降解率(37.1%)分别提高12.7%和24.2%。这表面活性剂Tween 80和Triton X-100都能在一定程度上增加细菌ODB01对原油的降解能力, 但Triton X-100比Tween 80效果好些。
| [1] |
赵硕伟, 沈嘉澍, 沈标. 复合菌群的构建及其对石油污染土壤修复的研究[J]. 农业环境科学学报, 2011, 30(8): 1567-1572. ZHAO Shuo-wei, SHEN Jia-shu, SHEN Biao. Construction of Multiple Bacterial Consortium and Its Application in Bioremediation of Petroleum-Contaminated Soil[J]. Journal of Agro-Environment Science, 2011, 30(8): 1567-1572. (  0) 0) |
| [2] |
沈伟航, 朱能武, 商儒, 等. 石油污染土壤微生物修复过程中植物毒性变化规律[J]. 环境科学学报, 2016, 36(1): 232-242. SHEN Wei-hang, ZHU Neng-wu, SHANG Ru, et al. Ecotoxicity Monitoring and Plant Bioindicators Screening of Oil-Contaminated Soil During Bioremediation[J]. Acta Scientiae Circumstantiae, 2016, 36(1): 232-242. (  0) 0) |
| [3] |
RUIZ Y, SUAREZ P, ALONSO A, et al. Environmental Quality of Mussel Farms in the Vigo Estuary:Pollution by PAHs, Origin and Effects on Reproduction[J]. Environmental Pollution, 2011, 159(1): 250-265. DOI:10.1016/j.envpol.2010.08.031 (  0) 0) |
| [4] |
LIU L Y, WANG J Z, WEI G L, et al. Polycyclic Aromatic Hydrocarbons (PAHs) in Continental Shelf Sediment of China:Implications for Anthropogenic Influences on Coastal Marine Environment[J]. Environmental Pollution, 2012, 167: 155-162. DOI:10.1016/j.envpol.2012.03.038 (  0) 0) |
| [5] |
杨振亚, 卢晓丹, 高彦征. 植物多酚氧化酶对多环芳烃污染的体外诱导响应[J]. 生态与农村环境学报, 2016, 32(4): 687-690. YANG Zhen-ya, LU Xiao-dan, GAO Yan-zheng. Response of Phenol Oxidase in Plant to in Vitro Induction of Contaminant of Polycyclic Aromatic Hydrocarbons[J]. Journal of Ecology and Rural Environment, 2016, 32(4): 687-690. DOI:10.11934/j.issn.1673-4831.2016.04.027 (  0) 0) |
| [6] |
BEOLCHINI F, ROCCHETTI L, REGOLI F, et al. Bioremediation of Marine Sediments Contaminated by Hydrocarbons:Experimental Analysis and Kinetic Modeling[J]. Journal Hazardous Materials, 2010, 182(1/2/3): 403-407. (  0) 0) |
| [7] |
WANG X B, CHI C Q, NIE Y, et al. Degradation of Petroleum Hydrocarbons (C6-C40) and Crude Oil by a Novel Dietziastrain[J]. Bioresource Technology, 2011, 102(17): 7755-7761. DOI:10.1016/j.biortech.2011.06.009 (  0) 0) |
| [8] |
PRITCHARD P H, COSTAC F. EPA's Alaska Oil Spill Bioremediation Project:Part 5[J]. Environmental Science & Technology, 1991, 25(3): 372-379. (  0) 0) |
| [9] |
SEO J S, KEUM Y S, LI Q X. Bacterial Degradation of Aromatic Compounds[J]. International Journal of Environmental Research Public Health, 2009, 6(1): 278-309. DOI:10.3390/ijerph6010278 (  0) 0) |
| [10] |
信艳娟, 吴佩春, 曹旭鹏, 等. 大连湾原油降解菌的分离和多样性分析[J]. 微生物学通报, 2013, 40(6): 979-987. XIN Yan-juan, WU Pei-chun, CAO Xu-peng, et al. Isolation and Diversity of Crude Oil-Degrading Bacteria From Dalian Bay[J]. Microbiology China, 2013, 40(6): 979-987. (  0) 0) |
| [11] |
YU Y, ZHANG W, CHEN G, et al. Preparation of Petroleum-Degrading Bacterial Agent and Its Application in Remediation of Contaminated Soil in Shengli Oil Field, China[J]. Environmental Science Pollution Research, 2014, 21(13): 7929-7937. DOI:10.1007/s11356-014-2707-0 (  0) 0) |
| [12] |
BAYAT Z, HASSANSHAHIAN M, HESNI M A. Enrichment and Isolation of Crude Oil Degrading Bacteria From Some Mussels Collected From the Persian Gulf[J]. Marine Pollution Bulletin, 2015, 101(1): 85-91. DOI:10.1016/j.marpolbul.2015.11.021 (  0) 0) |
| [13] |
LIU B, JU M, LIU J, et al. Isolation, Identification, and Crude Oil Degradation Characteristics of a High-Temperature, Hydrocarbon-Degrading Strain[J]. Marine Pollution Bulletin, 2016, 106(1/2): 301-307. (  0) 0) |
| [14] |
LI X F, ZHAO L, ADAM M. Biodegradation of Marine Crude Oil Pollution Using a Salt-Tolerant Bacterial Consortium Isolated From Bohai Bay, China[J]. Marine Pollution Bulletin, 2016, 105(1): 43-50. DOI:10.1016/j.marpolbul.2016.02.073 (  0) 0) |
| [15] |
FATHEPURE B Z. Recent Studies in Microbial Degradation of Petroleum Hydrocarbons in Hypersaline Environments[J]. Front Microbiology, 2014, 5: 173. (  0) 0) |
| [16] |
KUMAR A G, VIJAYAKUMAR L, JOSHI G, et al. Biodegradation of Complex Hydrocarbons in Spent Engine Oil by Novel Bacterial Consortium Isolated From Deep Sea Sediment[J]. Bioresource Technology, 2014, 170: 556-564. DOI:10.1016/j.biortech.2014.08.008 (  0) 0) |
| [17] |
周德庆. 微生物学实验室教程[M]. 2版. 北京: 高等教育出版社, 2006, 3-54. ZHOU De-qing. Microbiology Laboratory Tutorial[M]. 2nd ed. Beijing: Higher Education Press, 2006, 3-54. (  0) 0) |
| [18] |
布坎南R E, 吉本斯N E. 伯杰氏细菌鉴定手册[M]. 8版. 北京: 北京科学出版社, 1948, 448-450. BUCHANAN R E, GIBBONS N E. Berger's Bacteria Identification Manual[M]. 8th ed. Beijing: Beijing Science Press, 1948, 448-450. (  0) 0) |
| [19] |
马爱青, 陈连喜, 包木太. 表面活性剂对原油生物降解的强化作用[J]. 油田化学, 2011, 28(22): 224-228. MA Ai-qing, CHEN Lian-xi, BAO Mu-tai. Reinforcement Effect of Surfactants on Petroleum Biodegradation[J]. Oilfield Chemistry, 2011, 28(2): 224-228. (  0) 0) |
| [20] |
SALEK K, KACZOREK E, GUZIK U, et al. Bacterial Properties Changing Under Triton X-100 Presence in the Diesel Oil Biodegradation Systems:From Surface and Cellular Changes to Mono-and Dioxygenases Activities[J]. Environmental Scienceand Pollution Research, 2015, 22(6): 4305-4315. DOI:10.1007/s11356-014-3668-z (  0) 0) |
| [21] |
KACZOREK E, OLSZANOWSKI A. Uptake of Hydrocarbon by Pseudomonas fluorescens(P1) and Pseudomonas putida(K1) Strains in the Presence of Surfactants:A Cell Surface Modification[J]. Water, Air, and Soil Pollution, 2011, 214(1/2/3/4): 451-459. (  0) 0) |
| [22] |
YANTO D H, TACHIBANA S. Enhanced Biodegradation of Asphalt in the Presence of Tween Surfactants, Mn2+ and H2O2 by Pestalotiopsis sp. in Liquid Medium and Soil[J]. Chemosphere, 2014, 103: 105-113. DOI:10.1016/j.chemosphere.2013.11.044 (  0) 0) |
| [23] |
MOHANTY S, MUKHERJI S. Surfactant Aided Biodegradation of NAPLs by Burkholderia multivorans:Comparison Between Triton X-100 and Rhamnolipid JBR-515[J]. Colloids and Surfaces B:Biointerfaces, 2013, 102: 644-652. DOI:10.1016/j.colsurfb.2012.08.064 (  0) 0) |
| [24] |
TIAN W, YAO J, LIU R, et al. Effect of Natural and Synthetic Surfactants on Crude Oil Biodegradation by Indigenous Strains[J]. Ecotoxicology and Environmental Safety, 2016, 129: 171-179. DOI:10.1016/j.ecoenv.2016.03.027 (  0) 0) |
| [25] |
谭丽泉, 余梅, 周天, 等. 白腐真菌对石油污染土壤的修复研究[J]. 化学工程师, 2015, 29(4): 41-45. TAN Li-quan, YU Mei, ZHOU Tian, et al. Study on Remediation of Petroleum Contaminated Soil by White-Rot Fungi[J]. Chemical Engineer, 2015, 29(4): 41-45. (  0) 0) |
| [26] |
KLEINDIENST S, PAUL J H, JOYE S B. Using Dispersants After Oil Spills:Impacts on the Composition and Activity of Microbial Communities[J]. Nature Reviews Microbiology, 2015, 13(6): 388-396. DOI:10.1038/nrmicro3452 (  0) 0) |




